【高效备课】人教A版(2019)高中化学选必修1同步课件 1.2反应热的计算(共22张PPT)
文档属性
| 名称 | 【高效备课】人教A版(2019)高中化学选必修1同步课件 1.2反应热的计算(共22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-26 08:12:41 | ||
图片预览







文档简介
(共22张PPT)
盖斯定律
Highlight the key points of the presentation to help the audience understand the content of the presentation and keep up with the pace of the presentation..
在化学科研中,经常要测量化学反应所放出或吸收的热量,但是某些物质的反应热,由于种种原因不能直接测得,那么如何获得它们的反应热数据呢?
例:C燃烧生成CO,但却很难控制C的氧化只生成CO而不继续生成CO2,那么其反应热该如何获得呢?
C(g)+ O2(g)=CO(g)
盖斯定律
PART01
Highlight the key points of the presentation to help the audience understand the content of the presentation and keep up with the pace of the presentation..
盖斯
盖斯,瑞士化学家,早年从事分析化学的研究,发现蔗糖可氧化成糖二酸。1830年专门从事化学热效应测定方法的改进。
1840年盖斯在总结大量实验事实(热化学实验数据)的基础上提出:“定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。”
一个化学反应,不管是一步完成的还是几步完成的,其反应热是相同的。
盖斯定律表明,在一定条件下化学反应的反应热只与反应体系的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。
盖斯定律
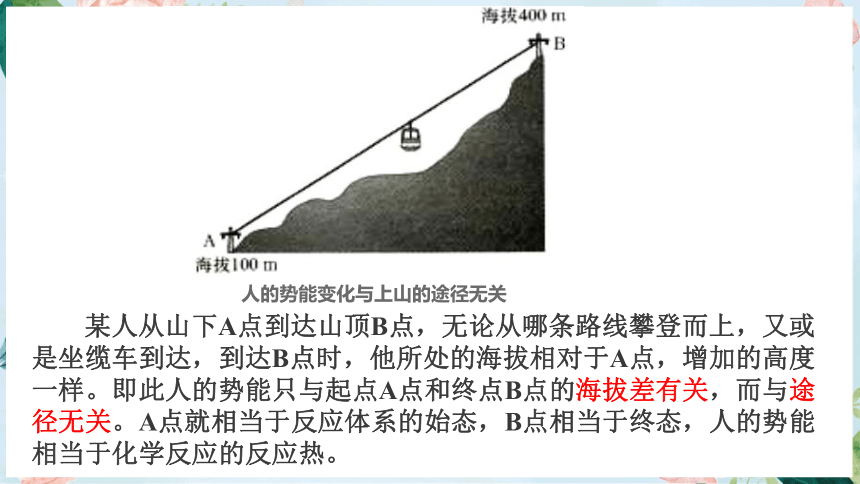
某人从山下A点到达山顶B点,无论从哪条路线攀登而上,又或是坐缆车到达,到达B点时,他所处的海拔相对于A点,增加的高度一样。即此人的势能只与起点A点和终点B点的海拔差有关,而与途径无关。A点就相当于反应体系的始态,B点相当于终态,人的势能相当于化学反应的反应热。
人的势能变化与上山的途径无关
例如 C(s)+ O2(g)=CO(g),因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得。
CO(g)+ O2(g)=CO2(g)
C(s)+ O2(g)=CO2(g)
ΔH1=-393.5 kJ/mol
ΔH2=-283.0 kJ/mol
∵ΔH1=ΔH2+ΔH3
∴ΔH2=ΔH1-ΔH3
=-393.5kJ/mol -(-283.0kJ/mol)
=-110.5 kJ/mol
即:C(s)+ O2(g)=CO(g) ΔH=-110.5 kJ/mol
有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。
计算原则
(1)若一个反应的焓变△H=a kJ·mol 1,
则其逆反 应的焓变△H=-a kJ·mol 1
(2)若一个化学反应方程式可由另外几个反应 的化学方程式相加减而得到,则该反应的焓变亦可以由这几个反应的焓变相加减而 得到。
盖斯定律的应用
例1,同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学反应是一步完成或分几步完成,这个总过程的热效应是相同的”。已知:
① P4(s,白磷)+5O2(g)=P4O10(s) ΔH1= -2983.2 kJ/mol
② P(s,红磷)+5/4O2(g)=1/4P4O10(s) ΔH2= -738.5 kJ/mol
试写出白磷转化为红磷的热化学方程式
①- ②×4得
_________________________________。
P4(s,白磷)=4 P(s,红磷) = -29.2 kJ/mol
H
【例题2】已知
① CO(g) + 1/2 O2(g) ====CO2(g) ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) ====H2O(l) ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3 H2O(l) ΔH3=-1370 kJ/mol
试计算④2CO(g)+ 4 H2(g)==== H2O(l)+ C2H5OH(l) 的ΔH
【解】:根据盖斯定律,反应④不论是一步完成还是分几步完成,其反应热效应都是相同的。下面就看看反应④能不能由①②③三个反应通过加减乘除组合而成,也就是说,看看反应④能不能分成①②③几步完成。
所以,ΔH=ΔH1×2 +ΔH2×4 -ΔH3
=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol
①×2 + ②×4 - ③ = ④
例3:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
① N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
② N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2 N2H4(g)+ 2NO2(g)== 3N2(g)+4H2O(l) △H=-1135.2kJ/mol
②×2-①×2
反应热的计算
PART02
Highlight the key points of the presentation to help the audience understand the content of the presentation and keep up with the pace of the presentation..
1.由化学反应的本质(旧键断裂-新键生成)及化学反应能量变化的原因(反应物的总能量与生成物的总能量不等)可得:
(1)反应热=断裂旧键所需的能量-生成新键释放的能量
(2)反应热=生成物的总能量-反应物的总能量
(3)反应热=反应物的总键能-生成物的总键能
△H =E生—E反
△H =Σ反—Σ生
△H =E(反应物断裂化学键吸收的能量)—E(形成化学键放出的能量)
例 化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知P4(白磷)、P4O6的分子结构如图所示。现提供以下化学键的键能(kJ·mol-1):P—P 198、P—O 360、O=O 498,则反应P4(s)+3O2(g)=P4O6(g)的反应热ΔH为( )
A.1638 kJ·mol-1 B.-1638 kJ·mol-1
C.-126 kJ·mol-1 D.126 kJ·mol-1
答案 B
2.根据盖斯定律计算:不管化学反应是一步完成或分几步完成,其反应热是相同的。也就是说,化学反应的反应热只与反应的始态和终态有关,而与具体反应的途径无关。所以,可将热化学方程式进行适当的“加”、“减”等变形,ΔH进行相应的变化后来计算反应热。
例2已知下列两个热化学方程式:
H2(g)+O2(g)=H2O(l)
ΔH=-285.8 kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)
ΔH=-2220.0 kJ·mol-1
实验测得氢气和丙烷的混合气体共5 mol,完全燃烧时放热3847 kJ,则混合气体中氢气和丙烷的体积比约是____________ A.1∶3 B.3∶1
C.1∶4 D.5∶13
答案 B
解1 :设H2、C3H8的物质的量分别为x,y
x + y = 5
(571.6/2)(x) + 2220y = 3847
V(H2):V(C3H8) =n(H2):n(C3H8) = 3.75:1.25 = 3:1
x = 3.75 mol
y = 1.25 mol
解2 :( 巧解)
5mol 混合气中,C3H8 物质的量必小于2mol,
H2 的物质的量必大于3mol。
∵ 2mol C3H8 燃烧放热 4440 kJ,
超过总放热量 3847 kJ
n (H2) : n (C3H8) 必大于 3 : 2
选 B
解3 :1mol H2 燃烧放热 285.8 kJ
1mol 混合气 燃烧放热 3847kJ/5 = 769.4 kJ
H2 285.8
C3H8 2220
769.4
1450.6
483.6
3
1
=
谢谢观看
Highlight the key points of the presentation to help the audience understand the content of the presentation and keep up with the pace of the presentation..
盖斯定律
Highlight the key points of the presentation to help the audience understand the content of the presentation and keep up with the pace of the presentation..
在化学科研中,经常要测量化学反应所放出或吸收的热量,但是某些物质的反应热,由于种种原因不能直接测得,那么如何获得它们的反应热数据呢?
例:C燃烧生成CO,但却很难控制C的氧化只生成CO而不继续生成CO2,那么其反应热该如何获得呢?
C(g)+ O2(g)=CO(g)
盖斯定律
PART01
Highlight the key points of the presentation to help the audience understand the content of the presentation and keep up with the pace of the presentation..
盖斯
盖斯,瑞士化学家,早年从事分析化学的研究,发现蔗糖可氧化成糖二酸。1830年专门从事化学热效应测定方法的改进。
1840年盖斯在总结大量实验事实(热化学实验数据)的基础上提出:“定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。”
一个化学反应,不管是一步完成的还是几步完成的,其反应热是相同的。
盖斯定律表明,在一定条件下化学反应的反应热只与反应体系的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。
盖斯定律
某人从山下A点到达山顶B点,无论从哪条路线攀登而上,又或是坐缆车到达,到达B点时,他所处的海拔相对于A点,增加的高度一样。即此人的势能只与起点A点和终点B点的海拔差有关,而与途径无关。A点就相当于反应体系的始态,B点相当于终态,人的势能相当于化学反应的反应热。
人的势能变化与上山的途径无关
例如 C(s)+ O2(g)=CO(g),因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得。
CO(g)+ O2(g)=CO2(g)
C(s)+ O2(g)=CO2(g)
ΔH1=-393.5 kJ/mol
ΔH2=-283.0 kJ/mol
∵ΔH1=ΔH2+ΔH3
∴ΔH2=ΔH1-ΔH3
=-393.5kJ/mol -(-283.0kJ/mol)
=-110.5 kJ/mol
即:C(s)+ O2(g)=CO(g) ΔH=-110.5 kJ/mol
有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。
计算原则
(1)若一个反应的焓变△H=a kJ·mol 1,
则其逆反 应的焓变△H=-a kJ·mol 1
(2)若一个化学反应方程式可由另外几个反应 的化学方程式相加减而得到,则该反应的焓变亦可以由这几个反应的焓变相加减而 得到。
盖斯定律的应用
例1,同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学反应是一步完成或分几步完成,这个总过程的热效应是相同的”。已知:
① P4(s,白磷)+5O2(g)=P4O10(s) ΔH1= -2983.2 kJ/mol
② P(s,红磷)+5/4O2(g)=1/4P4O10(s) ΔH2= -738.5 kJ/mol
试写出白磷转化为红磷的热化学方程式
①- ②×4得
_________________________________。
P4(s,白磷)=4 P(s,红磷) = -29.2 kJ/mol
H
【例题2】已知
① CO(g) + 1/2 O2(g) ====CO2(g) ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) ====H2O(l) ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3 H2O(l) ΔH3=-1370 kJ/mol
试计算④2CO(g)+ 4 H2(g)==== H2O(l)+ C2H5OH(l) 的ΔH
【解】:根据盖斯定律,反应④不论是一步完成还是分几步完成,其反应热效应都是相同的。下面就看看反应④能不能由①②③三个反应通过加减乘除组合而成,也就是说,看看反应④能不能分成①②③几步完成。
所以,ΔH=ΔH1×2 +ΔH2×4 -ΔH3
=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol
①×2 + ②×4 - ③ = ④
例3:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
① N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
② N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2 N2H4(g)+ 2NO2(g)== 3N2(g)+4H2O(l) △H=-1135.2kJ/mol
②×2-①×2
反应热的计算
PART02
Highlight the key points of the presentation to help the audience understand the content of the presentation and keep up with the pace of the presentation..
1.由化学反应的本质(旧键断裂-新键生成)及化学反应能量变化的原因(反应物的总能量与生成物的总能量不等)可得:
(1)反应热=断裂旧键所需的能量-生成新键释放的能量
(2)反应热=生成物的总能量-反应物的总能量
(3)反应热=反应物的总键能-生成物的总键能
△H =E生—E反
△H =Σ反—Σ生
△H =E(反应物断裂化学键吸收的能量)—E(形成化学键放出的能量)
例 化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知P4(白磷)、P4O6的分子结构如图所示。现提供以下化学键的键能(kJ·mol-1):P—P 198、P—O 360、O=O 498,则反应P4(s)+3O2(g)=P4O6(g)的反应热ΔH为( )
A.1638 kJ·mol-1 B.-1638 kJ·mol-1
C.-126 kJ·mol-1 D.126 kJ·mol-1
答案 B
2.根据盖斯定律计算:不管化学反应是一步完成或分几步完成,其反应热是相同的。也就是说,化学反应的反应热只与反应的始态和终态有关,而与具体反应的途径无关。所以,可将热化学方程式进行适当的“加”、“减”等变形,ΔH进行相应的变化后来计算反应热。
例2已知下列两个热化学方程式:
H2(g)+O2(g)=H2O(l)
ΔH=-285.8 kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)
ΔH=-2220.0 kJ·mol-1
实验测得氢气和丙烷的混合气体共5 mol,完全燃烧时放热3847 kJ,则混合气体中氢气和丙烷的体积比约是____________ A.1∶3 B.3∶1
C.1∶4 D.5∶13
答案 B
解1 :设H2、C3H8的物质的量分别为x,y
x + y = 5
(571.6/2)(x) + 2220y = 3847
V(H2):V(C3H8) =n(H2):n(C3H8) = 3.75:1.25 = 3:1
x = 3.75 mol
y = 1.25 mol
解2 :( 巧解)
5mol 混合气中,C3H8 物质的量必小于2mol,
H2 的物质的量必大于3mol。
∵ 2mol C3H8 燃烧放热 4440 kJ,
超过总放热量 3847 kJ
n (H2) : n (C3H8) 必大于 3 : 2
选 B
解3 :1mol H2 燃烧放热 285.8 kJ
1mol 混合气 燃烧放热 3847kJ/5 = 769.4 kJ
H2 285.8
C3H8 2220
769.4
1450.6
483.6
3
1
=
谢谢观看
Highlight the key points of the presentation to help the audience understand the content of the presentation and keep up with the pace of the presentation..
