【高效备课】人教A版(2019)高中化学选必修1同步课件 2.2.2化学平衡影响因素(共23张)
文档属性
| 名称 | 【高效备课】人教A版(2019)高中化学选必修1同步课件 2.2.2化学平衡影响因素(共23张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-26 00:00:00 | ||
图片预览






文档简介
(共23张PPT)
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
2.2.2 影响化学平衡的因素
一定条件下,可逆反应里,正反应速率和逆反应速率相等,
反应混合物中各组分的浓度保持不变的状态。
化学平衡状态
复习
等: v正 = v逆 (不等于零)
定:平衡时,各组分的浓度或含量保持不变
动:正逆反应均未停止,只是速率相等,是动态平衡
变:条件改变,原平衡被破坏,在新的条件下建立新的平衡。平衡移动
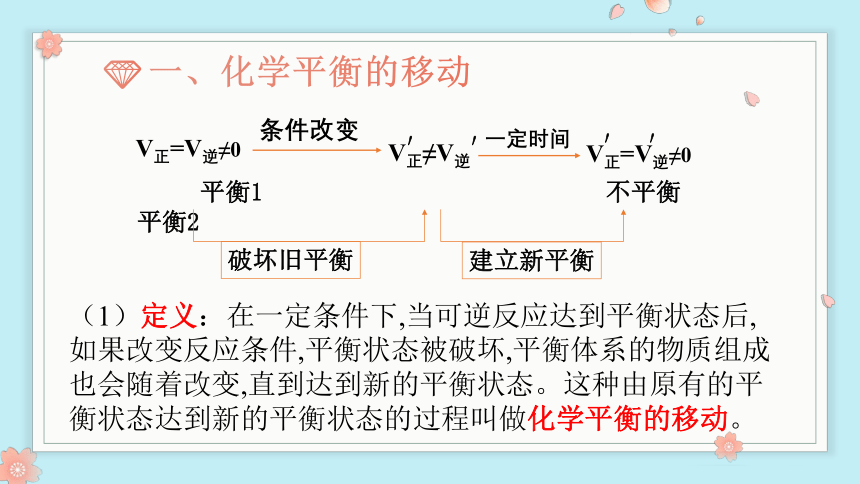
V正≠V逆
V正=V逆≠0
条件改变
平衡1 不平衡 平衡2
建立新平衡
破坏旧平衡
V正=V逆≠0
′
′
一定时间
′
′
一、化学平衡的移动
(1)定义:在一定条件下,当可逆反应达到平衡状态后,如果改变反应条件,平衡状态被破坏,平衡体系的物质组成也会随着改变,直到达到新的平衡状态。这种由原有的平衡状态达到新的平衡状态的过程叫做化学平衡的移动。
(2)平衡移动与反应速率的关系
外界条件对化学平衡移动的影响是通过改变反应速率来实现的。条件改变时:
(1)若v(正) v(逆),平衡 移动;
(2)若v(正)>v(逆),平衡向 反应方向移动;
(3)若v(正)一、化学平衡的移动
=
不
正
逆
二、浓度对化学平衡的影响
将上述溶液平均分装在a、b、c三支试管中,向b试管中加入少量铁粉,溶液红色 ;向c试管中滴加4滴1 mol·L-1KSCN溶液,溶液红色 。这些现象说明当向平衡混合物中加入铁粉或硫氰化钾溶液后,平衡混合物的 发生了变化。
红
变浅
加深
硫氰化铁
实验2-1
浓度的改变导致 的改变,但K ,使Q K,从而导致平衡移动。但浓度的改变不一定会使化学平衡发生移动。
正反应
逆反应
浓度商
不变
≠
二、浓度对化学平衡的影响
在可逆反应达到平衡时,在其他条件不变的情况下:
(1)c(反应物)增大或c(生成物)减小,平衡向 方向移动。
(2)c(反应物)减小或c(生成物)增大,平衡向 方向移动。
结论
理论解释
二、浓度对化学平衡的影响
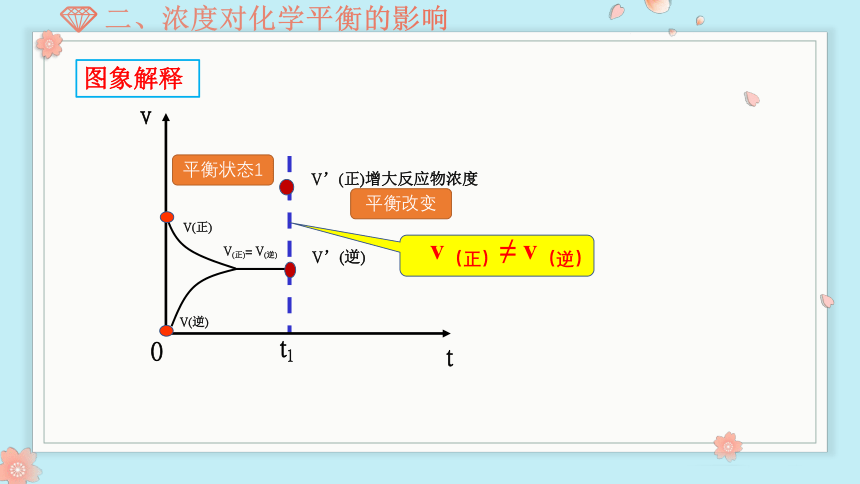
t1
v(正)≠ v(逆)
0
v
t
V(正)
V(逆)
V(正)= V(逆)
V’(正)增大反应物浓度
V’(逆)
平衡状态1
平衡改变
图象解释
二、浓度对化学平衡的影响
0
v
t
V(正)
V(逆)
V(正)= V(逆)
V (正)= V (逆)
V’(正)
V’(逆)
平衡状态2
平衡状态1
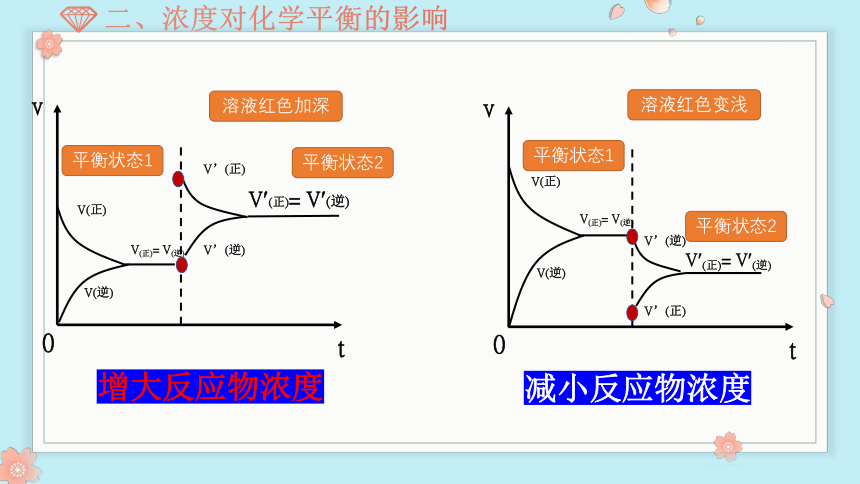
增大反应物浓度
溶液红色加深
0
v
t
V(正)
V(逆)
V(正)= V(逆)
V (正)= V (逆)
V’(逆)
V’(正)
减小反应物浓度
平衡状态1
平衡状态2
溶液红色变浅
二、浓度对化学平衡的影响
0
v
t
V(正)
V(逆)
V(正)= V(逆)
V’ (逆)
V’ (正)
V’ (正)= V’ (逆)
增大C生,平衡逆移
0
v
t
v正
v逆
v正= v逆
V’正
V’逆
v 正= v 逆
减小C生,平衡正移
三、压强对化学平衡的影响
(1)实验操作:用50 mL注射器吸入20 mL NO2与N2O4的混合气体,并将细管端用橡皮塞封闭。然后将活塞向外拉,观察管内混合气体颜色的变化。当反复推拉活塞时,观察管内混合气体颜色的变化。
(2)实验现象与结论:
实验2-2
实验 实验现象 实验结论
活塞往外拉 气体颜色 , 减小压强,化学平衡向生成 的方向移动
活塞往里推 气体颜色 , 增大压强,化学平衡向生成 的方向移动
先变浅又逐渐变深
NO2
先变深又逐渐变浅
N2O4
三、压强对化学平衡的影响
(1)若为反应前后气体体积不等的反应,如N2+3H2 2NH3:
增大压强后,平衡向 的方向移动;
减小压强后,平衡向 的方向移动。
气体体积减小
气体体积增大
不移动
结论
(2)若为等体积反应,如H2+I2 2HI:
改变压强后,平衡 。
三、压强对化学平衡的影响
aA(g)+bB(g) cC(g) (a+b>c)
图象解释
0
v
v正
v逆
v正= v逆
V’正
V’逆
v 正= v 逆
增大压强
0
v
v正
v逆
v正= v逆
V'逆
V'正
v'正= v'逆
减小压强
三、压强对化学平衡的影响
aA(g)+bB(g) cC(g) (a+b图象解释
0
v
v正
v逆
v正= v逆
V'逆
V'正
v 正= v 逆
增大压强
0
v
v正
v逆
v正= v逆
V'正
V'逆
v'正= v'逆
减小压强
三、压强对化学平衡的影响
aA(g)+bB(g) cC(g) (a+b=c)
图象解释
0
v
v正
v逆
v正= v逆
V'逆
V'正
v 正= v 逆
增大压强
0
v
v正
v逆
v正= v逆
V'正
V'逆
v'正= v'逆
减小压强
平衡不移动
三、温度对化学平衡的影响
把NO2和N2O4混合气体通入两只连通的烧瓶,然后用弹簧夹夹住乳胶管;把一只烧瓶浸泡在热水中,另一只浸泡在冰水中。观察颜色变化。
实验2-3
三、温度对化学平衡的影响
吸热
放热
其他条件不变时,升高温度平衡向着 的方向移动,降低温度平衡向着 的方向移动。
红棕色变浅
红棕色加深
冰水中 热水中
现象
解释 降温→颜色变浅→平衡向放热方向移动; 升温→颜色变深→平衡向吸热方向移动 结论
三、压强对化学平衡的影响
aA(g)+bB(g) cC(g)
图象解释
0
v
v正
v逆
v正= v逆
V’正
V’逆
v 正= v 逆
升高温度
0
v
v正
v逆
v正= v逆
V'逆
V'正
v'正= v'逆
降低温度
ΔH>0
三、压强对化学平衡的影响
aA(g)+bB(g) cC(g)
图象解释
0
v
v正
v逆
v正= v逆
V'逆
V'正
v 正= v 逆
升高温度
0
v
v正
v逆
v正= v逆
V'正
V'逆
v'正= v'逆
降低温度
ΔH<0
三、催化剂对化学平衡的影响
催化剂可 地改变正反应速率和逆反应速率,因此催化剂对化学平衡的移动 。但催化剂可 反应达到平衡所需的时间。
同等程度
没有影响
改变
0
v
v正
v逆
v正= v逆
V'正
V'逆
v 正= v 逆
如果改变影响平衡的一个因素,平衡就向着能够 这种改变的方向移动,这就是 ,又称为化学平衡移动原理。
减弱
勒夏特列原理
四、勒夏特列原理
提示
①影响平衡的因素只有浓度、压强、温度三种;
②原理的适用范围是只有一项条件变化的情况(温度或压强或一种物质的浓度),当多项条件同时发生变化时,情况比较复杂;
③平衡移动的结果只能减弱(不可能抵消)外界条件的变化。
若其他条件不变,改变下列条件对化学平衡的影响如下:
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
感谢聆听 下次再会
Thanks For Listening. See You Next Time
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
2.2.2 影响化学平衡的因素
一定条件下,可逆反应里,正反应速率和逆反应速率相等,
反应混合物中各组分的浓度保持不变的状态。
化学平衡状态
复习
等: v正 = v逆 (不等于零)
定:平衡时,各组分的浓度或含量保持不变
动:正逆反应均未停止,只是速率相等,是动态平衡
变:条件改变,原平衡被破坏,在新的条件下建立新的平衡。平衡移动
V正≠V逆
V正=V逆≠0
条件改变
平衡1 不平衡 平衡2
建立新平衡
破坏旧平衡
V正=V逆≠0
′
′
一定时间
′
′
一、化学平衡的移动
(1)定义:在一定条件下,当可逆反应达到平衡状态后,如果改变反应条件,平衡状态被破坏,平衡体系的物质组成也会随着改变,直到达到新的平衡状态。这种由原有的平衡状态达到新的平衡状态的过程叫做化学平衡的移动。
(2)平衡移动与反应速率的关系
外界条件对化学平衡移动的影响是通过改变反应速率来实现的。条件改变时:
(1)若v(正) v(逆),平衡 移动;
(2)若v(正)>v(逆),平衡向 反应方向移动;
(3)若v(正)
=
不
正
逆
二、浓度对化学平衡的影响
将上述溶液平均分装在a、b、c三支试管中,向b试管中加入少量铁粉,溶液红色 ;向c试管中滴加4滴1 mol·L-1KSCN溶液,溶液红色 。这些现象说明当向平衡混合物中加入铁粉或硫氰化钾溶液后,平衡混合物的 发生了变化。
红
变浅
加深
硫氰化铁
实验2-1
浓度的改变导致 的改变,但K ,使Q K,从而导致平衡移动。但浓度的改变不一定会使化学平衡发生移动。
正反应
逆反应
浓度商
不变
≠
二、浓度对化学平衡的影响
在可逆反应达到平衡时,在其他条件不变的情况下:
(1)c(反应物)增大或c(生成物)减小,平衡向 方向移动。
(2)c(反应物)减小或c(生成物)增大,平衡向 方向移动。
结论
理论解释
二、浓度对化学平衡的影响
t1
v(正)≠ v(逆)
0
v
t
V(正)
V(逆)
V(正)= V(逆)
V’(正)增大反应物浓度
V’(逆)
平衡状态1
平衡改变
图象解释
二、浓度对化学平衡的影响
0
v
t
V(正)
V(逆)
V(正)= V(逆)
V (正)= V (逆)
V’(正)
V’(逆)
平衡状态2
平衡状态1
增大反应物浓度
溶液红色加深
0
v
t
V(正)
V(逆)
V(正)= V(逆)
V (正)= V (逆)
V’(逆)
V’(正)
减小反应物浓度
平衡状态1
平衡状态2
溶液红色变浅
二、浓度对化学平衡的影响
0
v
t
V(正)
V(逆)
V(正)= V(逆)
V’ (逆)
V’ (正)
V’ (正)= V’ (逆)
增大C生,平衡逆移
0
v
t
v正
v逆
v正= v逆
V’正
V’逆
v 正= v 逆
减小C生,平衡正移
三、压强对化学平衡的影响
(1)实验操作:用50 mL注射器吸入20 mL NO2与N2O4的混合气体,并将细管端用橡皮塞封闭。然后将活塞向外拉,观察管内混合气体颜色的变化。当反复推拉活塞时,观察管内混合气体颜色的变化。
(2)实验现象与结论:
实验2-2
实验 实验现象 实验结论
活塞往外拉 气体颜色 , 减小压强,化学平衡向生成 的方向移动
活塞往里推 气体颜色 , 增大压强,化学平衡向生成 的方向移动
先变浅又逐渐变深
NO2
先变深又逐渐变浅
N2O4
三、压强对化学平衡的影响
(1)若为反应前后气体体积不等的反应,如N2+3H2 2NH3:
增大压强后,平衡向 的方向移动;
减小压强后,平衡向 的方向移动。
气体体积减小
气体体积增大
不移动
结论
(2)若为等体积反应,如H2+I2 2HI:
改变压强后,平衡 。
三、压强对化学平衡的影响
aA(g)+bB(g) cC(g) (a+b>c)
图象解释
0
v
v正
v逆
v正= v逆
V’正
V’逆
v 正= v 逆
增大压强
0
v
v正
v逆
v正= v逆
V'逆
V'正
v'正= v'逆
减小压强
三、压强对化学平衡的影响
aA(g)+bB(g) cC(g) (a+b
0
v
v正
v逆
v正= v逆
V'逆
V'正
v 正= v 逆
增大压强
0
v
v正
v逆
v正= v逆
V'正
V'逆
v'正= v'逆
减小压强
三、压强对化学平衡的影响
aA(g)+bB(g) cC(g) (a+b=c)
图象解释
0
v
v正
v逆
v正= v逆
V'逆
V'正
v 正= v 逆
增大压强
0
v
v正
v逆
v正= v逆
V'正
V'逆
v'正= v'逆
减小压强
平衡不移动
三、温度对化学平衡的影响
把NO2和N2O4混合气体通入两只连通的烧瓶,然后用弹簧夹夹住乳胶管;把一只烧瓶浸泡在热水中,另一只浸泡在冰水中。观察颜色变化。
实验2-3
三、温度对化学平衡的影响
吸热
放热
其他条件不变时,升高温度平衡向着 的方向移动,降低温度平衡向着 的方向移动。
红棕色变浅
红棕色加深
冰水中 热水中
现象
解释 降温→颜色变浅→平衡向放热方向移动; 升温→颜色变深→平衡向吸热方向移动 结论
三、压强对化学平衡的影响
aA(g)+bB(g) cC(g)
图象解释
0
v
v正
v逆
v正= v逆
V’正
V’逆
v 正= v 逆
升高温度
0
v
v正
v逆
v正= v逆
V'逆
V'正
v'正= v'逆
降低温度
ΔH>0
三、压强对化学平衡的影响
aA(g)+bB(g) cC(g)
图象解释
0
v
v正
v逆
v正= v逆
V'逆
V'正
v 正= v 逆
升高温度
0
v
v正
v逆
v正= v逆
V'正
V'逆
v'正= v'逆
降低温度
ΔH<0
三、催化剂对化学平衡的影响
催化剂可 地改变正反应速率和逆反应速率,因此催化剂对化学平衡的移动 。但催化剂可 反应达到平衡所需的时间。
同等程度
没有影响
改变
0
v
v正
v逆
v正= v逆
V'正
V'逆
v 正= v 逆
如果改变影响平衡的一个因素,平衡就向着能够 这种改变的方向移动,这就是 ,又称为化学平衡移动原理。
减弱
勒夏特列原理
四、勒夏特列原理
提示
①影响平衡的因素只有浓度、压强、温度三种;
②原理的适用范围是只有一项条件变化的情况(温度或压强或一种物质的浓度),当多项条件同时发生变化时,情况比较复杂;
③平衡移动的结果只能减弱(不可能抵消)外界条件的变化。
若其他条件不变,改变下列条件对化学平衡的影响如下:
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
感谢聆听 下次再会
Thanks For Listening. See You Next Time
