【高效备课】人教A版(2019)高中化学选必修1同步课件 2.2.3化学平衡图像
文档属性
| 名称 | 【高效备课】人教A版(2019)高中化学选必修1同步课件 2.2.3化学平衡图像 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-26 08:16:28 | ||
图片预览




文档简介
(共20张PPT)
2.2.3 化学平衡图像
化学平衡图像题的解题方法
1.一看轴,即横坐标和纵坐标的意义。
2.二看点,即一些特殊点如起点、拐点、交点、终点、最高点的意义。
3.三看线即弄清图像中线的走向和变化趋势。
4.四看辅助线弄清图像斜率的大小。
5.五看量的变化如浓度、温度、转化率、物质的量斜率的变化等。
看图像
一、速率-时间图像
① (已知反应)判断引起平衡移动的因素.
② 已知引起平衡移动的因素,
判断反应是吸热或放热,反应前后气体体积的变化.
①改变条件使平衡移动的瞬间曲线是连续的,
则是物质浓度发生改变
②改变条件使平衡移动的瞬间曲线出现断点,
则是温度改变或是压强改变
③改变条件反应速率变化但是平衡不移动,
则是使用催化剂或是反应前后气体系数不变的反应中压强改变
解法:
考法:
D
V正
V逆
V
t
A
V正
V逆
V
t
B
V逆
V正
V
t
C
V正
V逆
V
t
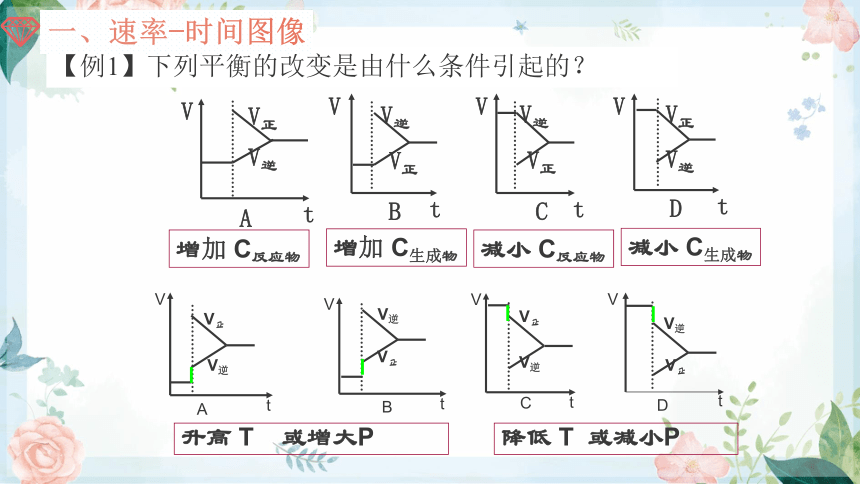
【例1】下列平衡的改变是由什么条件引起的?
增加 C反应物
减小 C生成物
减小 C反应物
增加 C生成物
V正
V逆
A
t
V
V逆
V正
C
V
t
V正
V逆
B
V
t
V逆
V正
D
V
t
升高 T 或增大P
降低 T 或减小P
一、速率-时间图像
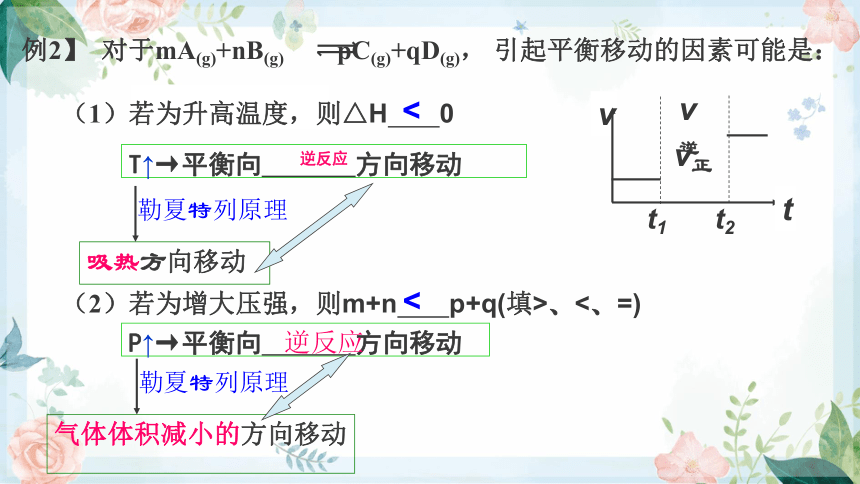
例2】 对于mA(g)+nB(g) pC(g)+qD(g), 引起平衡移动的因素可能是:
v逆
t1 t2
t
v
v正
<
T↑→平衡向 方向移动
逆反应
吸热方向移动
勒夏特列原理
P↑→平衡向 方向移动
逆反应
气体体积减小的方向移动
勒夏特列原理
<
(1)若为升高温度,则△H 0
(2)若为增大压强,则m+n p+q(填>、<、=)
【练1】对于反应mA(g )+ nB(g) pC(g) + qD(g)
v逆
t1
t
v
v正=
t1时的改变因素可能是
_______________________
_____________________
引起的平衡没有移动。
a.加入(正)催化剂
b.当m+n=p+q时增大压强
t
V(正)
V(逆)
V(正)
V(逆)
V(逆)
V(正)
v
V(正)
V(逆)
t1
t2
t3
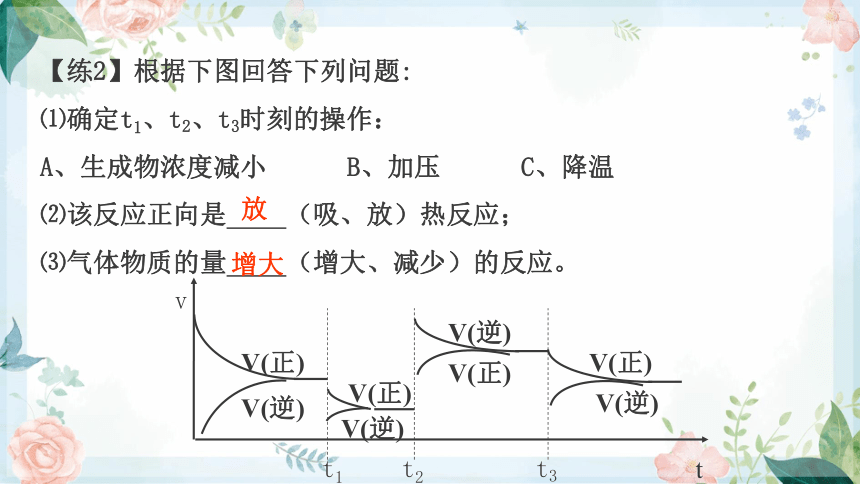
【练2】根据下图回答下列问题:
⑴确定t1、t2、t3时刻的操作:
A、生成物浓度减小 B、加压 C、降温
⑵该反应正向是 (吸、放)热反应;
⑶气体物质的量 (增大、减少)的反应。
放
增大
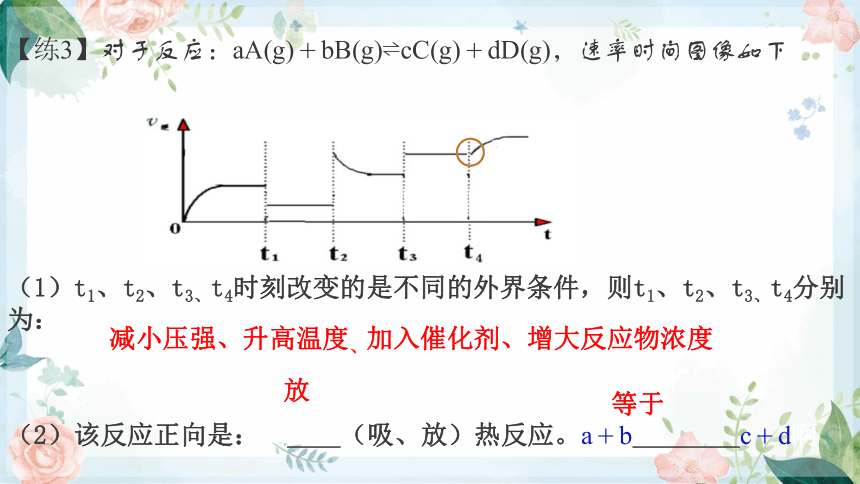
(1)t1、t2、t3、t4时刻改变的是不同的外界条件,则t1、t2、t3、t4分别为:
(2)该反应正向是:啊 (吸、放)热反应。a+b c+d啊
【练3】对于反应:aA(g)+bB(g) cC(g)+dD(g),速率时间图像如下
减小压强、升高温度、加入催化剂、增大反应物浓度
放
等于
t
c
C
A
B
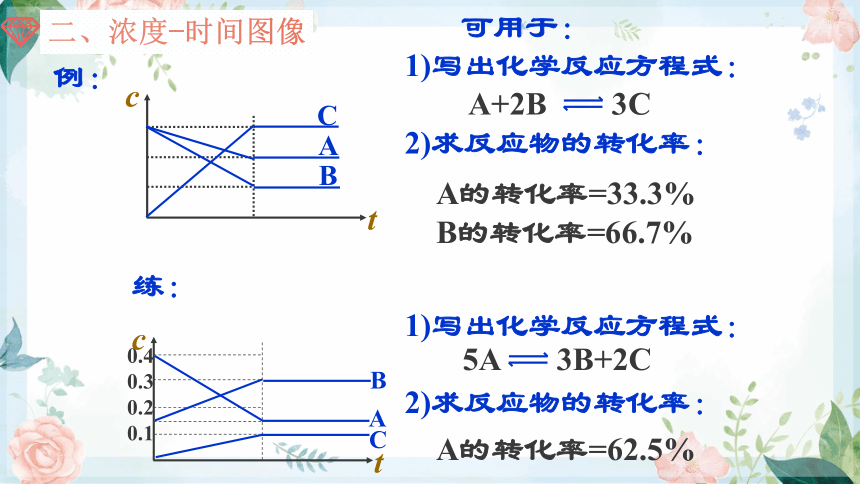
可用于:
1)写出化学反应方程式:
2)求反应物的转化率:
A的转化率=33.3%
B的转化率=66.7%
A
B
C
t
c
0.4
0.3
0.2
0.1
1)写出化学反应方程式:
2)求反应物的转化率:
例:
练:
A的转化率=62.5%
5A 3B+2C
A+2B 3C
二、浓度-时间图像
三、某物质的转化率(或百分含量)-时间-温度(或压强)图像
先从拐点向横轴作垂线:先拐先平,温度、压强均高。
再从拐点向纵轴作垂线:
①分析温度、压强升高时,转化率或含量的变化,
② 判断平衡移动的方向,从而确定反应的热效应
或物质计量数。
t
A的转化率
T1
T2
对于反应 mA(g)+ nB(g) pC(g)+ qD(g)
T1____T2, 正反应____热
P1
P2
t
B的转化率
P1 ___P2 m+n___p+q
>
<
升温
吸
加压
<
【例 】
t
T1
T2
A%
判断正反应是放热还是吸热?
正反应放热
【练】对于反应mA(g)+nB(g) pC(g)+qD(g)
t
P1
P2
m+n=p+q
C%
判断m+n与p+q的关系?
C
B
对于反应mA(g)+nB(g) pC(g)+qD(g)
t
T2P2
T1P2
T1P1
B%
判断m+n与p+q的关系?
正反应是放热还是吸热?
m+n正反应吸热
四、某物质的转化率(或百分含量)-时间-温度和压强图像
先拐先平
定一议二
【例 】 mA(g)+ nB(g) pC(g)+ qD(g)
正反应 热m+n p+q
放
>
等温线
两个变量影响平衡:
① 直接看横轴:
温度升高,图象的变化趋势,得知温度对平衡的影响。
② 再向横轴作垂线:
(即在等温时),得知压强对平衡的影响。
T
C%
1.01*106Pa
1.01*105Pa
1.01*104Pa
四、某物质的转化率(或百分含量)-时间-温度和压强图像
P
A%
500℃
200℃
对于反应mA(g)+nB(g) pC(g)+qD(g)
T
A的转化率
1.01*107Pa
1.01*106Pa
1.01*105Pa
正反应放热
m+n>p+q
正反应放热
m+n等温线
等压线
T
C%
1.01*106Pa
1.01*105Pa
1.01*104Pa
对于反应mA(g)+nB(g) pC(g)+qD(g)
正反应吸热m+n>p+q
P
A%
300℃
200℃
正反应吸热m+n=p+q
对于2A(g)+B(g) C(g)+3D(g)(正反应吸热)有如下图所示的变化,图中Y轴可能表示:
A、B物质的转化率
B、正反应的速率
C、平衡体系中的A%
D、平衡体系中的C%
P
Y
100℃
200℃
300℃
A、D
T
v
v逆
v正
T1
T2
正反应吸热
T
v
v正
v逆
正反应吸热
T
C%
450℃
正反应放热
P
A%
P1
m+n对于反应mA(g)+nB(g) pC(g)+qD(g)
五、其他
[例] 可逆反应: mA(s)+nB(g) ?? pC(g);△H<0,在一定温度下B的转化率与压强的关系如图所示,则下列判断正确的是( )。(双选)
A.m+n<p
B.n>p
C.x点的状态是v正>v逆
D.x点比y点的反应速度慢
α(B)
压强
0
X
Y
BD
六、平衡状态与非平衡状态的判断
谢谢观看
Highlight the key points of the presentation to help the audience understand the content of the presentation and keep up with the pace of the presentation..
2.2.3 化学平衡图像
化学平衡图像题的解题方法
1.一看轴,即横坐标和纵坐标的意义。
2.二看点,即一些特殊点如起点、拐点、交点、终点、最高点的意义。
3.三看线即弄清图像中线的走向和变化趋势。
4.四看辅助线弄清图像斜率的大小。
5.五看量的变化如浓度、温度、转化率、物质的量斜率的变化等。
看图像
一、速率-时间图像
① (已知反应)判断引起平衡移动的因素.
② 已知引起平衡移动的因素,
判断反应是吸热或放热,反应前后气体体积的变化.
①改变条件使平衡移动的瞬间曲线是连续的,
则是物质浓度发生改变
②改变条件使平衡移动的瞬间曲线出现断点,
则是温度改变或是压强改变
③改变条件反应速率变化但是平衡不移动,
则是使用催化剂或是反应前后气体系数不变的反应中压强改变
解法:
考法:
D
V正
V逆
V
t
A
V正
V逆
V
t
B
V逆
V正
V
t
C
V正
V逆
V
t
【例1】下列平衡的改变是由什么条件引起的?
增加 C反应物
减小 C生成物
减小 C反应物
增加 C生成物
V正
V逆
A
t
V
V逆
V正
C
V
t
V正
V逆
B
V
t
V逆
V正
D
V
t
升高 T 或增大P
降低 T 或减小P
一、速率-时间图像
例2】 对于mA(g)+nB(g) pC(g)+qD(g), 引起平衡移动的因素可能是:
v逆
t1 t2
t
v
v正
<
T↑→平衡向 方向移动
逆反应
吸热方向移动
勒夏特列原理
P↑→平衡向 方向移动
逆反应
气体体积减小的方向移动
勒夏特列原理
<
(1)若为升高温度,则△H 0
(2)若为增大压强,则m+n p+q(填>、<、=)
【练1】对于反应mA(g )+ nB(g) pC(g) + qD(g)
v逆
t1
t
v
v正=
t1时的改变因素可能是
_______________________
_____________________
引起的平衡没有移动。
a.加入(正)催化剂
b.当m+n=p+q时增大压强
t
V(正)
V(逆)
V(正)
V(逆)
V(逆)
V(正)
v
V(正)
V(逆)
t1
t2
t3
【练2】根据下图回答下列问题:
⑴确定t1、t2、t3时刻的操作:
A、生成物浓度减小 B、加压 C、降温
⑵该反应正向是 (吸、放)热反应;
⑶气体物质的量 (增大、减少)的反应。
放
增大
(1)t1、t2、t3、t4时刻改变的是不同的外界条件,则t1、t2、t3、t4分别为:
(2)该反应正向是:啊 (吸、放)热反应。a+b c+d啊
【练3】对于反应:aA(g)+bB(g) cC(g)+dD(g),速率时间图像如下
减小压强、升高温度、加入催化剂、增大反应物浓度
放
等于
t
c
C
A
B
可用于:
1)写出化学反应方程式:
2)求反应物的转化率:
A的转化率=33.3%
B的转化率=66.7%
A
B
C
t
c
0.4
0.3
0.2
0.1
1)写出化学反应方程式:
2)求反应物的转化率:
例:
练:
A的转化率=62.5%
5A 3B+2C
A+2B 3C
二、浓度-时间图像
三、某物质的转化率(或百分含量)-时间-温度(或压强)图像
先从拐点向横轴作垂线:先拐先平,温度、压强均高。
再从拐点向纵轴作垂线:
①分析温度、压强升高时,转化率或含量的变化,
② 判断平衡移动的方向,从而确定反应的热效应
或物质计量数。
t
A的转化率
T1
T2
对于反应 mA(g)+ nB(g) pC(g)+ qD(g)
T1____T2, 正反应____热
P1
P2
t
B的转化率
P1 ___P2 m+n___p+q
>
<
升温
吸
加压
<
【例 】
t
T1
T2
A%
判断正反应是放热还是吸热?
正反应放热
【练】对于反应mA(g)+nB(g) pC(g)+qD(g)
t
P1
P2
m+n=p+q
C%
判断m+n与p+q的关系?
C
B
对于反应mA(g)+nB(g) pC(g)+qD(g)
t
T2P2
T1P2
T1P1
B%
判断m+n与p+q的关系?
正反应是放热还是吸热?
m+n
四、某物质的转化率(或百分含量)-时间-温度和压强图像
先拐先平
定一议二
【例 】 mA(g)+ nB(g) pC(g)+ qD(g)
正反应 热m+n p+q
放
>
等温线
两个变量影响平衡:
① 直接看横轴:
温度升高,图象的变化趋势,得知温度对平衡的影响。
② 再向横轴作垂线:
(即在等温时),得知压强对平衡的影响。
T
C%
1.01*106Pa
1.01*105Pa
1.01*104Pa
四、某物质的转化率(或百分含量)-时间-温度和压强图像
P
A%
500℃
200℃
对于反应mA(g)+nB(g) pC(g)+qD(g)
T
A的转化率
1.01*107Pa
1.01*106Pa
1.01*105Pa
正反应放热
m+n>p+q
正反应放热
m+n
等压线
T
C%
1.01*106Pa
1.01*105Pa
1.01*104Pa
对于反应mA(g)+nB(g) pC(g)+qD(g)
正反应吸热m+n>p+q
P
A%
300℃
200℃
正反应吸热m+n=p+q
对于2A(g)+B(g) C(g)+3D(g)(正反应吸热)有如下图所示的变化,图中Y轴可能表示:
A、B物质的转化率
B、正反应的速率
C、平衡体系中的A%
D、平衡体系中的C%
P
Y
100℃
200℃
300℃
A、D
T
v
v逆
v正
T1
T2
正反应吸热
T
v
v正
v逆
正反应吸热
T
C%
450℃
正反应放热
P
A%
P1
m+n
五、其他
[例] 可逆反应: mA(s)+nB(g) ?? pC(g);△H<0,在一定温度下B的转化率与压强的关系如图所示,则下列判断正确的是( )。(双选)
A.m+n<p
B.n>p
C.x点的状态是v正>v逆
D.x点比y点的反应速度慢
α(B)
压强
0
X
Y
BD
六、平衡状态与非平衡状态的判断
谢谢观看
Highlight the key points of the presentation to help the audience understand the content of the presentation and keep up with the pace of the presentation..
