【高效备课】人教A版(2019)高中化学选必修1同步课件 2.2.4等效平衡(共25张PPT)
文档属性
| 名称 | 【高效备课】人教A版(2019)高中化学选必修1同步课件 2.2.4等效平衡(共25张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-26 00:00:00 | ||
图片预览







文档简介
(共25张PPT)
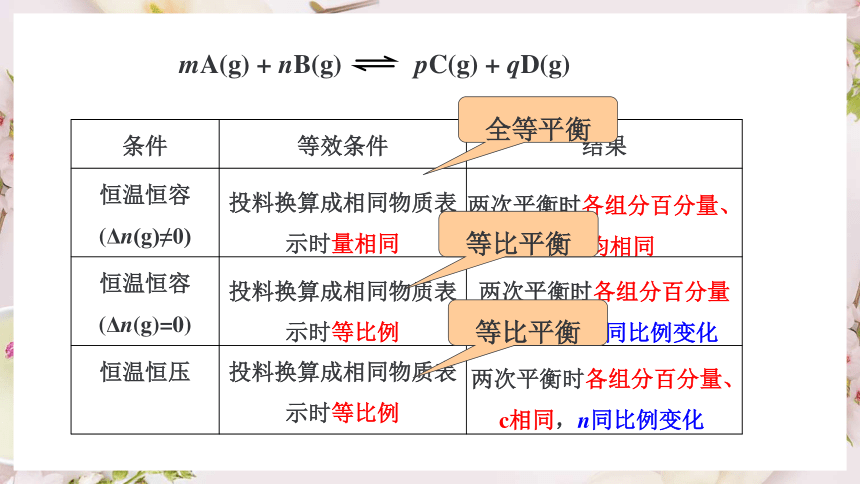
等效平衡
等 效 平 衡
等效平衡:在相同的条件下通过不同的途径,达到的相同的平衡状态。
(1)相同条件:恒温、恒容或恒温、恒压
(2)不同途径:
(3)两平衡等效的标志:达到平衡时,各组分的含量(物质的量分数、质量分数、体积分数等)均对应相等。
①正向建立:只加反应物;
②逆向建立:只加生成物;
③中间建立:反应物、生成物同时加入;
④分批加入:反应一段时间再投料。
两次平衡时各组分百分量、c相同,n同比例变化
投料换算成相同物质表示时等比例
恒温恒压
两次平衡时各组分百分量相同,n、c同比例变化
投料换算成相同物质表示时等比例
恒温恒容
(Δn(g)=0)
两次平衡时各组分百分量、n、c均相同
投料换算成相同物质表示时量相同
恒温恒容
(Δn(g)≠0)
结果
等效条件
条件
mA(g) + nB(g) pC(g) + qD(g)
全等平衡
等比平衡
等比平衡
恒温、恒容下同一可逆反应,无论起始投料如何,只要按化学计量数关系折算成同一边的物质,同一组分的物质的量完全相同,即互为等效平衡。
达到平衡时,相同组分的各项物理数据(包括物质的量、质量、以及物质的量分数、质量分数、体积分数甚至化学反应速率)均相同。这样的平衡状态互称为全同平衡状态,简称全等效平衡。
结论一:恒温恒容条件下全等效平衡
例:2SO2 + O2 2SO3
起 2 mol 1 mol 0
起 0 0 2 mol
等效
起 4 mol 2 mol 0
平衡右移 V(SO3)%大于w%
如V(SO3)%
均为w%
现象
极端假设法:
通过可逆反应的化学计量系数比换算成同一边的物质的物质的量。
结论一:恒温恒容条件下全等效平衡
例1.在恒温恒容条件下,按下列四种情况分别建立平衡,其中为等效平衡的是 。
N2(g) + 3H2(g) 2NH3(g)
① 1 mol 3 mol 0 mol
0 mol 0 mol 2 mol
③ 0.5 mol 1.5 mol 1 mol
1 mol 3 mol 2 mol
⑤ x mol y mol z mol
①②③
一边倒 1 mol 3 mol 0 mol
思考:其它条件不变,第⑤组数据满足什么条件,会和第①组数据建立起等效平衡
x+z/2=1;
y+3z/2=3.
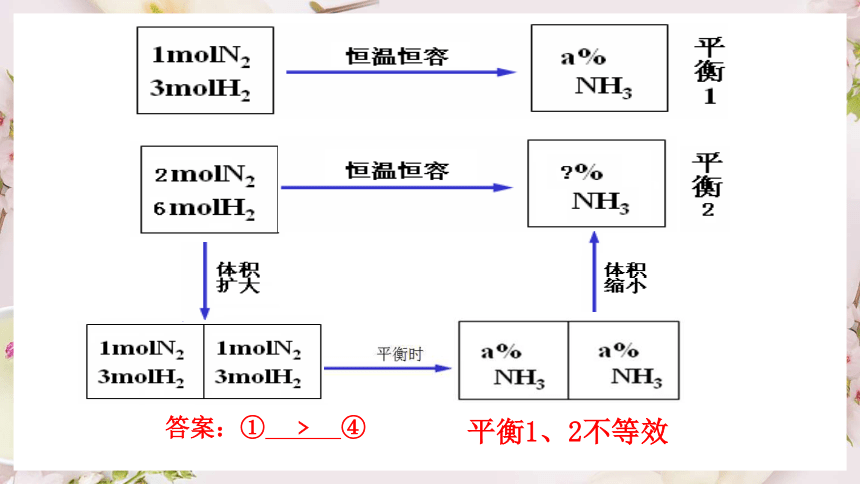
在例1中,①④的起始量如下,它们不能建立等效平衡,那么平衡时N2的体积分数大小关系式① ④
N2(g) + 3H2(g) 2NH3(g)
① 1 mol 3 mol 0 mol
④ 1 mol 3 mol 2 mol
解析:利用恒温恒容下的等效平衡观点 ④与之全等效
全等效 2 mol 6 mol 0 mol
建模处理:
恒温恒容下
平衡1、2不等效
答案:① ﹥ ④
例2.一固定体积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g) 3C(g)+D(g),达到平衡时,C的浓度为Wmol/L;若维持容器体积和温度不变,按下列四种方法改变起始物质,达平衡时C的浓度仍为Wmol/L的是( )
A.4mol A + 2mol B
B.2mol A + 1mol B + 3mol C + 1mol D
C.3mol C + 1mol D +1mol B
D.3mol C + 1mol D
E、1molA+0.5molB+1.5molC+0.5molD
(2+2)molA+(1+1)molB
2molA
+(1+1)molB
2molA+1molB
(1+1)molA+(0.5+0.5)molB
DE
延伸提问,A选项平衡时C的浓度是多少?
Wmol/L ﹤ C(C) ﹤ 2Wmol/L
1.将3 mol A和1 mol B放入恒温恒容的密闭容器中,发生如下
3A(g)+B(g) 2C(g)+D(g),达到平衡后C的含量为 w %,
若维持温度和体积不变,按下列4种配比投料,平衡后C的含量
仍为 w %的是 ( )
A. 6 mol A + 2 mol B
B. 3 mol A + 1 mol B + 2 mol C
C. 1 mol B + 2 mol C + 1 mol D
D. 2 mol C + 1 mol D
D
(6 2 0 0)
(3 1 2 0)
(3 2 0 0)
(3 1 0 0)
2.一定温度下,将a mol PCl5通入一个容积固定不变的密闭容器中,发生反应:PCl5(g) PCl3(g)+Cl2(g),反应达到平衡时,测得混合气体的压强为p1,此时再向容器中通入a mol PCl5,同样温度下再达到平衡时,测得压强为p2,下列判断正确的是( )
A.2p1>p2 B.PCl5的分解率增大
C.p1>p2 D.Cl2的体积分数增大
a mol
PCl5
原开始
平衡压强为p1
平衡状态
2a mol
PCl5
后开始
平衡压强为p2
平衡状态
A
3.将1 mol SO2和1 mol O2通入体积不变的密闭容器中,在一定条件下发生反应,达到平衡时SO3为0.3 mol,此时若移走0.5 molO2和0.5 molSO2,相同温度下再次达到新平衡时SO3的物质的量为( )
A.0.3 mol B.0.15 mol
C.小于0.15 mol D.大于0.15 mol,小于0.3 mol
1mol SO2
1mol O2
原开始
平衡SO3为0.3 mol
平衡状态
0.5molSO2
0.5mol O2
后开始
平衡SO3为?
平衡状态
C
2 SO2(g)+ O2(g) 2SO3(g)
结论二:恒温恒容条件下等体积反应等比等效平衡
恒温、恒容时,对等体积反应,无论起始投料如何,只要按化学计量数关系折算成同一边的物质后,物质的量之比对应相等即等效平衡。
平衡时,相同组分的百分含量(物质的量分数、质量分数、体积分数)均相同。但相同组分平衡时的物质的量、物质的量浓度和一边倒后的量成正比关系。
例如,恒温恒容时H2(g) + Br2(g) 2HBr (g)
① 1mol 1mol 0mol
② 2mol 2mol 1mol
两种情况建立的化学平衡状态等效。
1.在恒温恒容条件下,按下列四种情况分别建立平衡,其中为等效平衡的是 。
CO(g) + H2O(g) CO2(g)+ H2(g)
① 2 mol 2 mol 0 mol 0 mol
② 0 mol 0 mol 4 mol 4 mol
③ 4 mol 4 mol 2 mol 2 mol
④ 1 mol 2 mol 1 mol 2 mol
①②③
2.固定容积的密闭容器中,一定温度下发生下:H2(g)+Br2(g) 2HBr(g)已知加入1molH2和2molBr2时,达到平衡后生成amolHBr,在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号(1)、(2)、(3)的状态,填写表中的空白。
起始状态(mol) 平衡时HBr的物质的量(mol)
编号 H2 Br2 HBr
已知 1 2 0 a
(1) 2 4 0
(2) 1 0.5a
(3) m n(n≥2m)
2a
0
0.5
2(n-2m)
(n-m)a
H2(g)+Br2(g) 2HBr
(3) m n x
一边倒 (m+x/2) (n+x/2) 0
(m+x/2) :(n+x/2)=1:2,
解得x= 2(n-2m)
则m+x/2 = n-m
所以平衡时的量为(n-m)a mol
3.在一固定容积的密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g) xC(g),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数仍为W%,则x值为( )
A、1 B、2 C、3 D、4
BC
2A(g) + B(g) xC(g)
原起始 2mol 1mol 0mol
后起始 0.6mol 0.3mol 1.4mol
一边倒 (0.6+2.8/x)mol (0.3+1.4/x) mol 0 mol
恒温恒容下有两种等效:
1.全等效,即:
0.6+2.8/x=2
0.3+1.4/x=1, 解得x=2
2.等体积反应成比例等效,即:若该反应是等体积反应,即x=3,若满足(0.6+2.8/x):( 0.3+1.4/x)=2:1,也可以等效。解得x=3,假设成立。
结论三:恒温恒压条件下等比等效平衡
恒温、恒压时,对任何可逆反应,无论起始投料如何,只要按化学计量数关系折算成同一边的物质后,物质的量之比对应相等即等效平衡。
平衡时,相同组分的百分含量(物质的量分数、质量分数、体积分数)、物质的量浓度均相同。但相同组分平衡时的物质的量、反应器的体积和一边倒后的量成正比关系。
起 2 mol 1 mol 0
起 0 0 2 mol
等效
起 4 mol 2 mol 0
起 a b c
a+c b+c/2 0
结论三:恒温恒压条件下等比等效平衡
例:2SO2 + O2 2SO3
例:恒温恒压下,在一个可变容积的容器中发生如下反应: A(g) + B(g) C(g)
(1)若开始时放入1molA和1molB,达到平衡后,生成amolC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,C的物质的量是3amol,x= mol。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量是 mol.
1-a
3a
2
6a
1: 在等温、等容条件下,有下列气体反应:
2A(g)+2B(g) C(g)+3D(g),
现分别从两条途径建立平衡: (1)A、B的起始浓度均为2 mol/L;(2)C、D的起始浓度分别为2 mol/L和6 mol/L。 (1)、(2)两途径最终达到平衡时,下列叙述正确的是( )
体系内混合气体的百分组成相同
B. 体系内混合气体的百分组成不同
C.体系内混合气体的平均分子量不同
D. (1)途径混合气体密度为(2) 途径混合气体密度为1/2
A D
2.某温度下,在一容积可变的容器中,反应
2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A .均减半 B.均加倍
C.均增加1 mol D.均减少1 mol
C
3.在恒温、恒压的条件下,向可变容积的密闭容器中充入3L A和2L B,发生如下反应:
3A(g)+2B(g) xC(g)+yD(g)
达到平衡时,C的体积分数为m%。若维持温度压强不变,以0.6LA , 0.4LB , 4LC , 0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则x、y的值分别为
A x=3 y=1 B x=4 y=1
C x=5 y =1 D x=10 y=2
C D
3A(气)+2B(气) xC(气)+yD(气)
3L 2L
0.6L 0.4 L 4 0.8
+x +y
+0.2 x
+0.2y
4+0.2 x
0.8+0.2y
=
x
y
x
y
=
5
1
两次平衡时各组分百分量、c相同,n同比例变化
投料换算成相同物质表示时等比例
恒温恒压
两次平衡时各组分百分量相同,n、c同比例变化
投料换算成相同物质表示时等比例
恒温恒容
(Δn(g)=0)
两次平衡时各组分百分量、n、c均相同
投料换算成相同物质表示时量相同
恒温恒容
(Δn(g)≠0)
结果
等效条件
条件
mA(g) + nB(g) pC(g) + qD(g)
全等平衡
等比平衡
等比平衡
谢谢您
等效平衡
等 效 平 衡
等效平衡:在相同的条件下通过不同的途径,达到的相同的平衡状态。
(1)相同条件:恒温、恒容或恒温、恒压
(2)不同途径:
(3)两平衡等效的标志:达到平衡时,各组分的含量(物质的量分数、质量分数、体积分数等)均对应相等。
①正向建立:只加反应物;
②逆向建立:只加生成物;
③中间建立:反应物、生成物同时加入;
④分批加入:反应一段时间再投料。
两次平衡时各组分百分量、c相同,n同比例变化
投料换算成相同物质表示时等比例
恒温恒压
两次平衡时各组分百分量相同,n、c同比例变化
投料换算成相同物质表示时等比例
恒温恒容
(Δn(g)=0)
两次平衡时各组分百分量、n、c均相同
投料换算成相同物质表示时量相同
恒温恒容
(Δn(g)≠0)
结果
等效条件
条件
mA(g) + nB(g) pC(g) + qD(g)
全等平衡
等比平衡
等比平衡
恒温、恒容下同一可逆反应,无论起始投料如何,只要按化学计量数关系折算成同一边的物质,同一组分的物质的量完全相同,即互为等效平衡。
达到平衡时,相同组分的各项物理数据(包括物质的量、质量、以及物质的量分数、质量分数、体积分数甚至化学反应速率)均相同。这样的平衡状态互称为全同平衡状态,简称全等效平衡。
结论一:恒温恒容条件下全等效平衡
例:2SO2 + O2 2SO3
起 2 mol 1 mol 0
起 0 0 2 mol
等效
起 4 mol 2 mol 0
平衡右移 V(SO3)%大于w%
如V(SO3)%
均为w%
现象
极端假设法:
通过可逆反应的化学计量系数比换算成同一边的物质的物质的量。
结论一:恒温恒容条件下全等效平衡
例1.在恒温恒容条件下,按下列四种情况分别建立平衡,其中为等效平衡的是 。
N2(g) + 3H2(g) 2NH3(g)
① 1 mol 3 mol 0 mol
0 mol 0 mol 2 mol
③ 0.5 mol 1.5 mol 1 mol
1 mol 3 mol 2 mol
⑤ x mol y mol z mol
①②③
一边倒 1 mol 3 mol 0 mol
思考:其它条件不变,第⑤组数据满足什么条件,会和第①组数据建立起等效平衡
x+z/2=1;
y+3z/2=3.
在例1中,①④的起始量如下,它们不能建立等效平衡,那么平衡时N2的体积分数大小关系式① ④
N2(g) + 3H2(g) 2NH3(g)
① 1 mol 3 mol 0 mol
④ 1 mol 3 mol 2 mol
解析:利用恒温恒容下的等效平衡观点 ④与之全等效
全等效 2 mol 6 mol 0 mol
建模处理:
恒温恒容下
平衡1、2不等效
答案:① ﹥ ④
例2.一固定体积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g) 3C(g)+D(g),达到平衡时,C的浓度为Wmol/L;若维持容器体积和温度不变,按下列四种方法改变起始物质,达平衡时C的浓度仍为Wmol/L的是( )
A.4mol A + 2mol B
B.2mol A + 1mol B + 3mol C + 1mol D
C.3mol C + 1mol D +1mol B
D.3mol C + 1mol D
E、1molA+0.5molB+1.5molC+0.5molD
(2+2)molA+(1+1)molB
2molA
+(1+1)molB
2molA+1molB
(1+1)molA+(0.5+0.5)molB
DE
延伸提问,A选项平衡时C的浓度是多少?
Wmol/L ﹤ C(C) ﹤ 2Wmol/L
1.将3 mol A和1 mol B放入恒温恒容的密闭容器中,发生如下
3A(g)+B(g) 2C(g)+D(g),达到平衡后C的含量为 w %,
若维持温度和体积不变,按下列4种配比投料,平衡后C的含量
仍为 w %的是 ( )
A. 6 mol A + 2 mol B
B. 3 mol A + 1 mol B + 2 mol C
C. 1 mol B + 2 mol C + 1 mol D
D. 2 mol C + 1 mol D
D
(6 2 0 0)
(3 1 2 0)
(3 2 0 0)
(3 1 0 0)
2.一定温度下,将a mol PCl5通入一个容积固定不变的密闭容器中,发生反应:PCl5(g) PCl3(g)+Cl2(g),反应达到平衡时,测得混合气体的压强为p1,此时再向容器中通入a mol PCl5,同样温度下再达到平衡时,测得压强为p2,下列判断正确的是( )
A.2p1>p2 B.PCl5的分解率增大
C.p1>p2 D.Cl2的体积分数增大
a mol
PCl5
原开始
平衡压强为p1
平衡状态
2a mol
PCl5
后开始
平衡压强为p2
平衡状态
A
3.将1 mol SO2和1 mol O2通入体积不变的密闭容器中,在一定条件下发生反应,达到平衡时SO3为0.3 mol,此时若移走0.5 molO2和0.5 molSO2,相同温度下再次达到新平衡时SO3的物质的量为( )
A.0.3 mol B.0.15 mol
C.小于0.15 mol D.大于0.15 mol,小于0.3 mol
1mol SO2
1mol O2
原开始
平衡SO3为0.3 mol
平衡状态
0.5molSO2
0.5mol O2
后开始
平衡SO3为?
平衡状态
C
2 SO2(g)+ O2(g) 2SO3(g)
结论二:恒温恒容条件下等体积反应等比等效平衡
恒温、恒容时,对等体积反应,无论起始投料如何,只要按化学计量数关系折算成同一边的物质后,物质的量之比对应相等即等效平衡。
平衡时,相同组分的百分含量(物质的量分数、质量分数、体积分数)均相同。但相同组分平衡时的物质的量、物质的量浓度和一边倒后的量成正比关系。
例如,恒温恒容时H2(g) + Br2(g) 2HBr (g)
① 1mol 1mol 0mol
② 2mol 2mol 1mol
两种情况建立的化学平衡状态等效。
1.在恒温恒容条件下,按下列四种情况分别建立平衡,其中为等效平衡的是 。
CO(g) + H2O(g) CO2(g)+ H2(g)
① 2 mol 2 mol 0 mol 0 mol
② 0 mol 0 mol 4 mol 4 mol
③ 4 mol 4 mol 2 mol 2 mol
④ 1 mol 2 mol 1 mol 2 mol
①②③
2.固定容积的密闭容器中,一定温度下发生下:H2(g)+Br2(g) 2HBr(g)已知加入1molH2和2molBr2时,达到平衡后生成amolHBr,在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号(1)、(2)、(3)的状态,填写表中的空白。
起始状态(mol) 平衡时HBr的物质的量(mol)
编号 H2 Br2 HBr
已知 1 2 0 a
(1) 2 4 0
(2) 1 0.5a
(3) m n(n≥2m)
2a
0
0.5
2(n-2m)
(n-m)a
H2(g)+Br2(g) 2HBr
(3) m n x
一边倒 (m+x/2) (n+x/2) 0
(m+x/2) :(n+x/2)=1:2,
解得x= 2(n-2m)
则m+x/2 = n-m
所以平衡时的量为(n-m)a mol
3.在一固定容积的密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g) xC(g),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数仍为W%,则x值为( )
A、1 B、2 C、3 D、4
BC
2A(g) + B(g) xC(g)
原起始 2mol 1mol 0mol
后起始 0.6mol 0.3mol 1.4mol
一边倒 (0.6+2.8/x)mol (0.3+1.4/x) mol 0 mol
恒温恒容下有两种等效:
1.全等效,即:
0.6+2.8/x=2
0.3+1.4/x=1, 解得x=2
2.等体积反应成比例等效,即:若该反应是等体积反应,即x=3,若满足(0.6+2.8/x):( 0.3+1.4/x)=2:1,也可以等效。解得x=3,假设成立。
结论三:恒温恒压条件下等比等效平衡
恒温、恒压时,对任何可逆反应,无论起始投料如何,只要按化学计量数关系折算成同一边的物质后,物质的量之比对应相等即等效平衡。
平衡时,相同组分的百分含量(物质的量分数、质量分数、体积分数)、物质的量浓度均相同。但相同组分平衡时的物质的量、反应器的体积和一边倒后的量成正比关系。
起 2 mol 1 mol 0
起 0 0 2 mol
等效
起 4 mol 2 mol 0
起 a b c
a+c b+c/2 0
结论三:恒温恒压条件下等比等效平衡
例:2SO2 + O2 2SO3
例:恒温恒压下,在一个可变容积的容器中发生如下反应: A(g) + B(g) C(g)
(1)若开始时放入1molA和1molB,达到平衡后,生成amolC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,C的物质的量是3amol,x= mol。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量是 mol.
1-a
3a
2
6a
1: 在等温、等容条件下,有下列气体反应:
2A(g)+2B(g) C(g)+3D(g),
现分别从两条途径建立平衡: (1)A、B的起始浓度均为2 mol/L;(2)C、D的起始浓度分别为2 mol/L和6 mol/L。 (1)、(2)两途径最终达到平衡时,下列叙述正确的是( )
体系内混合气体的百分组成相同
B. 体系内混合气体的百分组成不同
C.体系内混合气体的平均分子量不同
D. (1)途径混合气体密度为(2) 途径混合气体密度为1/2
A D
2.某温度下,在一容积可变的容器中,反应
2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A .均减半 B.均加倍
C.均增加1 mol D.均减少1 mol
C
3.在恒温、恒压的条件下,向可变容积的密闭容器中充入3L A和2L B,发生如下反应:
3A(g)+2B(g) xC(g)+yD(g)
达到平衡时,C的体积分数为m%。若维持温度压强不变,以0.6LA , 0.4LB , 4LC , 0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则x、y的值分别为
A x=3 y=1 B x=4 y=1
C x=5 y =1 D x=10 y=2
C D
3A(气)+2B(气) xC(气)+yD(气)
3L 2L
0.6L 0.4 L 4 0.8
+x +y
+0.2 x
+0.2y
4+0.2 x
0.8+0.2y
=
x
y
x
y
=
5
1
两次平衡时各组分百分量、c相同,n同比例变化
投料换算成相同物质表示时等比例
恒温恒压
两次平衡时各组分百分量相同,n、c同比例变化
投料换算成相同物质表示时等比例
恒温恒容
(Δn(g)=0)
两次平衡时各组分百分量、n、c均相同
投料换算成相同物质表示时量相同
恒温恒容
(Δn(g)≠0)
结果
等效条件
条件
mA(g) + nB(g) pC(g) + qD(g)
全等平衡
等比平衡
等比平衡
谢谢您
