【高效备课】人教A版(2019)高中化学选必修1同步课件 2.3化学反应的方向(共28张PPT)
文档属性
| 名称 | 【高效备课】人教A版(2019)高中化学选必修1同步课件 2.3化学反应的方向(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-26 08:17:50 | ||
图片预览







文档简介
(共28张PPT)
第三节 化学反应的方向
生活中的自发过程
高山流水
电流
高山流水
高能状态
低能状态
水总是自发地从高处往低处流——有趋向于最低能量状态的倾向。
利用水泵可将水从低处流向高处
生活中的自发过程
高电势状态
低电势状态
电流总是自发地从高电势流向低电势——有趋向于最低电势状态的倾向。
生活中的自发过程
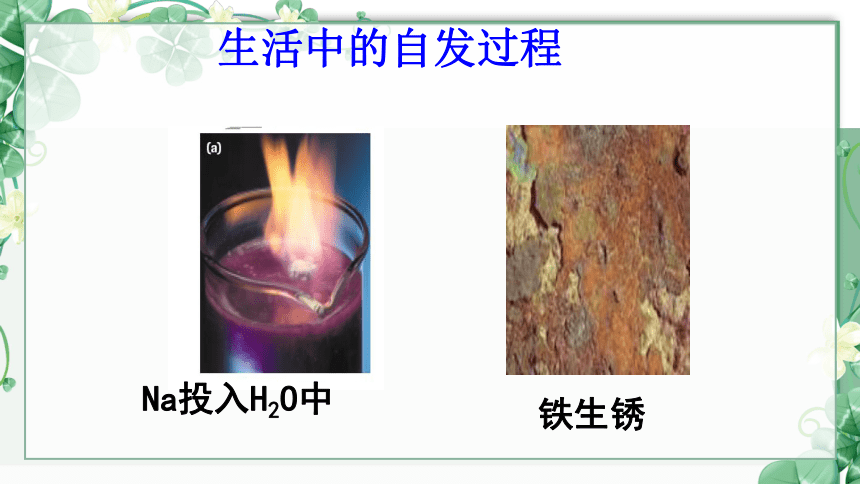
Na投入H2O中
铁生锈
生活中的自发过程
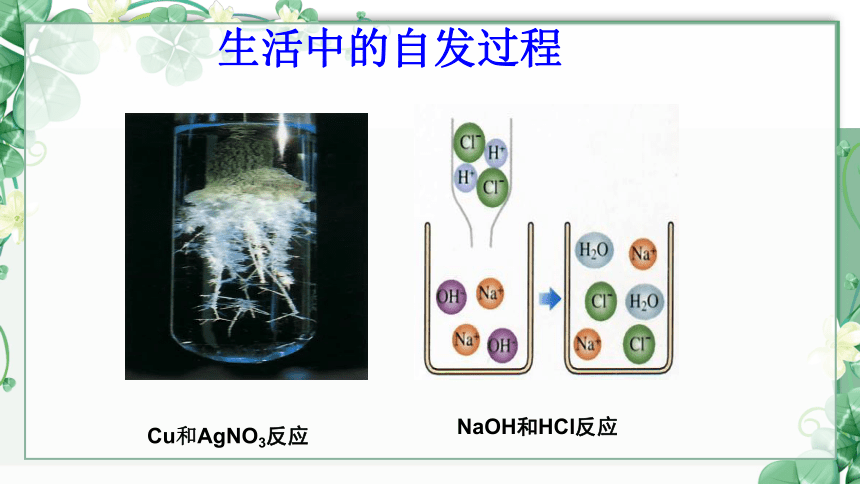
Cu和AgNO3反应
NaOH和HCl反应
生活中的自发过程
在一定条件下,不借助外部力量就能自动进行的过程
在给定的一组条件下,一个反应可以自发地进行到显著程度,就称为自发反应。
如何判断一个过程,一个反应能否自发进行?
自发反应:
非自发过程:
在一定条件下,需要持续外力作用才能维持进行的过程。
自发过程:
Cu和AgNO3反应
NaOH和HCl反应
Na投入H2O中
铁生锈
Cu(s)+2AgNO3(aq)=Cu(NO3)2(aq)+2Ag (s) △H= -181.75 kJ·mol-1
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H= -57.3 kJ·mol-1
2Na(s)+2H2O(l)=2NaOH(aq)+H2(g) △H= -636.1 kJ·mol-1
Fe(s) …… Fe2O3 (aq) △H= -790.7 kJ·mol-1
自发反应
共同点——放热反应 △H<0
能量判据(焓判据)∶
自发过程的体系趋向于从高能状态转变为低能状态(△H ﹤0)。
即△H<0的反应有自发进行的倾向。
多数能自发进行的化学反应是放热反应
反应物的总能量高
生成物的总能量低
放热反应
△H<0
焓判据是判断化学反应进行方向的判据之一。
一、化学反应进行方向的焓判据
注意:
(1)焓判据只能用于判断过程的方向,能否实现要看具体条件;
(2)焓判据只判断一定条件化学反应能否自发进行,与化学反应速率无关。
(3)反应焓变是反应能否自发进行的一个因素,但不是唯一因素
2N2O5(g) =4NO2(g)+O2(g) △H=+109.8kJ/mol
(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H=+74.9 kJ/mol
NaHCO3(s)+HCl(aq)=CO2(g)+NaCl(aq)+H2O(l) △H=+31.4KJ/mol
结论:△H < O有利于反应自发进行
但自发反应不一定要△H < 0
自发反应一定要△H < O ?
焓变是反应能否自发进行的一个因素,但不是唯一因素。
冰块融化
品红在水中扩散
你能解释蒸汽扩散和火柴混乱的真正原因吗?
蒸汽扩散
火柴散落
——趋向于体系混乱度增大
有序
混乱
火柴散落
定义:描述体系混乱度的物理量
符号:S 单位:J·mol-1·K-1
体系混乱度越大,熵值越大;
体系混乱度越小,熵值越小。
熵增原理(又称为熵判据).
体系有自发向混乱度增加的方向变化的倾向。(即熵增△S>0)
△S=S生成物总熵-S反应物总熵
△S越大,越有利于反应自发进行
熵
二、化学反应进行方向的熵判据
CH4 O2 CO2
186.15 205.03 214
H2O(l) HNO3(l) Br2(l)
69.9 156 152
NaCl Fe 金刚石
72.1 27.3 2.4
标准状况下:1 mol不同物质的熵S(J mol-1K-1)
熵值最大
熵值最小
(1)物质的混乱度:体系混乱度越大,熵值越大;
(2)同一条件:不同物质的熵值不同;
(3)物质的存在状态:S(g) > S(l) > S(s)。
2N2O5(g) =4NO2(g)+O2(g) △H=+56.7kJ/mol
(NH4 )2CO3(s)=NH4HCO3(s)+NH3(g) △H=+74.9 kJ/mol
思考:
两个反应都是混乱度增大的反应。
熵增,△S>0,有利于自发反应
这两个反应都是吸热反应,但却能自发进行,为什么?
1、同一物质状态改变:
2、固体的溶解过程、墨水扩散过程和气体扩散过程。
3、反应过程中气体物质的量增多的反应。
4. 生成气体的反应。
导致熵增(△S>0)的一些因素
固态
液态
气态
熵增
熵增
自发反应一定是熵增加的反应吗?
2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) △S=-39.35J mol-1 K-1
结论:△S > O,有利于反应自发进行,
自发反应不一定要△S > O。
熵变是反应能否自发进行一个因素,但不是唯一因素。
铝热反应( △S<0)也能自发反应。
CaCO3(s)=CaO(s)+CO2(g)这个反应能否自发进行?
已知: △H(298K)=+178.2KJ mol-1,
△S(298K)=+169.6J mol-1 K-1
思考思考
总结:自发过程的变化趋势
1.能量趋于降低 2.混乱度趋于增加
美国物理化学家吉布斯
研究表明:在等温、等压条件下封闭体系中,自由能的变化综合反应了体系的焓变和熵变对洗发过程的影响:
△G = △H - T△S
( G :自由能 T:绝对温度)
△G = △H - T△S < 0 反应能自发进行
△G = △H - T△S >0 反应不能自发进行
△G = △H - T△S =0 反应达到平衡状态
反应进行方向的判断方法:
三、化学反应进行方向的复合判据
2、物质的混乱度趋于增加
1、物质具有的能量趋于降低
H(焓变)
S(熵变)>0
焓(H)判据
熵(S)判据
放热反应
焓变 熵变 化学反应能否自发进行
自发进行
不自发进行
不能定性判断
不能定性判断
H<0
H<0
H>0
H>0
S>0
S>0
S<0
S<0
熵增原理
<0
三、化学反应进行方向的复合判据
△H
△S
H>0
S>0
高温下
反应自发进行
H>0
S<0
所有温度下
反应不能自发进行
H<0
S>0
所有温度下
反应自发进行
H<0
S<0
低温下
反应自发进行
△G = △H - T△S
1)H+(aq)+OH-(aq)=H2O (l) △S=+80.7J·mol-1·K-1
放热
熵增
吸热
熵减
放热
熵减
吸热
熵增
2)TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) △H=+161.9kJ·mol-1
3)NH3(g)+HCl(g)=NH4Cl(s) △H= -176.9kJ·mol-1
△S= -38.4J·mol-1·K-1
△S= -284.3J·mol-1·K-1
△S=+169.6J·mol-1·K-1
4)CaCO3(s)=CaO(s)+CO2(g )
应用判据解决问题
根据你已有的知识和经验,分析下列过程的焓变、熵变与是能否自发进行
△H=+178.2kJ·mol-1
△H= - 57.3kJ·mol-1
自发
不自发
自发
高温自发,低温不自发
小结
化学反应进行方向的判据
1.焓判据:
2.熵判据:
3.复合判据:
能量降低的方向,就是反应容易进行的方向( H<0)
熵增的方向,就是反应容易进行的方向( S>0)
吉布斯自由能减小的方向,就是反应容易进行的方向( G<0)
清 新
欣
赏
感
谢
Small potted plants, potted plants that express landscapes.
您
第三节 化学反应的方向
生活中的自发过程
高山流水
电流
高山流水
高能状态
低能状态
水总是自发地从高处往低处流——有趋向于最低能量状态的倾向。
利用水泵可将水从低处流向高处
生活中的自发过程
高电势状态
低电势状态
电流总是自发地从高电势流向低电势——有趋向于最低电势状态的倾向。
生活中的自发过程
Na投入H2O中
铁生锈
生活中的自发过程
Cu和AgNO3反应
NaOH和HCl反应
生活中的自发过程
在一定条件下,不借助外部力量就能自动进行的过程
在给定的一组条件下,一个反应可以自发地进行到显著程度,就称为自发反应。
如何判断一个过程,一个反应能否自发进行?
自发反应:
非自发过程:
在一定条件下,需要持续外力作用才能维持进行的过程。
自发过程:
Cu和AgNO3反应
NaOH和HCl反应
Na投入H2O中
铁生锈
Cu(s)+2AgNO3(aq)=Cu(NO3)2(aq)+2Ag (s) △H= -181.75 kJ·mol-1
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H= -57.3 kJ·mol-1
2Na(s)+2H2O(l)=2NaOH(aq)+H2(g) △H= -636.1 kJ·mol-1
Fe(s) …… Fe2O3 (aq) △H= -790.7 kJ·mol-1
自发反应
共同点——放热反应 △H<0
能量判据(焓判据)∶
自发过程的体系趋向于从高能状态转变为低能状态(△H ﹤0)。
即△H<0的反应有自发进行的倾向。
多数能自发进行的化学反应是放热反应
反应物的总能量高
生成物的总能量低
放热反应
△H<0
焓判据是判断化学反应进行方向的判据之一。
一、化学反应进行方向的焓判据
注意:
(1)焓判据只能用于判断过程的方向,能否实现要看具体条件;
(2)焓判据只判断一定条件化学反应能否自发进行,与化学反应速率无关。
(3)反应焓变是反应能否自发进行的一个因素,但不是唯一因素
2N2O5(g) =4NO2(g)+O2(g) △H=+109.8kJ/mol
(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H=+74.9 kJ/mol
NaHCO3(s)+HCl(aq)=CO2(g)+NaCl(aq)+H2O(l) △H=+31.4KJ/mol
结论:△H < O有利于反应自发进行
但自发反应不一定要△H < 0
自发反应一定要△H < O ?
焓变是反应能否自发进行的一个因素,但不是唯一因素。
冰块融化
品红在水中扩散
你能解释蒸汽扩散和火柴混乱的真正原因吗?
蒸汽扩散
火柴散落
——趋向于体系混乱度增大
有序
混乱
火柴散落
定义:描述体系混乱度的物理量
符号:S 单位:J·mol-1·K-1
体系混乱度越大,熵值越大;
体系混乱度越小,熵值越小。
熵增原理(又称为熵判据).
体系有自发向混乱度增加的方向变化的倾向。(即熵增△S>0)
△S=S生成物总熵-S反应物总熵
△S越大,越有利于反应自发进行
熵
二、化学反应进行方向的熵判据
CH4 O2 CO2
186.15 205.03 214
H2O(l) HNO3(l) Br2(l)
69.9 156 152
NaCl Fe 金刚石
72.1 27.3 2.4
标准状况下:1 mol不同物质的熵S(J mol-1K-1)
熵值最大
熵值最小
(1)物质的混乱度:体系混乱度越大,熵值越大;
(2)同一条件:不同物质的熵值不同;
(3)物质的存在状态:S(g) > S(l) > S(s)。
2N2O5(g) =4NO2(g)+O2(g) △H=+56.7kJ/mol
(NH4 )2CO3(s)=NH4HCO3(s)+NH3(g) △H=+74.9 kJ/mol
思考:
两个反应都是混乱度增大的反应。
熵增,△S>0,有利于自发反应
这两个反应都是吸热反应,但却能自发进行,为什么?
1、同一物质状态改变:
2、固体的溶解过程、墨水扩散过程和气体扩散过程。
3、反应过程中气体物质的量增多的反应。
4. 生成气体的反应。
导致熵增(△S>0)的一些因素
固态
液态
气态
熵增
熵增
自发反应一定是熵增加的反应吗?
2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) △S=-39.35J mol-1 K-1
结论:△S > O,有利于反应自发进行,
自发反应不一定要△S > O。
熵变是反应能否自发进行一个因素,但不是唯一因素。
铝热反应( △S<0)也能自发反应。
CaCO3(s)=CaO(s)+CO2(g)这个反应能否自发进行?
已知: △H(298K)=+178.2KJ mol-1,
△S(298K)=+169.6J mol-1 K-1
思考思考
总结:自发过程的变化趋势
1.能量趋于降低 2.混乱度趋于增加
美国物理化学家吉布斯
研究表明:在等温、等压条件下封闭体系中,自由能的变化综合反应了体系的焓变和熵变对洗发过程的影响:
△G = △H - T△S
( G :自由能 T:绝对温度)
△G = △H - T△S < 0 反应能自发进行
△G = △H - T△S >0 反应不能自发进行
△G = △H - T△S =0 反应达到平衡状态
反应进行方向的判断方法:
三、化学反应进行方向的复合判据
2、物质的混乱度趋于增加
1、物质具有的能量趋于降低
H(焓变)
S(熵变)>0
焓(H)判据
熵(S)判据
放热反应
焓变 熵变 化学反应能否自发进行
自发进行
不自发进行
不能定性判断
不能定性判断
H<0
H<0
H>0
H>0
S>0
S>0
S<0
S<0
熵增原理
<0
三、化学反应进行方向的复合判据
△H
△S
H>0
S>0
高温下
反应自发进行
H>0
S<0
所有温度下
反应不能自发进行
H<0
S>0
所有温度下
反应自发进行
H<0
S<0
低温下
反应自发进行
△G = △H - T△S
1)H+(aq)+OH-(aq)=H2O (l) △S=+80.7J·mol-1·K-1
放热
熵增
吸热
熵减
放热
熵减
吸热
熵增
2)TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) △H=+161.9kJ·mol-1
3)NH3(g)+HCl(g)=NH4Cl(s) △H= -176.9kJ·mol-1
△S= -38.4J·mol-1·K-1
△S= -284.3J·mol-1·K-1
△S=+169.6J·mol-1·K-1
4)CaCO3(s)=CaO(s)+CO2(g )
应用判据解决问题
根据你已有的知识和经验,分析下列过程的焓变、熵变与是能否自发进行
△H=+178.2kJ·mol-1
△H= - 57.3kJ·mol-1
自发
不自发
自发
高温自发,低温不自发
小结
化学反应进行方向的判据
1.焓判据:
2.熵判据:
3.复合判据:
能量降低的方向,就是反应容易进行的方向( H<0)
熵增的方向,就是反应容易进行的方向( S>0)
吉布斯自由能减小的方向,就是反应容易进行的方向( G<0)
清 新
欣
赏
感
谢
Small potted plants, potted plants that express landscapes.
您
