【高效备课】人教A版(2019)高中化学选必修1同步课件 3.2.2 pH相关计算(共40张ppt)
文档属性
| 名称 | 【高效备课】人教A版(2019)高中化学选必修1同步课件 3.2.2 pH相关计算(共40张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-26 08:20:48 | ||
图片预览


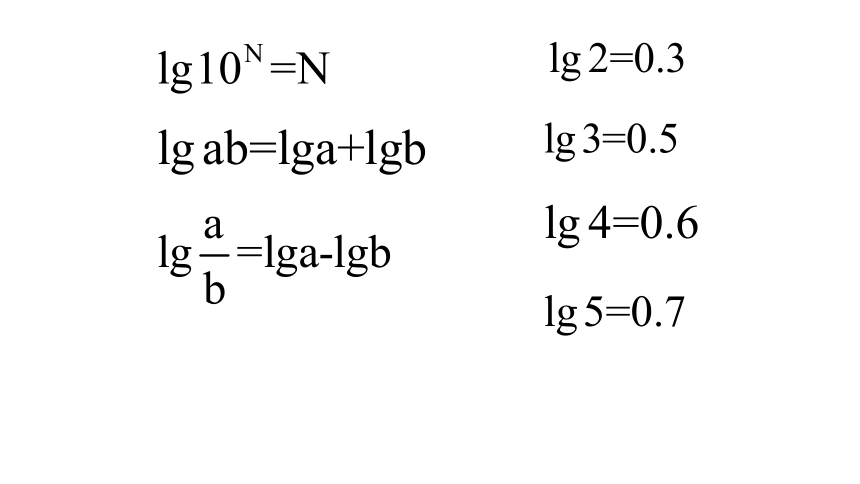








文档简介
3.2.2 pH的相关计算
学
习
目
标
1.掌握pH的简单计算,了解各类混合溶液pH的计算。(难点)
2.了解溶液稀释时pH的变化规律。(重点)
总的原则
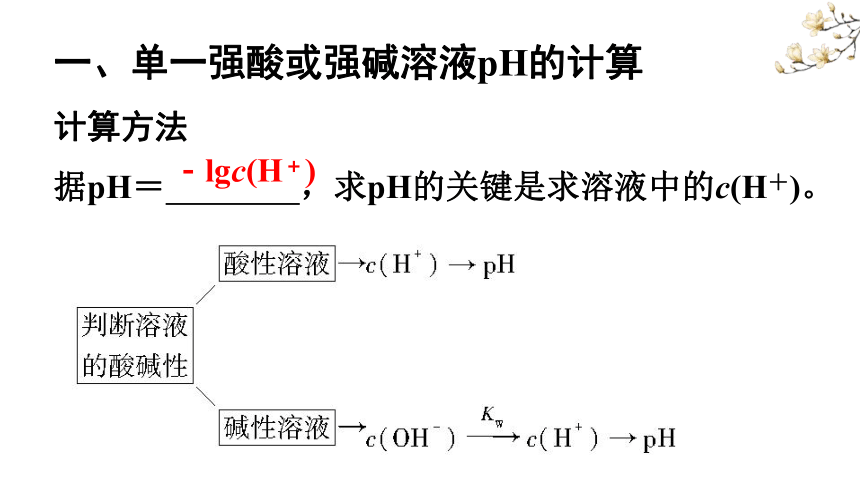
1、若溶液呈酸性,先求c(H+)→再求pH=-lg c(H+)。
2、若溶液呈碱性,先求c(OH-)→再求c(H+)=KW/c(OH-)
→最后求pH。
-lgc(H+)
一、单一强酸或强碱溶液pH的计算
计算方法
据pH= ,求pH的关键是求溶液中的c(H+)。
例1:常温下,计算浓度为0.05mol/L的硫酸溶液的pH。
解:c(H+)=2c(H2SO4)=0.05×2=10-1mol/L
pH =-lg c(H+)=1
解:c(OH-)=2c[Ba(OH)2 ] =0.005×2=10-2mol/L
c(H+)=
KW
c(OH—)
=10-12mol/L
pH =-lg c(H+)=12
例2:常温时,计算浓度为0.005mol/L的氢氧化钡溶液的pH。
强酸和强碱溶液的pH计算
(1)强酸溶液(以c mol·L-1的HnA溶液为例)
c(H+)= mol·L-1
pH=-lg c(H+)= 。
(2)强碱溶液[以c mol·L-1的B(OH)n溶液为例]
c(OH-)= mol·L-1
c(H+)= ,pH=-lg c(H+)=
nc
-lgnc
nc
1. 计算25 ℃时,下列溶液的pH。
(1)0.005 mol·L-1的H2SO4溶液;
(2)0.005 mol·L-1的Ba(OH)2溶液。
解析:
(1)c(H+)=2c(H2SO4)=2×0.005 mol·L-1=0.01 mol·L-1,pH=2;
(2)c(OH-)=2c[Ba(OH)2]=2×0.005 mol·L-1=0.01 mol·L-1,
c(H+)=KW/c(OH-)=10-12 mol·L-1,pH=12。
课堂练习
解:
c(H+)=
=
10-5V+ 10-3V
2V
≈
10-3V
2V
=
10-3
2
mol/L
pH =-lg c(H+)=3.3
例3 pH=5和pH=3的两种盐酸,以等体积混合后,计算溶液的pH。
二、强酸强酸或强碱强碱混合溶液pH的计算
n1(H+)+n2(H+)
V总
解:
c(OH-)=
=
10-4V+ 10-2V
2V
≈
10-2V
2V
=
10-2
2
mol/L
pH =-lg c(H+)=11.7
n1(OH-)+n2(OH-)
V总
c(H+)=
KW
c(OH-)
=2×10-12mol/L
例4:常温时,将pH=10的NaOH溶液与pH=12的NaOH溶液以1:1体积比混合,混合后的pH为多少?
2. 求室温下,下列溶液的pH(忽略混合后溶液体积的变化,已知lg 2=0.3,lg 5=0.7)。
(1)pH=13的NaOH溶液与pH=11的NaOH溶液等体积混合;
(2)pH=1的盐酸与pH=3的盐酸等体积混合。
解析:(1)c(OH-)=≈5×10-2 mol·L-1,
则c(H+)= mol·L-1=2×10-13 mol·L-1,即pH=12.7。
(2)c(H+)=≈5×10-2 mol·L-1,即pH=1.3。
课堂练习
两种强碱等体积混合,混合液pH = pH 大- lg2 = pH大- 0.3
■计算:
⑴pH=13和pH=11的强碱
⑵pH=1和pH=3的强酸等体积混合的混合液的pH值
解:⑴pH混= pH大-0.3=13-0.3=12.7
⑵pH混= pH小+0.3=1+0.3=1.3
两种强酸等体积混合,混合液pH = pH 小+ lg2 = pH小+0.3
三、酸碱中和后溶液pH的计算
例6:常温时,0.1mol/L的NaOH和0.06mol/L 的H2SO4
溶液等体积混合,求混合溶液的pH。
n(H+)=2c(H2SO4)V=0.12V
解:
设两溶液的体积都为V
n(OH—)=c(NaOH)V=0.1V
H+ + OH— = H2O
x=0.1V 0.1V
设氢氧根离子完全反应,需要氢离子为xmol
因为0.12V>0.1V 所以酸过量
c(H+)=
n(H+)—n(OH-)
V(总)
=
0.12V—0.1V
2V
=10—2mol/L
pH =2
酸碱中和后溶液pH的计算
先计算酸溶液中n(H+)和碱溶液中n(OH-),判断酸碱反应后是酸剩余还是碱剩余还是酸碱恰好完全反应。
若n(H+)>n(OH-),则酸剩余,计算混合溶液中剩余的c(H+), 再计算pH=-lg c(H+)
若n(H+)的c(OH-),c(H+)= ,再计算pH=-lg c(H+)
若n(H+)=n(OH-),则酸碱恰好完全反应,溶液显中性,常温下溶液的pH=7。
例7:常温时,0.1mol/L的盐酸和0.06mol/L的Ba(OH)2溶液等体积混合,求混合溶液的pH。
解:
n(OH—)=2c(Ba(OH)2)V=0.12V
设两溶液的体积都为V
n(H+)=C(HCl)V=0.1V
因为0.12V>0.1V 所以碱过量
c(OH—)=
n(OH—)—n(H+)
V(总)
=
0.12V—0.1V
2V
=10-2mol/L
pH=-lgc(H+)=12
c(H+)=10-12mol/L
3.求室温下,下列溶液的pH(忽略混合后溶液体积的变化,
已知lg 2=0.3,lg 5=0.7)。
(1)pH=3的盐酸与pH=13的NaOH溶液等体积混合;
(2)pH=1的盐酸与pH=11的NaOH溶液等体积混合。
解析:(1)盐酸中:c(H+)=1×10-3 mol·L-1,NaOH溶液中:c(OH-)=0.1 mol·L-1,故两溶液等体积混合后,NaOH过量,c(OH-)=≈5×10-2 mol·L-1,即pH=12.7。
(2)盐酸过量,c(H+)≈=5×10-2 mol·L-1,即pH=1.3。
课堂练习
四、稀释问题
例8:将pH=3的盐酸溶液,稀释10倍,100倍,10000倍,计算稀释溶液的pH
稀释10倍
c(H+)=
10—3V
10V
=10—4mol/L
pH =—lg c(H+)=4
稀释100倍
c(H+)=
10—3V
100V
pH =—lg c(H+)=5
=10—5mol/L
稀释10000倍
c(H+)=
10—3V
10000V
1、强酸或强碱稀释
=10—8mol/L
pH =—lg c(H+)=8
×
稀释10000倍
pH =—lg C(H+)=6.99
c(H+) =
10—3V+9999V×10—7
10000V
c(H+)=
(10—8+10—7)mol/L
总结:强酸每稀释倍,pH增加1个单位,
当把酸电离出的氢离子稀释到接近10—7mol/L时候要考虑水的电离,pH<7。
=1.1×10—7mol/L
2、弱酸或弱碱稀释
弱电解质是越稀越电离,稀释向电离平衡移动
例9 将pH=3的醋酸酸溶液,稀释10倍,100倍,10000倍,计算稀释溶液的pH
稀释10倍
c(H+)=
10—3V+ n(H+)补
10V
>10—4mol/L
pH =—lg c(H+)<4
稀释10倍
pH =—lg c(H+)<5
>10—5mol/L
c(H+)=
10—3V+ n(H+)补
100V
pH=2的盐酸和醋酸稀释100倍后的pH情况
NaOH
c(OH—)=
10—2V
100V
=10—4mol/L
c(H+)=
KW
c(OH—)
=10—10mol/L
pH=10
氨水
c(OH—)=
10—2V +n(OH—)补
100V
>10—4mol/L
c(H+)=
KW
C(OH—)
< 10—10mol/L
pH>10
例10 将pH=12的NaOH溶液、氨水,稀释100倍,计算稀释溶液的pH
pH=12的NaOH溶液、氨水,稀释100倍
稀释后溶液pH的变化规律
(1)对于强酸溶液(pH=a)每稀释10n倍,pH增大n个单位,即pH=a+n(a+n<7)。
(2)对于强碱溶液(pH=b)每稀释10n倍,pH减小n个单位,即pH=b-n(b-n>7)。
(3)对于弱酸溶液(pH=a)每稀释10n倍,pH的范围是:a (4)对于弱碱溶液(pH=b)每稀释10n倍,pH的范围是:
b-n (5)pH相等的强酸、弱酸、强碱、弱碱稀释时的pH变化如下图所示:
加水稀释的倍数
五、pH之和为14的问题
例11 将pH=2的盐酸与 pH=12的NaOH溶液等体积混合,计算混合后溶液的pH
例12 将pH=2的盐酸与 pH=12的氨水等体积混合,判断混合后溶液的酸碱性
例13 将pH=2的醋酸与 pH=12的NaOH溶液等体积混合,判断混合后溶液的酸碱性
酸、碱中和反应后溶液pH的判断方法
(1)酸与碱的pH之和为14,等体积混合
规律:谁弱谁过量,谁弱显谁性。
原因:酸和碱已电离出的H+与OH-恰好中和,谁弱谁过量,中和后还能继续电离。
(2)等体积的强酸(pH1)和强碱(pH2)混合
1、计算下列溶液的pH:
(1)某H2SO4溶液的浓度是0.005 mol·L-1,
①此溶液的pH为________。
②用水稀释到原来体积的100倍,pH为________。
③再继续稀释104倍,pH为________。
2
4
接近7
课堂练习
(2)pH=3的盐酸与pH=5的硫酸等体积混合,pH为________。
(3)pH=10和pH=12的两种NaOH溶液等体积混合,pH为_____。
(4)pH=12的NaOH溶液和pH=4的HCl溶液等体积混合,pH
为______。
3.3
11.7
11.7
课堂练习
2、pH=2的两种弱酸HA、HB加水稀释后,溶液pH随加水量
变化的曲线如下图所示。则下列叙述正确的是( )
A.电离常数HA>HB
B.等体积的HA和HB与等浓度的NaOH 反应,HA消耗的NaOH多
C.等体积的HA和HB与足量的Zn反应,HA生成的氢气多
D.两种酸的物质的量浓度相同
【解析】 由图中曲线可以看出,HA的酸性强于HB,故电离常数HA>HB,即A正确;酸性越弱,电离的程度越小,故pH=2时,HB的浓度大于HA,D错;等体积时,HB的物质的量大于HA,故B、C错误。
【答案】 A
3、室温时,下列混合溶液的pH一定小于7的是( )
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
【解析】 解答本题时应先明确所给的酸或碱是强电解质,还是弱电解质,是一元的还是二元的,然后判断酸碱发生反应时是酸过量还是碱过量,从而判断溶液的pH是否小于7。A项,反应时氨水过量溶液显碱性,pH>7,错误;B项,盐酸中c(H+)=1×10-3 mol·L-1,Ba(OH)2溶液中c(OH-)=1×10-3 mol·L-1,两者又是等体积混合,故有n(H+)=n(OH-),混合后溶液的pH=7,错误;C项,因醋酸是弱酸,反应时酸过量,反应后pH<7,正确;D项,因NH3·H2O是弱碱,反应时碱过量,反应后pH>7,错误。
【答案】 C
4、25 ℃时,将某强酸和某强碱溶液按1∶10的体积比混合后,溶液恰好呈中性,则混合前此强酸和强碱的pH和为( )
A.12 B.13 C.14 D.15
【解析】 强酸和强碱溶液按1∶10的体积比混合恰好呈中性,则说明酸溶液中的氢离子浓度等于碱溶液中的氢氧根离子的浓度的10倍,故pH和为13,选B。
学
习
目
标
1.掌握pH的简单计算,了解各类混合溶液pH的计算。(难点)
2.了解溶液稀释时pH的变化规律。(重点)
总的原则
1、若溶液呈酸性,先求c(H+)→再求pH=-lg c(H+)。
2、若溶液呈碱性,先求c(OH-)→再求c(H+)=KW/c(OH-)
→最后求pH。
-lgc(H+)
一、单一强酸或强碱溶液pH的计算
计算方法
据pH= ,求pH的关键是求溶液中的c(H+)。
例1:常温下,计算浓度为0.05mol/L的硫酸溶液的pH。
解:c(H+)=2c(H2SO4)=0.05×2=10-1mol/L
pH =-lg c(H+)=1
解:c(OH-)=2c[Ba(OH)2 ] =0.005×2=10-2mol/L
c(H+)=
KW
c(OH—)
=10-12mol/L
pH =-lg c(H+)=12
例2:常温时,计算浓度为0.005mol/L的氢氧化钡溶液的pH。
强酸和强碱溶液的pH计算
(1)强酸溶液(以c mol·L-1的HnA溶液为例)
c(H+)= mol·L-1
pH=-lg c(H+)= 。
(2)强碱溶液[以c mol·L-1的B(OH)n溶液为例]
c(OH-)= mol·L-1
c(H+)= ,pH=-lg c(H+)=
nc
-lgnc
nc
1. 计算25 ℃时,下列溶液的pH。
(1)0.005 mol·L-1的H2SO4溶液;
(2)0.005 mol·L-1的Ba(OH)2溶液。
解析:
(1)c(H+)=2c(H2SO4)=2×0.005 mol·L-1=0.01 mol·L-1,pH=2;
(2)c(OH-)=2c[Ba(OH)2]=2×0.005 mol·L-1=0.01 mol·L-1,
c(H+)=KW/c(OH-)=10-12 mol·L-1,pH=12。
课堂练习
解:
c(H+)=
=
10-5V+ 10-3V
2V
≈
10-3V
2V
=
10-3
2
mol/L
pH =-lg c(H+)=3.3
例3 pH=5和pH=3的两种盐酸,以等体积混合后,计算溶液的pH。
二、强酸强酸或强碱强碱混合溶液pH的计算
n1(H+)+n2(H+)
V总
解:
c(OH-)=
=
10-4V+ 10-2V
2V
≈
10-2V
2V
=
10-2
2
mol/L
pH =-lg c(H+)=11.7
n1(OH-)+n2(OH-)
V总
c(H+)=
KW
c(OH-)
=2×10-12mol/L
例4:常温时,将pH=10的NaOH溶液与pH=12的NaOH溶液以1:1体积比混合,混合后的pH为多少?
2. 求室温下,下列溶液的pH(忽略混合后溶液体积的变化,已知lg 2=0.3,lg 5=0.7)。
(1)pH=13的NaOH溶液与pH=11的NaOH溶液等体积混合;
(2)pH=1的盐酸与pH=3的盐酸等体积混合。
解析:(1)c(OH-)=≈5×10-2 mol·L-1,
则c(H+)= mol·L-1=2×10-13 mol·L-1,即pH=12.7。
(2)c(H+)=≈5×10-2 mol·L-1,即pH=1.3。
课堂练习
两种强碱等体积混合,混合液pH = pH 大- lg2 = pH大- 0.3
■计算:
⑴pH=13和pH=11的强碱
⑵pH=1和pH=3的强酸等体积混合的混合液的pH值
解:⑴pH混= pH大-0.3=13-0.3=12.7
⑵pH混= pH小+0.3=1+0.3=1.3
两种强酸等体积混合,混合液pH = pH 小+ lg2 = pH小+0.3
三、酸碱中和后溶液pH的计算
例6:常温时,0.1mol/L的NaOH和0.06mol/L 的H2SO4
溶液等体积混合,求混合溶液的pH。
n(H+)=2c(H2SO4)V=0.12V
解:
设两溶液的体积都为V
n(OH—)=c(NaOH)V=0.1V
H+ + OH— = H2O
x=0.1V 0.1V
设氢氧根离子完全反应,需要氢离子为xmol
因为0.12V>0.1V 所以酸过量
c(H+)=
n(H+)—n(OH-)
V(总)
=
0.12V—0.1V
2V
=10—2mol/L
pH =2
酸碱中和后溶液pH的计算
先计算酸溶液中n(H+)和碱溶液中n(OH-),判断酸碱反应后是酸剩余还是碱剩余还是酸碱恰好完全反应。
若n(H+)>n(OH-),则酸剩余,计算混合溶液中剩余的c(H+), 再计算pH=-lg c(H+)
若n(H+)
若n(H+)=n(OH-),则酸碱恰好完全反应,溶液显中性,常温下溶液的pH=7。
例7:常温时,0.1mol/L的盐酸和0.06mol/L的Ba(OH)2溶液等体积混合,求混合溶液的pH。
解:
n(OH—)=2c(Ba(OH)2)V=0.12V
设两溶液的体积都为V
n(H+)=C(HCl)V=0.1V
因为0.12V>0.1V 所以碱过量
c(OH—)=
n(OH—)—n(H+)
V(总)
=
0.12V—0.1V
2V
=10-2mol/L
pH=-lgc(H+)=12
c(H+)=10-12mol/L
3.求室温下,下列溶液的pH(忽略混合后溶液体积的变化,
已知lg 2=0.3,lg 5=0.7)。
(1)pH=3的盐酸与pH=13的NaOH溶液等体积混合;
(2)pH=1的盐酸与pH=11的NaOH溶液等体积混合。
解析:(1)盐酸中:c(H+)=1×10-3 mol·L-1,NaOH溶液中:c(OH-)=0.1 mol·L-1,故两溶液等体积混合后,NaOH过量,c(OH-)=≈5×10-2 mol·L-1,即pH=12.7。
(2)盐酸过量,c(H+)≈=5×10-2 mol·L-1,即pH=1.3。
课堂练习
四、稀释问题
例8:将pH=3的盐酸溶液,稀释10倍,100倍,10000倍,计算稀释溶液的pH
稀释10倍
c(H+)=
10—3V
10V
=10—4mol/L
pH =—lg c(H+)=4
稀释100倍
c(H+)=
10—3V
100V
pH =—lg c(H+)=5
=10—5mol/L
稀释10000倍
c(H+)=
10—3V
10000V
1、强酸或强碱稀释
=10—8mol/L
pH =—lg c(H+)=8
×
稀释10000倍
pH =—lg C(H+)=6.99
c(H+) =
10—3V+9999V×10—7
10000V
c(H+)=
(10—8+10—7)mol/L
总结:强酸每稀释倍,pH增加1个单位,
当把酸电离出的氢离子稀释到接近10—7mol/L时候要考虑水的电离,pH<7。
=1.1×10—7mol/L
2、弱酸或弱碱稀释
弱电解质是越稀越电离,稀释向电离平衡移动
例9 将pH=3的醋酸酸溶液,稀释10倍,100倍,10000倍,计算稀释溶液的pH
稀释10倍
c(H+)=
10—3V+ n(H+)补
10V
>10—4mol/L
pH =—lg c(H+)<4
稀释10倍
pH =—lg c(H+)<5
>10—5mol/L
c(H+)=
10—3V+ n(H+)补
100V
pH=2的盐酸和醋酸稀释100倍后的pH情况
NaOH
c(OH—)=
10—2V
100V
=10—4mol/L
c(H+)=
KW
c(OH—)
=10—10mol/L
pH=10
氨水
c(OH—)=
10—2V +n(OH—)补
100V
>10—4mol/L
c(H+)=
KW
C(OH—)
< 10—10mol/L
pH>10
例10 将pH=12的NaOH溶液、氨水,稀释100倍,计算稀释溶液的pH
pH=12的NaOH溶液、氨水,稀释100倍
稀释后溶液pH的变化规律
(1)对于强酸溶液(pH=a)每稀释10n倍,pH增大n个单位,即pH=a+n(a+n<7)。
(2)对于强碱溶液(pH=b)每稀释10n倍,pH减小n个单位,即pH=b-n(b-n>7)。
(3)对于弱酸溶液(pH=a)每稀释10n倍,pH的范围是:a
b-n
加水稀释的倍数
五、pH之和为14的问题
例11 将pH=2的盐酸与 pH=12的NaOH溶液等体积混合,计算混合后溶液的pH
例12 将pH=2的盐酸与 pH=12的氨水等体积混合,判断混合后溶液的酸碱性
例13 将pH=2的醋酸与 pH=12的NaOH溶液等体积混合,判断混合后溶液的酸碱性
酸、碱中和反应后溶液pH的判断方法
(1)酸与碱的pH之和为14,等体积混合
规律:谁弱谁过量,谁弱显谁性。
原因:酸和碱已电离出的H+与OH-恰好中和,谁弱谁过量,中和后还能继续电离。
(2)等体积的强酸(pH1)和强碱(pH2)混合
1、计算下列溶液的pH:
(1)某H2SO4溶液的浓度是0.005 mol·L-1,
①此溶液的pH为________。
②用水稀释到原来体积的100倍,pH为________。
③再继续稀释104倍,pH为________。
2
4
接近7
课堂练习
(2)pH=3的盐酸与pH=5的硫酸等体积混合,pH为________。
(3)pH=10和pH=12的两种NaOH溶液等体积混合,pH为_____。
(4)pH=12的NaOH溶液和pH=4的HCl溶液等体积混合,pH
为______。
3.3
11.7
11.7
课堂练习
2、pH=2的两种弱酸HA、HB加水稀释后,溶液pH随加水量
变化的曲线如下图所示。则下列叙述正确的是( )
A.电离常数HA>HB
B.等体积的HA和HB与等浓度的NaOH 反应,HA消耗的NaOH多
C.等体积的HA和HB与足量的Zn反应,HA生成的氢气多
D.两种酸的物质的量浓度相同
【解析】 由图中曲线可以看出,HA的酸性强于HB,故电离常数HA>HB,即A正确;酸性越弱,电离的程度越小,故pH=2时,HB的浓度大于HA,D错;等体积时,HB的物质的量大于HA,故B、C错误。
【答案】 A
3、室温时,下列混合溶液的pH一定小于7的是( )
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
【解析】 解答本题时应先明确所给的酸或碱是强电解质,还是弱电解质,是一元的还是二元的,然后判断酸碱发生反应时是酸过量还是碱过量,从而判断溶液的pH是否小于7。A项,反应时氨水过量溶液显碱性,pH>7,错误;B项,盐酸中c(H+)=1×10-3 mol·L-1,Ba(OH)2溶液中c(OH-)=1×10-3 mol·L-1,两者又是等体积混合,故有n(H+)=n(OH-),混合后溶液的pH=7,错误;C项,因醋酸是弱酸,反应时酸过量,反应后pH<7,正确;D项,因NH3·H2O是弱碱,反应时碱过量,反应后pH>7,错误。
【答案】 C
4、25 ℃时,将某强酸和某强碱溶液按1∶10的体积比混合后,溶液恰好呈中性,则混合前此强酸和强碱的pH和为( )
A.12 B.13 C.14 D.15
【解析】 强酸和强碱溶液按1∶10的体积比混合恰好呈中性,则说明酸溶液中的氢离子浓度等于碱溶液中的氢氧根离子的浓度的10倍,故pH和为13,选B。
