【高效备课】人教A版(2019)高中化学选必修1同步课件 3.3.2 盐类水解的应用(共27张PPT)
文档属性
| 名称 | 【高效备课】人教A版(2019)高中化学选必修1同步课件 3.3.2 盐类水解的应用(共27张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 991.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-26 08:22:19 | ||
图片预览








文档简介
(共27张PPT)
*
第三章 水溶液中的离子平衡
第三节 盐类的水解
第2课时影响盐类水解的因素和盐类水解的应用
能发生水解的盐的类型是什么?
不同类型的盐水解后的酸碱性分别是什么?
强酸弱碱盐、强碱弱酸盐、弱酸弱碱盐
——有弱才水解
强酸强碱盐、强酸弱碱盐、强碱弱酸盐
中 性
酸 性
碱 性
——谁强显谁性、同强显中性
*
NaA = A- + Na+
H2O
H+ + OH-
+
HA
(弱酸)
如HA越弱, 则A-和H+更 结合, 水的电离平衡程度更 , 即水解的程度更 。
容易
大
大
*
1)内因:反应物本身的性质
例:比较Na2CO3和CH3COONa的碱性?
H2CO3
CH3COOH
酸性:
<
碱性:
Na2CO3 CH3COONa
>
越弱越水解
二、影响盐类水解的因素
*
影响盐类水解的因素
已知HClO、CH3COOH、HNO2都是弱酸,其电离常数Ka分别为3.0×10-8、1.8×10-5、 4.6×10-4。则浓度都为0.1mol/LNaClO、CH3COONa、NaNO2溶液的pH值大小顺序为:
NaClO>CH3COONa>NaNO2
识记常见弱酸的酸性顺序:
H2SO3 >H3PO4>HF>CH3COOH
>H2CO3>HClO
*
2) 外因:
①温度:
水解是中和反应的逆反应,
是吸热反应。
越热越水解
问题: 能否通过加热蒸发FeCl3溶液的方法得到其结晶?
Fe3+ + 3H2O Fe(OH)3 + 3H+
只能得到Fe2O3固体
例、热的碱液(Na2CO3溶液)去油污的能力较强
二、影响盐类水解的因素
*
③溶液的酸碱度:
问题:配制FeCl3溶液需要注意什么问题?
Fe3+ + 3H2O Fe(OH)3 + 3H+
加入一定量的HCl,抑制FeCl3的水解。
酸碱能够抑制或促进水解
盐类水解产生H+或OH-,凡是能够结合H+,OH-的物质,均会促进盐类的水解。
②浓度:
稀释溶液可以促进水解,使水解平衡向右移动,即盐的浓度越小其水解程度越大
越稀越水解
二、影响盐类水解的因素
*
二、影响盐类水解的因素
P73
1.FeCl3溶液能否发生水解 如果可以,请写出水解方程式。
2.应用平衡移动原理,影响其水解的因素有哪些
FeCl3+3H2O Fe(OH)3+3HCl
Fe3++3H2O Fe(OH)3+3H+
*
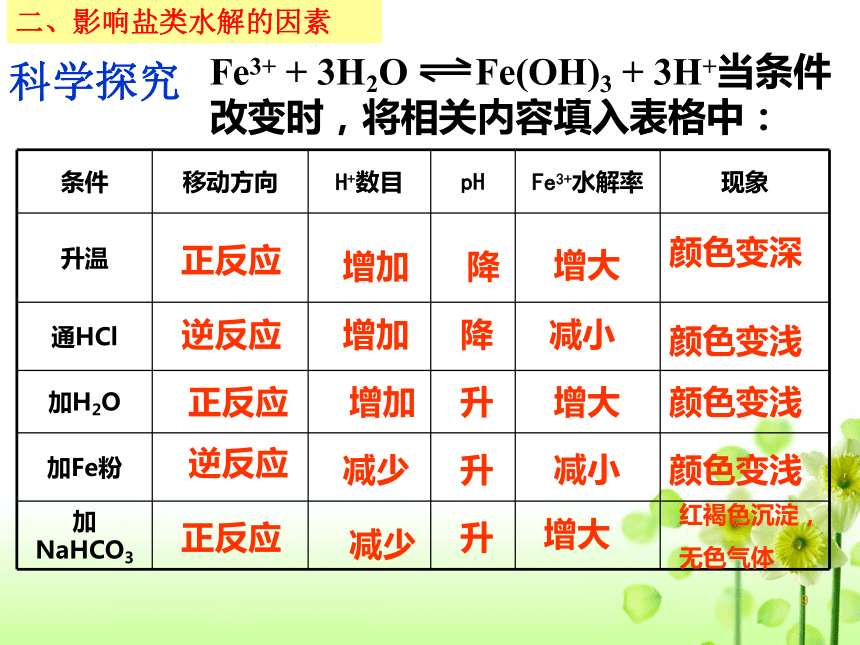
条件 移动方向 H+数目 pH Fe3+水解率 现象
升温
通HCl
加H2O
加Fe粉
加NaHCO3
Fe3+ + 3H2O Fe(OH)3 + 3H+当条件改变时,将相关内容填入表格中:
正反应
增加
降
增大
颜色变深
逆反应
正反应
逆反应
正反应
增加
增加
减少
减少
降
升
升
升
减小
增大
减小
增大
颜色变浅
颜色变浅
颜色变浅
红褐色沉淀,
无色气体
科学探究
二、影响盐类水解的因素
影响盐类水解的因素
1、决定因素(内因):
2、外界条件(外因):
(1)加水稀释,促进水解
(2)温度升高,促进水解
(3)外加酸、碱:
加酸抑制阳离子的水解,促进阴离子的水解;
加碱抑制阴离子的水解,促进阳离子的水解。
(4)弱离子:同性抑制,异性促进
【小结】
盐本身的性质
--- 浓度、温度及溶液酸碱度
越热越水解
越稀越水解
越弱越水解
练习:
1.比较同浓度的下列各组溶液pH值的大小:
A. Na2CO3 ___ CH3COONa ; B.AlCl3 ___MgCl2 C.NaHCO3 ___ Na2CO3 ; D. NaHCO3___NaHSO3
>
<
<
>
2.为了使Na2S溶液中c(Na+) /c(S2-)接近于2:1,可加入的物质是( )
A.盐酸 B.适量的NaOH
C.适量的KOH D.适量的NaHS溶液
C
1、判断或比较溶液的酸碱性强弱时要考虑盐的水解
三、 盐类水解的应用
例如:0.1mol/L下列溶液pH值由大到小的顺序是
①H2SO4 ② NH3.H2O ③ NaOH ④NH4Cl ⑤NaCl ⑥CH3COONa ⑦ HCl ⑧ CH3COOH ⑨Ba(OH)2
⑨>③>②>⑥>⑤>④>⑧>⑦>①
如:用明矾、FeCl3 等作净水剂
KAl(SO4)2=K + +Al3++2SO42-
Al3++3H2O Al(OH)3(胶体)+3H+
水解生成Al(OH)3、Fe(OH)3胶体具有吸附作用,可以吸附水中杂质和悬浮物形成沉淀
Fe3++3H2O (沸水) == Fe(OH)3(胶体)+3H+
2、净水剂的选择有时要考虑盐的水解
用盐作洗涤剂:Na2CO3、C17H35COONa 等
CO32-+H2O HCO3-+OH-
溶液呈碱性。加热促进水解,碱性更强,去污效果更好
C17H35COO -+H2O C17H35COOH+OH-
3、洗涤剂的应用考虑盐的水解
草木灰的成分:K2CO3,水解呈碱性.
CO32-+H2O HCO3- +OH-
HCO3-+H2O H2CO3 +OH-
铵态氮肥——铵盐,水解呈酸性.
NH4++H2O NH3·H2O+ H+
如:草木灰(含K2CO3)不能和铵态氮肥混和使用,不能和磷肥(主要成分是磷酸二氢钙)混合使用
4、一些化肥的使用要考虑盐的水解
5、一些离子的共存要考虑盐的水解
例:某同学欲配制下列含有较多量不同阴、阳离子的4种水溶液,其中配不成的是( )
A. Ca2+、Al3+、Cl-、HCO3- B. Mg2+、Al3+、Cl-、SO42-
C. Na+、OH-、K+、Cl- D. Ca2+、Al3+、NO3-、Cl-
A
Al3+
CO32 -
HCO3 -
AlO2—
S2 -
HS —
ClO—
Fe3+
CO32 -
HCO3 -
AlO2—
S2 -
HS —
NH4+ :
SiO32 -
氧化还原
ClO—
ClO—
SiO32 -
SiO32 -
内筒(玻璃筒)里面放入什么药品?
外筒(铁筒)放入
什么药品?
玻璃筒 Al2(SO4)3溶液
铁筒: NaHCO3溶液
Al3++3HCO3- = Al(OH)3↓+3CO2↑;
6.泡沫灭火器要考虑盐类的水解
泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
7.某些盐溶液的配制与保存
FeCl3 :加少量稀盐酸
FeCl2 :加少量稀盐酸和铁屑
加相应的酸或碱
抑制Fe2+的水解
防止Fe2+被氧化
练习:在配制Al2(SO4)3溶液时,为了防止发生水解,可以加入少量的 ,在配制Na2S溶液时,为了防止发生水解,可以加入少量的 。
FeCl3 溶液加热,蒸干,灼烧 ,得 。
Fe2O3
溶液中的反应:
FeCl3 + 3H2O Fe(OH)3 +3HCl
蒸干:
灼烧:
2Fe(OH)3===Fe2O3+3H2O
得Fe(OH)3
只有在干燥的HCl气流中加热,才能得到无水晶体
8、盐溶液蒸干时要考虑盐的水解
FeCl3 溶液加热,蒸干,得 。
CuSO4溶液加热蒸干,得到 。
CuSO4
Na2CO3溶液加热蒸干,得到 。
Na2CO3
总结:盐溶液蒸干规律
(1)、盐溶液水解生成易挥发性酸和弱碱,蒸干得对应弱碱;如AlCl3,Fe(NO3)3
(2)、盐溶液水解生成难挥发性酸,蒸干得原物质;如CuSO4
(3)、盐水解生成强碱时,蒸干后一般得原物质
Fe(OH)3
(4)、易被氧化的盐,蒸干得氧化产物;
如:Na2SO3蒸干得Na2SO4;FeSO4蒸干得Fe2(SO4)3
(5)、考虑盐受热是否分解
如1:Ca(HCO3)2
蒸干
CaCO3
灼烧
CaO
如2:NaHCO3 ; KMnO4 ;
蒸干并灼烧
Na2CO3 ; K2MnO4 和 MnO2
如3:NH4Cl
蒸干并灼烧:
无固体
(6)、有时要多方面考虑
蒸干NaClO溶液得到固NaCl
CuSO4溶液加热得CuSO4·5H2O;蒸干得CuSO4
思考:向FeCl3溶液中加MgO 有什么现象?
除去MgCl2溶液中的FeCl3用什么试剂?
Fe3+ + 3H2O Fe(OH)3 + 3H+
① 加Mg(OH)2
②加 MgO
③ 加MgCO3
除杂试剂:不溶于水,与H+反应,不引入新杂质
思考:除去CuCl2溶液中的FeCl3用什么试剂?
CuO Cu(OH)2 CuCO3等
9、除杂时可能要考虑盐的水解
例、某溶液中含有铜离子和二价铁离子,如何除去铁离子得到比较纯净的铜离子已知各离子的水解情况:
Cu2+ Fe2+ Fe3+
开始水解的PH值 6 5 3
水解完全的PH值 7 6.5 4
操作过程:首先向溶液中加入 。使Fe2+氧化成Fe3+
氧气、臭氧、双氧水等
然后向溶液中加入 调节溶液的PH值到5左右,最后过滤除去Fe(OH)3得到纯净的铜离子。
CuO Cu(OH)2 CuCO3等
问题探究:金属镁与水反应比较困难,若加一些NH4Cl马上产生大量气体?为什么?
总化学方程式:Mg+2NH4Cl=MgCl2+2NH3↑ +2H2↑
10. “焊药”—金属焊接时常用于除去金属表面的氧化膜,常用ZnCl2、NH4Cl。
NH4++H2O NH3 H2O + H+
△
NH3 H2O = NH3 ↑ + H2O
Mg+ 2H+ = Mg2+ + H2↑
如:碳酸钠溶液呈碱性,证明碳酸是弱酸
11、证明酸或碱是强弱电解质时可能要考虑盐的水解
12、比较溶液中离子浓度的大小时一般要考虑盐的水解
离子浓度
比较
泡沫
灭火剂
明矾净水
混施化肥
判断溶液
酸碱性
溶液配制
试剂贮存
制备胶体
盐类水解
的利用
盐溶液
的蒸发
小结
【课 堂 总 结】
一、影响盐类水解的因素
1、决定因素(内因):
2、外界条件(外因):
--- 浓度、温度及溶液酸碱度
越热越水解
越稀越水解
越弱越水解
加酸抑制弱碱阳离子的水解;
加碱抑制弱酸阴离子的水解。
同性抑制,异性促进
二、 盐类水解的应用
*
第三章 水溶液中的离子平衡
第三节 盐类的水解
第2课时影响盐类水解的因素和盐类水解的应用
能发生水解的盐的类型是什么?
不同类型的盐水解后的酸碱性分别是什么?
强酸弱碱盐、强碱弱酸盐、弱酸弱碱盐
——有弱才水解
强酸强碱盐、强酸弱碱盐、强碱弱酸盐
中 性
酸 性
碱 性
——谁强显谁性、同强显中性
*
NaA = A- + Na+
H2O
H+ + OH-
+
HA
(弱酸)
如HA越弱, 则A-和H+更 结合, 水的电离平衡程度更 , 即水解的程度更 。
容易
大
大
*
1)内因:反应物本身的性质
例:比较Na2CO3和CH3COONa的碱性?
H2CO3
CH3COOH
酸性:
<
碱性:
Na2CO3 CH3COONa
>
越弱越水解
二、影响盐类水解的因素
*
影响盐类水解的因素
已知HClO、CH3COOH、HNO2都是弱酸,其电离常数Ka分别为3.0×10-8、1.8×10-5、 4.6×10-4。则浓度都为0.1mol/LNaClO、CH3COONa、NaNO2溶液的pH值大小顺序为:
NaClO>CH3COONa>NaNO2
识记常见弱酸的酸性顺序:
H2SO3 >H3PO4>HF>CH3COOH
>H2CO3>HClO
*
2) 外因:
①温度:
水解是中和反应的逆反应,
是吸热反应。
越热越水解
问题: 能否通过加热蒸发FeCl3溶液的方法得到其结晶?
Fe3+ + 3H2O Fe(OH)3 + 3H+
只能得到Fe2O3固体
例、热的碱液(Na2CO3溶液)去油污的能力较强
二、影响盐类水解的因素
*
③溶液的酸碱度:
问题:配制FeCl3溶液需要注意什么问题?
Fe3+ + 3H2O Fe(OH)3 + 3H+
加入一定量的HCl,抑制FeCl3的水解。
酸碱能够抑制或促进水解
盐类水解产生H+或OH-,凡是能够结合H+,OH-的物质,均会促进盐类的水解。
②浓度:
稀释溶液可以促进水解,使水解平衡向右移动,即盐的浓度越小其水解程度越大
越稀越水解
二、影响盐类水解的因素
*
二、影响盐类水解的因素
P73
1.FeCl3溶液能否发生水解 如果可以,请写出水解方程式。
2.应用平衡移动原理,影响其水解的因素有哪些
FeCl3+3H2O Fe(OH)3+3HCl
Fe3++3H2O Fe(OH)3+3H+
*
条件 移动方向 H+数目 pH Fe3+水解率 现象
升温
通HCl
加H2O
加Fe粉
加NaHCO3
Fe3+ + 3H2O Fe(OH)3 + 3H+当条件改变时,将相关内容填入表格中:
正反应
增加
降
增大
颜色变深
逆反应
正反应
逆反应
正反应
增加
增加
减少
减少
降
升
升
升
减小
增大
减小
增大
颜色变浅
颜色变浅
颜色变浅
红褐色沉淀,
无色气体
科学探究
二、影响盐类水解的因素
影响盐类水解的因素
1、决定因素(内因):
2、外界条件(外因):
(1)加水稀释,促进水解
(2)温度升高,促进水解
(3)外加酸、碱:
加酸抑制阳离子的水解,促进阴离子的水解;
加碱抑制阴离子的水解,促进阳离子的水解。
(4)弱离子:同性抑制,异性促进
【小结】
盐本身的性质
--- 浓度、温度及溶液酸碱度
越热越水解
越稀越水解
越弱越水解
练习:
1.比较同浓度的下列各组溶液pH值的大小:
A. Na2CO3 ___ CH3COONa ; B.AlCl3 ___MgCl2 C.NaHCO3 ___ Na2CO3 ; D. NaHCO3___NaHSO3
>
<
<
>
2.为了使Na2S溶液中c(Na+) /c(S2-)接近于2:1,可加入的物质是( )
A.盐酸 B.适量的NaOH
C.适量的KOH D.适量的NaHS溶液
C
1、判断或比较溶液的酸碱性强弱时要考虑盐的水解
三、 盐类水解的应用
例如:0.1mol/L下列溶液pH值由大到小的顺序是
①H2SO4 ② NH3.H2O ③ NaOH ④NH4Cl ⑤NaCl ⑥CH3COONa ⑦ HCl ⑧ CH3COOH ⑨Ba(OH)2
⑨>③>②>⑥>⑤>④>⑧>⑦>①
如:用明矾、FeCl3 等作净水剂
KAl(SO4)2=K + +Al3++2SO42-
Al3++3H2O Al(OH)3(胶体)+3H+
水解生成Al(OH)3、Fe(OH)3胶体具有吸附作用,可以吸附水中杂质和悬浮物形成沉淀
Fe3++3H2O (沸水) == Fe(OH)3(胶体)+3H+
2、净水剂的选择有时要考虑盐的水解
用盐作洗涤剂:Na2CO3、C17H35COONa 等
CO32-+H2O HCO3-+OH-
溶液呈碱性。加热促进水解,碱性更强,去污效果更好
C17H35COO -+H2O C17H35COOH+OH-
3、洗涤剂的应用考虑盐的水解
草木灰的成分:K2CO3,水解呈碱性.
CO32-+H2O HCO3- +OH-
HCO3-+H2O H2CO3 +OH-
铵态氮肥——铵盐,水解呈酸性.
NH4++H2O NH3·H2O+ H+
如:草木灰(含K2CO3)不能和铵态氮肥混和使用,不能和磷肥(主要成分是磷酸二氢钙)混合使用
4、一些化肥的使用要考虑盐的水解
5、一些离子的共存要考虑盐的水解
例:某同学欲配制下列含有较多量不同阴、阳离子的4种水溶液,其中配不成的是( )
A. Ca2+、Al3+、Cl-、HCO3- B. Mg2+、Al3+、Cl-、SO42-
C. Na+、OH-、K+、Cl- D. Ca2+、Al3+、NO3-、Cl-
A
Al3+
CO32 -
HCO3 -
AlO2—
S2 -
HS —
ClO—
Fe3+
CO32 -
HCO3 -
AlO2—
S2 -
HS —
NH4+ :
SiO32 -
氧化还原
ClO—
ClO—
SiO32 -
SiO32 -
内筒(玻璃筒)里面放入什么药品?
外筒(铁筒)放入
什么药品?
玻璃筒 Al2(SO4)3溶液
铁筒: NaHCO3溶液
Al3++3HCO3- = Al(OH)3↓+3CO2↑;
6.泡沫灭火器要考虑盐类的水解
泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
7.某些盐溶液的配制与保存
FeCl3 :加少量稀盐酸
FeCl2 :加少量稀盐酸和铁屑
加相应的酸或碱
抑制Fe2+的水解
防止Fe2+被氧化
练习:在配制Al2(SO4)3溶液时,为了防止发生水解,可以加入少量的 ,在配制Na2S溶液时,为了防止发生水解,可以加入少量的 。
FeCl3 溶液加热,蒸干,灼烧 ,得 。
Fe2O3
溶液中的反应:
FeCl3 + 3H2O Fe(OH)3 +3HCl
蒸干:
灼烧:
2Fe(OH)3===Fe2O3+3H2O
得Fe(OH)3
只有在干燥的HCl气流中加热,才能得到无水晶体
8、盐溶液蒸干时要考虑盐的水解
FeCl3 溶液加热,蒸干,得 。
CuSO4溶液加热蒸干,得到 。
CuSO4
Na2CO3溶液加热蒸干,得到 。
Na2CO3
总结:盐溶液蒸干规律
(1)、盐溶液水解生成易挥发性酸和弱碱,蒸干得对应弱碱;如AlCl3,Fe(NO3)3
(2)、盐溶液水解生成难挥发性酸,蒸干得原物质;如CuSO4
(3)、盐水解生成强碱时,蒸干后一般得原物质
Fe(OH)3
(4)、易被氧化的盐,蒸干得氧化产物;
如:Na2SO3蒸干得Na2SO4;FeSO4蒸干得Fe2(SO4)3
(5)、考虑盐受热是否分解
如1:Ca(HCO3)2
蒸干
CaCO3
灼烧
CaO
如2:NaHCO3 ; KMnO4 ;
蒸干并灼烧
Na2CO3 ; K2MnO4 和 MnO2
如3:NH4Cl
蒸干并灼烧:
无固体
(6)、有时要多方面考虑
蒸干NaClO溶液得到固NaCl
CuSO4溶液加热得CuSO4·5H2O;蒸干得CuSO4
思考:向FeCl3溶液中加MgO 有什么现象?
除去MgCl2溶液中的FeCl3用什么试剂?
Fe3+ + 3H2O Fe(OH)3 + 3H+
① 加Mg(OH)2
②加 MgO
③ 加MgCO3
除杂试剂:不溶于水,与H+反应,不引入新杂质
思考:除去CuCl2溶液中的FeCl3用什么试剂?
CuO Cu(OH)2 CuCO3等
9、除杂时可能要考虑盐的水解
例、某溶液中含有铜离子和二价铁离子,如何除去铁离子得到比较纯净的铜离子已知各离子的水解情况:
Cu2+ Fe2+ Fe3+
开始水解的PH值 6 5 3
水解完全的PH值 7 6.5 4
操作过程:首先向溶液中加入 。使Fe2+氧化成Fe3+
氧气、臭氧、双氧水等
然后向溶液中加入 调节溶液的PH值到5左右,最后过滤除去Fe(OH)3得到纯净的铜离子。
CuO Cu(OH)2 CuCO3等
问题探究:金属镁与水反应比较困难,若加一些NH4Cl马上产生大量气体?为什么?
总化学方程式:Mg+2NH4Cl=MgCl2+2NH3↑ +2H2↑
10. “焊药”—金属焊接时常用于除去金属表面的氧化膜,常用ZnCl2、NH4Cl。
NH4++H2O NH3 H2O + H+
△
NH3 H2O = NH3 ↑ + H2O
Mg+ 2H+ = Mg2+ + H2↑
如:碳酸钠溶液呈碱性,证明碳酸是弱酸
11、证明酸或碱是强弱电解质时可能要考虑盐的水解
12、比较溶液中离子浓度的大小时一般要考虑盐的水解
离子浓度
比较
泡沫
灭火剂
明矾净水
混施化肥
判断溶液
酸碱性
溶液配制
试剂贮存
制备胶体
盐类水解
的利用
盐溶液
的蒸发
小结
【课 堂 总 结】
一、影响盐类水解的因素
1、决定因素(内因):
2、外界条件(外因):
--- 浓度、温度及溶液酸碱度
越热越水解
越稀越水解
越弱越水解
加酸抑制弱碱阳离子的水解;
加碱抑制弱酸阴离子的水解。
同性抑制,异性促进
二、 盐类水解的应用
