【高效备课】人教A版(2019)高中化学选必修1同步课件 3.3.3离子浓度大小的比较
文档属性
| 名称 | 【高效备课】人教A版(2019)高中化学选必修1同步课件 3.3.3离子浓度大小的比较 |  | |
| 格式 | pptx | ||
| 文件大小 | 9.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-26 08:22:46 | ||
图片预览










文档简介
(共35张PPT)
离子浓度大小的比较
Exothermic reaction and endothermic reaction
离子浓度
比较
泡沫
灭火剂
明矾净水
混施化肥
判断溶液
酸碱性
溶液配制
与贮存
离子共存
物质制备
和除杂
盐类水解
的利用
盐溶液
的蒸发
热碱去油污
溶液中离子浓度
大小比较
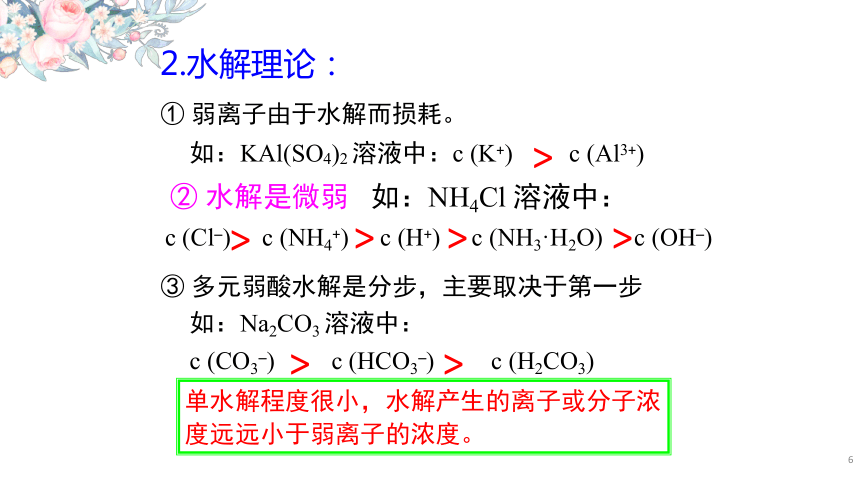
解题指导电解质溶液中离子浓度大小比较问题,是高考的“热点”之一。 多年以来全国高考化学试卷年年涉及这种题型。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、电离度、水的电离、pH值、离子反应、盐类水解等基本概念的掌握程度及对这些知识的综合运用能力。一、紧抓“两个微弱”1.电离理论:②多元弱酸电离是分步,主要取决于第一步①弱电解质电离是微弱的如:NH3· H2O溶液中:c (NH3· H2O) c (OH–) c (NH4+) c (H+)如:H2S溶液中:c (H2S) c (H+) c (HS–)c (S2–) c (OH–)>>>>>>>对于弱酸、弱碱,其电离程度小,产生的离子浓度远远小于弱电解质分子的浓度。2.水解理论:①弱离子由于水解而损耗。如:KAl(SO4)2溶液中:c (K+) c (Al3+)②水解是微弱③多元弱酸水解是分步,主要取决于第一步c (Cl–) c (NH4+) c (H+) c (NH3·H2O) c (OH–)如:Na2CO3溶液中:c (CO3–) c (HCO3–) c (H2CO3)>>>>>>>单水解程度很小,水解产生的离子或分子浓度远远小于弱离子的浓度。如:NH4Cl溶液中:1.电荷守恒例1:NH4Cl溶液中阳离子:NH4+H+阴离子:Cl–OH–正电荷总数==负电荷总数n ( NH4+)+n ( H+) == n ( Cl–)+n ( OH–)溶液中阴离子和阳离子所带的电荷总数相等。即c ( NH4+)+c ( H+) == c ( Cl–)+c ( OH–)????二牢记“三个守恒”写法归纳:找离子→分阴阳→乘电荷→列等式阳离子:Na+、H+阴离子:OH–、S2–、HS–练习:Na2S溶液Na2S == 2Na++S2–H2O H++OH–S2–+H2O HS–+OH–HS–+H2O H2S+OH–c (Na+)+c ( H+) == c ( OH–) + 2c ( S2–) + c ( HS–)∵正电荷总数==负电荷总数c(Na+)+c(H+)=c(HCO-3)+c(OH-)+2c(CO32-)c(K+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)K2S溶液NaHCO3溶液2.物料守恒(元素or原子守恒)溶液中,尽管有些离子能电离或水解,变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不变的。是指某一元素的原始浓度应该等于该元素在溶液中各种存在形式的浓度之和。Na2CO3==2Na++CO32–H2O H++OH–CO32–+H2OHCO3–+OH–HCO3–+H2OH2CO3+OH–∴c (Na+)=2[c(CO32–)+c(HCO3–)+c(H2CO3)]c (Na+)=2a mol / Lc(CO32–)+c(HCO3–)+c(H2CO3)=a mol / L即c (Na+) : c (C)=2 : 1例2:a mol / L的Na2CO3溶液中Na2S==2Na++S2–H2O H++OH–S2–+H2OHS–+OH–HS–+H2OH2S+OH–因此:c (Na+)==2[c(S2–)+c(HS–)+c(H2S)]∵c (Na+) : c (S)=2 : 1练习:NaHCO3溶液∵c (Na+) : c (C)=1 : 1因此c (Na+)=c (HCO3–)+c (CO32–)+c (H2CO3)练习:Na2S溶液水电离出的c(H+)c(OH-)始终相等,溶液中的H+或OH-虽与其他离子结合而以不同形式存在,但其总量相等
CH3COONa溶液
CH3COO-
H2O
+H+
CH3COOH
+H+
H3O+
(即H+)
-H+
OH-
c( CH3COOH )+c(H+)=c(OH-)
3.质子守恒
K2S溶液:
S2-
H2O
+H+
HS-
+H+
H3O+
(即H+)
-H+
OH-
+2H+
H2S
c(HS- )+c(H+) +2c(H2S)=c(OH-)
KHS溶液:
HS-
H2O
+H+
H3O+
-H+
OH-
+H+
H2S
-H+
S2-
c(H+) +c(H2S) -c(S2- )= c(OH-)
质子守恒与电荷守恒、原子守恒的关系
通过联立电荷守恒和原子守恒,消去与得到
和给出质子无关的粒子
K2S溶液
c(K+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)
电荷守恒
原子守恒
c(K+)=2[c(HS-)+c(H2S)+c(S2-)]
联立,消去K+得
c(HS- )+c(H+) +2c(H2S)=c(OH-)
你能写出NaHS溶液中相应的三个守恒式吗?
c(Na+ ) +c(H+ )=c(HS- ) +2c(S2- )+ c(OH- )
c(Na+ )=c(H2S )+ c(HS- )+c(S2- )
c(H+ )+ c(H2S )—c(S2- )=c(OH-)
电荷守恒:
物料守恒:
质子守恒:
思考
对于Na2CO3下列关系正确的是( )
A.c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
B.c(OH-)=2c(HCO3-) + c(H+) + c(H2CO3)
C.c(OH-) = c(HCO3-) + c(H+)+ 2c(H2CO3)
D.c(OH-) = c(HCO3-) + c(H+) + c(H2CO3)
E. c(Na+)>c(CO32-)> c(OH-) >c(HCO3-)
CE
【练习】
1、单一溶质溶液:根据电离、水解情况分析
(1)弱酸溶液:
【例1】在0.1mol/L的H2S溶液中,下列关系错误的是
A.c(H+)=c(HS-)+c(S2-)+c(OH-)
B.c(H+)=c(HS-)+2c(S2-)+c(OH-)
C.c(H+)>[c(HS-)+c(S2-)+c(OH-)]
D.c(H2S)+c(HS-)+c(S2-)=0.1mol/L
( A )
三、【题型与对策】
—只考虑电解质的电离与水的电离
(2)弱碱溶液:
( c )
—只考虑电解质的电离与水的电离
(3)强酸弱碱盐溶液:
【例3】在氯化铵溶液中,下列关系正确的是
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(Cl-)> c(H+) > c(OH-)
C. c(NH4+) =c(Cl-)> c(H+) = c(OH-)
D.c(Cl-)= c(NH4+) > c(H+) > c(OH-)
( A )
—考虑弱碱根离子的水解和水的电离
(4)强碱弱酸盐溶液:
【例4】在Na2S溶液中下列关系不正确的是
A.c(Na+) =2c( HS-) +2c(S2-) +c(H2S)
B. c(Na+) +c(H+)=c(OH-)+c(HS-)+ 2c(S2-)
C. c(Na+) > c(S2-) >c(OH-)>c(HS-)
D.c(OH-)=c(HS-)+c(H+)+ c(H2S)
( AD )
—考虑弱酸根离子的水解或分步水解及水的电离
(5)强碱弱酸的酸式盐溶液:
【例5】草酸是二元弱酸,草酸氢钾溶液呈酸性,在0.1mol/LKHC2O4溶液中,下列关系正确的是
A.c(K+) +c(H+)=c(HC2O4-)+c(OH-)+ c(C2O42-)
B. c(HC2O4-) + c(C2O42-) =0.1mol/L
C. c(C2O42-) >c(H2C2O4)
D. c(K+) = c(H2C2O4)+ c(HC2O4-) + c(C2O42-)
( CD )
电离为主显酸性:NaHSO3、NaH2PO4溶液
水解为主显碱性:NaHCO3、Na2HPO4、NaHS溶液
【例6】等物质的量的下列溶液中,NH4+的浓度由大到小的顺序是
①NH4Cl ②NH4HCO3 ③ NH4HSO4 ④ NH4NO3
⑤(NH4)2SO4 ⑥(NH4)2Fe(SO4) ⑦(NH4)2CO3
⑥>⑤>⑦>③>①=④>②
(6)不同物质同种离子浓度比较型
【例7】用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中C(CH3COO-)>C(Na+),对该混合溶液的下列判断正确的是( )
A.C(H+)>C(OH-)
B.C(CH3COOH)+C(CH3COO-)=0.2 mol/L
C.C(CH3COOH)>C(CH3COO-)
D.C(CH3COO-)+C(OH-)=0.2 mol/L
(1)两种物质混合不反应:
AB
2.混合溶液:关注混合后溶液的酸碱性
中常化学常见的有三对:
1.等浓度的HAc与NaAc的混合溶液:
弱酸的电离>其对应弱酸盐的水解,溶液呈酸性
2.等浓度的NH3·H2O与NH4Cl的混合液:
弱碱的电离>其对应弱碱盐的水解,溶液呈碱性
3.等浓度的HCN与NaCN的混合溶液:
弱酸的电离<其对应弱酸盐的水解,溶液呈碱性
(1).两种物质混合不反应:
(2)两种物质恰好完全反应
【例8】在10ml 0.1mol·L-1NaOH溶液中加入同体积、同浓度
CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是( )
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(Na+)=c(CH3COO -)+c(CH3COO H)
D.c(Na+)+c(H+)=c(CH3COO -)+c(OH-)
A
(3)两种物质反应,其中一种有剩余:
【例9】:把0.02 mol·L-1 CH3COOH溶液与0.01 mol·L-1NaOH溶液等体积混合,则混合液中微粒浓度关系正确的是( )
A、c(CH3COO -)>c(Na+)
B、c(CH3COOH)>c(CH3COO -)
C、2c(H+)=c(CH3COO -)-c(CH3COOH)
D、c(CH3COOH)+c(CH3COO -)=0.01 mol·L-1
AD
(3)两种物质反应,其中一种有剩余:
【例10】:将0.02mol·L-1HCN溶液和0.01mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是 ( )
A . c(HCN)B. c(Na+)>c(CN-)
C .
D. c(HCN)+c(CN-)=0.01mol·L-1
BD
2c(H+)=c(CN -)-c(HCN)
3.未指明酸碱的强弱:
例11:一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断正确的是( )
A.[A-]≥[M+]
B.[A-]≤[M+]
C.若MA不水解,则[OH-]<[A-]
D.若MA水解,则[OH-]>[A-]
解析:因为没有告知一元酸HA的相对强弱,因此要考虑两种情况,若是强酸,则[A-]=[M+] ,若是弱酸则 [A-]<[M+] ,还要考虑MA的水解,所以选B C
BC
考虑电离
考虑水解
考虑电离
按盐溶液考虑
(分清主次)
根据过量情况考虑电离或水解
电解质溶液
单一溶液
混合溶液
酸或碱溶液
盐溶液
不反应
反应
不过量
过量
生成酸或碱
生成盐
正盐溶液
酸式盐溶液
考虑水解与电离
(分清主次)
考虑水解与电离
(分清主次)
【课堂小结】
一、紧抓两个“微弱”
①弱电解质的电离是微弱的:如稀CH3COOH溶液里粒子浓度的大小为:
②弱根离子的水解是微弱的:如CH3COONa溶液里粒子浓度大小为:
【基本原理】
C(Na+)>C(CH3COO-)>C(OH-)>C(CH3COOH)>C(H+)
——两个“微弱”和三个“守恒”
二、牢记三个“守恒”
1、电荷守恒
2、物料守恒 (原子守恒)
3、质子守恒:
1、将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度的关系正确的是( )
A.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
B.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B
2、在0.1mol/L氨水中滴加同浓度的盐酸,至溶液正好呈中性,溶液中离子浓度的大小关系为 。
C(NH4+)=C(Cl-) > C(OH-) = C(H+)
学以致用
学以致用
3、(NH4)2SO4溶液中离子浓度的关系:
C(NH4+)>C(SO42-)>C(H+) >C(OH-)
4、在Na2S溶液中下列关系不正确的是( )
A、c(Na+) =2c(HS-) +2c(S2-) +c(H2S)
B、c(Na+) +c(H+)=c(OH-)+c(HS-)+2c(S2-)
C.c(Na+)>c(S2-)>c(OH-)>c(HS-) >C(H+)
D.c(OH-) =c(HS-)+c(H+)+c(H2S)
AD
Lorem ipsum dolor sit amet, consectetuer adipiscing elit. Aenean commodo ligula eget dolor. Lorem ipsum dolor sit amet, consectetuer adipiscing elit. Aenean commodo ligula eget dolor.
感谢您观看!
离子浓度大小的比较
Exothermic reaction and endothermic reaction
离子浓度
比较
泡沫
灭火剂
明矾净水
混施化肥
判断溶液
酸碱性
溶液配制
与贮存
离子共存
物质制备
和除杂
盐类水解
的利用
盐溶液
的蒸发
热碱去油污
溶液中离子浓度
大小比较
解题指导电解质溶液中离子浓度大小比较问题,是高考的“热点”之一。 多年以来全国高考化学试卷年年涉及这种题型。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、电离度、水的电离、pH值、离子反应、盐类水解等基本概念的掌握程度及对这些知识的综合运用能力。一、紧抓“两个微弱”1.电离理论:②多元弱酸电离是分步,主要取决于第一步①弱电解质电离是微弱的如:NH3· H2O溶液中:c (NH3· H2O) c (OH–) c (NH4+) c (H+)如:H2S溶液中:c (H2S) c (H+) c (HS–)c (S2–) c (OH–)>>>>>>>对于弱酸、弱碱,其电离程度小,产生的离子浓度远远小于弱电解质分子的浓度。2.水解理论:①弱离子由于水解而损耗。如:KAl(SO4)2溶液中:c (K+) c (Al3+)②水解是微弱③多元弱酸水解是分步,主要取决于第一步c (Cl–) c (NH4+) c (H+) c (NH3·H2O) c (OH–)如:Na2CO3溶液中:c (CO3–) c (HCO3–) c (H2CO3)>>>>>>>单水解程度很小,水解产生的离子或分子浓度远远小于弱离子的浓度。如:NH4Cl溶液中:1.电荷守恒例1:NH4Cl溶液中阳离子:NH4+H+阴离子:Cl–OH–正电荷总数==负电荷总数n ( NH4+)+n ( H+) == n ( Cl–)+n ( OH–)溶液中阴离子和阳离子所带的电荷总数相等。即c ( NH4+)+c ( H+) == c ( Cl–)+c ( OH–)????二牢记“三个守恒”写法归纳:找离子→分阴阳→乘电荷→列等式阳离子:Na+、H+阴离子:OH–、S2–、HS–练习:Na2S溶液Na2S == 2Na++S2–H2O H++OH–S2–+H2O HS–+OH–HS–+H2O H2S+OH–c (Na+)+c ( H+) == c ( OH–) + 2c ( S2–) + c ( HS–)∵正电荷总数==负电荷总数c(Na+)+c(H+)=c(HCO-3)+c(OH-)+2c(CO32-)c(K+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)K2S溶液NaHCO3溶液2.物料守恒(元素or原子守恒)溶液中,尽管有些离子能电离或水解,变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不变的。是指某一元素的原始浓度应该等于该元素在溶液中各种存在形式的浓度之和。Na2CO3==2Na++CO32–H2O H++OH–CO32–+H2OHCO3–+OH–HCO3–+H2OH2CO3+OH–∴c (Na+)=2[c(CO32–)+c(HCO3–)+c(H2CO3)]c (Na+)=2a mol / Lc(CO32–)+c(HCO3–)+c(H2CO3)=a mol / L即c (Na+) : c (C)=2 : 1例2:a mol / L的Na2CO3溶液中Na2S==2Na++S2–H2O H++OH–S2–+H2OHS–+OH–HS–+H2OH2S+OH–因此:c (Na+)==2[c(S2–)+c(HS–)+c(H2S)]∵c (Na+) : c (S)=2 : 1练习:NaHCO3溶液∵c (Na+) : c (C)=1 : 1因此c (Na+)=c (HCO3–)+c (CO32–)+c (H2CO3)练习:Na2S溶液水电离出的c(H+)c(OH-)始终相等,溶液中的H+或OH-虽与其他离子结合而以不同形式存在,但其总量相等
CH3COONa溶液
CH3COO-
H2O
+H+
CH3COOH
+H+
H3O+
(即H+)
-H+
OH-
c( CH3COOH )+c(H+)=c(OH-)
3.质子守恒
K2S溶液:
S2-
H2O
+H+
HS-
+H+
H3O+
(即H+)
-H+
OH-
+2H+
H2S
c(HS- )+c(H+) +2c(H2S)=c(OH-)
KHS溶液:
HS-
H2O
+H+
H3O+
-H+
OH-
+H+
H2S
-H+
S2-
c(H+) +c(H2S) -c(S2- )= c(OH-)
质子守恒与电荷守恒、原子守恒的关系
通过联立电荷守恒和原子守恒,消去与得到
和给出质子无关的粒子
K2S溶液
c(K+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)
电荷守恒
原子守恒
c(K+)=2[c(HS-)+c(H2S)+c(S2-)]
联立,消去K+得
c(HS- )+c(H+) +2c(H2S)=c(OH-)
你能写出NaHS溶液中相应的三个守恒式吗?
c(Na+ ) +c(H+ )=c(HS- ) +2c(S2- )+ c(OH- )
c(Na+ )=c(H2S )+ c(HS- )+c(S2- )
c(H+ )+ c(H2S )—c(S2- )=c(OH-)
电荷守恒:
物料守恒:
质子守恒:
思考
对于Na2CO3下列关系正确的是( )
A.c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
B.c(OH-)=2c(HCO3-) + c(H+) + c(H2CO3)
C.c(OH-) = c(HCO3-) + c(H+)+ 2c(H2CO3)
D.c(OH-) = c(HCO3-) + c(H+) + c(H2CO3)
E. c(Na+)>c(CO32-)> c(OH-) >c(HCO3-)
CE
【练习】
1、单一溶质溶液:根据电离、水解情况分析
(1)弱酸溶液:
【例1】在0.1mol/L的H2S溶液中,下列关系错误的是
A.c(H+)=c(HS-)+c(S2-)+c(OH-)
B.c(H+)=c(HS-)+2c(S2-)+c(OH-)
C.c(H+)>[c(HS-)+c(S2-)+c(OH-)]
D.c(H2S)+c(HS-)+c(S2-)=0.1mol/L
( A )
三、【题型与对策】
—只考虑电解质的电离与水的电离
(2)弱碱溶液:
( c )
—只考虑电解质的电离与水的电离
(3)强酸弱碱盐溶液:
【例3】在氯化铵溶液中,下列关系正确的是
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(Cl-)> c(H+) > c(OH-)
C. c(NH4+) =c(Cl-)> c(H+) = c(OH-)
D.c(Cl-)= c(NH4+) > c(H+) > c(OH-)
( A )
—考虑弱碱根离子的水解和水的电离
(4)强碱弱酸盐溶液:
【例4】在Na2S溶液中下列关系不正确的是
A.c(Na+) =2c( HS-) +2c(S2-) +c(H2S)
B. c(Na+) +c(H+)=c(OH-)+c(HS-)+ 2c(S2-)
C. c(Na+) > c(S2-) >c(OH-)>c(HS-)
D.c(OH-)=c(HS-)+c(H+)+ c(H2S)
( AD )
—考虑弱酸根离子的水解或分步水解及水的电离
(5)强碱弱酸的酸式盐溶液:
【例5】草酸是二元弱酸,草酸氢钾溶液呈酸性,在0.1mol/LKHC2O4溶液中,下列关系正确的是
A.c(K+) +c(H+)=c(HC2O4-)+c(OH-)+ c(C2O42-)
B. c(HC2O4-) + c(C2O42-) =0.1mol/L
C. c(C2O42-) >c(H2C2O4)
D. c(K+) = c(H2C2O4)+ c(HC2O4-) + c(C2O42-)
( CD )
电离为主显酸性:NaHSO3、NaH2PO4溶液
水解为主显碱性:NaHCO3、Na2HPO4、NaHS溶液
【例6】等物质的量的下列溶液中,NH4+的浓度由大到小的顺序是
①NH4Cl ②NH4HCO3 ③ NH4HSO4 ④ NH4NO3
⑤(NH4)2SO4 ⑥(NH4)2Fe(SO4) ⑦(NH4)2CO3
⑥>⑤>⑦>③>①=④>②
(6)不同物质同种离子浓度比较型
【例7】用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中C(CH3COO-)>C(Na+),对该混合溶液的下列判断正确的是( )
A.C(H+)>C(OH-)
B.C(CH3COOH)+C(CH3COO-)=0.2 mol/L
C.C(CH3COOH)>C(CH3COO-)
D.C(CH3COO-)+C(OH-)=0.2 mol/L
(1)两种物质混合不反应:
AB
2.混合溶液:关注混合后溶液的酸碱性
中常化学常见的有三对:
1.等浓度的HAc与NaAc的混合溶液:
弱酸的电离>其对应弱酸盐的水解,溶液呈酸性
2.等浓度的NH3·H2O与NH4Cl的混合液:
弱碱的电离>其对应弱碱盐的水解,溶液呈碱性
3.等浓度的HCN与NaCN的混合溶液:
弱酸的电离<其对应弱酸盐的水解,溶液呈碱性
(1).两种物质混合不反应:
(2)两种物质恰好完全反应
【例8】在10ml 0.1mol·L-1NaOH溶液中加入同体积、同浓度
CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是( )
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(Na+)=c(CH3COO -)+c(CH3COO H)
D.c(Na+)+c(H+)=c(CH3COO -)+c(OH-)
A
(3)两种物质反应,其中一种有剩余:
【例9】:把0.02 mol·L-1 CH3COOH溶液与0.01 mol·L-1NaOH溶液等体积混合,则混合液中微粒浓度关系正确的是( )
A、c(CH3COO -)>c(Na+)
B、c(CH3COOH)>c(CH3COO -)
C、2c(H+)=c(CH3COO -)-c(CH3COOH)
D、c(CH3COOH)+c(CH3COO -)=0.01 mol·L-1
AD
(3)两种物质反应,其中一种有剩余:
【例10】:将0.02mol·L-1HCN溶液和0.01mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是 ( )
A . c(HCN)
C .
D. c(HCN)+c(CN-)=0.01mol·L-1
BD
2c(H+)=c(CN -)-c(HCN)
3.未指明酸碱的强弱:
例11:一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断正确的是( )
A.[A-]≥[M+]
B.[A-]≤[M+]
C.若MA不水解,则[OH-]<[A-]
D.若MA水解,则[OH-]>[A-]
解析:因为没有告知一元酸HA的相对强弱,因此要考虑两种情况,若是强酸,则[A-]=[M+] ,若是弱酸则 [A-]<[M+] ,还要考虑MA的水解,所以选B C
BC
考虑电离
考虑水解
考虑电离
按盐溶液考虑
(分清主次)
根据过量情况考虑电离或水解
电解质溶液
单一溶液
混合溶液
酸或碱溶液
盐溶液
不反应
反应
不过量
过量
生成酸或碱
生成盐
正盐溶液
酸式盐溶液
考虑水解与电离
(分清主次)
考虑水解与电离
(分清主次)
【课堂小结】
一、紧抓两个“微弱”
①弱电解质的电离是微弱的:如稀CH3COOH溶液里粒子浓度的大小为:
②弱根离子的水解是微弱的:如CH3COONa溶液里粒子浓度大小为:
【基本原理】
C(Na+)>C(CH3COO-)>C(OH-)>C(CH3COOH)>C(H+)
——两个“微弱”和三个“守恒”
二、牢记三个“守恒”
1、电荷守恒
2、物料守恒 (原子守恒)
3、质子守恒:
1、将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度的关系正确的是( )
A.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
B.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B
2、在0.1mol/L氨水中滴加同浓度的盐酸,至溶液正好呈中性,溶液中离子浓度的大小关系为 。
C(NH4+)=C(Cl-) > C(OH-) = C(H+)
学以致用
学以致用
3、(NH4)2SO4溶液中离子浓度的关系:
C(NH4+)>C(SO42-)>C(H+) >C(OH-)
4、在Na2S溶液中下列关系不正确的是( )
A、c(Na+) =2c(HS-) +2c(S2-) +c(H2S)
B、c(Na+) +c(H+)=c(OH-)+c(HS-)+2c(S2-)
C.c(Na+)>c(S2-)>c(OH-)>c(HS-) >C(H+)
D.c(OH-) =c(HS-)+c(H+)+c(H2S)
AD
Lorem ipsum dolor sit amet, consectetuer adipiscing elit. Aenean commodo ligula eget dolor. Lorem ipsum dolor sit amet, consectetuer adipiscing elit. Aenean commodo ligula eget dolor.
感谢您观看!
