【高效备课】人教A版(2019)高中化学选必修1同步课件 3.2.1 水电电离(共24张PPT)
文档属性
| 名称 | 【高效备课】人教A版(2019)高中化学选必修1同步课件 3.2.1 水电电离(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 31.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-26 08:24:56 | ||
图片预览








文档简介
(共24张PPT)
水的电离
Asadal has been running one of the biggest domain and web hosting sites in Korea since March 1998. More than 3,000,000 people have.visited our website, www. for domain registration and web hosting
水的电离
1.水是一种极弱电解质,能微弱电离
+
+
+
-
H2O +H2O H3O+ + OH-
( H2O H++OH-)
水电离出来的H+和OH-在任何情况下总是相等。
实验测得:在室温下1L水中只有1×10-7mol水电离,电离前后水的物质的量几乎不变, C(H2O)的浓度为常数。
水的电离
所以 K 电离× c(H2O) = c(H+)×c(OH-)= K W
平衡常数:K 电离=
c(H+)×c(OH-)
c(H2O)
2.水的离子积
KW 叫做水的离子积常数,简称水的离子积。
注:c(H2O)=
1 L
1000 g
18 g·mol-1
Kw =
c( H+) .c(OH-)
水的电离
KW只与温度有关(与浓度无关):温度升高,KW增大
如: 25℃ KW=10-14 100℃ KW=10-12
温度
0℃
20℃
25℃
50℃
100℃
Kw
1.14×10-15
6.81×10-15
1×10-14
5.47×10-14
1×10-12
水的电离
(3)在任何水溶液中,均存在水的电离平衡,
也就是任何水溶液中都是H+、OH-共存的。
(1)Kw是温度函数,只随温度的升高而增大,
与c(H+) 、 c(OH-)无关。
(2)Kw适用于一定温度下任何稀的电解质溶液。
水的电离
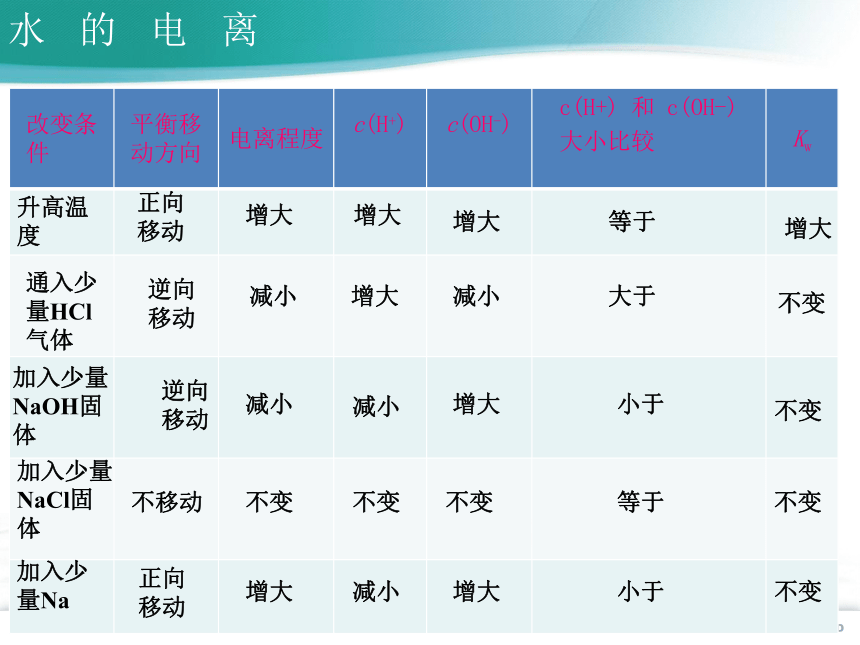
改变条件 平衡移动方向 电离程度 c(H+) c(OH-) c(H+) 和 c(OH-) 大小比较
Kw
升高温度
通入少量HCl气体
加入少量NaOH固体
加入少量NaCl固体
加入少量Na
增大
增大
增大
增大
增大
增大
增大
增大
减小
减小
减小
减小
正向移动
正向移动
逆向移动
逆向移动
不移动
不变
不变
不变
不变
不变
不变
不变
大于
小于
等于
小于
等于
减小
水的电离
(1)温度
抑制水的电离,Kw保持不变
升高温度促进水的电离,Kw增大
(下一节再讲)
3.水的离子平衡的影响因素
(2)酸
(3)碱
(4)发生化学反应
促进水的电离,Kw不变
(5)能水解的盐
水的电离
1、在25℃ 0.01mol/L盐酸溶液中:
c(H+) = , c(OH-) = ;
c(H+)水= , c(OH-)水= 。
2、在25℃ 0.01mol/L NaOH溶液中:
c(H+)= , c(OH-)= ;
c(H+)水= , c(OH-)水= 。
0.01mol/L
10-12mol/L
10-12mol/L
10-12mol/L
■加酸后Kw =1×10-14
=c(H+)水
酸溶液中Kw =c(H+)酸 · c(OH-)水
=c(OH-)水
碱溶液中Kw =c(OH-)碱·c(H+)水
10-12mol/L
10-12mol/L
10-12mol/L
0.01mol/L
■加碱后Kw =1×10-14
课堂练习
水的电离
3.在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( )
① K+、Cl-、NO3-、S2-
② K+、Fe2+、I-、SO42-
③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-
⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
酸性条件不能共存
碱性条件不能共存
能共存
酸、碱性条件都不能共存
能共存
B
课堂练习
溶液的酸碱性与pH值
c (H+)与c (OH-)关系 25℃, c(H+)/mol·L-1 溶液酸碱性
c (H+) =c (OH-)
=1×10-7
中性
c (H+)>c (OH-)
> 1×10-7
酸性
c (H+)<1×10-7
碱性
+
-
1.溶液的酸碱性与c(H+)、c(OH-)的关系
溶液的酸碱性与pH值
2.溶液的酸碱性与pH的关系
c(H+) ﹥ 1mol/L或c(OH-) ﹥ 1mol/L时,可直接用c(H+) 或c(OH-)表示溶液的酸碱性。一定温度下c(H+)越大,溶液酸性越强。 c(OH-)越大,溶液碱性越强,酸性越弱。
c(H+) ﹤ 1mol/L时,常用pH表示溶液的酸碱性。
溶液的酸碱性与pH值
溶液的pH
(1)定义:
c(H+)的负对数
(2)使用范围:
c(H+)<1mol/L
例:c(H+)=0.001 mol /L
pH=-lg 10-3 = 3
例:c(OH-) = 0.01mol /L
c(H+)=1×10-14 / 10-2 = 1×10-12 mol /L
pH=-lg 1×10-12 = 12
lg2=0.3
lg3=0.477
溶液的酸碱性与pH值
溶液的酸碱性 c(H+)和c(OH-)的关系 常温下:c(H+) 常温下:pH
中性溶液 1×10-7mol/L
[H+]>[OH-]
>7
酸性溶液
碱性溶液
[H+]=[OH-]
[H+] >1×10-7mol/L
<7
=7
[H+]<[OH-]
[H+] <1×10-7mol/L
2.溶液的酸碱性与pH的关系
溶液的酸碱性与pH值
25℃溶液的pH值
0 100
1 10—1
2 10—2
3 10—3
4 10—4
5 10—5
6 10—6
7 10—7
8 10—8
9 10—9
10 10—10
11 10—11
12 10—12
13 10—13
14 10—14
酸性增强
碱性增强
溶液的酸碱性与pH值
测定方法:酸碱指示剂法、pH试纸法、pH计法等。
酸碱指示剂:一般是弱的有机酸或弱的有机碱,他们的颜色变化是在一定的pH值范围内发生的。我们把指示剂发生颜色变化的pH值范围叫做指示剂的变色范围。
3.pH值测定方法
酸碱指示剂法
溶液的酸碱性与pH值
估计溶液的pH范围
指示剂 变色范围(pH) 遇酸的颜色 遇碱的颜色
甲基橙
石蕊
酚酞
3.1
4.4
橙色
红色
(pH<3.1)
黄色
(pH>4.4)
5.0
8.0
紫色
红色
(pH<5.0)
蓝色
(pH>8.0)
8.2
10.0
粉红色
无色
(pH<8.2)
红色
(pH>10.0)
酸碱指示剂法
溶液的酸碱性与pH值
注意:①试纸不能用水润湿
②不能将试纸伸到溶液中
③广泛pH试纸只能读出整数
(1)广泛pH试纸:测量出溶液的整数pH
pH试纸法
使用方法:用镊子撕取一小片pH试纸放于洁净干燥的表面皿(或玻璃片)上,用洁净干燥的玻璃棒蘸取待测液点在试纸中部,待试纸显色稳定后与标准比色卡对比,读出pH。
溶液的酸碱性与pH值
(2)精密pH试纸:
pH试纸法
可以判别0.2或0.3的pH差值
溶液的酸碱性与pH值
精确测定溶液pH
pH计法
溶液的酸碱性与pH值
(2)环保治理污水:酸性废水可投加_____物质使之中和,碱性废水可投加_____物质或利用烟道气中和。
碱性
酸性
4.pH的应用
(1)人体健康调节:如洗发时人们用的护发素主要功能是调节头发的pH使之达到适宜的酸碱度。
(5)在科学实验和工业生产方面:溶液pH的控制常常是影响实验结果或产品质量、产量的关键因素。
(3)农业生产调节:控制土壤的pH使之适宜作物生长,提高作物的质量和产量。
(4)在医疗上:可以通过测试和调节pH来进行诊断和治疗疾病。
溶液的酸碱性与pH值
pH在农业中的应用
在农业上,土壤的pH关系到农作物的生长,有的作物如芝麻、油菜、萝卜等可以生长在较大的pH范围内,有的却对土壤的pH反应非常敏感,如茶树适宜在pH约为4.0~5.5的土壤中生长。
溶液的酸碱性与pH值
在工业上,例如,氯碱工业生产中所用食盐水的pH要控制在12左右,以除去其中的Ca2+和Mg2+等杂质。在无机盐的生产中,为了分离所含的杂质如Fe3+,常把无机盐溶液的pH调到5左右,此时Fe3+形成Fe(OH)3沉淀而分离析出,其他阳离子却留在溶液中。
pH在工业生产中的应用
溶液的酸碱性与pH值
在医疗上,测定血液等的pH可以帮助诊断疾病。例如,人体内血液的pH一般在7.35~7.45范围内,如果超过这个范围,便属于病理现象。
在科学实验中,pH是影响某些反应过程的重要因素,因此测定和控制溶液的pH,就如控制温度和浓度等同样重要。
pH在科研中的应用
THANK YOU
Asadal has been running one of the biggest domain and web hosting sites in Korea since March 1998. More than 3,000,000 people have.visited our website, www. for domain registration and web hosting
水的电离
Asadal has been running one of the biggest domain and web hosting sites in Korea since March 1998. More than 3,000,000 people have.visited our website, www. for domain registration and web hosting
水的电离
1.水是一种极弱电解质,能微弱电离
+
+
+
-
H2O +H2O H3O+ + OH-
( H2O H++OH-)
水电离出来的H+和OH-在任何情况下总是相等。
实验测得:在室温下1L水中只有1×10-7mol水电离,电离前后水的物质的量几乎不变, C(H2O)的浓度为常数。
水的电离
所以 K 电离× c(H2O) = c(H+)×c(OH-)= K W
平衡常数:K 电离=
c(H+)×c(OH-)
c(H2O)
2.水的离子积
KW 叫做水的离子积常数,简称水的离子积。
注:c(H2O)=
1 L
1000 g
18 g·mol-1
Kw =
c( H+) .c(OH-)
水的电离
KW只与温度有关(与浓度无关):温度升高,KW增大
如: 25℃ KW=10-14 100℃ KW=10-12
温度
0℃
20℃
25℃
50℃
100℃
Kw
1.14×10-15
6.81×10-15
1×10-14
5.47×10-14
1×10-12
水的电离
(3)在任何水溶液中,均存在水的电离平衡,
也就是任何水溶液中都是H+、OH-共存的。
(1)Kw是温度函数,只随温度的升高而增大,
与c(H+) 、 c(OH-)无关。
(2)Kw适用于一定温度下任何稀的电解质溶液。
水的电离
改变条件 平衡移动方向 电离程度 c(H+) c(OH-) c(H+) 和 c(OH-) 大小比较
Kw
升高温度
通入少量HCl气体
加入少量NaOH固体
加入少量NaCl固体
加入少量Na
增大
增大
增大
增大
增大
增大
增大
增大
减小
减小
减小
减小
正向移动
正向移动
逆向移动
逆向移动
不移动
不变
不变
不变
不变
不变
不变
不变
大于
小于
等于
小于
等于
减小
水的电离
(1)温度
抑制水的电离,Kw保持不变
升高温度促进水的电离,Kw增大
(下一节再讲)
3.水的离子平衡的影响因素
(2)酸
(3)碱
(4)发生化学反应
促进水的电离,Kw不变
(5)能水解的盐
水的电离
1、在25℃ 0.01mol/L盐酸溶液中:
c(H+) = , c(OH-) = ;
c(H+)水= , c(OH-)水= 。
2、在25℃ 0.01mol/L NaOH溶液中:
c(H+)= , c(OH-)= ;
c(H+)水= , c(OH-)水= 。
0.01mol/L
10-12mol/L
10-12mol/L
10-12mol/L
■加酸后Kw =1×10-14
=c(H+)水
酸溶液中Kw =c(H+)酸 · c(OH-)水
=c(OH-)水
碱溶液中Kw =c(OH-)碱·c(H+)水
10-12mol/L
10-12mol/L
10-12mol/L
0.01mol/L
■加碱后Kw =1×10-14
课堂练习
水的电离
3.在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( )
① K+、Cl-、NO3-、S2-
② K+、Fe2+、I-、SO42-
③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-
⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
酸性条件不能共存
碱性条件不能共存
能共存
酸、碱性条件都不能共存
能共存
B
课堂练习
溶液的酸碱性与pH值
c (H+)与c (OH-)关系 25℃, c(H+)/mol·L-1 溶液酸碱性
c (H+) =c (OH-)
=1×10-7
中性
c (H+)>c (OH-)
> 1×10-7
酸性
c (H+)
碱性
+
-
1.溶液的酸碱性与c(H+)、c(OH-)的关系
溶液的酸碱性与pH值
2.溶液的酸碱性与pH的关系
c(H+) ﹥ 1mol/L或c(OH-) ﹥ 1mol/L时,可直接用c(H+) 或c(OH-)表示溶液的酸碱性。一定温度下c(H+)越大,溶液酸性越强。 c(OH-)越大,溶液碱性越强,酸性越弱。
c(H+) ﹤ 1mol/L时,常用pH表示溶液的酸碱性。
溶液的酸碱性与pH值
溶液的pH
(1)定义:
c(H+)的负对数
(2)使用范围:
c(H+)<1mol/L
例:c(H+)=0.001 mol /L
pH=-lg 10-3 = 3
例:c(OH-) = 0.01mol /L
c(H+)=1×10-14 / 10-2 = 1×10-12 mol /L
pH=-lg 1×10-12 = 12
lg2=0.3
lg3=0.477
溶液的酸碱性与pH值
溶液的酸碱性 c(H+)和c(OH-)的关系 常温下:c(H+) 常温下:pH
中性溶液 1×10-7mol/L
[H+]>[OH-]
>7
酸性溶液
碱性溶液
[H+]=[OH-]
[H+] >1×10-7mol/L
<7
=7
[H+]<[OH-]
[H+] <1×10-7mol/L
2.溶液的酸碱性与pH的关系
溶液的酸碱性与pH值
25℃溶液的pH值
0 100
1 10—1
2 10—2
3 10—3
4 10—4
5 10—5
6 10—6
7 10—7
8 10—8
9 10—9
10 10—10
11 10—11
12 10—12
13 10—13
14 10—14
酸性增强
碱性增强
溶液的酸碱性与pH值
测定方法:酸碱指示剂法、pH试纸法、pH计法等。
酸碱指示剂:一般是弱的有机酸或弱的有机碱,他们的颜色变化是在一定的pH值范围内发生的。我们把指示剂发生颜色变化的pH值范围叫做指示剂的变色范围。
3.pH值测定方法
酸碱指示剂法
溶液的酸碱性与pH值
估计溶液的pH范围
指示剂 变色范围(pH) 遇酸的颜色 遇碱的颜色
甲基橙
石蕊
酚酞
3.1
4.4
橙色
红色
(pH<3.1)
黄色
(pH>4.4)
5.0
8.0
紫色
红色
(pH<5.0)
蓝色
(pH>8.0)
8.2
10.0
粉红色
无色
(pH<8.2)
红色
(pH>10.0)
酸碱指示剂法
溶液的酸碱性与pH值
注意:①试纸不能用水润湿
②不能将试纸伸到溶液中
③广泛pH试纸只能读出整数
(1)广泛pH试纸:测量出溶液的整数pH
pH试纸法
使用方法:用镊子撕取一小片pH试纸放于洁净干燥的表面皿(或玻璃片)上,用洁净干燥的玻璃棒蘸取待测液点在试纸中部,待试纸显色稳定后与标准比色卡对比,读出pH。
溶液的酸碱性与pH值
(2)精密pH试纸:
pH试纸法
可以判别0.2或0.3的pH差值
溶液的酸碱性与pH值
精确测定溶液pH
pH计法
溶液的酸碱性与pH值
(2)环保治理污水:酸性废水可投加_____物质使之中和,碱性废水可投加_____物质或利用烟道气中和。
碱性
酸性
4.pH的应用
(1)人体健康调节:如洗发时人们用的护发素主要功能是调节头发的pH使之达到适宜的酸碱度。
(5)在科学实验和工业生产方面:溶液pH的控制常常是影响实验结果或产品质量、产量的关键因素。
(3)农业生产调节:控制土壤的pH使之适宜作物生长,提高作物的质量和产量。
(4)在医疗上:可以通过测试和调节pH来进行诊断和治疗疾病。
溶液的酸碱性与pH值
pH在农业中的应用
在农业上,土壤的pH关系到农作物的生长,有的作物如芝麻、油菜、萝卜等可以生长在较大的pH范围内,有的却对土壤的pH反应非常敏感,如茶树适宜在pH约为4.0~5.5的土壤中生长。
溶液的酸碱性与pH值
在工业上,例如,氯碱工业生产中所用食盐水的pH要控制在12左右,以除去其中的Ca2+和Mg2+等杂质。在无机盐的生产中,为了分离所含的杂质如Fe3+,常把无机盐溶液的pH调到5左右,此时Fe3+形成Fe(OH)3沉淀而分离析出,其他阳离子却留在溶液中。
pH在工业生产中的应用
溶液的酸碱性与pH值
在医疗上,测定血液等的pH可以帮助诊断疾病。例如,人体内血液的pH一般在7.35~7.45范围内,如果超过这个范围,便属于病理现象。
在科学实验中,pH是影响某些反应过程的重要因素,因此测定和控制溶液的pH,就如控制温度和浓度等同样重要。
pH在科研中的应用
THANK YOU
Asadal has been running one of the biggest domain and web hosting sites in Korea since March 1998. More than 3,000,000 people have.visited our website, www. for domain registration and web hosting
