1.1.2物质的转化 课件(共22张PPT)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1.2物质的转化 课件(共22张PPT)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-24 19:39:15 | ||
图片预览





文档简介
(共22张PPT)
课时2 物质的转化
第一章 物质及其变化
第一节 物质的分类及转化
学习目标
1.从物质类别角度,找出金属、氧化物、酸、碱、盐等各类物质的通性,理清物质之间的转化规律。
2.能用分类观及物质转化关系,学会设计多种方案制备常见物质。
新课导入
美丽的化学——
化学实验中物质的转化
新课导入
教学过程
如何通过化学变化来实现物质之间的转化?
了解物质的组成和性质(基础)
遵循反应前后质量守恒、得失电子守恒等(依据)
教学过程
一、各类物质的性质
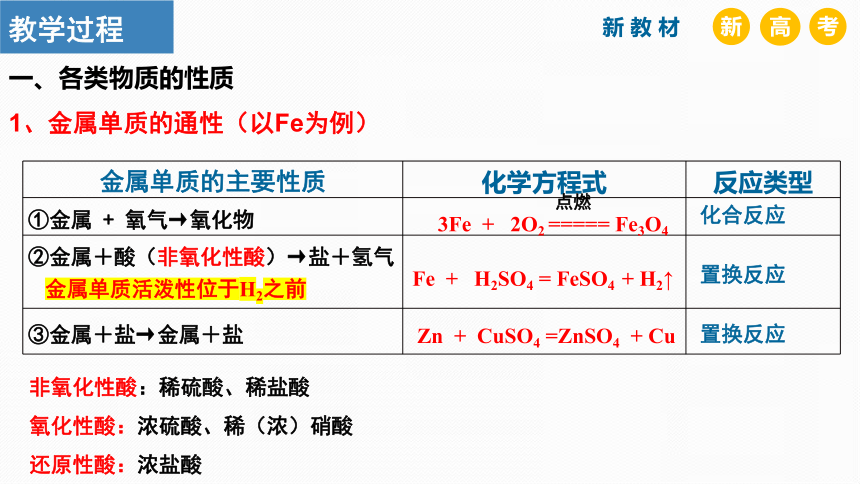
1、金属单质的通性(以Fe为例)
金属单质的主要性质 化学方程式 反应类型
①金属 + 氧气→氧化物
②金属+酸(非氧化性酸)→盐+氢气
③金属+盐→金属+盐
非氧化性酸:稀硫酸、稀盐酸
氧化性酸:浓硫酸、稀(浓)硝酸
还原性酸:浓盐酸
Fe + H2SO4 = FeSO4 + H2↑
Zn + CuSO4 =ZnSO4 + Cu
点燃
3Fe + 2O2 ===== Fe3O4
化合反应
置换反应
置换反应
金属单质活泼性位于H2之前
教学过程
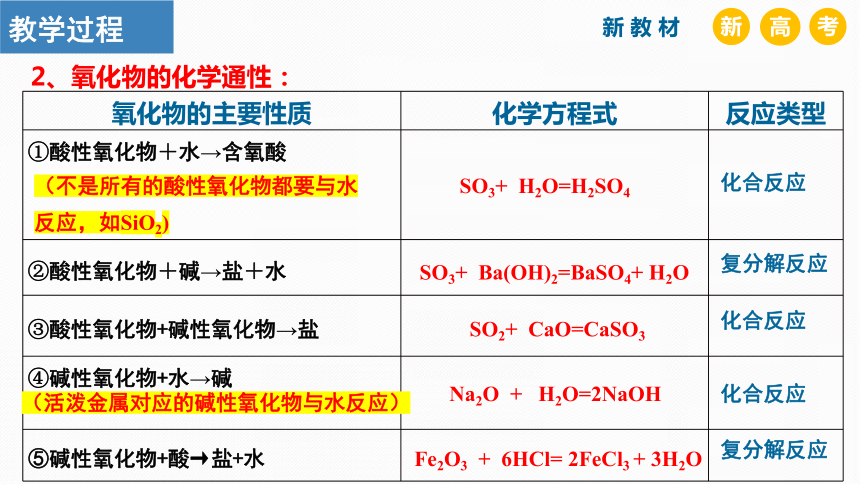
氧化物的主要性质 化学方程式 反应类型
①酸性氧化物+水→含氧酸
②酸性氧化物+碱→盐+水
③酸性氧化物+碱性氧化物→盐
④碱性氧化物+水→碱
⑤碱性氧化物+酸→盐+水
2、氧化物的化学通性:
SO3+ H2O=H2SO4
SO3+ Ba(OH)2=BaSO4+ H2O
SO2+ CaO=CaSO3
Na2O + H2O=2NaOH
Fe2O3 + 6HCl= 2FeCl3 + 3H2O
(不是所有的酸性氧化物都要与水反应,如SiO2)
(活泼金属对应的碱性氧化物与水反应)
化合反应
复分解反应
化合反应
化合反应
复分解反应
教学过程
酸的主要性质 化学方程式 反应类型
①酸遇酸碱指示剂发生显色反应 -------
②酸+活泼金属→盐+氢气
③酸+碱→盐+水
④酸+碱性氧化物→盐+水
⑤酸+盐→新酸+新盐
3、酸(非氧化性酸)的化学通性:
紫色石蕊溶液遇酸变红
Fe + 2HCl= FeCl2 + H2↑
H2SO4+ Ba(OH)2=BaSO4 + 2H2O
2HCl + Na2O=2NaCl + H2O
HCl + AgNO3=HNO3 + AgCl
置换反应
复分解反应
复分解反应
复分解反应
教学过程
碱的主要性质 化学方程式 反应类型
①碱遇酸碱指示剂发生显色反应 ------
②碱+酸→盐+水
③碱+酸性氧化物→盐+水
⑤酸+盐→新酸+新盐
4、碱的化学通性:
紫色石蕊溶液遇碱变蓝,酚酞遇碱变红
NaOH +HCl=NaCl+H2O
2NaOH + SO2=NaSO3 + H2O
2NaOH + SO3=NaSO4+ H2O
HCl + AgNO3=HNO3 + AgCl
复分解反应
复分解反应
复分解反应
教学过程
盐的主要性质 化学方程式 反应类型
①盐+酸→新盐+新酸
②盐+碱→新盐+新碱
③盐+盐→新盐+新盐
④盐+金属→新盐+金属
5、盐的化学通性:
Na2CO3+ 2HCl =2NaCl +CO2↑+ H2O
Na2CO3+ Ba(OH)2=BaCO3+ 2NaOH
Na2CO3+ CaCl2=CaCO3+ 2NaCl
Fe + CuSO4= Cu+ FeSO4
复分解反应
复分解反应
复分解反应
置换反应
反应物都必须是可溶性
反应物都必须是可溶性
活泼性强的金属置换活泼性弱的金属,前提条件是该活泼金属不与水反应。
教学过程
阴离子 阳离子 OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 —
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 —
Cu2+ 不 溶 溶 溶 不
Ag+ — 溶 不 微 不
酸
碱
铵 盐
钠 盐
钙 盐
铝 盐
硝 酸 盐
氯化物(盐酸盐)
硫 酸 盐
碳 酸 盐
教学过程
【思考与讨论】为什么酸、碱或者盐具有相似的化学性质呢?
宏观辨识
组成相似
微观探析
H+
HCl
H2SO4
HNO3
NaOH
KOH
Ba(OH)2
Na2CO3
K2CO3
(NH4)2CO3
OH-
CO32—
物质的结构
决定
物质的性质
反映
教学过程
请同学们完成P11思考与讨论
C CO2 H2CO3 CaCO3
Ca CaO Ca(OH)2 CaSO4
① 2Ca+O2 = 2CaO
② CaO+H2O = Ca(OH)2
③ Ca(OH)2+SO3 =CaSO4↓+H2O
④C+O2 = CO2
⑤CO2+H2O = H2CO3
⑥Ca(OH)2+H2CO3 = CaCO3↓+2H2O
金属单质 碱性氧化物 碱 盐
非金属单质 酸性氧化物 酸 盐
教学过程
金属单质
碱性氧化物
碱
盐
非金属单质
酸性氧化物
酸
盐
O2
O2
H2O
H2O
酸或酸性氧化物
碱或碱性氧化物
思维模型
物质转化的一般流程
教学过程
金属单质
碱性氧化物
碱
盐
非金属单质
酸性氧化物
酸
盐
盐
酸和盐
碱和盐
金属
和盐
盐和盐
盐和氢气
盐和水
通过对物质类别共性的梳理,可知不同类别物质之间存在着各种反应关系和转化关系,请你用图示的形式将这种关系呈现出来。
教学过程
阅读教材P11页第三自然段,以制备氢氧化钠为例,说明在具体的生产过程中怎样选择更合适的途径。
氢氧化钠的制备
途径(方法)
选择因素
①氧化钠与水反应
②盐 (如 Na2CO3)与 碱 [如 Ca(OH)2]反应
③电解饱和食盐水等
考虑成本
电解饱和食盐水
反应的可能性、原料来源、成本高低、设备要求等方面来选择物质制备的适宜方法。
课堂练习
设计合适的途径制备硫酸钠
Na2SO3
元素组成
Na 、S、 O
物质类别
盐
含Na物质
Na2CO3
Na
Na2O
NaOH
金属单质
碱性氧化物
碱
盐
S
SO2
H2SO3
K2SO3
SO3
K2SO4
H2SO4
非金属单质
酸性氧化物
酸
盐
含
S
物质
物质分类
1、寻找原材料
教学过程
H2SO3
方案一
2、运用“各类物质的反应关系图”设计以Na 为原料制备Na2SO3的转化路径。
Na
Na2O
NaOH
H2SO3
教学过程
H2SO3
方案二
Na
Na2O
NaOH
SO2
教学过程
H2SO3
方案三
Na
Na2O
SO2
课堂总结
酸+碱=盐+水;酸+活泼金属单质=盐+H2;酸+碱性氧化物=盐+水;酸+某些盐=盐+酸;
1、酸的通性
2、碱的通性
碱+酸=盐+水;碱+酸性氧化物=盐+水;碱+某些盐=盐+碱;
3、盐的通性
某些盐+酸=盐+酸;某些盐+碱=盐+碱;某些盐+某些盐=盐+盐;
4、金属单质到盐
5、非金属单质到盐
探究课堂
谢 谢 观 看!
课时2 物质的转化
第一章 物质及其变化
第一节 物质的分类及转化
学习目标
1.从物质类别角度,找出金属、氧化物、酸、碱、盐等各类物质的通性,理清物质之间的转化规律。
2.能用分类观及物质转化关系,学会设计多种方案制备常见物质。
新课导入
美丽的化学——
化学实验中物质的转化
新课导入
教学过程
如何通过化学变化来实现物质之间的转化?
了解物质的组成和性质(基础)
遵循反应前后质量守恒、得失电子守恒等(依据)
教学过程
一、各类物质的性质
1、金属单质的通性(以Fe为例)
金属单质的主要性质 化学方程式 反应类型
①金属 + 氧气→氧化物
②金属+酸(非氧化性酸)→盐+氢气
③金属+盐→金属+盐
非氧化性酸:稀硫酸、稀盐酸
氧化性酸:浓硫酸、稀(浓)硝酸
还原性酸:浓盐酸
Fe + H2SO4 = FeSO4 + H2↑
Zn + CuSO4 =ZnSO4 + Cu
点燃
3Fe + 2O2 ===== Fe3O4
化合反应
置换反应
置换反应
金属单质活泼性位于H2之前
教学过程
氧化物的主要性质 化学方程式 反应类型
①酸性氧化物+水→含氧酸
②酸性氧化物+碱→盐+水
③酸性氧化物+碱性氧化物→盐
④碱性氧化物+水→碱
⑤碱性氧化物+酸→盐+水
2、氧化物的化学通性:
SO3+ H2O=H2SO4
SO3+ Ba(OH)2=BaSO4+ H2O
SO2+ CaO=CaSO3
Na2O + H2O=2NaOH
Fe2O3 + 6HCl= 2FeCl3 + 3H2O
(不是所有的酸性氧化物都要与水反应,如SiO2)
(活泼金属对应的碱性氧化物与水反应)
化合反应
复分解反应
化合反应
化合反应
复分解反应
教学过程
酸的主要性质 化学方程式 反应类型
①酸遇酸碱指示剂发生显色反应 -------
②酸+活泼金属→盐+氢气
③酸+碱→盐+水
④酸+碱性氧化物→盐+水
⑤酸+盐→新酸+新盐
3、酸(非氧化性酸)的化学通性:
紫色石蕊溶液遇酸变红
Fe + 2HCl= FeCl2 + H2↑
H2SO4+ Ba(OH)2=BaSO4 + 2H2O
2HCl + Na2O=2NaCl + H2O
HCl + AgNO3=HNO3 + AgCl
置换反应
复分解反应
复分解反应
复分解反应
教学过程
碱的主要性质 化学方程式 反应类型
①碱遇酸碱指示剂发生显色反应 ------
②碱+酸→盐+水
③碱+酸性氧化物→盐+水
⑤酸+盐→新酸+新盐
4、碱的化学通性:
紫色石蕊溶液遇碱变蓝,酚酞遇碱变红
NaOH +HCl=NaCl+H2O
2NaOH + SO2=NaSO3 + H2O
2NaOH + SO3=NaSO4+ H2O
HCl + AgNO3=HNO3 + AgCl
复分解反应
复分解反应
复分解反应
教学过程
盐的主要性质 化学方程式 反应类型
①盐+酸→新盐+新酸
②盐+碱→新盐+新碱
③盐+盐→新盐+新盐
④盐+金属→新盐+金属
5、盐的化学通性:
Na2CO3+ 2HCl =2NaCl +CO2↑+ H2O
Na2CO3+ Ba(OH)2=BaCO3+ 2NaOH
Na2CO3+ CaCl2=CaCO3+ 2NaCl
Fe + CuSO4= Cu+ FeSO4
复分解反应
复分解反应
复分解反应
置换反应
反应物都必须是可溶性
反应物都必须是可溶性
活泼性强的金属置换活泼性弱的金属,前提条件是该活泼金属不与水反应。
教学过程
阴离子 阳离子 OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 —
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 —
Cu2+ 不 溶 溶 溶 不
Ag+ — 溶 不 微 不
酸
碱
铵 盐
钠 盐
钙 盐
铝 盐
硝 酸 盐
氯化物(盐酸盐)
硫 酸 盐
碳 酸 盐
教学过程
【思考与讨论】为什么酸、碱或者盐具有相似的化学性质呢?
宏观辨识
组成相似
微观探析
H+
HCl
H2SO4
HNO3
NaOH
KOH
Ba(OH)2
Na2CO3
K2CO3
(NH4)2CO3
OH-
CO32—
物质的结构
决定
物质的性质
反映
教学过程
请同学们完成P11思考与讨论
C CO2 H2CO3 CaCO3
Ca CaO Ca(OH)2 CaSO4
① 2Ca+O2 = 2CaO
② CaO+H2O = Ca(OH)2
③ Ca(OH)2+SO3 =CaSO4↓+H2O
④C+O2 = CO2
⑤CO2+H2O = H2CO3
⑥Ca(OH)2+H2CO3 = CaCO3↓+2H2O
金属单质 碱性氧化物 碱 盐
非金属单质 酸性氧化物 酸 盐
教学过程
金属单质
碱性氧化物
碱
盐
非金属单质
酸性氧化物
酸
盐
O2
O2
H2O
H2O
酸或酸性氧化物
碱或碱性氧化物
思维模型
物质转化的一般流程
教学过程
金属单质
碱性氧化物
碱
盐
非金属单质
酸性氧化物
酸
盐
盐
酸和盐
碱和盐
金属
和盐
盐和盐
盐和氢气
盐和水
通过对物质类别共性的梳理,可知不同类别物质之间存在着各种反应关系和转化关系,请你用图示的形式将这种关系呈现出来。
教学过程
阅读教材P11页第三自然段,以制备氢氧化钠为例,说明在具体的生产过程中怎样选择更合适的途径。
氢氧化钠的制备
途径(方法)
选择因素
①氧化钠与水反应
②盐 (如 Na2CO3)与 碱 [如 Ca(OH)2]反应
③电解饱和食盐水等
考虑成本
电解饱和食盐水
反应的可能性、原料来源、成本高低、设备要求等方面来选择物质制备的适宜方法。
课堂练习
设计合适的途径制备硫酸钠
Na2SO3
元素组成
Na 、S、 O
物质类别
盐
含Na物质
Na2CO3
Na
Na2O
NaOH
金属单质
碱性氧化物
碱
盐
S
SO2
H2SO3
K2SO3
SO3
K2SO4
H2SO4
非金属单质
酸性氧化物
酸
盐
含
S
物质
物质分类
1、寻找原材料
教学过程
H2SO3
方案一
2、运用“各类物质的反应关系图”设计以Na 为原料制备Na2SO3的转化路径。
Na
Na2O
NaOH
H2SO3
教学过程
H2SO3
方案二
Na
Na2O
NaOH
SO2
教学过程
H2SO3
方案三
Na
Na2O
SO2
课堂总结
酸+碱=盐+水;酸+活泼金属单质=盐+H2;酸+碱性氧化物=盐+水;酸+某些盐=盐+酸;
1、酸的通性
2、碱的通性
碱+酸=盐+水;碱+酸性氧化物=盐+水;碱+某些盐=盐+碱;
3、盐的通性
某些盐+酸=盐+酸;某些盐+碱=盐+碱;某些盐+某些盐=盐+盐;
4、金属单质到盐
5、非金属单质到盐
探究课堂
谢 谢 观 看!
