2024年中考化学冲刺专项训练:综合题(含答案)
文档属性
| 名称 | 2024年中考化学冲刺专项训练:综合题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 774.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-25 17:14:30 | ||
图片预览

文档简介
2024年中考化学冲刺专项训练:综合题
综合题
1.与中华民族五千年文明相比,人类用火、防火的历史则更为久远。
(1)诗人陆游的笔记中记载“书灯勿用铜盏,惟瓷盏最省油,蜀中有夹瓷盏……可省油之半”。“一端作小窍,注清冷水于其中,每夕一易之”。夹瓷盏被称为省油灯,用棉绳做炷(灯芯),上层盏盛油,下层盏盛水,其结构示意图如图1。
①图中属于可燃物的是 和 ,这是燃烧的 个条件之一。
②省油灯的原理是 。
③“注清冷水于其中,每夕一易之”说明下层盏中的水不断减少。对该现象的微观解释正确的是 (填字母序号)。
a.水分子受热分解b.水分子不断运动c.水分子间隔变大d.水分子数目减少
(2)依据灭火原理,徽派防火墙如图2(又叫马头墙,能阻止火灾蔓延)的主要作用是 。
2.(1)Ⅰ:A、B、C、D、E五种物质都是己学化学内容中涉及到的常见物质,其转化关系如下图所示:
写出物质A的化学式: 。
(2)物质E的一种用途 反应③的实验现象是 。
(3)从微观的角度:分析A与C化学性质不同的原因是 。
(4)写出反应①的文字表达式 。
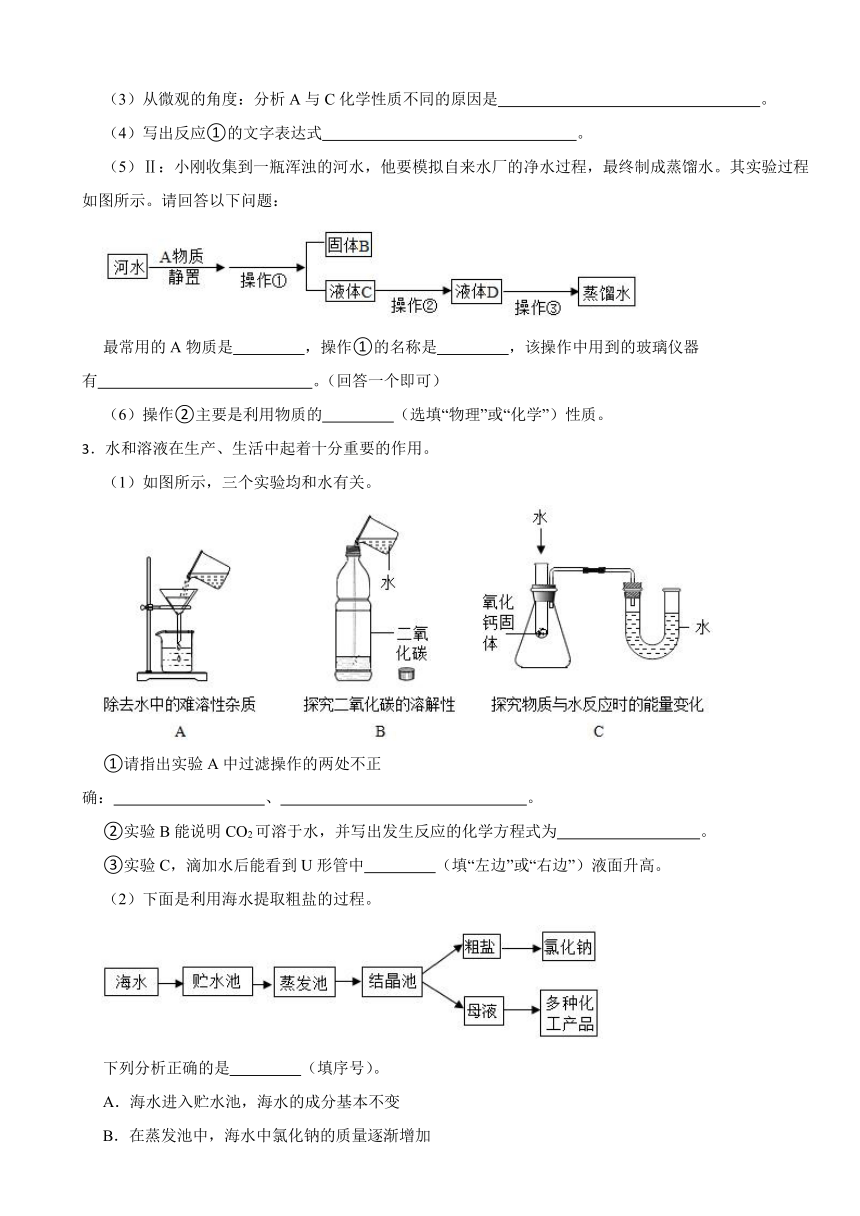
(5)Ⅱ:小刚收集到一瓶浑浊的河水,他要模拟自来水厂的净水过程,最终制成蒸馏水。其实验过程如图所示。请回答以下问题:
最常用的A物质是 ,操作①的名称是 ,该操作中用到的玻璃仪器有 。(回答一个即可)
(6)操作②主要是利用物质的 (选填“物理”或“化学”)性质。
3.水和溶液在生产、生活中起着十分重要的作用。
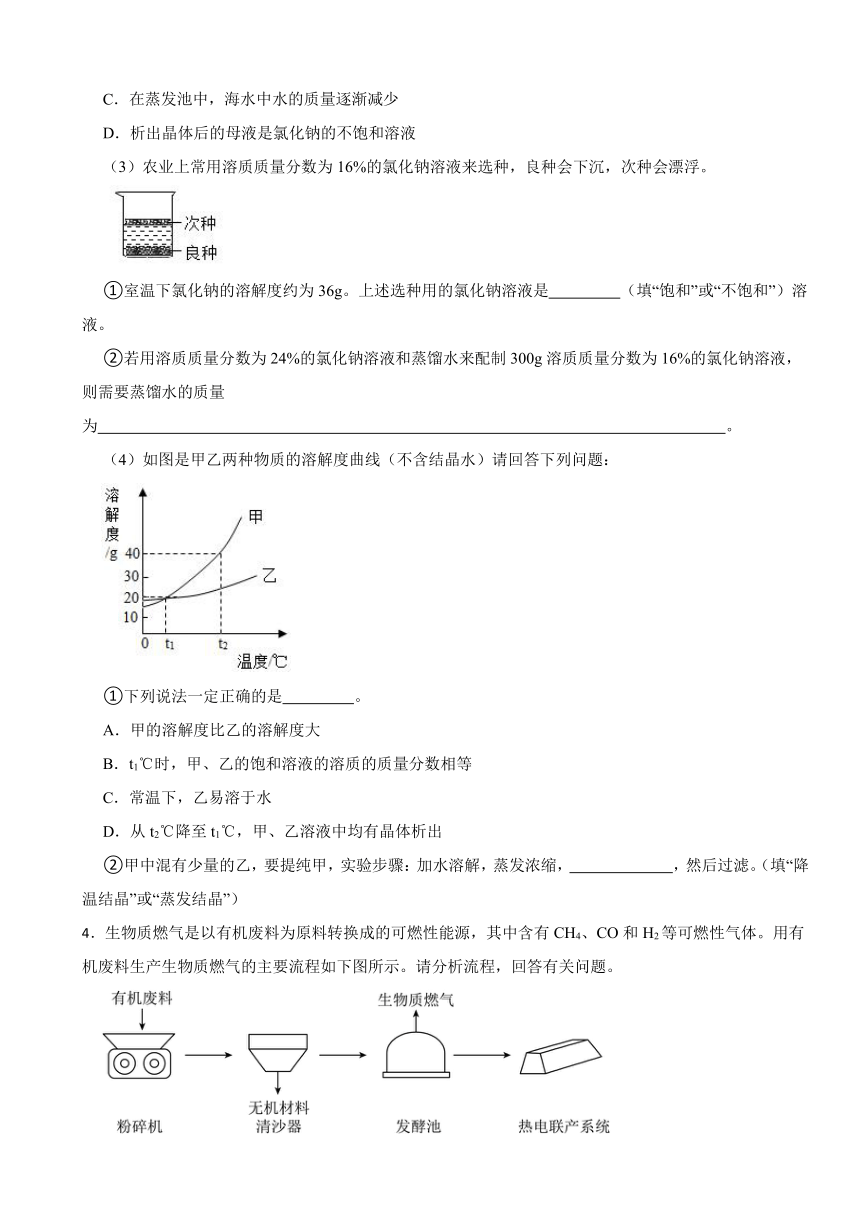
(1)如图所示,三个实验均和水有关。
①请指出实验A中过滤操作的两处不正确: 、 。
②实验B能说明CO2可溶于水,并写出发生反应的化学方程式为 。
③实验C,滴加水后能看到U形管中 (填“左边”或“右边”)液面升高。
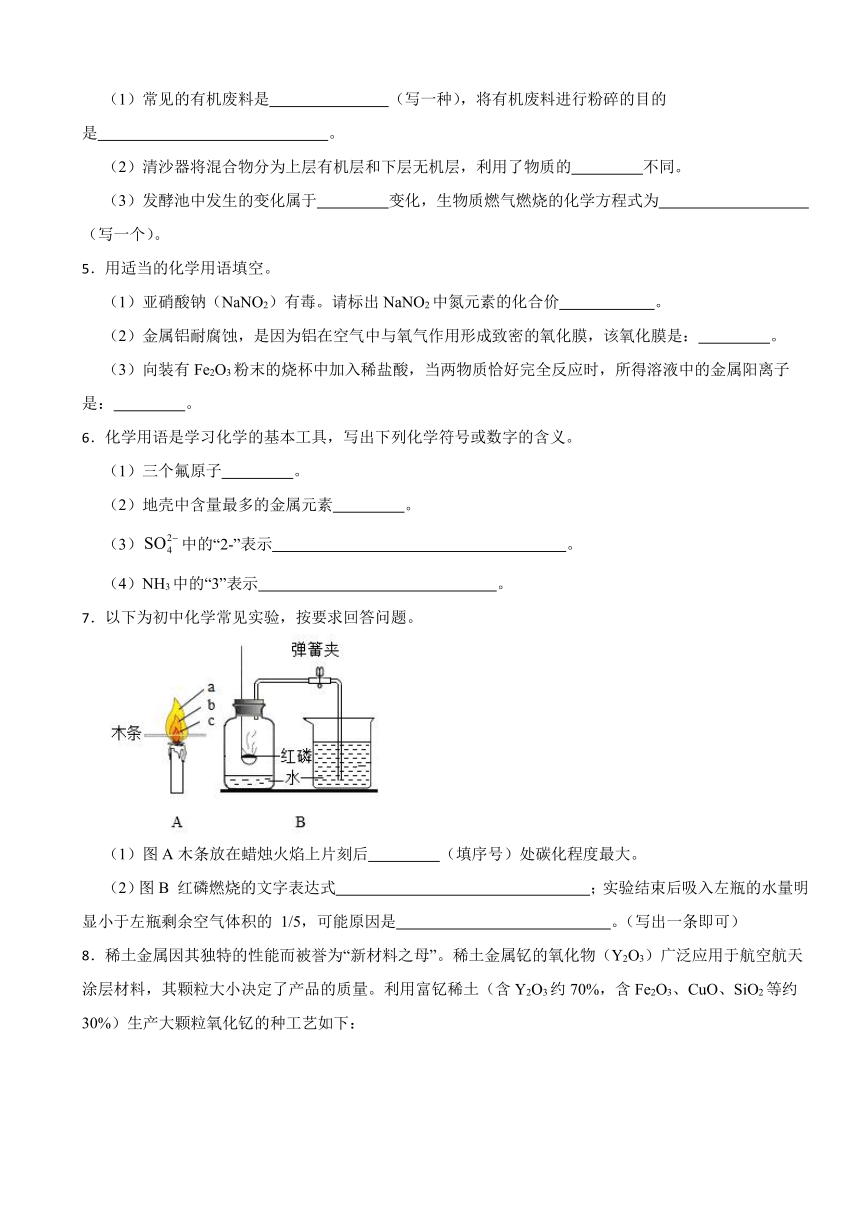
(2)下面是利用海水提取粗盐的过程。
下列分析正确的是 (填序号)。
A.海水进入贮水池,海水的成分基本不变
B.在蒸发池中,海水中氯化钠的质量逐渐增加
C.在蒸发池中,海水中水的质量逐渐减少
D.析出晶体后的母液是氯化钠的不饱和溶液
(3)农业上常用溶质质量分数为16%的氯化钠溶液来选种,良种会下沉,次种会漂浮。
①室温下氯化钠的溶解度约为36g。上述选种用的氯化钠溶液是 (填“饱和”或“不饱和”)溶液。
②若用溶质质量分数为24%的氯化钠溶液和蒸馏水来配制300g溶质质量分数为16%的氯化钠溶液,则需要蒸馏水的质量为 。
(4)如图是甲乙两种物质的溶解度曲线(不含结晶水)请回答下列问题:
①下列说法一定正确的是 。
A.甲的溶解度比乙的溶解度大
B.t1℃时,甲、乙的饱和溶液的溶质的质量分数相等
C.常温下,乙易溶于水
D.从t2℃降至t1℃,甲、乙溶液中均有晶体析出
②甲中混有少量的乙,要提纯甲,实验步骤:加水溶解,蒸发浓缩, ,然后过滤。(填“降温结晶”或“蒸发结晶”)
4.生物质燃气是以有机废料为原料转换成的可燃性能源,其中含有CH4、CO和H2等可燃性气体。用有机废料生产生物质燃气的主要流程如下图所示。请分析流程,回答有关问题。
(1)常见的有机废料是 (写一种),将有机废料进行粉碎的目的是 。
(2)清沙器将混合物分为上层有机层和下层无机层,利用了物质的 不同。
(3)发酵池中发生的变化属于 变化,生物质燃气燃烧的化学方程式为 (写一个)。
5.用适当的化学用语填空。
(1)亚硝酸钠(NaNO2)有毒。请标出NaNO2中氮元素的化合价 。
(2)金属铝耐腐蚀,是因为铝在空气中与氧气作用形成致密的氧化膜,该氧化膜是: 。
(3)向装有Fe2O3粉末的烧杯中加入稀盐酸,当两物质恰好完全反应时,所得溶液中的金属阳离子是: 。
6.化学用语是学习化学的基本工具,写出下列化学符号或数字的含义。
(1)三个氟原子 。
(2)地壳中含量最多的金属元素 。
(3)中的“2-”表示 。
(4)NH3中的“3”表示 。
7.以下为初中化学常见实验,按要求回答问题。
(1)图A木条放在蜡烛火焰上片刻后 (填序号)处碳化程度最大。
(2)图B 红磷燃烧的文字表达式 ;实验结束后吸入左瓶的水量明显小于左瓶剩余空气体积的 1/5,可能原因是 。(写出一条即可)
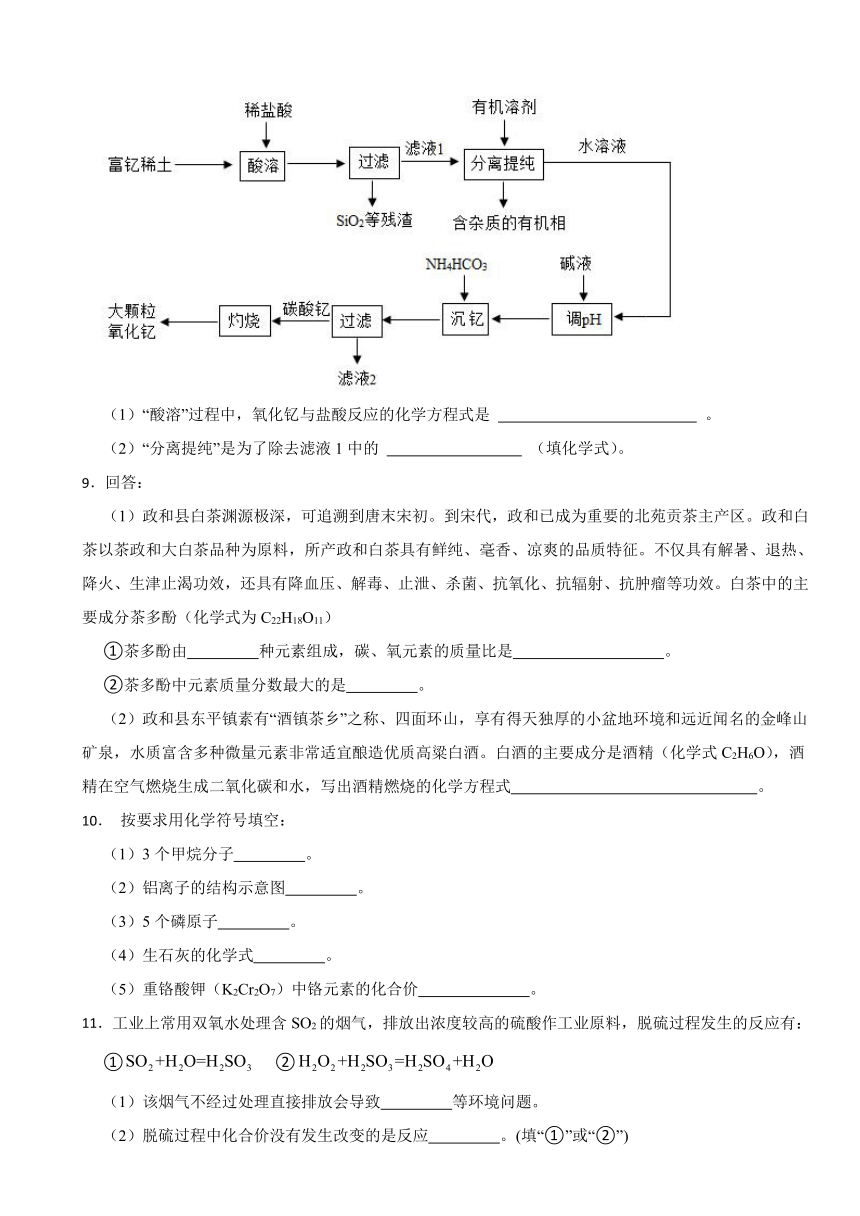
8.稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物(Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含Y2O3约70%,含Fe2O3、CuO、SiO2等约30%)生产大颗粒氧化钇的种工艺如下:
(1)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是 。
(2)“分离提纯”是为了除去滤液1中的
(填化学式)。
9.回答:
(1)政和县白茶渊源极深,可追溯到唐末宋初。到宋代,政和已成为重要的北苑贡茶主产区。政和白茶以茶政和大白茶品种为原料,所产政和白茶具有鲜纯、毫香、凉爽的品质特征。不仅具有解暑、退热、降火、生津止渴功效,还具有降血压、解毒、止泄、杀菌、抗氧化、抗辐射、抗肿瘤等功效。白茶中的主要成分茶多酚(化学式为C22H18O11)
①茶多酚由 种元素组成,碳、氧元素的质量比是 。
②茶多酚中元素质量分数最大的是 。
(2)政和县东平镇素有“酒镇茶乡”之称、四面环山,享有得天独厚的小盆地环境和远近闻名的金峰山矿泉,水质富含多种微量元素非常适宜酿造优质高粱白酒。白酒的主要成分是酒精(化学式C2H6O),酒精在空气燃烧生成二氧化碳和水,写出酒精燃烧的化学方程式 。
10. 按要求用化学符号填空:
(1)3个甲烷分子 。
(2)铝离子的结构示意图 。
(3)5个磷原子 。
(4)生石灰的化学式 。
(5)重铬酸钾(K2Cr2O7)中铬元素的化合价 。
11.工业上常用双氧水处理含SO2的烟气,排放出浓度较高的硫酸作工业原料,脱硫过程发生的反应有:
① ②
(1)该烟气不经过处理直接排放会导致 等环境问题。
(2)脱硫过程中化合价没有发生改变的是反应 。(填“①”或“②”)
(3)若排放出100千克溶质质量分数为29.4%的硫酸,需要用溶质质量分数为34%的双氧水多少千克?(写出计算过程)
(4)工业上还有种脱硫法——“双碱法脱硫”,该工艺是先将含SO2的烟气通过排烟机送入脱硫塔,与NaOH、Na2CO3、Na2SO3等水溶液充分接触后与烟气中的SO2反应。将吸收液送至石灰反应器,进行吸收液的再生和固体副产品的析出。吸收过程中涉及的反应方程式:
用NaOH吸收:
用Na2CO3吸收:
用Na2SO3吸收:
若在脱硫塔内吸收等质量的含SO2的烟气,用 吸收所需要的原料质量最少。
12.我们常从微观认识宏观的化学反应,如图是乙烯(C2H4)燃烧的微观示意图。
(1)该反应中单质的化学式为 ;
(2)该反应的化学方程式为 ;
(3)化学反应前后质量守恒的微观实质是 。
13.生活中处处有化学知识,请根据题意回答相关问题
(1)新型冠状病毒蔓延期间,为做好自我防护,要佩戴符合要求的口罩。活性炭口罩能有效阻隔氨、苯、甲醛等有害气体,因为活性炭具有 性。
(2)电器着火,下列做法正确的是____。
A.用水浇灭 B.用干粉灭火器灭火
C.用湿棉被覆盖住电器 D.立即打开所有门窗
(3)中药“石灰”是由生石灰和熟石灰混合而成,具有解毒蚀腐,敛疮止血、杀虫止痒的功效,写出生石灰变成熟石灰的反应方程式 。
14.实验室加热氯酸钾(KClO3)和二氧化锰的混合物28.0g制取氧气,完全反应后剩余固体质量为18.4g,请计算:生成氧气的质量。原混合物中氯酸钾的质量。
15.2022年8月1日,国产C919大飞机完成取证试飞,该飞机的制造中9%的用料为钛合金。如图是工业上以金红石(主要成分是TiO2)为原料生产金属钛(Ti)的流程图:
(1)金红石和焦炭要先经粉碎处理,目的是 ;写出反应①的化学方程式: 。
(2)反应②在氩气环境中进行,氩气能用作保护气是因为其 。
(3)反应③涉及的化学反应的基本反应类型为 。
(4)该流程中可以循环利用的物质有 。
16.盐文化积淀了扬州深厚的文化底蕴。如图是《天工开物》中制取井盐的插图。
(1)中国卫生部向食盐中添加碘酸钾(KIO3)来补碘。碘是人体必需的 (填“常量”或“微量”)元素,加碘盐的水溶液遇淀粉 (填“会”或“不会”)变蓝,碘分子与氢分子一样为双原子分子,则碘分子化学式为 ;KIO3中碘元素的化合价 。
(2)“凿井”过程有“其器冶铁锥”的记载其中“铁锥”属于 (填字母);
A.金属材料 B.复合材料 C.有机合成材料 D.无机非金属材料
“足踏锥梢,春石成粉碎”体现了“铁锥”具有的物理性质: 。
(3)“制盐”过程中“入于釜中煎炼顷刻成盐”描写的是氯化钠 结晶的过程,其中的“釜”类似于化学实验中的 (填仪器名称)。
(4)“井火”主要由天然气燃烧产生,写出天然气完全燃烧的化学方程式 。
17.我国提出要在2026年达到“碳平衡”,“碳平衡”是指碳的排放和吸收两方面在数量或质量上相等或相抵。实现“碳平衡”可采取以下措施。
(1)抓紧制定二氧化碳排放达峰行动方案。生产生活中产生的含量过高会引起的环境问题是 ,应减少化石燃料煤、石油和 的使用。
(2)为实现“碳平衡”,要加强转变能源结构,采取技术捕集、利用和封存二氧化碳,如将工厂废气中的转化成甲醇(),该反应的微观示意图如下图所示。该反应的化学反应方程式为 ,反应生成丙和丁的质量比为 。
(3)实现“碳平衡”的重要方式之一是升级能源消费方式,请写出一种清洁能源: 。
(4)为实现“碳平衡”,还可以采取下列措施____。
A.整改不合格的、污染大的企业
B.节约纸张,保护森林
C.多使用公共交通工具,倡导绿色出行
18.皮蛋是我国一种传统风味蛋制品。某化学课外小组的同学查阅资料后得知,腌制皮蛋的主要原料有:生石灰、纯碱和食盐。同学们向这三种物质中加入足量水,充分搅拌,过滤,对滤液中溶质的成分进行探究。
【提出问题】滤液中可能含有哪些溶质?
(1)【作出猜想】
猜想一:
猜想二: NaCl、NaOH、Na2CO3
猜想三:NaCl、NaOH、Ca(OH)2
(2)【进行实验】同学们分别设计了如下三种方案并进行实验:
方案一:取少量滤液于试管中,滴加少量的稀盐酸,没有观察到产生气泡,从而得出猜想二不成立。同学们一致认为,通过该实验不足以判断猜想二不成立,理由是 。
(3)方案二:取少量滤液于试管中,通入二氧化碳气体,没有观察到明显现象。从而得出猜
想二成立 。同学们一致认为,通过该实验 也 不足以得出其结论,原因是 。
(4)方案三:进行了如下实验:
实验步骤 实验现象 实验结论
①取少量滤液于试管中,加入足量的氯化钡溶液 无明显现象 猜想 不正确
②继续向步骤①所得溶液中通入二氧化碳 有白色沉淀生成 猜想三正确
(5)【反思评价】小组同学经过讨论,一致认为根据步骤(2)的现象不足以证明猜想三是正确的,理由是 。
(6)同学们经过认真思考后,对步骤(2)进行了修改,并做了下面的实验,最终得出了正确的结论,记录如下。请你完善实验报告。
实验步骤 实验现象 实验结论
有白色沉淀生成 猜想三正确
19.如图1是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。回答下列问题:
(1)t1℃时,甲、乙、丙三种物质的溶解度由小到大的顺序是 。
(2)P点表示在t2℃时,甲、丙两种物质的饱和溶液中,溶质与溶剂的质量比相同,它们的比为m质:m剂= (化为最简比)。
(3)t2 ℃时,取甲、乙两种固体各13g,分别加入50g水中充分溶解,实验结果如图2所示,则烧杯a中溶解的物质一定是 (填“甲”或“乙”),所得溶液的质量为 g。
(4)当甲含有少量的乙和丙(甲、乙、丙相互间均不发生化学反应)时,可采用 (填“降温”或“蒸发”)结晶的方法提取甲物质。
20. 学习小组同学利用下图实验,回收实验室废弃的铜粉与铁粉混合物中的铜粉。
(1)反应生成氢气的质量是 g。
(2)计算上述实验回收铜粉的质量。(忽略回收过程中铜粉的损失)
(3)上述实验所用稀硫酸的溶质质量分数 (填“可能”或“不可能”)是15%。
21.运用所学知识回答问题
(1)用化学符号表示下列意义:
①2个铜原子 ;②甲烷 ;③氯化铁 ;④硫酸根离子 。
(2)在迎来中国共产党建党一百周年之际,“嫦娥五号”探测器返回舱带回月球样品(月壤),“天问一号”探测器着陆火星,这是我国航天事业发展具有里程碑意义的进展。
①经检测知,月壤中主要含有橄榄石、辉石、钛铁矿、斜长石以及玻璃态物质,该月球样品属于 (填“纯净物”或“混合物”)。
②在月壤中还含有丰富的稀有气体氦-3(He-3)。一个氦-3原子的原子核内含有2个质子和1个中子,其核外电子数为 。
③火星表面呈黄褐色,是由于火星表面土壤中含有氧化铁(Fe2O3)等物质引起的。Fe2O3中铁元素的化合价为 。
22.空气是宝贵的资源,利用空气合成尿素【CO(NH2)2】的主要转化过程如图所示。
(1)I中空气经液化分离后,得到的X是 。
(2)Ⅱ中将氧气压缩后储存在钢瓶中,其分子间隔 (填“变大”或“变小”)。
(3)补全合成尿素的化学方程式: 。
23.写出下列反应的文字表达式:
(1)加热碳酸氢铵固体 。
(2)铁丝在氧气中燃烧 。
(3)用双氧水和二氧化锰混合分解制取氧气 。
24.空气是人类赖以生存的物质基础。
(1)空气中含量最多的气体是 。
(2)下列现象中,能说明我们身边存在空气的是____。
A.快速奔跑时感受到风吹来
B.把塑料袋抖开后扎紧,感到不易压缩
C.将玻璃杯倒扣在水槽中,水不能充满玻璃杯
25.煤是社会生产、生活中最重要的能源,其主要成分是碳。工业上常把煤进行气化和液化处理,使煤变成清洁能源。煤气化和液化的流程如图所示:
(1)粗煤属于 (选填“纯净物”或“混合物”)。
(2)步骤①中分离操作的名称是 。
(3)步骤③中发生反应的化学方程式为 。
(4)相比于直接用煤作燃料,“煤的气化和液化”的优点是 。
26.在学习“质量守恒定律”时,小泽查阅到以下材料:
(1)从现在的视角分析波义耳实验,金属灰比原金属增加的质量是 。
(2)质量守恒定律的发现过程,带给我们的启示有 (填序号)。
a.要善于总结前人的成果和经验
b.定量方法是科学研究的重要方法
c.实验的成功与否,只取决于药品的选择
(3)受科学家研究的启发,小泽参照教材中的实验继续深入探究。该实验反应前后质量是否相等 (填“是”或“否”)。
27.化学发展史上,中国科学家取得了很多伟大成就。
(1)国际标准贡献者:张青莲教授主持测定了铟的相对原子质量被采用为国际新标准。铟元素的原子结构示意图如图所示。
①图中x= ,铟原子形成的铟离子是 (填符号)。
②铟元素位于元素周期表中第 周期,其相对原子质量是 。
(2)人工合成先锋者:2021年9月,我国科研人员首次实现了二氧化碳到淀粉的合成,合成路线简图如图所示:
①淀粉(C6H10O5)n中氢元素和氧元素的质量比为 。
②写出上图中①中反应生成甲醇(CH3OH)和水的化学方程式: 。
③人工合成的淀粉与天然淀粉非常接近,该项研究成果的实际应用价值不包括 (填字母)。
A.可以降低空气中二氧化碳含量 B.能缓解人类粮食短缺问题
C.可以节约耕地资源 D.能减少白色污染
28.化学实验是科学探究的重要手段。根据装置图回答下列问题(装置用代号表示):
(1)写出有编号仪器的名称:① 。
(2)实验室用高锰酸钾制取氧气的发生装置可选用 (填代号,下同),反应的文字表达式 收集纯净的氧气可选用装置 ;用排水法制取氧气,停止加热时,应先 ;写出用B装置制取氧气的文字表达式 。
(3)将红热的铁丝置于充满氧气并盛有少量水的集气瓶中,盛少量水的作用是 。
(4)请你根据高锰酸钾的化学式计算:
①高锰酸钾的相对分子质量 。
②高锰酸钾中各元素的质量比为 。
③15.8克高锰酸钾中所含氧元素质量是多少克。(写出计算过程)
29.(Li2CO3)是制备新能源汽车电池的重要原料。下图是一种摸拟提纯碳酸锂的工艺,根据要求回答问题。
【查阅资料】
I.锂辉矿主要成分为Li2CO3,含泥沙等杂质。
Ⅱ.Li2CO3(化学性质Na2CO3类似】为无色晶体,微溶于水,在冷水中的溶解度比热水中大。
(1)X是一种酸。其溶质化学式为 ,常用 (填试剂名称)检验气体Y。
(2)②中发生中和反应的化学方程式为 。
(3)有以下三种温度的饱和Na2CO3溶液,③中你选择的是____(填序号)。
A.0℃ B.25℃ C.80℃
(4)将滤液2蒸发,当有 时(填现象),停止加热,可得到其他化工产品。
30.我国煤炭资源丰富。目前人们除了将煤作为燃料外,更是重要的化工原料。工业上以煤和空气为原料生产尿素[CO(NH2)2]的一种流程如图:
(1)从液态空气中分离出N2的过程属于 (填“物理”或“化学”)变化。
(2)在煤和水蒸气反应前需先将煤粉碎,这样做的目的是 。
(3)工业上以CO2为原料生产尿素的反应的微观示意图如图,该反应中,反应物A和B的质量之比为 。
(4)半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和水蒸气。某化学兴趣小组为检验半水煤气的某些成分,设计的实验方案如下图所示。(以下实验中使用的药品均足量)
【查阅资料】碱石灰的作用是吸水,干燥气体;H2与CO性质相似,具有可燃性和还原性。
①C装置的硬质玻璃管中出现的现象是 。
②证明半水煤气中含有CO的现象是 。
③你认为该实验方案的不足之处是 。
④若E中白色沉淀10g,则半水煤气中的CO质量是多少 ?(写出详细过程)
答案解析部分
1.【答案】(1)炷;油;三;油燃烧放热,上层油温度升高,下层盏内水吸热,减少油的蒸发,以达到省油的目的;bcd
(2)隔离可燃物
2.【答案】(1)H2O2
(2)作燃料;发出淡蓝色火焰,放出热量
(3)分子种类不同或分子的构成不同
(4)过氧化氢 水+氧气
(5)明矾;过滤;玻璃棒(或烧杯或漏斗)
(6)物理
3.【答案】(1)缺少玻璃棒引流;漏斗的管口没有紧靠烧杯内壁;CO2+H2O=H2CO3;右边
(2)A;C
(3)不饱和;解:需要蒸馏水的质量=300g 300g×16%÷24%=100g 答:需要蒸馏水的质量为100g。
(4)BC;降温结晶
4.【答案】(1)农作物秸杆;便于分离有机物和无机材料
(2)密度
(3)化学;(或CH4+2O2CO2+2H2O或2H2+O2 2H2O)
5.【答案】(1)
(2)Al2O3
(3)Fe3+
6.【答案】(1)3F
(2)Al
(3)一个硫酸根离子带两个单位的负电荷
(4)一个氨气分子中含3个氢原子
7.【答案】(1)a
(2)红磷+氧气 五氧化二磷;红磷的量不足或装置漏气
8.【答案】(1)
(2)FeCl3、CuCl2
9.【答案】(1)3或三;264:176或3:2;C或碳
(2)C2H6O+3O23H2O+2CO2
10.【答案】(1)3CH4
(2)
(3)5P
(4)CaO
(5)
11.【答案】(1)酸雨
(2)①
(3)硫酸中溶质质量是
设质量分数为34%的双氧水质量为
需要用溶质质量分数为34%的双氧水30kg
(4)氢氧化钠
12.【答案】(1)O2
(2)C2H4+3O22CO2+2H2O
(3)反应前后原子种类、个数和质量都不变
13.【答案】(1)吸附
(2)B
(3)
14.【答案】解:根据质量守恒定律可得,生成的氧气的质量为28.0g- 18.4g=9.6g
设氯酸钾的质量为x
2KClO3 2KCl + 3O2↑
245 96
x 9.6g
x=24.5g
答:生成氧气的质量为9.6g,原混合物中氯酸钾的质量为24.5g。
15.【答案】(1)增大接触面积,加快反应速率;
(2)化学性质稳定
(3)分解反应
(4)Mg或镁、Cl2或氯气
16.【答案】(1)微量;不会;I2;+5或+5价
(2)A;硬度大
(3)蒸发;蒸发皿
(4)
17.【答案】(1)温室效应;天然气
(2);略
(3)太阳能(答案合理即可)
(4)A;B;C
18.【答案】(1)NaCl、NaOH
(2)加入的稀盐酸太少,稀盐酸先和氢氧化钠反应了
(3)如果滤液中含氯化钠和氢氧化钠,通入二氧化碳,二氧化碳和氢氧化钠反应生成碳酸钠和水,也无明显现象
(4)二
(5)氢氧化钠能与二氧化碳反应生成碳酸钠和水,碳酸钠和氯化钡反应生成碳酸钡和氯化钠,也能生成白色沉淀,不能说明一定含氢氧化钙
(6)另取少量滤液于试管中,加入碳酸钠溶液(或通入二氧化碳)
19.【答案】(1)甲、乙、丙
(2)1:4
(3)甲;62.5
(4)降温
20.【答案】(1)0.4
(2):设混合物中铁粉的质量为x,硫酸质量为y
解得:
该混合物中铜粉的质量为30g-11.2g=18.8g
答:上述实验回收铜粉的质量为18.8g
(3)不可能
21.【答案】(1)2Cu;CH4;FeCl3;
(2)混合物;2;+3或+3价
22.【答案】(1)/氮气
(2)变小
(3)
23.【答案】(1)
(2)
(3)
24.【答案】(1)氮气或N2
(2)A;B;C
25.【答案】(1)混合物
(2)过滤
(3)
(4)实现了煤的综合利用,更环保(合理即可)
26.【答案】(1)参加反应的O2质量
(2)ab
(3)是
27.【答案】(1)18;In3+;五或5;114.8
(2)1∶8;;D
28.【答案】(1)酒精灯
(2)A;;C;撤离导管出水面;
(3)防止高温的生成物溅落瓶底炸裂瓶底
(4)158;m(K):m(Mn):m(O)=39:55:64;解:15.8克高锰酸钾中所含氧元素质量是;答:15.8g高锰酸钾中所含氧元素质量是6.4g
29.【答案】(1)H2SO4;澄清石灰水/氢氧化钙溶液
(2)2NaOH+H2SO4=Na2SO4+2H2O
(3)C
(4)较多固体出现
30.【答案】(1)物理
(2)增大反应物之间的接触面积,使反应更充分
(3)17:22
(4)黑色固体逐渐变成红色;E中澄清石灰水变浑浊;缺少尾气处理装置;一氧化碳和氧化铜反应:,二氧化碳和氢氧化钙反应:,可得关系式:CO~CaCO3解:设该半水煤气中的CO质量是x x=2.8g答:半水煤气中的CO质量是2.8g
综合题
1.与中华民族五千年文明相比,人类用火、防火的历史则更为久远。
(1)诗人陆游的笔记中记载“书灯勿用铜盏,惟瓷盏最省油,蜀中有夹瓷盏……可省油之半”。“一端作小窍,注清冷水于其中,每夕一易之”。夹瓷盏被称为省油灯,用棉绳做炷(灯芯),上层盏盛油,下层盏盛水,其结构示意图如图1。
①图中属于可燃物的是 和 ,这是燃烧的 个条件之一。
②省油灯的原理是 。
③“注清冷水于其中,每夕一易之”说明下层盏中的水不断减少。对该现象的微观解释正确的是 (填字母序号)。
a.水分子受热分解b.水分子不断运动c.水分子间隔变大d.水分子数目减少
(2)依据灭火原理,徽派防火墙如图2(又叫马头墙,能阻止火灾蔓延)的主要作用是 。
2.(1)Ⅰ:A、B、C、D、E五种物质都是己学化学内容中涉及到的常见物质,其转化关系如下图所示:
写出物质A的化学式: 。
(2)物质E的一种用途 反应③的实验现象是 。
(3)从微观的角度:分析A与C化学性质不同的原因是 。
(4)写出反应①的文字表达式 。
(5)Ⅱ:小刚收集到一瓶浑浊的河水,他要模拟自来水厂的净水过程,最终制成蒸馏水。其实验过程如图所示。请回答以下问题:
最常用的A物质是 ,操作①的名称是 ,该操作中用到的玻璃仪器有 。(回答一个即可)
(6)操作②主要是利用物质的 (选填“物理”或“化学”)性质。
3.水和溶液在生产、生活中起着十分重要的作用。
(1)如图所示,三个实验均和水有关。
①请指出实验A中过滤操作的两处不正确: 、 。
②实验B能说明CO2可溶于水,并写出发生反应的化学方程式为 。
③实验C,滴加水后能看到U形管中 (填“左边”或“右边”)液面升高。
(2)下面是利用海水提取粗盐的过程。
下列分析正确的是 (填序号)。
A.海水进入贮水池,海水的成分基本不变
B.在蒸发池中,海水中氯化钠的质量逐渐增加
C.在蒸发池中,海水中水的质量逐渐减少
D.析出晶体后的母液是氯化钠的不饱和溶液
(3)农业上常用溶质质量分数为16%的氯化钠溶液来选种,良种会下沉,次种会漂浮。
①室温下氯化钠的溶解度约为36g。上述选种用的氯化钠溶液是 (填“饱和”或“不饱和”)溶液。
②若用溶质质量分数为24%的氯化钠溶液和蒸馏水来配制300g溶质质量分数为16%的氯化钠溶液,则需要蒸馏水的质量为 。
(4)如图是甲乙两种物质的溶解度曲线(不含结晶水)请回答下列问题:
①下列说法一定正确的是 。
A.甲的溶解度比乙的溶解度大
B.t1℃时,甲、乙的饱和溶液的溶质的质量分数相等
C.常温下,乙易溶于水
D.从t2℃降至t1℃,甲、乙溶液中均有晶体析出
②甲中混有少量的乙,要提纯甲,实验步骤:加水溶解,蒸发浓缩, ,然后过滤。(填“降温结晶”或“蒸发结晶”)
4.生物质燃气是以有机废料为原料转换成的可燃性能源,其中含有CH4、CO和H2等可燃性气体。用有机废料生产生物质燃气的主要流程如下图所示。请分析流程,回答有关问题。
(1)常见的有机废料是 (写一种),将有机废料进行粉碎的目的是 。
(2)清沙器将混合物分为上层有机层和下层无机层,利用了物质的 不同。
(3)发酵池中发生的变化属于 变化,生物质燃气燃烧的化学方程式为 (写一个)。
5.用适当的化学用语填空。
(1)亚硝酸钠(NaNO2)有毒。请标出NaNO2中氮元素的化合价 。
(2)金属铝耐腐蚀,是因为铝在空气中与氧气作用形成致密的氧化膜,该氧化膜是: 。
(3)向装有Fe2O3粉末的烧杯中加入稀盐酸,当两物质恰好完全反应时,所得溶液中的金属阳离子是: 。
6.化学用语是学习化学的基本工具,写出下列化学符号或数字的含义。
(1)三个氟原子 。
(2)地壳中含量最多的金属元素 。
(3)中的“2-”表示 。
(4)NH3中的“3”表示 。
7.以下为初中化学常见实验,按要求回答问题。
(1)图A木条放在蜡烛火焰上片刻后 (填序号)处碳化程度最大。
(2)图B 红磷燃烧的文字表达式 ;实验结束后吸入左瓶的水量明显小于左瓶剩余空气体积的 1/5,可能原因是 。(写出一条即可)
8.稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物(Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含Y2O3约70%,含Fe2O3、CuO、SiO2等约30%)生产大颗粒氧化钇的种工艺如下:
(1)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是 。
(2)“分离提纯”是为了除去滤液1中的
(填化学式)。
9.回答:
(1)政和县白茶渊源极深,可追溯到唐末宋初。到宋代,政和已成为重要的北苑贡茶主产区。政和白茶以茶政和大白茶品种为原料,所产政和白茶具有鲜纯、毫香、凉爽的品质特征。不仅具有解暑、退热、降火、生津止渴功效,还具有降血压、解毒、止泄、杀菌、抗氧化、抗辐射、抗肿瘤等功效。白茶中的主要成分茶多酚(化学式为C22H18O11)
①茶多酚由 种元素组成,碳、氧元素的质量比是 。
②茶多酚中元素质量分数最大的是 。
(2)政和县东平镇素有“酒镇茶乡”之称、四面环山,享有得天独厚的小盆地环境和远近闻名的金峰山矿泉,水质富含多种微量元素非常适宜酿造优质高粱白酒。白酒的主要成分是酒精(化学式C2H6O),酒精在空气燃烧生成二氧化碳和水,写出酒精燃烧的化学方程式 。
10. 按要求用化学符号填空:
(1)3个甲烷分子 。
(2)铝离子的结构示意图 。
(3)5个磷原子 。
(4)生石灰的化学式 。
(5)重铬酸钾(K2Cr2O7)中铬元素的化合价 。
11.工业上常用双氧水处理含SO2的烟气,排放出浓度较高的硫酸作工业原料,脱硫过程发生的反应有:
① ②
(1)该烟气不经过处理直接排放会导致 等环境问题。
(2)脱硫过程中化合价没有发生改变的是反应 。(填“①”或“②”)
(3)若排放出100千克溶质质量分数为29.4%的硫酸,需要用溶质质量分数为34%的双氧水多少千克?(写出计算过程)
(4)工业上还有种脱硫法——“双碱法脱硫”,该工艺是先将含SO2的烟气通过排烟机送入脱硫塔,与NaOH、Na2CO3、Na2SO3等水溶液充分接触后与烟气中的SO2反应。将吸收液送至石灰反应器,进行吸收液的再生和固体副产品的析出。吸收过程中涉及的反应方程式:
用NaOH吸收:
用Na2CO3吸收:
用Na2SO3吸收:
若在脱硫塔内吸收等质量的含SO2的烟气,用 吸收所需要的原料质量最少。
12.我们常从微观认识宏观的化学反应,如图是乙烯(C2H4)燃烧的微观示意图。
(1)该反应中单质的化学式为 ;
(2)该反应的化学方程式为 ;
(3)化学反应前后质量守恒的微观实质是 。
13.生活中处处有化学知识,请根据题意回答相关问题
(1)新型冠状病毒蔓延期间,为做好自我防护,要佩戴符合要求的口罩。活性炭口罩能有效阻隔氨、苯、甲醛等有害气体,因为活性炭具有 性。
(2)电器着火,下列做法正确的是____。
A.用水浇灭 B.用干粉灭火器灭火
C.用湿棉被覆盖住电器 D.立即打开所有门窗
(3)中药“石灰”是由生石灰和熟石灰混合而成,具有解毒蚀腐,敛疮止血、杀虫止痒的功效,写出生石灰变成熟石灰的反应方程式 。
14.实验室加热氯酸钾(KClO3)和二氧化锰的混合物28.0g制取氧气,完全反应后剩余固体质量为18.4g,请计算:生成氧气的质量。原混合物中氯酸钾的质量。
15.2022年8月1日,国产C919大飞机完成取证试飞,该飞机的制造中9%的用料为钛合金。如图是工业上以金红石(主要成分是TiO2)为原料生产金属钛(Ti)的流程图:
(1)金红石和焦炭要先经粉碎处理,目的是 ;写出反应①的化学方程式: 。
(2)反应②在氩气环境中进行,氩气能用作保护气是因为其 。
(3)反应③涉及的化学反应的基本反应类型为 。
(4)该流程中可以循环利用的物质有 。
16.盐文化积淀了扬州深厚的文化底蕴。如图是《天工开物》中制取井盐的插图。
(1)中国卫生部向食盐中添加碘酸钾(KIO3)来补碘。碘是人体必需的 (填“常量”或“微量”)元素,加碘盐的水溶液遇淀粉 (填“会”或“不会”)变蓝,碘分子与氢分子一样为双原子分子,则碘分子化学式为 ;KIO3中碘元素的化合价 。
(2)“凿井”过程有“其器冶铁锥”的记载其中“铁锥”属于 (填字母);
A.金属材料 B.复合材料 C.有机合成材料 D.无机非金属材料
“足踏锥梢,春石成粉碎”体现了“铁锥”具有的物理性质: 。
(3)“制盐”过程中“入于釜中煎炼顷刻成盐”描写的是氯化钠 结晶的过程,其中的“釜”类似于化学实验中的 (填仪器名称)。
(4)“井火”主要由天然气燃烧产生,写出天然气完全燃烧的化学方程式 。
17.我国提出要在2026年达到“碳平衡”,“碳平衡”是指碳的排放和吸收两方面在数量或质量上相等或相抵。实现“碳平衡”可采取以下措施。
(1)抓紧制定二氧化碳排放达峰行动方案。生产生活中产生的含量过高会引起的环境问题是 ,应减少化石燃料煤、石油和 的使用。
(2)为实现“碳平衡”,要加强转变能源结构,采取技术捕集、利用和封存二氧化碳,如将工厂废气中的转化成甲醇(),该反应的微观示意图如下图所示。该反应的化学反应方程式为 ,反应生成丙和丁的质量比为 。
(3)实现“碳平衡”的重要方式之一是升级能源消费方式,请写出一种清洁能源: 。
(4)为实现“碳平衡”,还可以采取下列措施____。
A.整改不合格的、污染大的企业
B.节约纸张,保护森林
C.多使用公共交通工具,倡导绿色出行
18.皮蛋是我国一种传统风味蛋制品。某化学课外小组的同学查阅资料后得知,腌制皮蛋的主要原料有:生石灰、纯碱和食盐。同学们向这三种物质中加入足量水,充分搅拌,过滤,对滤液中溶质的成分进行探究。
【提出问题】滤液中可能含有哪些溶质?
(1)【作出猜想】
猜想一:
猜想二: NaCl、NaOH、Na2CO3
猜想三:NaCl、NaOH、Ca(OH)2
(2)【进行实验】同学们分别设计了如下三种方案并进行实验:
方案一:取少量滤液于试管中,滴加少量的稀盐酸,没有观察到产生气泡,从而得出猜想二不成立。同学们一致认为,通过该实验不足以判断猜想二不成立,理由是 。
(3)方案二:取少量滤液于试管中,通入二氧化碳气体,没有观察到明显现象。从而得出猜
想二成立 。同学们一致认为,通过该实验 也 不足以得出其结论,原因是 。
(4)方案三:进行了如下实验:
实验步骤 实验现象 实验结论
①取少量滤液于试管中,加入足量的氯化钡溶液 无明显现象 猜想 不正确
②继续向步骤①所得溶液中通入二氧化碳 有白色沉淀生成 猜想三正确
(5)【反思评价】小组同学经过讨论,一致认为根据步骤(2)的现象不足以证明猜想三是正确的,理由是 。
(6)同学们经过认真思考后,对步骤(2)进行了修改,并做了下面的实验,最终得出了正确的结论,记录如下。请你完善实验报告。
实验步骤 实验现象 实验结论
有白色沉淀生成 猜想三正确
19.如图1是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。回答下列问题:
(1)t1℃时,甲、乙、丙三种物质的溶解度由小到大的顺序是 。
(2)P点表示在t2℃时,甲、丙两种物质的饱和溶液中,溶质与溶剂的质量比相同,它们的比为m质:m剂= (化为最简比)。
(3)t2 ℃时,取甲、乙两种固体各13g,分别加入50g水中充分溶解,实验结果如图2所示,则烧杯a中溶解的物质一定是 (填“甲”或“乙”),所得溶液的质量为 g。
(4)当甲含有少量的乙和丙(甲、乙、丙相互间均不发生化学反应)时,可采用 (填“降温”或“蒸发”)结晶的方法提取甲物质。
20. 学习小组同学利用下图实验,回收实验室废弃的铜粉与铁粉混合物中的铜粉。
(1)反应生成氢气的质量是 g。
(2)计算上述实验回收铜粉的质量。(忽略回收过程中铜粉的损失)
(3)上述实验所用稀硫酸的溶质质量分数 (填“可能”或“不可能”)是15%。
21.运用所学知识回答问题
(1)用化学符号表示下列意义:
①2个铜原子 ;②甲烷 ;③氯化铁 ;④硫酸根离子 。
(2)在迎来中国共产党建党一百周年之际,“嫦娥五号”探测器返回舱带回月球样品(月壤),“天问一号”探测器着陆火星,这是我国航天事业发展具有里程碑意义的进展。
①经检测知,月壤中主要含有橄榄石、辉石、钛铁矿、斜长石以及玻璃态物质,该月球样品属于 (填“纯净物”或“混合物”)。
②在月壤中还含有丰富的稀有气体氦-3(He-3)。一个氦-3原子的原子核内含有2个质子和1个中子,其核外电子数为 。
③火星表面呈黄褐色,是由于火星表面土壤中含有氧化铁(Fe2O3)等物质引起的。Fe2O3中铁元素的化合价为 。
22.空气是宝贵的资源,利用空气合成尿素【CO(NH2)2】的主要转化过程如图所示。
(1)I中空气经液化分离后,得到的X是 。
(2)Ⅱ中将氧气压缩后储存在钢瓶中,其分子间隔 (填“变大”或“变小”)。
(3)补全合成尿素的化学方程式: 。
23.写出下列反应的文字表达式:
(1)加热碳酸氢铵固体 。
(2)铁丝在氧气中燃烧 。
(3)用双氧水和二氧化锰混合分解制取氧气 。
24.空气是人类赖以生存的物质基础。
(1)空气中含量最多的气体是 。
(2)下列现象中,能说明我们身边存在空气的是____。
A.快速奔跑时感受到风吹来
B.把塑料袋抖开后扎紧,感到不易压缩
C.将玻璃杯倒扣在水槽中,水不能充满玻璃杯
25.煤是社会生产、生活中最重要的能源,其主要成分是碳。工业上常把煤进行气化和液化处理,使煤变成清洁能源。煤气化和液化的流程如图所示:
(1)粗煤属于 (选填“纯净物”或“混合物”)。
(2)步骤①中分离操作的名称是 。
(3)步骤③中发生反应的化学方程式为 。
(4)相比于直接用煤作燃料,“煤的气化和液化”的优点是 。
26.在学习“质量守恒定律”时,小泽查阅到以下材料:
(1)从现在的视角分析波义耳实验,金属灰比原金属增加的质量是 。
(2)质量守恒定律的发现过程,带给我们的启示有 (填序号)。
a.要善于总结前人的成果和经验
b.定量方法是科学研究的重要方法
c.实验的成功与否,只取决于药品的选择
(3)受科学家研究的启发,小泽参照教材中的实验继续深入探究。该实验反应前后质量是否相等 (填“是”或“否”)。
27.化学发展史上,中国科学家取得了很多伟大成就。
(1)国际标准贡献者:张青莲教授主持测定了铟的相对原子质量被采用为国际新标准。铟元素的原子结构示意图如图所示。
①图中x= ,铟原子形成的铟离子是 (填符号)。
②铟元素位于元素周期表中第 周期,其相对原子质量是 。
(2)人工合成先锋者:2021年9月,我国科研人员首次实现了二氧化碳到淀粉的合成,合成路线简图如图所示:
①淀粉(C6H10O5)n中氢元素和氧元素的质量比为 。
②写出上图中①中反应生成甲醇(CH3OH)和水的化学方程式: 。
③人工合成的淀粉与天然淀粉非常接近,该项研究成果的实际应用价值不包括 (填字母)。
A.可以降低空气中二氧化碳含量 B.能缓解人类粮食短缺问题
C.可以节约耕地资源 D.能减少白色污染
28.化学实验是科学探究的重要手段。根据装置图回答下列问题(装置用代号表示):
(1)写出有编号仪器的名称:① 。
(2)实验室用高锰酸钾制取氧气的发生装置可选用 (填代号,下同),反应的文字表达式 收集纯净的氧气可选用装置 ;用排水法制取氧气,停止加热时,应先 ;写出用B装置制取氧气的文字表达式 。
(3)将红热的铁丝置于充满氧气并盛有少量水的集气瓶中,盛少量水的作用是 。
(4)请你根据高锰酸钾的化学式计算:
①高锰酸钾的相对分子质量 。
②高锰酸钾中各元素的质量比为 。
③15.8克高锰酸钾中所含氧元素质量是多少克。(写出计算过程)
29.(Li2CO3)是制备新能源汽车电池的重要原料。下图是一种摸拟提纯碳酸锂的工艺,根据要求回答问题。
【查阅资料】
I.锂辉矿主要成分为Li2CO3,含泥沙等杂质。
Ⅱ.Li2CO3(化学性质Na2CO3类似】为无色晶体,微溶于水,在冷水中的溶解度比热水中大。
(1)X是一种酸。其溶质化学式为 ,常用 (填试剂名称)检验气体Y。
(2)②中发生中和反应的化学方程式为 。
(3)有以下三种温度的饱和Na2CO3溶液,③中你选择的是____(填序号)。
A.0℃ B.25℃ C.80℃
(4)将滤液2蒸发,当有 时(填现象),停止加热,可得到其他化工产品。
30.我国煤炭资源丰富。目前人们除了将煤作为燃料外,更是重要的化工原料。工业上以煤和空气为原料生产尿素[CO(NH2)2]的一种流程如图:
(1)从液态空气中分离出N2的过程属于 (填“物理”或“化学”)变化。
(2)在煤和水蒸气反应前需先将煤粉碎,这样做的目的是 。
(3)工业上以CO2为原料生产尿素的反应的微观示意图如图,该反应中,反应物A和B的质量之比为 。
(4)半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和水蒸气。某化学兴趣小组为检验半水煤气的某些成分,设计的实验方案如下图所示。(以下实验中使用的药品均足量)
【查阅资料】碱石灰的作用是吸水,干燥气体;H2与CO性质相似,具有可燃性和还原性。
①C装置的硬质玻璃管中出现的现象是 。
②证明半水煤气中含有CO的现象是 。
③你认为该实验方案的不足之处是 。
④若E中白色沉淀10g,则半水煤气中的CO质量是多少 ?(写出详细过程)
答案解析部分
1.【答案】(1)炷;油;三;油燃烧放热,上层油温度升高,下层盏内水吸热,减少油的蒸发,以达到省油的目的;bcd
(2)隔离可燃物
2.【答案】(1)H2O2
(2)作燃料;发出淡蓝色火焰,放出热量
(3)分子种类不同或分子的构成不同
(4)过氧化氢 水+氧气
(5)明矾;过滤;玻璃棒(或烧杯或漏斗)
(6)物理
3.【答案】(1)缺少玻璃棒引流;漏斗的管口没有紧靠烧杯内壁;CO2+H2O=H2CO3;右边
(2)A;C
(3)不饱和;解:需要蒸馏水的质量=300g 300g×16%÷24%=100g 答:需要蒸馏水的质量为100g。
(4)BC;降温结晶
4.【答案】(1)农作物秸杆;便于分离有机物和无机材料
(2)密度
(3)化学;(或CH4+2O2CO2+2H2O或2H2+O2 2H2O)
5.【答案】(1)
(2)Al2O3
(3)Fe3+
6.【答案】(1)3F
(2)Al
(3)一个硫酸根离子带两个单位的负电荷
(4)一个氨气分子中含3个氢原子
7.【答案】(1)a
(2)红磷+氧气 五氧化二磷;红磷的量不足或装置漏气
8.【答案】(1)
(2)FeCl3、CuCl2
9.【答案】(1)3或三;264:176或3:2;C或碳
(2)C2H6O+3O23H2O+2CO2
10.【答案】(1)3CH4
(2)
(3)5P
(4)CaO
(5)
11.【答案】(1)酸雨
(2)①
(3)硫酸中溶质质量是
设质量分数为34%的双氧水质量为
需要用溶质质量分数为34%的双氧水30kg
(4)氢氧化钠
12.【答案】(1)O2
(2)C2H4+3O22CO2+2H2O
(3)反应前后原子种类、个数和质量都不变
13.【答案】(1)吸附
(2)B
(3)
14.【答案】解:根据质量守恒定律可得,生成的氧气的质量为28.0g- 18.4g=9.6g
设氯酸钾的质量为x
2KClO3 2KCl + 3O2↑
245 96
x 9.6g
x=24.5g
答:生成氧气的质量为9.6g,原混合物中氯酸钾的质量为24.5g。
15.【答案】(1)增大接触面积,加快反应速率;
(2)化学性质稳定
(3)分解反应
(4)Mg或镁、Cl2或氯气
16.【答案】(1)微量;不会;I2;+5或+5价
(2)A;硬度大
(3)蒸发;蒸发皿
(4)
17.【答案】(1)温室效应;天然气
(2);略
(3)太阳能(答案合理即可)
(4)A;B;C
18.【答案】(1)NaCl、NaOH
(2)加入的稀盐酸太少,稀盐酸先和氢氧化钠反应了
(3)如果滤液中含氯化钠和氢氧化钠,通入二氧化碳,二氧化碳和氢氧化钠反应生成碳酸钠和水,也无明显现象
(4)二
(5)氢氧化钠能与二氧化碳反应生成碳酸钠和水,碳酸钠和氯化钡反应生成碳酸钡和氯化钠,也能生成白色沉淀,不能说明一定含氢氧化钙
(6)另取少量滤液于试管中,加入碳酸钠溶液(或通入二氧化碳)
19.【答案】(1)甲、乙、丙
(2)1:4
(3)甲;62.5
(4)降温
20.【答案】(1)0.4
(2):设混合物中铁粉的质量为x,硫酸质量为y
解得:
该混合物中铜粉的质量为30g-11.2g=18.8g
答:上述实验回收铜粉的质量为18.8g
(3)不可能
21.【答案】(1)2Cu;CH4;FeCl3;
(2)混合物;2;+3或+3价
22.【答案】(1)/氮气
(2)变小
(3)
23.【答案】(1)
(2)
(3)
24.【答案】(1)氮气或N2
(2)A;B;C
25.【答案】(1)混合物
(2)过滤
(3)
(4)实现了煤的综合利用,更环保(合理即可)
26.【答案】(1)参加反应的O2质量
(2)ab
(3)是
27.【答案】(1)18;In3+;五或5;114.8
(2)1∶8;;D
28.【答案】(1)酒精灯
(2)A;;C;撤离导管出水面;
(3)防止高温的生成物溅落瓶底炸裂瓶底
(4)158;m(K):m(Mn):m(O)=39:55:64;解:15.8克高锰酸钾中所含氧元素质量是;答:15.8g高锰酸钾中所含氧元素质量是6.4g
29.【答案】(1)H2SO4;澄清石灰水/氢氧化钙溶液
(2)2NaOH+H2SO4=Na2SO4+2H2O
(3)C
(4)较多固体出现
30.【答案】(1)物理
(2)增大反应物之间的接触面积,使反应更充分
(3)17:22
(4)黑色固体逐渐变成红色;E中澄清石灰水变浑浊;缺少尾气处理装置;一氧化碳和氧化铜反应:,二氧化碳和氢氧化钙反应:,可得关系式:CO~CaCO3解:设该半水煤气中的CO质量是x x=2.8g答:半水煤气中的CO质量是2.8g
同课章节目录
