专题13铁及其化合物--2025年高三化学一轮复习【专题专练】(含解析)
文档属性
| 名称 | 专题13铁及其化合物--2025年高三化学一轮复习【专题专练】(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-27 08:18:02 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
专题13 铁及其化合物--2025年高三化学一轮复习【专题专练】(含解析)
1.下列说法正确的是
A.氯化铁溶液具有氧化性,所以可用于制作印刷电路板
B.植物油中含碳碳双键,所以可用于生产甘油
C.硬铝强度高、密度大,所以是制造飞机的理想材料
D.重金属盐能使蛋白质变性,所以吞服“钡餐”会引起中毒
2.部分含铁物质的分类与相应化合价关系如图所示。下列描述合理的是
A.c可由a在空气中燃烧得到 B.b溶于水可以得到e
C.d粒子在纳米级别时可以产生丁达尔效应 D.f与g的相互转化均可通过化合反应来实现
3.实验室中利用下图装置验证铁与水蒸气反应。下列说法错误的是
A.反应为
B.酒精灯移至湿棉花下方实验效果更好
C.用木柴点燃肥皂泡检验生成的氢气
D.使用硬质玻璃试管盛装还原铁粉
4.下列实验的操作和现象与结论对应且都正确的是
选项 操作和现象 结论
A 向紫色石蕊溶液中加入新制氯水,溶液先变红后褪色 新制氯水具有酸性和漂白性
B 向某未知溶液中滴加KSCN溶液,溶液变红 该未知溶液不含
C 向1mL浓度均为的和混合溶液中滴加2滴NaOH溶液,先出现红褐色沉淀 相同温度下,
D 微热滴有酚酞的饱和溶液,红色变浅 加热时,的水解平衡逆向移动
A.A B.B C.C D.D
5.铁、硫元素的部分“价-类”关系如图所示。下列叙述正确的是
A.a在高温下与水蒸气反应生成b B.实验室用浓f溶液干燥e和d
C.常温下,d和e不能大量共存 D.加热c会生成红色粉末b
6.下列实验操作、现象、结论均正确的是
选项 实验操作 现象 结论
A 向溶液中加入溶液,出现白色沉淀后,继续滴入几滴浓溶液,静置 出现红褐色沉淀 同温下,
B 分别向等物质的量浓度、等体积的KCl溶液和KI溶液中滴加2滴稀溶液,充分振荡后静置 KCl溶液中无白色沉淀,KI溶液中有黄色沉淀 结合微粒的能力:
C 向某溶液中先滴加氯水,后滴加KSCN溶液 溶液显红色 原溶液中一定含有
D 在淀粉溶液中滴入稀硫酸,加热一段时间,冷却后加入氢氧化钠溶液至溶液呈碱性,再滴加碘水 溶液未变蓝色 证明淀粉已水解完全
A.A B.B C.C D.D
7.下列实验方法或试剂使用合理的是
选项 实验目的 实验方法或试剂
A 检验溶液中是否含有 溶液
B 测定溶液中 用溶液滴定
C 除去乙醇中少量的水 加入金属,过滤
D 测定溶液的 使用试纸
A.A B.B C.C D.D
8.化学品在食品工业中也有重要应用,下列说法错误的是
A.活性炭可用作食品脱色剂 B.铁粉可用作食品脱氧剂
C.谷氨酸钠可用作食品增味剂 D.五氧化二磷可用作食品干燥剂
9.LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如下:
下列说法正确的是
A.滤渣的主要成分有Fe(OH)3、Al(OH)3、NiS、CaSO4
B.可以用H2O2替换第一步酸溶中的MnO2,并没有什么影响
C.电解过程中为保证电解液成分稳定需要加入水
D.煅烧窑中的气体产物物质的量之比为2:1
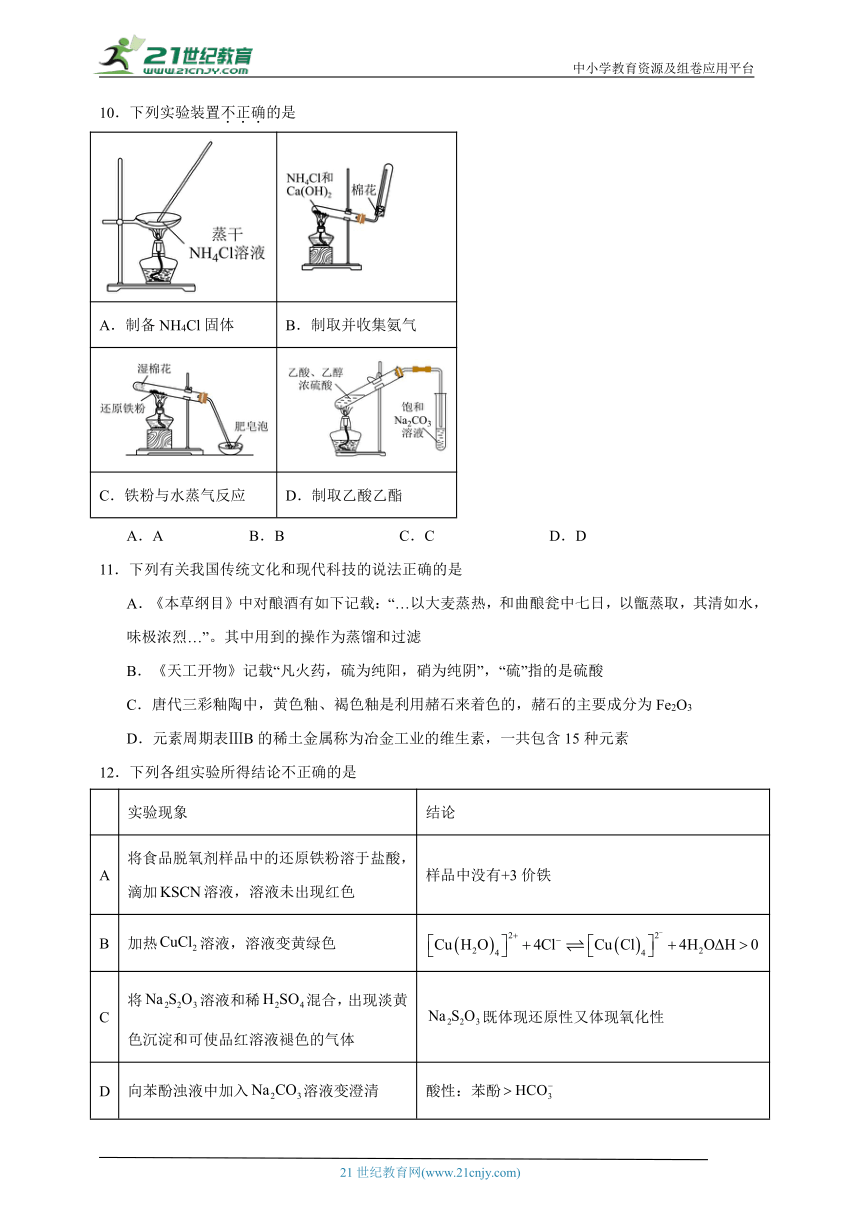
10.下列实验装置不正确的是
A.制备NH4Cl固体 B.制取并收集氨气
C.铁粉与水蒸气反应 D.制取乙酸乙酯
A.A B.B C.C D.D
11.下列有关我国传统文化和现代科技的说法正确的是
A.《本草纲目》中对酿酒有如下记载:“…以大麦蒸热,和曲酿瓮中七日,以甑蒸取,其清如水,味极浓烈…”。其中用到的操作为蒸馏和过滤
B.《天工开物》记载“凡火药,硫为纯阳,硝为纯阴”,“硫”指的是硫酸
C.唐代三彩釉陶中,黄色釉、褐色釉是利用赭石来着色的,赭石的主要成分为Fe2O3
D.元素周期表ⅢB的稀土金属称为冶金工业的维生素,一共包含15种元素
12.下列各组实验所得结论不正确的是
实验现象 结论
A 将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加溶液,溶液未出现红色 样品中没有+3价铁
B 加热溶液,溶液变黄绿色
C 将溶液和稀混合,出现淡黄色沉淀和可使品红溶液褪色的气体 既体现还原性又体现氧化性
D 向苯酚浊液中加入溶液变澄清 酸性:苯酚
A.A B.B C.C D.D
13.下列实验中,由实验现象得出的结论正确的是
选项 实验 现象 结论
A 向溶液中通入足量的 生成淡黄色沉淀 不溶于盐酸
B 少量粉加到的溶液中 溶液颜色变浅 金属比Fe活泼
C 向溶液中滴入1滴新制氯水 溶液变橙色 氧化性:
D 向浓度均为的和混合溶液中滴加少量溶液 仅出现浅蓝色沉淀 的溶度积比的小
A.A B.B C.C D.D
14.下列实验操作,现象和结论对应关系正确的是
操作 现象 结论
A 常温下,相同体积的HX和HY两种酸分别与足量的锌反应 都放出,HX放出的多 酸性:
B 向溶液中加入酸性高锰酸钾溶液后,再加入盐酸酸化,最后加入溶液 产生白色沉淀 中的被高锰酸钾氧化生成了
C 取少量的淀粉水解液于试管中,先加适量的NaOH溶液,再滴入碘水 溶液未变蓝 淀粉完全水解
D 将铁和反应后的黑色固体溶解于HCl溶液中,加入KSCN溶液 溶液不变红 黑色固体中无+3价的铁
A.A B.B C.C D.D
15.下列物质性质实验对应的离子方程式书写正确的是
A.漂白粉溶液吸收后产生白色沉淀:
B.溶于氢碘酸:
C.溶液与稀硫酸反应:
D.用溶液处理锅炉水垢:
16.下列方程式的书写正确的是
A.红热的铁与水蒸气反应:
B.硅酸钠溶液中通入二氧化碳:
C.向新制氯水中加入少量:
D.邻羟基苯甲醛中加入足量浓溴水:
17.下列有关物质的鉴别或检验的实验方案能达到目的的是
A.用聚光束仪鉴别硫酸铜溶液和淀粉溶液
B.用氯化钡溶液检验溶液中是否含有硫酸根
C.用KSCN溶液检验电路板刻蚀液中的Fe2+
D.用酸性高锰酸钾溶液鉴别乙醇与丙烯酸溶液
18.铁及其化合物的转化具有重要应用。在指定条件下,下列物质间转化能实现的是
A.
B.
C.
D.
19.软磁材料可由阳极渣和黄铁矿制得。阳极渣的主要成分为且含有少量Pb、Fe、Cu等元素的化合物。制备流程如下。
25℃时,。下列说法错误的是
A.X可为稀硫酸
B.滤渣2成分是和
C.“酸浸”时中的铁元素转化为,该反应中氧化剂与还原剂物质的量之比为3:2
D.利用替代CaO可优化该流程
20.下列实验操作和现象及结论均正确的是
选项 实验操作和现象 结论
A 向溴水中加入苯,振荡后静置,水层颜色变浅 溴与苯发生了加成反应
B 向5 mL 0.01 mol/L KI溶液中加入2 mL 0.01 mol/L 溶液,将溶液分成两份,一份滴加淀粉溶液呈蓝色,另一份滴加KSCN溶液呈红色 和的反应存在限度
C 常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象 稀硝酸的氧化性比浓硝酸强
D 向丙烯醛中滴加溴水,溴水褪色 丙烯醛分子中含有碳碳双键
A.A B.B C.C D.D
21.轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,以卤块(主要成分为,含、等杂质离子)为原料制备轻质碳酸镁的工艺流程如图。下列说法错误的是
A.在实验室进行①操作所用的仪器为玻璃棒、烧杯
B.“氧化”工序中发生反应的离子方程式为
C.②和③工序名称均为“过滤”
D.“沉镁”工序控制合适的温度,产生的气体主要为和
22.对于下列实验,描述其反应的离子方程式错误的是
A.用惰性电极电解硫酸铜溶液:
B.向苯酚钠溶液中滴加稀盐酸:
C.将溶液滴入溶液中:
D.向氢氧化钙溶液中滴加少量碳酸氢钙溶液:
23.在溶液中能大量共存的离子组是
A. B.
C. D.
24.已知为拟卤素,性质与卤素类似。老师将学生分为四组,做如下探究实验:甲组:分别配制500mLKSCN溶液、溶液;乙组:向的KSCN溶液中滴加酸性溶液,酸性溶液褪色;丙组:向的溶液中滴加酸性溶液,酸性溶液褪色;丁组:分别取50mLKSCN溶液和50mL溶液,混合,向混合液中滴加酸性溶液,溶液先变红后褪色,下列说法错误的是
A.甲组同学用到500mL容量瓶、玻璃棒、烧杯、胶头滴管等玻璃仪器
B.乙组实验中将氧化为
C.丙组实验发生反应的离子方程式:
D.丁组实验说明还原性:
25.部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是
A.在一定条件下分别与氧气或水蒸气反应均可生成相同的化合物
B.溶于氢碘酸的离子方程式为
C.与的相互转化均可通过化合反应来实现
D.既可被氧化,也可被还原
26.下列有关实验的离子方程式正确的是
A.将少量加入蒸馏水中:
B.将铁粉加入足量稀硫酸中:
C.将加入过量氢碘酸中:
D.将少量溶液加入溶液中:
27.下列由离子检验有关的实验得出的结论正确的是
选项 实验 结论
A 溶液X的焰色试验呈黄色 溶液X中一定有,一定没有
B 取少量溶液Y于试管中,滴加溶液后,再滴加溶液,溶液变为红色 溶液Y中一定有,一定没有
C 取少量溶液Z,向其中加入少量盐酸酸化的溶液,有白色沉淀产生、无气体生成 溶液Z中一定有,一定没有
D 取少量溶液W,加入少量淀粉,无明显现象,向其中加入新制氯水,溶液变蓝 溶液W中一定有,一定没有
A.A B.B C.C D.D
28.下列选项中的物质能按图示路径在自然界中转化,且甲和水可以直接生成乙的是
选项 甲 乙 丙
A
B
C
D
A.A B.B C.C D.D
29.现有下列实验探究摩尔盐的化学性质。
装置 实验 试剂a 现象
① 紫色石蕊溶液 溶液变红色
② 过量NaOH溶液 产生白色沉淀
③ 酸性KMnO4溶液 KMnO4溶液褪色
④ 溶液 产生蓝色沉淀
下列解释相应实验现象的离子方程式错误的是
A.①中溶液变红:;
B.②中产生白色沉淀:
C.③中溶液褪色:
D.④中产生蓝色沉淀:
30.下列过程中的化学反应,相应的离子方程式正确的是
A.用淀粉溶液和醋酸检验加碘盐中的:
B.溶液中通入少量:
C.氯化亚铁溶液中加入酸性的溶液:
D.固体与氢碘酸反应:
参考答案:
1.A
【详解】A.氯化铁溶液具有氧化性,能氧化铜单质,所以可用于制作印刷电路板,发生的反应为,A正确;
B.丙三醇俗称甘油,植物油含有酯基,能发生水解反应生成甘油,并不是因为植物油含有碳碳双键, B错误;
C.硬铝是一种合金,具有强度高、密度小、耐腐蚀的性质,所以是制造飞机的理想材料,C错误;
D.“钡餐”的成分是硫酸钡,硫酸钡不溶于酸,无法生成钡离子,不能被人体吸收,不会引起中毒,D错误;
答案为A。
2.D
【分析】根据化合价和物质类别分析,A为Fe,b为FeO,C为Fe2O3,e为Fe(OH)2、d为Fe(OH)3、f为亚铁盐、g为铁盐、h为盐。
【详解】A.Fe在空气中不能燃烧,在氧气中燃烧生成Fe3O4,故A错误;
B.FeO难溶于水,故B错误;
C.Fe(OH)3在纳米级别时,分散中水中形成胶体,才可以产生丁达尔效应,故C错误;
D.亚铁盐与铁盐的相互转化均可通过化合反应来实现,反应的化学方程式,如、,故D正确;
故选D。
3.B
【详解】A.铁和水蒸气在高温下发生反应生成和,该反应的化学方程式为,A正确;
B.酒精灯放在铁粉下方加热可以产生高温,且不影响水的蒸发,若移至湿棉花下方则难以产生高温,则实验效果不好,B错误;
C.用木柴点燃肥皂泡,若产生尖锐的爆鸣声,则可检验生成的气体为氢气,C正确;
D.由于该实验中的反应要在高温下发生,因此要使用硬质玻璃试管盛装还原铁粉,D正确;
故选B。
4.A
【详解】A.新制氯水中含有盐酸和次氯酸,具有酸性和漂白性,则向紫色石蕊溶液中加入新制氯水,溶液先变红后褪色,故A正确;
B.向某未知溶液中滴加KSCN溶液,溶液变红,说明溶液含,不能说明不含,故B错误;
C.向1mL浓度均为的和混合溶液中滴加2滴NaOH溶液,由于沉淀比沉淀更难溶,所以先出现红褐色沉淀,说明相同温度下,,故C错误;
D.碳酸钠为强碱弱酸盐,水解显碱性, 滴入酚酞呈浅红色,盐类的水解是吸热过程,温度升高,平衡正向移动,碱性增强,红色加深,故D错误;
故选A。
5.C
【分析】根据图示,相关物质如下:a:Fe,b:FeO, c:,d:,e:,f:,据此分析解答。
【详解】A.高温下,铁与水蒸气反应生成,A项错误;
B.浓硫酸与会发生氧化还原反应,B项错误;
C.和能发生氧化还原反应生成S和水,C项正确;
D.分解生成,D项错误;
故选:C。
6.B
【详解】A.向溶液中加入溶液,由于溶液过量,不能说明沉淀发生沉淀转化,故不能得出同温下的结论,错误;
B.分别向等物质的量浓度、等体积的溶液和溶液中滴加2滴稀溶液,充分振荡后静置,溶液中无白色沉淀,说明结合的能力小于;溶液中有黄色沉淀,说明结合的能力大于,故结合微粒的能力:,B正确;
C.若某溶液不含有,而含有,则先滴加氯水,后滴加溶液,溶液也会显红色,正确的结论是原溶液中可能含有,C错误;
D.向淀粉水解液中加入氢氧化钠溶液至溶液呈碱性,再滴加碘水,与发生了反应,所以溶液未变蓝色,不能证明淀粉已水解完全,D错误;
故选B。
7.A
【详解】A.溶液中含有Fe2+,可以与K3[Fe(CN)6]发生反应使溶液变成蓝色,A项合理;
B.随着滴定的不断进行,溶液中S2-不断被消耗,但是溶液中的HS-还可以继续发生电离生成S2-,B项不合理;
C.金属Na既可以和水发生反应又可以和乙醇发生反应,故不能用金属Na除去乙醇中少量的水,C项不合理;
D.ClO-具有氧化性,不能用pH试纸测定其pH的大小,可以用pH计进行测量,D项不合理;
故答案选A。
8.D
【详解】A.活性炭结构疏松多孔,具有吸附性,能够吸附一些食品中的色素,故A正确;
B.铁粉具有还原性,能与O2反应,可延长食品的保质期,作食品脱氧剂,故B正确;
C.谷氨酸钠是味精的主要成分,能增加食物的鲜味,是一种常用的食品增味剂,故C正确;
D.P2O5吸水后的产物有毒,不能用作食品干燥剂,故D错误;
故选D。
9.D
【分析】根据题给的流程,将菱锰矿置于反应器中,加入硫酸和MnO2,可将固体溶解为离子,将杂质中的Fe、Ni、Al等元素物质也转化为其离子形式,加入的MnO2可以将溶液中的Fe2+氧化为Fe3+;随后将溶液pH调至制约等于7,溶液中的Al3+ 、Ca2+、Fe3+沉淀出来;随后加入BaS,可以将溶液中的Ni2+沉淀,得到相应的滤渣;后溶液中含有大量的Mn2+,将此溶液置于电解槽中电解,得到MnO2,将MnO2与碳酸锂共同煅烧得到最终产物LiMn2O4;据此分析解题。
【详解】A.滤渣的主要成分有Fe(OH)3、Al(OH)3、NiS、CaSO4、SiO2,A错误;
B.应为最终产物中含有锰元素,若替换为双氧水后,则应该后续添加锰元素,不能实现节能高效的目的,B错误;
C.电解时电解液中Mn2+大量减少,H+大量增加,为了保证电解液成分稳定,应不断补充Mn(OH)2,Mn(OH)2可与氢离子反应生成Mn2+,C错误;
D.煅烧窑中MnO2与Li2CO3发生反应生成LiMn2O4,反应的化学方程式为2Li2CO3+8MnO2 4LiMn2O4+2CO2↑+O2↑,煅烧窑中的气体产物物质的量之比为2:1,D正确;
故选D。
10.A
【详解】A.蒸干NH4Cl溶液时,NH4Cl水解生成的HCl挥发,一水合氨分解,最后得不到NH4Cl固体,A不正确;
B.NH4Cl与Ca(OH)2在加热条件下反应生成NH3等,用向下排空气法收集NH3,B正确;
C.铁粉与水蒸气在高温条件下反应,生成四氧化三铁和氢气,可用点燃肥皂泡的方法检验H2的存在,C正确;
D.乙醇与浓硫酸混合后,再加入乙酸,加热条件下发生反应,生成乙酸乙酯和水,导管口位于液面上,以防倒吸,D正确;
故选A。
11.C
【详解】A.《本草纲目》中记载的酿酒操作为蒸馏,没有过滤,故A错误;
B.“硝”是KNO3,“硫”指的是单质硫,故B错误;
C.利用赭石的颜色可知其主要成分为Fe2O3,故C正确;
D.稀土元素包含镧系元素和Y、Sc,共17种元素,故D错误。
答案选C。
12.A
【详解】A.将食品脱氧剂样品中的还原铁粉溶于盐酸,由于Fe3+能被Fe还原为Fe2+,所以滴加溶液,溶液未出现红色,不能说明样品中没有+3价铁,故A错误;
B.加热溶液,溶液变黄绿色,说明加热平衡右移,,故B正确;
C.将溶液和稀混合,出现淡黄色沉淀和可使品红溶液褪色的气体,说明发生反应:,中硫元素化合价一部分升高、一部分降低,即既体现还原性又体现氧化性,故C正确;
D.向苯酚浊液中加入溶液变澄清,是因为发生反应:+→+NaHCO3,所以酸性:苯酚,故D正确;
故答案为:A。
13.D
【详解】A.向氯化铁溶液中通入硫化氢,反应生成氯化亚铁、硫和水,淡黄色沉淀是S,A错误;
B.锌粉加到的溶液中,生成硫酸锌、硫酸亚铁,(少量),无法比较与的活泼性,B错误;
C.向溶液中滴入1滴新制氯水,溶液变橙色,说明反应产生,是得到电子被还原产生,作氧化剂,作还原剂,故物质的氧化性:,不能比较和氧化性的强弱,C错误;
D.相同浓度的和中加入,仅出现浅蓝色沉淀,因为先析出物质的溶解度小,因此的溶度积比的小,D正确;
故答案选D。
14.A
【详解】A.等pH时HX放出氢气多,则HX的酸性弱,则现象、结论均合理,故A正确;
B.酸性高锰酸钾溶液是用硫酸进行酸化,向溶液中加入酸性高锰酸钾溶液后,再加入盐酸酸化,最后加入溶液,产生白色沉淀,不能说明被高锰酸钾氧化生成了,故B错误;
C.淀粉水解液于试管中,先加适量的NaOH溶液,再滴入碘水,碘可能与过量的氢氧化钠溶液反应,溶液未变蓝不能说明淀粉已经水解完全,故C错误;
D.可能是过量的铁粉将Fe3+还原为Fe2+,故无法证明黑色固体中是否有+3价的铁,故D错误;
故选A。
15.D
【详解】A.漂白粉溶液吸收二氧化碳后生成碳酸钙沉淀和次氯酸,离子方程式为Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO,A错误;
B.Fe(OH)3溶于氢碘酸生成亚铁离子、碘单质和水,离子方程式为2Fe(OH)3+6H++2I-=2Fe2++6H2O+I2,B错误;
C.氢氧化钡与稀硫酸反应的离子方程式为,C错误;
D.用碳酸钠溶液处理锅炉水垢,硫酸钙与碳酸根离子反应生成碳酸钙和硫酸根离子,选项中离子方程式正确,D正确;
故答案选D。
16.C
【详解】A.红热的铁与水蒸气发生反应生成四氧化三铁和氢气,反应的化学方程式为:,故A错误;
B.硅酸的酸性小于碳酸,向硅酸钠溶液中通入二氧化碳时,生成硅酸沉淀,反应的离子方程式为:、,故B错误;
C.向新制氯水中加入少量,生成CO2和HClO,离子方程式为:,故C正确;
D.邻羟基苯甲醛中加入足量浓溴水,醛基会被氧化为羧基,故D错误;
故选C。
17.A
【详解】A.淀粉溶液属于胶体,可发生丁达尔效应,可用聚光束仪鉴别溶液和胶体,故A项正确;
B.检验需先加稀盐酸,排出银离子的干扰,再加BaCl2溶液,若产生白色沉淀,则证明含有,故B项错误;
C.铁离子与KSCN反应生成血红色溶液,不能检验亚铁离子,故C项错误;
D.乙醇与丙烯酸溶液均能使酸性高锰酸钾溶液褪色,故D项错误;
故本题选A。
18.B
【详解】A.Fe2O3溶于稀盐酸生成FeCl3和水,FeCl3为挥发性酸的弱碱盐,蒸发时会发生水解,转化为Fe(OH)3沉淀,A不正确;
B.I2具有弱氧化性,只能将Fe氧化为FeI2,FeI2电离产生的Fe2+和I-都能被Cl2氧化,从而生成FeCl3和I2,B正确;
C.FeS2在高温条件下能被O2氧化,生成Fe2O3和SO2,但Fe2O3难溶于水,与水不能发生反应,C不正确;
D.Fe溶于盐酸生成FeCl2和H2,SO2具有弱氧化性,不能将Fe2+氧化为Fe3+,D不正确;
故选B。
19.B
【分析】黄铁矿和阳极渣加稀硫酸酸浸,发生氧化还原反应,过滤,滤渣1为S、PbSO4,滤液中加H2O2和CaO,其中CaO调溶液pH,将Fe3+和Cu2+转化为Fe(OH)3和Cu(OH)2沉淀,过滤,滤液中加MnF2沉淀Ca2+,过滤得到含MnSO4的滤液,然后经过一系列处理得Mn3O4。
【详解】A.MnO2具有较强氧化性,具有较强还原性,据流程图可知,后续操作得到MnSO4,所以X可为稀硫酸,故A正确;
B.滤液中加CaO调溶液pH,将Fe3+和Cu2+转化为Fe(OH)3和Cu(OH)2沉淀,由于CaSO4微溶,所以滤渣2的成分是、CaSO4和Fe(OH)3,故B错误;
C.“酸浸”时中的铁元素转化为,MnO2被还原为MnSO4,反应的离子方程式为,所以该反应中氧化剂与还原剂物质的量之比为3:2,故C正确;
D.利用替代CaO可避免引入杂质Ca2+,即可优化该流程,故D正确;
故答案为:B。
20.B
【详解】A.向溴水中加入苯,振荡后静置,溴被苯萃取,水层颜色变浅,故A错误;
B.与发生反应:,过量但溶液中还剩余,说明该反应是可逆反应,存在反应限度,故B正确;
C.浓硝酸常温下使Fe发生钝化,浓硝酸的氧化性强于稀硝酸,故C错误;
D.丙烯醛分子中含有碳碳双键和醛基,醛基具有还原性,溴水可将醛基氧化成羧基,检验碳碳双键时应先排除醛基的干扰,故D错误;
故选B。
21.D
【分析】由图知,向卤块(主要成分为,含、等杂质离子)中加入盐酸进行酸溶,再加入过氧化氢发生将氧化为,再加入氢氧化钠溶液转化为氢氧化铁沉淀,过滤将其除去得到滤渣,滤渣为氢氧化铁,向滤液中加入碳酸氢铵进行沉镁,发生,故X主要为二氧化碳,经过过滤,得到轻质碳酸镁,据此回答。
【详解】A.①操作需用盐酸溶解卤块,所用仪器为玻璃棒、烧杯,A正确;
B.“氧化”目的是将氧化为,再通过调节除去,离子方程式为,B正确;
C.②和③操作都得到液体和固体,均为过滤,C正确;
D.“沉镁”工序中、转化为(),温度过高分解才可能产生,D错误;
故选D。
22.B
【详解】A.用惰性电极电解硫酸铜溶液,阳极发生的反应为水失电子生成氧气,阴极发生的反应为铜离子得电子生成铜单质,因此电解反应的总方程式为:,故A正确;
B.向苯酚钠溶液中滴加稀盐酸的反应为:,故B错误;
C.二价铁的检验是加入溶液后产生蓝色沉淀,反应为:,故C正确;
D.碳酸氢钙溶液加入是少量,因此以碳酸氢钙配平可得,反应为:,故D正确;
故答案为:B。
23.D
【详解】A.发生氧化还原反应,不能共存,故A错误;
B.结合生成Fe(SCN)3,不能共存,故B错误;
C. 生成硅酸镁沉淀,不能共存,故C错误;
D.各离子之间互不反应,能共存,故D正确;
故选D。
24.D
【详解】A.甲组同学用到500mL容量瓶、玻璃棒、烧杯、胶头滴管等玻璃仪器,A正确;
B.实验乙中阴离子SCN﹣被氧化为(SCN)2,B正确;
C.酸性高锰酸钾与亚铁离子反应的离子方程式:,C正确;
D.在等体积浓度均为0.1mol/L的KSCN和FeSO4混合溶液中滴加酸性高锰酸钾,溶液先变红,说明亚铁离子先被高锰酸根离子氧化成铁离子,故还原性SCN-答案选D。
25.B
【分析】如图,根据含铁化合物的价态可知,a为,b为; d为;e为;c为、f为,g为;以此作答
【详解】A.,;分别与氧气和水蒸气反应可生成相同的化合物,A正确;
B.溶于氢碘酸的离子方程式为,B错误;
C.与的相互转化可通过,两个化合反应来实现,C正确;
D.g为,既可以被氧化生成+6价的高铁酸根,也可以被还原生成+2价的,D正确;
故选B。
26.D
【详解】A.不能拆开写,正确的离子方程式为,项错误;
B.稀硫酸将氧化为,正确的离子方程式为,B项错误;
C.将Fe3O4溶于氢碘酸后生成的会氧化,正确的离子方程式为,C项错误;
D.将少量溶液加入溶液中,发生反应的离子方程式为,D项正确;
故选D。
27.D
【详解】A.观察钾的焰色试验颜色时,要透过蓝色钴玻璃,以滤去黄色的光,故溶液X的焰色试验呈黄色不能判断没有,A项错误;
B.取少量溶液Y于试管中,滴加溶液后,再滴加溶液,溶液变为红色,原溶液中也可能含有,B项错误;
C.取少量溶液Z,向其中加入少量盐酸酸化的溶液,有白色沉淀产生、无气体生成,不能说明溶液Z中一定含有,也可能含,C项错误;
D.加入新制氯水后,可使含淀粉的溶液W变蓝,说明溶液W中含有,与可发生氧化还原反应,不能大量共存,D项正确。
答案选D。
28.D
【详解】A.Cl2与水反应生成HClO和HCl,无法直接生成NaClO,A错误;
B.SO2与水反应生成亚硫酸而不是硫酸,B错误;
C.氧化铁与水不反应,不能生成氢氧化铁沉淀,C错误;
D.CO2与水反应生成碳酸,碳酸与碳酸钙反应生成碳酸氢钙,碳酸氢钙受热分解生成二氧化碳气体,D正确;
故答案选D。
29.B
【详解】A.铵根离子、亚铁离子水解使得溶液显酸性,酸性溶液使紫色石蕊试液变红色,A正确;
B.少量摩尔盐与过量的NaOH溶液反应的离子方程式为,B错误;
C.+2价的铁被氧化为+3价,被还原为,反应的离子方程式为,C正确;
D.用来鉴别生成蓝色沉淀,反应的离子方程式为,D正确;
故答案选B。
30.B
【详解】A.醋酸是弱酸,在离子方程式书写中应写化学式符号,不能拆写离子符号,,A错误;
B.溶液中通入少量,强酸制弱酸离子方程式为:,B正确;
C.酸性溶液中,+2价的铁被双氧水氧化为+3价,反应的离子方程式为,,C错误;
D.固体与氢碘酸反应,其中Fe3+可与I-发生氧化还原反应:,D错误;
故选B。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
专题13 铁及其化合物--2025年高三化学一轮复习【专题专练】(含解析)
1.下列说法正确的是
A.氯化铁溶液具有氧化性,所以可用于制作印刷电路板
B.植物油中含碳碳双键,所以可用于生产甘油
C.硬铝强度高、密度大,所以是制造飞机的理想材料
D.重金属盐能使蛋白质变性,所以吞服“钡餐”会引起中毒
2.部分含铁物质的分类与相应化合价关系如图所示。下列描述合理的是
A.c可由a在空气中燃烧得到 B.b溶于水可以得到e
C.d粒子在纳米级别时可以产生丁达尔效应 D.f与g的相互转化均可通过化合反应来实现
3.实验室中利用下图装置验证铁与水蒸气反应。下列说法错误的是
A.反应为
B.酒精灯移至湿棉花下方实验效果更好
C.用木柴点燃肥皂泡检验生成的氢气
D.使用硬质玻璃试管盛装还原铁粉
4.下列实验的操作和现象与结论对应且都正确的是
选项 操作和现象 结论
A 向紫色石蕊溶液中加入新制氯水,溶液先变红后褪色 新制氯水具有酸性和漂白性
B 向某未知溶液中滴加KSCN溶液,溶液变红 该未知溶液不含
C 向1mL浓度均为的和混合溶液中滴加2滴NaOH溶液,先出现红褐色沉淀 相同温度下,
D 微热滴有酚酞的饱和溶液,红色变浅 加热时,的水解平衡逆向移动
A.A B.B C.C D.D
5.铁、硫元素的部分“价-类”关系如图所示。下列叙述正确的是
A.a在高温下与水蒸气反应生成b B.实验室用浓f溶液干燥e和d
C.常温下,d和e不能大量共存 D.加热c会生成红色粉末b
6.下列实验操作、现象、结论均正确的是
选项 实验操作 现象 结论
A 向溶液中加入溶液,出现白色沉淀后,继续滴入几滴浓溶液,静置 出现红褐色沉淀 同温下,
B 分别向等物质的量浓度、等体积的KCl溶液和KI溶液中滴加2滴稀溶液,充分振荡后静置 KCl溶液中无白色沉淀,KI溶液中有黄色沉淀 结合微粒的能力:
C 向某溶液中先滴加氯水,后滴加KSCN溶液 溶液显红色 原溶液中一定含有
D 在淀粉溶液中滴入稀硫酸,加热一段时间,冷却后加入氢氧化钠溶液至溶液呈碱性,再滴加碘水 溶液未变蓝色 证明淀粉已水解完全
A.A B.B C.C D.D
7.下列实验方法或试剂使用合理的是
选项 实验目的 实验方法或试剂
A 检验溶液中是否含有 溶液
B 测定溶液中 用溶液滴定
C 除去乙醇中少量的水 加入金属,过滤
D 测定溶液的 使用试纸
A.A B.B C.C D.D
8.化学品在食品工业中也有重要应用,下列说法错误的是
A.活性炭可用作食品脱色剂 B.铁粉可用作食品脱氧剂
C.谷氨酸钠可用作食品增味剂 D.五氧化二磷可用作食品干燥剂
9.LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如下:
下列说法正确的是
A.滤渣的主要成分有Fe(OH)3、Al(OH)3、NiS、CaSO4
B.可以用H2O2替换第一步酸溶中的MnO2,并没有什么影响
C.电解过程中为保证电解液成分稳定需要加入水
D.煅烧窑中的气体产物物质的量之比为2:1
10.下列实验装置不正确的是
A.制备NH4Cl固体 B.制取并收集氨气
C.铁粉与水蒸气反应 D.制取乙酸乙酯
A.A B.B C.C D.D
11.下列有关我国传统文化和现代科技的说法正确的是
A.《本草纲目》中对酿酒有如下记载:“…以大麦蒸热,和曲酿瓮中七日,以甑蒸取,其清如水,味极浓烈…”。其中用到的操作为蒸馏和过滤
B.《天工开物》记载“凡火药,硫为纯阳,硝为纯阴”,“硫”指的是硫酸
C.唐代三彩釉陶中,黄色釉、褐色釉是利用赭石来着色的,赭石的主要成分为Fe2O3
D.元素周期表ⅢB的稀土金属称为冶金工业的维生素,一共包含15种元素
12.下列各组实验所得结论不正确的是
实验现象 结论
A 将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加溶液,溶液未出现红色 样品中没有+3价铁
B 加热溶液,溶液变黄绿色
C 将溶液和稀混合,出现淡黄色沉淀和可使品红溶液褪色的气体 既体现还原性又体现氧化性
D 向苯酚浊液中加入溶液变澄清 酸性:苯酚
A.A B.B C.C D.D
13.下列实验中,由实验现象得出的结论正确的是
选项 实验 现象 结论
A 向溶液中通入足量的 生成淡黄色沉淀 不溶于盐酸
B 少量粉加到的溶液中 溶液颜色变浅 金属比Fe活泼
C 向溶液中滴入1滴新制氯水 溶液变橙色 氧化性:
D 向浓度均为的和混合溶液中滴加少量溶液 仅出现浅蓝色沉淀 的溶度积比的小
A.A B.B C.C D.D
14.下列实验操作,现象和结论对应关系正确的是
操作 现象 结论
A 常温下,相同体积的HX和HY两种酸分别与足量的锌反应 都放出,HX放出的多 酸性:
B 向溶液中加入酸性高锰酸钾溶液后,再加入盐酸酸化,最后加入溶液 产生白色沉淀 中的被高锰酸钾氧化生成了
C 取少量的淀粉水解液于试管中,先加适量的NaOH溶液,再滴入碘水 溶液未变蓝 淀粉完全水解
D 将铁和反应后的黑色固体溶解于HCl溶液中,加入KSCN溶液 溶液不变红 黑色固体中无+3价的铁
A.A B.B C.C D.D
15.下列物质性质实验对应的离子方程式书写正确的是
A.漂白粉溶液吸收后产生白色沉淀:
B.溶于氢碘酸:
C.溶液与稀硫酸反应:
D.用溶液处理锅炉水垢:
16.下列方程式的书写正确的是
A.红热的铁与水蒸气反应:
B.硅酸钠溶液中通入二氧化碳:
C.向新制氯水中加入少量:
D.邻羟基苯甲醛中加入足量浓溴水:
17.下列有关物质的鉴别或检验的实验方案能达到目的的是
A.用聚光束仪鉴别硫酸铜溶液和淀粉溶液
B.用氯化钡溶液检验溶液中是否含有硫酸根
C.用KSCN溶液检验电路板刻蚀液中的Fe2+
D.用酸性高锰酸钾溶液鉴别乙醇与丙烯酸溶液
18.铁及其化合物的转化具有重要应用。在指定条件下,下列物质间转化能实现的是
A.
B.
C.
D.
19.软磁材料可由阳极渣和黄铁矿制得。阳极渣的主要成分为且含有少量Pb、Fe、Cu等元素的化合物。制备流程如下。
25℃时,。下列说法错误的是
A.X可为稀硫酸
B.滤渣2成分是和
C.“酸浸”时中的铁元素转化为,该反应中氧化剂与还原剂物质的量之比为3:2
D.利用替代CaO可优化该流程
20.下列实验操作和现象及结论均正确的是
选项 实验操作和现象 结论
A 向溴水中加入苯,振荡后静置,水层颜色变浅 溴与苯发生了加成反应
B 向5 mL 0.01 mol/L KI溶液中加入2 mL 0.01 mol/L 溶液,将溶液分成两份,一份滴加淀粉溶液呈蓝色,另一份滴加KSCN溶液呈红色 和的反应存在限度
C 常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象 稀硝酸的氧化性比浓硝酸强
D 向丙烯醛中滴加溴水,溴水褪色 丙烯醛分子中含有碳碳双键
A.A B.B C.C D.D
21.轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,以卤块(主要成分为,含、等杂质离子)为原料制备轻质碳酸镁的工艺流程如图。下列说法错误的是
A.在实验室进行①操作所用的仪器为玻璃棒、烧杯
B.“氧化”工序中发生反应的离子方程式为
C.②和③工序名称均为“过滤”
D.“沉镁”工序控制合适的温度,产生的气体主要为和
22.对于下列实验,描述其反应的离子方程式错误的是
A.用惰性电极电解硫酸铜溶液:
B.向苯酚钠溶液中滴加稀盐酸:
C.将溶液滴入溶液中:
D.向氢氧化钙溶液中滴加少量碳酸氢钙溶液:
23.在溶液中能大量共存的离子组是
A. B.
C. D.
24.已知为拟卤素,性质与卤素类似。老师将学生分为四组,做如下探究实验:甲组:分别配制500mLKSCN溶液、溶液;乙组:向的KSCN溶液中滴加酸性溶液,酸性溶液褪色;丙组:向的溶液中滴加酸性溶液,酸性溶液褪色;丁组:分别取50mLKSCN溶液和50mL溶液,混合,向混合液中滴加酸性溶液,溶液先变红后褪色,下列说法错误的是
A.甲组同学用到500mL容量瓶、玻璃棒、烧杯、胶头滴管等玻璃仪器
B.乙组实验中将氧化为
C.丙组实验发生反应的离子方程式:
D.丁组实验说明还原性:
25.部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是
A.在一定条件下分别与氧气或水蒸气反应均可生成相同的化合物
B.溶于氢碘酸的离子方程式为
C.与的相互转化均可通过化合反应来实现
D.既可被氧化,也可被还原
26.下列有关实验的离子方程式正确的是
A.将少量加入蒸馏水中:
B.将铁粉加入足量稀硫酸中:
C.将加入过量氢碘酸中:
D.将少量溶液加入溶液中:
27.下列由离子检验有关的实验得出的结论正确的是
选项 实验 结论
A 溶液X的焰色试验呈黄色 溶液X中一定有,一定没有
B 取少量溶液Y于试管中,滴加溶液后,再滴加溶液,溶液变为红色 溶液Y中一定有,一定没有
C 取少量溶液Z,向其中加入少量盐酸酸化的溶液,有白色沉淀产生、无气体生成 溶液Z中一定有,一定没有
D 取少量溶液W,加入少量淀粉,无明显现象,向其中加入新制氯水,溶液变蓝 溶液W中一定有,一定没有
A.A B.B C.C D.D
28.下列选项中的物质能按图示路径在自然界中转化,且甲和水可以直接生成乙的是
选项 甲 乙 丙
A
B
C
D
A.A B.B C.C D.D
29.现有下列实验探究摩尔盐的化学性质。
装置 实验 试剂a 现象
① 紫色石蕊溶液 溶液变红色
② 过量NaOH溶液 产生白色沉淀
③ 酸性KMnO4溶液 KMnO4溶液褪色
④ 溶液 产生蓝色沉淀
下列解释相应实验现象的离子方程式错误的是
A.①中溶液变红:;
B.②中产生白色沉淀:
C.③中溶液褪色:
D.④中产生蓝色沉淀:
30.下列过程中的化学反应,相应的离子方程式正确的是
A.用淀粉溶液和醋酸检验加碘盐中的:
B.溶液中通入少量:
C.氯化亚铁溶液中加入酸性的溶液:
D.固体与氢碘酸反应:
参考答案:
1.A
【详解】A.氯化铁溶液具有氧化性,能氧化铜单质,所以可用于制作印刷电路板,发生的反应为,A正确;
B.丙三醇俗称甘油,植物油含有酯基,能发生水解反应生成甘油,并不是因为植物油含有碳碳双键, B错误;
C.硬铝是一种合金,具有强度高、密度小、耐腐蚀的性质,所以是制造飞机的理想材料,C错误;
D.“钡餐”的成分是硫酸钡,硫酸钡不溶于酸,无法生成钡离子,不能被人体吸收,不会引起中毒,D错误;
答案为A。
2.D
【分析】根据化合价和物质类别分析,A为Fe,b为FeO,C为Fe2O3,e为Fe(OH)2、d为Fe(OH)3、f为亚铁盐、g为铁盐、h为盐。
【详解】A.Fe在空气中不能燃烧,在氧气中燃烧生成Fe3O4,故A错误;
B.FeO难溶于水,故B错误;
C.Fe(OH)3在纳米级别时,分散中水中形成胶体,才可以产生丁达尔效应,故C错误;
D.亚铁盐与铁盐的相互转化均可通过化合反应来实现,反应的化学方程式,如、,故D正确;
故选D。
3.B
【详解】A.铁和水蒸气在高温下发生反应生成和,该反应的化学方程式为,A正确;
B.酒精灯放在铁粉下方加热可以产生高温,且不影响水的蒸发,若移至湿棉花下方则难以产生高温,则实验效果不好,B错误;
C.用木柴点燃肥皂泡,若产生尖锐的爆鸣声,则可检验生成的气体为氢气,C正确;
D.由于该实验中的反应要在高温下发生,因此要使用硬质玻璃试管盛装还原铁粉,D正确;
故选B。
4.A
【详解】A.新制氯水中含有盐酸和次氯酸,具有酸性和漂白性,则向紫色石蕊溶液中加入新制氯水,溶液先变红后褪色,故A正确;
B.向某未知溶液中滴加KSCN溶液,溶液变红,说明溶液含,不能说明不含,故B错误;
C.向1mL浓度均为的和混合溶液中滴加2滴NaOH溶液,由于沉淀比沉淀更难溶,所以先出现红褐色沉淀,说明相同温度下,,故C错误;
D.碳酸钠为强碱弱酸盐,水解显碱性, 滴入酚酞呈浅红色,盐类的水解是吸热过程,温度升高,平衡正向移动,碱性增强,红色加深,故D错误;
故选A。
5.C
【分析】根据图示,相关物质如下:a:Fe,b:FeO, c:,d:,e:,f:,据此分析解答。
【详解】A.高温下,铁与水蒸气反应生成,A项错误;
B.浓硫酸与会发生氧化还原反应,B项错误;
C.和能发生氧化还原反应生成S和水,C项正确;
D.分解生成,D项错误;
故选:C。
6.B
【详解】A.向溶液中加入溶液,由于溶液过量,不能说明沉淀发生沉淀转化,故不能得出同温下的结论,错误;
B.分别向等物质的量浓度、等体积的溶液和溶液中滴加2滴稀溶液,充分振荡后静置,溶液中无白色沉淀,说明结合的能力小于;溶液中有黄色沉淀,说明结合的能力大于,故结合微粒的能力:,B正确;
C.若某溶液不含有,而含有,则先滴加氯水,后滴加溶液,溶液也会显红色,正确的结论是原溶液中可能含有,C错误;
D.向淀粉水解液中加入氢氧化钠溶液至溶液呈碱性,再滴加碘水,与发生了反应,所以溶液未变蓝色,不能证明淀粉已水解完全,D错误;
故选B。
7.A
【详解】A.溶液中含有Fe2+,可以与K3[Fe(CN)6]发生反应使溶液变成蓝色,A项合理;
B.随着滴定的不断进行,溶液中S2-不断被消耗,但是溶液中的HS-还可以继续发生电离生成S2-,B项不合理;
C.金属Na既可以和水发生反应又可以和乙醇发生反应,故不能用金属Na除去乙醇中少量的水,C项不合理;
D.ClO-具有氧化性,不能用pH试纸测定其pH的大小,可以用pH计进行测量,D项不合理;
故答案选A。
8.D
【详解】A.活性炭结构疏松多孔,具有吸附性,能够吸附一些食品中的色素,故A正确;
B.铁粉具有还原性,能与O2反应,可延长食品的保质期,作食品脱氧剂,故B正确;
C.谷氨酸钠是味精的主要成分,能增加食物的鲜味,是一种常用的食品增味剂,故C正确;
D.P2O5吸水后的产物有毒,不能用作食品干燥剂,故D错误;
故选D。
9.D
【分析】根据题给的流程,将菱锰矿置于反应器中,加入硫酸和MnO2,可将固体溶解为离子,将杂质中的Fe、Ni、Al等元素物质也转化为其离子形式,加入的MnO2可以将溶液中的Fe2+氧化为Fe3+;随后将溶液pH调至制约等于7,溶液中的Al3+ 、Ca2+、Fe3+沉淀出来;随后加入BaS,可以将溶液中的Ni2+沉淀,得到相应的滤渣;后溶液中含有大量的Mn2+,将此溶液置于电解槽中电解,得到MnO2,将MnO2与碳酸锂共同煅烧得到最终产物LiMn2O4;据此分析解题。
【详解】A.滤渣的主要成分有Fe(OH)3、Al(OH)3、NiS、CaSO4、SiO2,A错误;
B.应为最终产物中含有锰元素,若替换为双氧水后,则应该后续添加锰元素,不能实现节能高效的目的,B错误;
C.电解时电解液中Mn2+大量减少,H+大量增加,为了保证电解液成分稳定,应不断补充Mn(OH)2,Mn(OH)2可与氢离子反应生成Mn2+,C错误;
D.煅烧窑中MnO2与Li2CO3发生反应生成LiMn2O4,反应的化学方程式为2Li2CO3+8MnO2 4LiMn2O4+2CO2↑+O2↑,煅烧窑中的气体产物物质的量之比为2:1,D正确;
故选D。
10.A
【详解】A.蒸干NH4Cl溶液时,NH4Cl水解生成的HCl挥发,一水合氨分解,最后得不到NH4Cl固体,A不正确;
B.NH4Cl与Ca(OH)2在加热条件下反应生成NH3等,用向下排空气法收集NH3,B正确;
C.铁粉与水蒸气在高温条件下反应,生成四氧化三铁和氢气,可用点燃肥皂泡的方法检验H2的存在,C正确;
D.乙醇与浓硫酸混合后,再加入乙酸,加热条件下发生反应,生成乙酸乙酯和水,导管口位于液面上,以防倒吸,D正确;
故选A。
11.C
【详解】A.《本草纲目》中记载的酿酒操作为蒸馏,没有过滤,故A错误;
B.“硝”是KNO3,“硫”指的是单质硫,故B错误;
C.利用赭石的颜色可知其主要成分为Fe2O3,故C正确;
D.稀土元素包含镧系元素和Y、Sc,共17种元素,故D错误。
答案选C。
12.A
【详解】A.将食品脱氧剂样品中的还原铁粉溶于盐酸,由于Fe3+能被Fe还原为Fe2+,所以滴加溶液,溶液未出现红色,不能说明样品中没有+3价铁,故A错误;
B.加热溶液,溶液变黄绿色,说明加热平衡右移,,故B正确;
C.将溶液和稀混合,出现淡黄色沉淀和可使品红溶液褪色的气体,说明发生反应:,中硫元素化合价一部分升高、一部分降低,即既体现还原性又体现氧化性,故C正确;
D.向苯酚浊液中加入溶液变澄清,是因为发生反应:+→+NaHCO3,所以酸性:苯酚,故D正确;
故答案为:A。
13.D
【详解】A.向氯化铁溶液中通入硫化氢,反应生成氯化亚铁、硫和水,淡黄色沉淀是S,A错误;
B.锌粉加到的溶液中,生成硫酸锌、硫酸亚铁,(少量),无法比较与的活泼性,B错误;
C.向溶液中滴入1滴新制氯水,溶液变橙色,说明反应产生,是得到电子被还原产生,作氧化剂,作还原剂,故物质的氧化性:,不能比较和氧化性的强弱,C错误;
D.相同浓度的和中加入,仅出现浅蓝色沉淀,因为先析出物质的溶解度小,因此的溶度积比的小,D正确;
故答案选D。
14.A
【详解】A.等pH时HX放出氢气多,则HX的酸性弱,则现象、结论均合理,故A正确;
B.酸性高锰酸钾溶液是用硫酸进行酸化,向溶液中加入酸性高锰酸钾溶液后,再加入盐酸酸化,最后加入溶液,产生白色沉淀,不能说明被高锰酸钾氧化生成了,故B错误;
C.淀粉水解液于试管中,先加适量的NaOH溶液,再滴入碘水,碘可能与过量的氢氧化钠溶液反应,溶液未变蓝不能说明淀粉已经水解完全,故C错误;
D.可能是过量的铁粉将Fe3+还原为Fe2+,故无法证明黑色固体中是否有+3价的铁,故D错误;
故选A。
15.D
【详解】A.漂白粉溶液吸收二氧化碳后生成碳酸钙沉淀和次氯酸,离子方程式为Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO,A错误;
B.Fe(OH)3溶于氢碘酸生成亚铁离子、碘单质和水,离子方程式为2Fe(OH)3+6H++2I-=2Fe2++6H2O+I2,B错误;
C.氢氧化钡与稀硫酸反应的离子方程式为,C错误;
D.用碳酸钠溶液处理锅炉水垢,硫酸钙与碳酸根离子反应生成碳酸钙和硫酸根离子,选项中离子方程式正确,D正确;
故答案选D。
16.C
【详解】A.红热的铁与水蒸气发生反应生成四氧化三铁和氢气,反应的化学方程式为:,故A错误;
B.硅酸的酸性小于碳酸,向硅酸钠溶液中通入二氧化碳时,生成硅酸沉淀,反应的离子方程式为:、,故B错误;
C.向新制氯水中加入少量,生成CO2和HClO,离子方程式为:,故C正确;
D.邻羟基苯甲醛中加入足量浓溴水,醛基会被氧化为羧基,故D错误;
故选C。
17.A
【详解】A.淀粉溶液属于胶体,可发生丁达尔效应,可用聚光束仪鉴别溶液和胶体,故A项正确;
B.检验需先加稀盐酸,排出银离子的干扰,再加BaCl2溶液,若产生白色沉淀,则证明含有,故B项错误;
C.铁离子与KSCN反应生成血红色溶液,不能检验亚铁离子,故C项错误;
D.乙醇与丙烯酸溶液均能使酸性高锰酸钾溶液褪色,故D项错误;
故本题选A。
18.B
【详解】A.Fe2O3溶于稀盐酸生成FeCl3和水,FeCl3为挥发性酸的弱碱盐,蒸发时会发生水解,转化为Fe(OH)3沉淀,A不正确;
B.I2具有弱氧化性,只能将Fe氧化为FeI2,FeI2电离产生的Fe2+和I-都能被Cl2氧化,从而生成FeCl3和I2,B正确;
C.FeS2在高温条件下能被O2氧化,生成Fe2O3和SO2,但Fe2O3难溶于水,与水不能发生反应,C不正确;
D.Fe溶于盐酸生成FeCl2和H2,SO2具有弱氧化性,不能将Fe2+氧化为Fe3+,D不正确;
故选B。
19.B
【分析】黄铁矿和阳极渣加稀硫酸酸浸,发生氧化还原反应,过滤,滤渣1为S、PbSO4,滤液中加H2O2和CaO,其中CaO调溶液pH,将Fe3+和Cu2+转化为Fe(OH)3和Cu(OH)2沉淀,过滤,滤液中加MnF2沉淀Ca2+,过滤得到含MnSO4的滤液,然后经过一系列处理得Mn3O4。
【详解】A.MnO2具有较强氧化性,具有较强还原性,据流程图可知,后续操作得到MnSO4,所以X可为稀硫酸,故A正确;
B.滤液中加CaO调溶液pH,将Fe3+和Cu2+转化为Fe(OH)3和Cu(OH)2沉淀,由于CaSO4微溶,所以滤渣2的成分是、CaSO4和Fe(OH)3,故B错误;
C.“酸浸”时中的铁元素转化为,MnO2被还原为MnSO4,反应的离子方程式为,所以该反应中氧化剂与还原剂物质的量之比为3:2,故C正确;
D.利用替代CaO可避免引入杂质Ca2+,即可优化该流程,故D正确;
故答案为:B。
20.B
【详解】A.向溴水中加入苯,振荡后静置,溴被苯萃取,水层颜色变浅,故A错误;
B.与发生反应:,过量但溶液中还剩余,说明该反应是可逆反应,存在反应限度,故B正确;
C.浓硝酸常温下使Fe发生钝化,浓硝酸的氧化性强于稀硝酸,故C错误;
D.丙烯醛分子中含有碳碳双键和醛基,醛基具有还原性,溴水可将醛基氧化成羧基,检验碳碳双键时应先排除醛基的干扰,故D错误;
故选B。
21.D
【分析】由图知,向卤块(主要成分为,含、等杂质离子)中加入盐酸进行酸溶,再加入过氧化氢发生将氧化为,再加入氢氧化钠溶液转化为氢氧化铁沉淀,过滤将其除去得到滤渣,滤渣为氢氧化铁,向滤液中加入碳酸氢铵进行沉镁,发生,故X主要为二氧化碳,经过过滤,得到轻质碳酸镁,据此回答。
【详解】A.①操作需用盐酸溶解卤块,所用仪器为玻璃棒、烧杯,A正确;
B.“氧化”目的是将氧化为,再通过调节除去,离子方程式为,B正确;
C.②和③操作都得到液体和固体,均为过滤,C正确;
D.“沉镁”工序中、转化为(),温度过高分解才可能产生,D错误;
故选D。
22.B
【详解】A.用惰性电极电解硫酸铜溶液,阳极发生的反应为水失电子生成氧气,阴极发生的反应为铜离子得电子生成铜单质,因此电解反应的总方程式为:,故A正确;
B.向苯酚钠溶液中滴加稀盐酸的反应为:,故B错误;
C.二价铁的检验是加入溶液后产生蓝色沉淀,反应为:,故C正确;
D.碳酸氢钙溶液加入是少量,因此以碳酸氢钙配平可得,反应为:,故D正确;
故答案为:B。
23.D
【详解】A.发生氧化还原反应,不能共存,故A错误;
B.结合生成Fe(SCN)3,不能共存,故B错误;
C. 生成硅酸镁沉淀,不能共存,故C错误;
D.各离子之间互不反应,能共存,故D正确;
故选D。
24.D
【详解】A.甲组同学用到500mL容量瓶、玻璃棒、烧杯、胶头滴管等玻璃仪器,A正确;
B.实验乙中阴离子SCN﹣被氧化为(SCN)2,B正确;
C.酸性高锰酸钾与亚铁离子反应的离子方程式:,C正确;
D.在等体积浓度均为0.1mol/L的KSCN和FeSO4混合溶液中滴加酸性高锰酸钾,溶液先变红,说明亚铁离子先被高锰酸根离子氧化成铁离子,故还原性SCN-
25.B
【分析】如图,根据含铁化合物的价态可知,a为,b为; d为;e为;c为、f为,g为;以此作答
【详解】A.,;分别与氧气和水蒸气反应可生成相同的化合物,A正确;
B.溶于氢碘酸的离子方程式为,B错误;
C.与的相互转化可通过,两个化合反应来实现,C正确;
D.g为,既可以被氧化生成+6价的高铁酸根,也可以被还原生成+2价的,D正确;
故选B。
26.D
【详解】A.不能拆开写,正确的离子方程式为,项错误;
B.稀硫酸将氧化为,正确的离子方程式为,B项错误;
C.将Fe3O4溶于氢碘酸后生成的会氧化,正确的离子方程式为,C项错误;
D.将少量溶液加入溶液中,发生反应的离子方程式为,D项正确;
故选D。
27.D
【详解】A.观察钾的焰色试验颜色时,要透过蓝色钴玻璃,以滤去黄色的光,故溶液X的焰色试验呈黄色不能判断没有,A项错误;
B.取少量溶液Y于试管中,滴加溶液后,再滴加溶液,溶液变为红色,原溶液中也可能含有,B项错误;
C.取少量溶液Z,向其中加入少量盐酸酸化的溶液,有白色沉淀产生、无气体生成,不能说明溶液Z中一定含有,也可能含,C项错误;
D.加入新制氯水后,可使含淀粉的溶液W变蓝,说明溶液W中含有,与可发生氧化还原反应,不能大量共存,D项正确。
答案选D。
28.D
【详解】A.Cl2与水反应生成HClO和HCl,无法直接生成NaClO,A错误;
B.SO2与水反应生成亚硫酸而不是硫酸,B错误;
C.氧化铁与水不反应,不能生成氢氧化铁沉淀,C错误;
D.CO2与水反应生成碳酸,碳酸与碳酸钙反应生成碳酸氢钙,碳酸氢钙受热分解生成二氧化碳气体,D正确;
故答案选D。
29.B
【详解】A.铵根离子、亚铁离子水解使得溶液显酸性,酸性溶液使紫色石蕊试液变红色,A正确;
B.少量摩尔盐与过量的NaOH溶液反应的离子方程式为,B错误;
C.+2价的铁被氧化为+3价,被还原为,反应的离子方程式为,C正确;
D.用来鉴别生成蓝色沉淀,反应的离子方程式为,D正确;
故答案选B。
30.B
【详解】A.醋酸是弱酸,在离子方程式书写中应写化学式符号,不能拆写离子符号,,A错误;
B.溶液中通入少量,强酸制弱酸离子方程式为:,B正确;
C.酸性溶液中,+2价的铁被双氧水氧化为+3价,反应的离子方程式为,,C错误;
D.固体与氢碘酸反应,其中Fe3+可与I-发生氧化还原反应:,D错误;
故选B。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
