专题18弱电解质的电离--2025年高三化学一轮复习【专题专练】(含解析)
文档属性
| 名称 | 专题18弱电解质的电离--2025年高三化学一轮复习【专题专练】(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-27 08:30:45 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
专题18弱电解质的电离--2025年高三化学一轮复习【专题专练】(含解析)
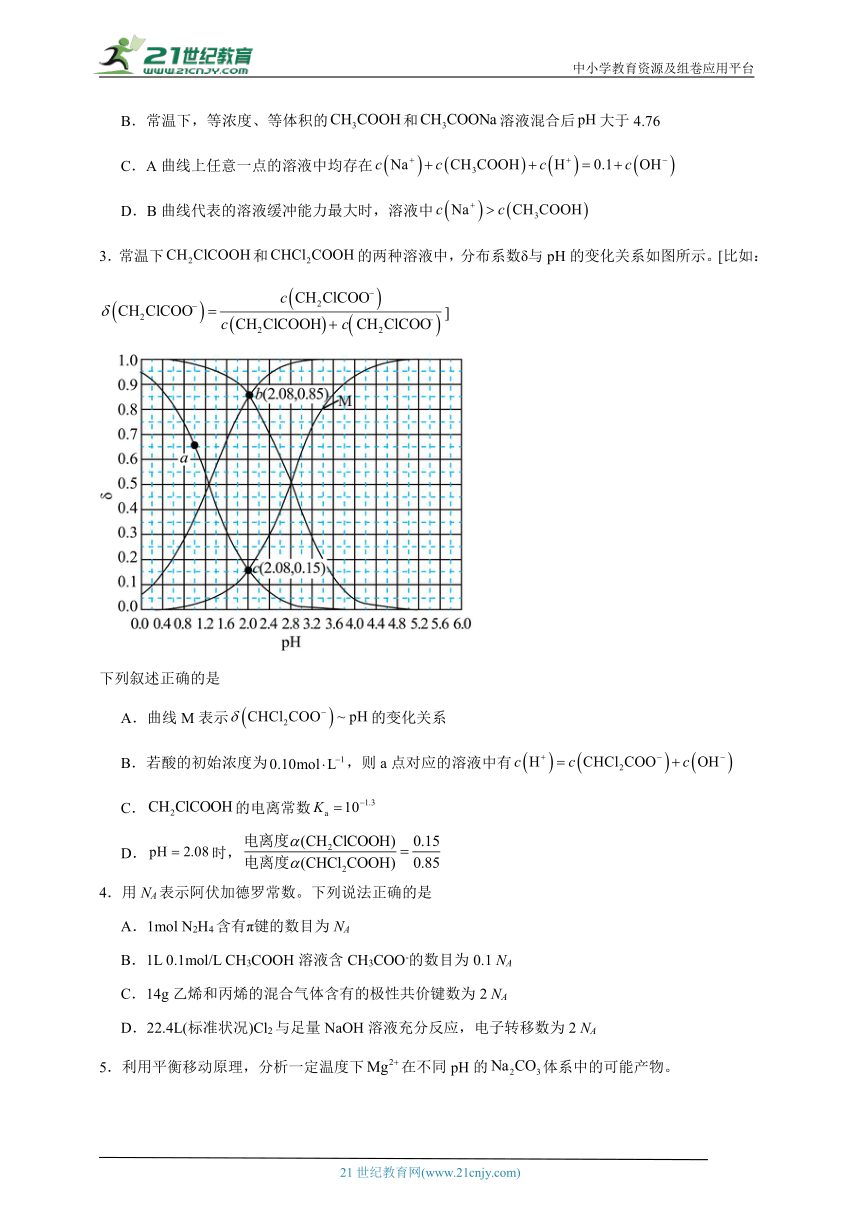
1.常温下,用硫酸滴定氨水溶液,所得溶液的和的物质的量分数与滴加硫酸体积的关系如图所示,忽略溶液混合过程中的温度变化。(假设:氨水溶液中的含氮微粒只有和)下列说法不正确的是
A.当滴入硫酸时,溶液中
B.当溶液呈中性时,滴入硫酸的体积小于,且此时溶液中
C.常温下,的水解常数为
D.曲线②代表点溶液中
2.1922年范斯莱克(Vanslyke)提出用缓冲容量来描述缓冲溶液缓冲能力的大小,越大,缓冲能力越大。如图是常温下,和组成缓冲溶液的关系图,其中两条曲线分别对应和。已知常温下,。
下列说法不正确的是
A.向的上述缓冲溶液加水稀释,增大
B.常温下,等浓度、等体积的和溶液混合后大于4.76
C.A曲线上任意一点的溶液中均存在
D.B曲线代表的溶液缓冲能力最大时,溶液中
3.常温下和的两种溶液中,分布系数δ与pH的变化关系如图所示。[比如:]
下列叙述正确的是
A.曲线M表示的变化关系
B.若酸的初始浓度为,则a点对应的溶液中有
C.的电离常数
D.时,
4.用NA表示阿伏加德罗常数。下列说法正确的是
A.1mol N2H4含有π键的数目为NA
B.1L 0.1mol/L CH3COOH溶液含CH3COO-的数目为0.1 NA
C.14g乙烯和丙烯的混合气体含有的极性共价键数为2 NA
D.22.4L(标准状况)Cl2与足量NaOH溶液充分反应,电子转移数为2 NA
5.利用平衡移动原理,分析一定温度下在不同pH的体系中的可能产物。
已知:i.图1中曲线表示体系中各含碳粒子的物质的量分数与pH的关系。
ii.图2中曲线Ⅰ的离子浓度关系符合;曲线Ⅱ的离子浓度关系符合;[注:起始,不同pH下由图1得到]。
iii.。下列说法不正确的是
A.
B.初始状态,时,发生反应:
C.初始状态、,平衡后溶液中存在
D.反应的平衡常数
6.侯氏制碱法是我国化学工程专家侯德榜于1943年创立的,是生产纯碱和氯化铵两种产品的方法。其原理为,,下列说法正确的是
A.氨水加水稀释过程中,逐渐减小
B.NH4Cl溶液中存在:
C.等物质的量浓度的NaHCO3溶液和Na2CO3溶液中水的电离程度:前者大于后者
D.0.1mol·L-1NaHCO3溶液中:
7.电石渣的主要成分为,含少量的、和C等杂质。从中回收制备高纯碳酸钙的工艺流程如下。已知:浸出液的金属阳离子只有。
下列说法错误的是
A.本流程中可以循环使用的物质是氨气和氯化铵
B.系列操作为洗涤和干燥
C.已知:,则属于弱电解质
D.滤渣1的成分为、和C
8.利用氨石灰水法吸收燃煤烟气中的过程如图所示。室温下,用1.0mol/L氨水溶液吸收,通入所引起的溶液体积变化和挥发可忽略,溶液中含硫物种的浓度。已知电离常数;电离常数,。下列说法正确的是
A.“吸收”时,的溶液中:
B.的吸收液中:
C.“转化”时,通入后的溶液增大
D.“再生”后的溶液中:
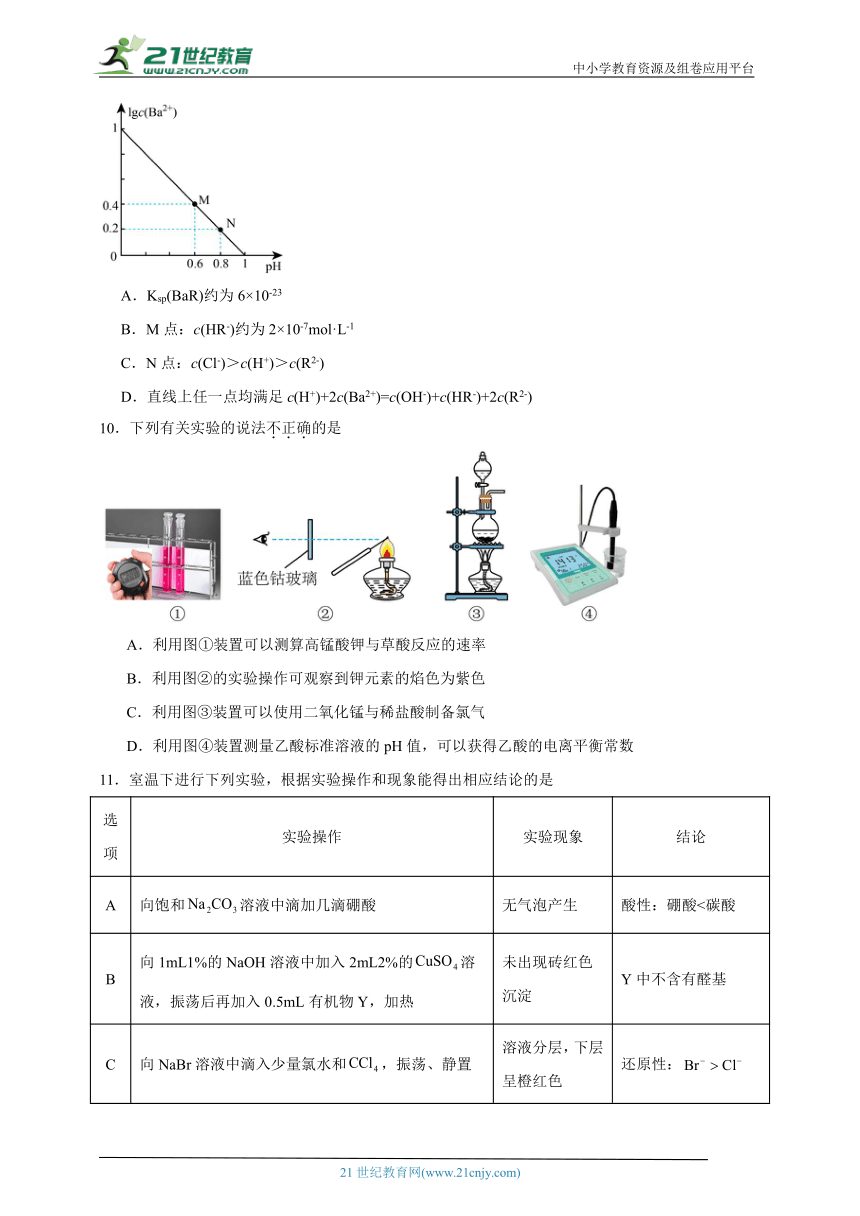
9.已知H2R的电离常数Ka1=2×10-8、Ka2=3×10-17。常温下,难溶物BaR在不同浓度盐酸(足量)中恰好不再溶解时,测得混合液中lgc(Ba2+)与pH的关系如图所示,下列说法错误的是
A.Ksp(BaR)约为6×10-23
B.M点:c(HR-)约为2×10-7mol·L-1
C.N点:c(Cl-)>c(H+)>c(R2-)
D.直线上任一点均满足c(H+)+2c(Ba2+)=c(OH-)+c(HR-)+2c(R2-)
10.下列有关实验的说法不正确的是
A.利用图①装置可以测算高锰酸钾与草酸反应的速率
B.利用图②的实验操作可观察到钾元素的焰色为紫色
C.利用图③装置可以使用二氧化锰与稀盐酸制备氯气
D.利用图④装置测量乙酸标准溶液的pH值,可以获得乙酸的电离平衡常数
11.室温下进行下列实验,根据实验操作和现象能得出相应结论的是
选项 实验操作 实验现象 结论
A 向饱和溶液中滴加几滴硼酸 无气泡产生 酸性:硼酸<碳酸
B 向1mL1%的NaOH溶液中加入2mL2%的溶液,振荡后再加入0.5mL有机物Y,加热 未出现砖红色沉淀 Y中不含有醛基
C 向NaBr溶液中滴入少量氯水和,振荡、静置 溶液分层,下层呈橙红色 还原性:
D 向含有ZnS和的悬浊液中滴加溶液 生成黑色沉淀 溶度积:
A.A B.B C.C D.D
12.已知是一元弱酸,是难溶盐,且不发生水解。常温下,向某的溶液中逐滴加入溶液后,溶液中和随的变化关系如下图所示。下列说法正确的是
A.曲线表示随的变化
B.
C.和两点溶液中浓度相等
D.点时溶液中存在:
13.已知:,且均为一元弱酸。常温下,向的溶液和HY溶液中分别加水稀释,所得溶液pH与变化的关系如图所示,其中V为稀释后溶液体积,为起始时溶液体积,下列说法正确的是
A.线iii代表HY,线i或ii可代表HX
B.升高温度,点溶液不变
C.水的电离程度
D.向等体积点溶液加入固体恰好中和后,溶液中
14.室温下,下列探究方案能达到实验目的的是
选项 探究方案 实验目的
A 依次通过足量酸性KMnO4溶液、碱石灰 除去C2H6中的C2H4
B 向FeCl2溶液中滴加酸性KMnO4溶液,观察现象 检验溶液中是否含有Fe2+
C 用pH试纸测试CH3COONa溶液和NaClO溶液的pH 比较Ka(CH3COOH)和Ka(HClO)的大小
D 用冰醋酸做导电性实验,电流表指针不偏转 醋酸不是电解质
A.A B.B C.C D.D
15.某氨基酸衍生物AcryMet(简称)的,。常温下构建体系,其中,,体系中含Cu物种分布系数与pH关系如图所示,下列说法正确的是
A.
B.时
C.时,存在
D.后继续增大pH,溶液中的一定继续增大
16.时,用气体调节氨水的,体系中粒子浓度的对数、反应物的物质的量之比与溶液的关系如图所示。若忽略通入气体后溶液体积的变化,下列有关说法错误的是
A.点溶液中:
B.点溶液中:
C.时,的水解平衡常数的数量级为
D.时,
17.一种利用含钴废料(主要成分为,还含有少量等杂质)制备的工艺流程如下。
已知:①常温下,部分金属离子沉淀的如下表:
金属离子
开始沉淀的 8.5 2.2 3.4 7.8
完全沉淀(金属离子)的的 10.0 3.0 4.5 9.4
②的的。
下列说法不正确的是
A.由流程可知氧化性:
B.常温下加入的溶液显碱性
C.气体通入氨水至过量后所得溶液可循环利用
D.“高温焙烧”时的化学方程式:
18.锡在材料、医药、化工等方面有广泛的应用,锡精矿(SnO2)中主要有Fe、S、As、Sb、Pb等杂质元素。下图为锡的冶炼工艺流程:
已知:SnO2性质稳定,难溶于酸。下列说法错误的是
A.焙烧产生的烟尘、烟气中主要杂质元素是S、As、Sb
B.酸浸时,PbO生成,为了提高铅的浸出率,可添加适量NaCl固体
C.的反应2中S元素化合价全部升高
D.电解精炼时,电源的正极与粗锡相连
19.常温下水溶液体系中存在反应:,平衡常数为K。已初始浓度,所有含碳物种的摩尔分数与变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
A.线Ⅱ表示的变化情况
B.的电离平衡常数
C.时,
D.时,
20.室温下,用含少量ZnSO4杂质的1 mol·L 1 MnSO4溶液制备MnCO3的过程如下图所示。下列说法不正确的是
已知:Ksp(MnS)=2×10 10,Ksp(ZnS)=2×10 24,Ka1(H2CO3)=4.5×10 7,Ka2(H2CO3)=4.7×10 11,Kb(NH3·H2O)=1.8×10 5
A.“除锌”反应的平衡常数K=1×1014
B.pH=8的氨水中存在c(NH)=9.9×10 7mol·L 1
C.氨水、NH4HCO3溶液中存在c(NH)<2c(CO)+c(HCO)
D.“沉锰”后的滤液中存在c(NH)+c(NH3·H2O)>2c(SO)
21.常温下,分别在、、溶液中滴加NaOH溶液,溶液pX=-lgX,X代表、、与pH的关系如图所示。
已知:。下列说法不正确的是
A.
B.的数量级为
C.
D.d点存在
22.25℃时,向一定浓度的溶液中滴加NaOH溶液,混合液中随pOH的变化如图所示,下列说法错误的是
已知:①中x表示、、;
②。
A.曲线III表示随pOH的变化关系
B.M点时,
C.当溶液时,
D.的平衡常数为
23.常温下,已知溶液中含磷物质的浓度之和为,溶液中各含磷物质的lgc与pOH的关系如图所示[]。下列说法错误的是
A.曲线②表示随pOH的变化
B.pH=7.22的溶液中:
C.b点时:
D.溶液中:
24.常温下,用浓度为的盐酸滴定浓度均为的和的混合溶液,滴定过程中溶液的随的变化曲线如图所示,下列说法正确的是
A.该温度下,约为
B.水的电离程度:
C.点
D.点
25.以磷石膏(主要成分,杂质、等)和氨水为原料可实现矿物封存同时制备轻质,转化部分流程如图。
,,
,。
下列说法正确的是
A.氨水中存在:
B.“转化”步骤,通入后清液中始终存在
C.“转化”步骤,若通入至溶液为6.5,此时溶液中
D.“滤液”中存在:
26.室温下,用相同浓度的HCl溶液,分别滴定浓度均为0.1mol/L的三种碱(XOH、YOH和ZOH)溶液,滴定曲线如图所示[已知]。
下列判断正确的是
A.三种碱的电离常数关系:
B.滴定至M点时,溶液中:
C.时,三种溶液中:
D.当中和百分数达100%时,将三种溶液混合后:
27.常温下,盐酸分别滴入溶液与溶液中,测得溶液的随滴入盐酸体积变化的图像如图所示。下列说法不正确的是
A.常温下,的电离常数约为
B.水的电离程度;d>c>a>b
C.c点:
D.b、d点溶液混合后为酸性
28.一种制备的工艺路线如图所示,反应所得溶液pH在3~4之间,反应需及时补加以保持反应在条件下进行。常温下,的电离平衡常数,。下列说法正确的是
A.反应、、均为氧化还原反应
B.低温真空蒸发主要目的是防止被氧化
C.溶液Y可循环用于反应所在操作单元吸收气体
D.若产量不变,参与反应的X与物质的量之比增大时,需补加的量增多
29.常温下,用相同物质的量浓度的溶液分别滴定起始物质的量浓度均为的三种酸溶液,滴定曲线如图所示,下列说法正确的是
A.常温下,三种酸的电离常数:
B.滴定至T点时,溶液中:
C.当时,三种酸溶液中HX溶液中和百分数最大
D.当中和百分数达到时,将三种溶液混合后:
30.NaOH溶液滴定20.00mL溶液时,、各含磷元素微粒的和pH的关系如图。下列说法错误的是
A.的
B.水的电离程度:d>c>b>a
C.③为的与pH的关系
D.c点时,溶液中存在
参考答案:
1.A
【分析】往氨水溶液中加入稀硫酸,随着滴加稀硫酸的体积变化,溶液pH的变化由一个突变过程,逐渐与盐酸反应生成氯化铵和水,含量下降为曲线①,的含量逐渐上升为曲线②,曲线③代表溶液的pH。
【详解】A.当滴入硫酸时,得到溶液溶质为和,且此时两者物质的量之比为2:1,由电荷守恒可知,,由物料守恒可知,,则存在,A错误;
B.得到硫酸铵为强酸弱碱盐,溶液酸性,则当溶液呈中性时,稀硫酸稍微不足,滴入硫酸的体积小于,由电荷守恒可知,,故此时溶液中,B正确;
C.由图可知,时,pH=9.26,pOH=4.74,则的,常温下,的水解常数为,C正确;
D.曲线②代表,a点溶液加入硫酸溶液后溶液体积增大,导致,D正确;
故选A。
2.D
【详解】A.向的上述缓冲溶液加水稀释,溶液酸性减弱,减小,水的离子积不变,故增大,故A正确;
B.,则,则常温下,等浓度、等体积的和溶液中,的电离程度大于的水解程度,则溶液显酸性,,又,,则混合溶液的大于4.76,故B正确;
C.根据电荷守恒,A曲线上任意一点的溶液中均存在,则,故C正确;
D.B曲线代表的溶液缓冲能力最大时,pH=4.76,,所以溶液中,根据电荷守恒,溶液呈酸性,则,所以,故D错误;
故选D。
3.D
【分析】随着pH的增大,、浓度减小,、浓度增大,—Cl为吸电子基团,的酸性强于,即),δ(酸分子)=δ(酸根离子)=0.5时的pH分别约为1.3、2.8,则两种酸的电离常数分别为,,由此分析解题。
【详解】A.根据分析,曲线M表示的变化关系,A错误;
B.根据,初始,若溶液中溶质只有,则,但a点对应的,说明此时溶液中加入了酸性更强的酸,根据电荷守恒,,B错误;
C.根据分析,CH2ClCOOH的电离常数Ka=10-2.8,C错误;
D.电离度,,则=,,时,,,D正确;
故答案选D。
4.C
【详解】
A.N2H4的结构式为,分子中不含有π键,A不正确;
B.CH3COOH 为弱酸,在水溶液中发生部分电离,则1L 0.1mol/L CH3COOH溶液含CH3COO-的数目小于0.1 NA,B不正确;
C.14g乙烯中含极性共价键的物质的量为=2mol,14g丙烯中含极性共价键的物质的量为=2mol,则4g乙烯和丙烯的混合气体含有的极性共价键数为2 NA,C正确;
D.Cl2与足量NaOH溶液发生反应时,存在如下关系式:Cl2——e-,则22.4L(标准状况)Cl2(物质的量为1mol)与足量NaOH溶液充分反应,电子转移数为NA,D不正确;
故选C。
5.C
【详解】A.由碳酸氢根离子和碳酸根离子的交点可知,,A正确;
B.初始状态,存在碳酸氢根离子,、时,由图2可知,该点位于曲线Ⅱ的上方,会生成碳酸镁沉淀,因此反应的离子方程式为,B正确;
C.初始状态、,该点位于曲线Ⅱ的上方,部分碳转化为碳酸镁沉淀,由物料守恒可知,平衡后溶液中存在,C错误;
D.由点(8,0.9)可知,此时pH=8,pOH=6,则,的平衡常数,D正确;
故选C。
6.D
【详解】A.,,氨水加水稀释过程中, 减小,逐渐增大,错误;
B.NH4Cl是强酸弱碱盐,溶液中存在:,B错误;
C.等物质的量浓度的NaHCO3溶液和Na2CO3溶液中水的电离程度:前者小于后者,C错误;
D.0.1mol·L-1NaHCO3溶液中:电荷守恒:,物料守恒:,两式相差得,D正确;
故选D。
7.C
【分析】已知:浸出液的金属阳离子只有,则、和C等杂质成为滤渣1的成分,浸出液中氯化钙和二氧化碳、氨气反应生成碳酸钙沉淀和氯化铵,滤液成分为NH4Cl;
【详解】A.加入氯化铵浸出与反应生成氯化钙、水和氨气,氯化钙和二氧化碳、氨气反应生成碳酸钙沉淀和氯化铵,可以循环使用的物质是氨气和氯化铵,故A正确;
B.滤渣2为碳酸钙沉淀,表面附着可溶性氯化铵,加水洗涤、干燥即可得到高纯碳酸钙,系列操作为洗涤和干燥,故B正确;
C.难溶,溶于水的部分能完全电离,属于强电解质,故C错误;
D.已知:浸出液的金属阳离子只有,则滤渣1的成分为、和C,故D正确;
故答案选C。
8.B
【详解】A.由题干信息可知,用1.0mol/L氨水“吸收”SO2时,当即含氮微粒浓度之和等于含硫微粒浓度之和的2倍,该溶液的溶质为(NH4)2SO3,又由于水解Kh=小于的水解Kh1=,即该溶液呈碱性,则有:,A错误;
B.已知H2SO3的Ka1Ka2=,则的吸收液中:=远大于1,即,B正确;
C. 由题干流程图可知,“转化”时,通入后将(NH4)2SO3转化为(NH4)2SO4,结合A项分析可知,溶液由碱性转化为酸性,故溶液减小,C错误;
D.由题干流程图可知,“再生”发生的反应为:Ca(OH)2+(NH4)2SO4=CaSO4+2NH3 H2O,此过程中生成了CaSO4沉淀,故溶液中:,D错误;
故答案为:B。
9.D
【详解】A.直线上,lgc(Ba2+)+pH=1,即=10;难溶物BaR与足量盐酸发生反应BaS+2H+Ba2++H2R,溶液中存在c(Ba2+)≈c(H2R),Ka1 Ka2=,Ksp(BaR)= c(Ba2+) c(R2-)= Ka1 Ka2×=2×10-8×3×10-17×100=6×10-23,A正确;
B.M点,c(H+)=10-0.6mol/L,c(Ba2+)≈c(H2R)=100.4mol/L,c(HR-)===2×10-7mol·L-1,B正确;
C.溶液中溶质为BaCl2、H2R、HCl,Ka1 Ka2=,N点时,c(H+)=10-0.8mol/L,c(Ba2+)≈c(H2R)=100.2mol/L,则c(R2-)==mol/L=6×10-23.2mol/L,c(Cl-)最大,所以N点:c(Cl-)>c(H+)>c(R2-),C正确;
D.直线上任一点均满足电荷守恒c(H+)+2c(Ba2+)=c(OH-)+c(HR-)+2c(R2-)+c(Cl-),所以c(H+)+2c(Ba2+)>c(OH-)+c(HR-)+2c(R2-),D错误;
故选D。
10.C
【详解】A.观察试管内溶液的颜色变化并计时,可以测算高锰酸钾与草酸反应的速率,A正确;
B.进行焰色试验时,通常使用铂丝(或铁丝)作为载体,将蘸有待检测溶液的金属丝置于火焰上灼烧,隔蓝色钴玻璃观察燃烧时火焰的颜色,钾的焰色反应呈紫色,B正确;
C.实验室制氯气可以用二氧化锰与浓盐酸加热反应制得,稀盐酸无法制得,C错误;
D.用电子pH计测量乙酸标准溶液的pH值,根据乙酸电离方程式得出电离平衡常数表达式,可以算得乙酸的电离平衡常数,D正确;
故选C。
11.C
【详解】A.向饱和Na2CO3溶液中滴加几滴硼酸,即使硼酸的酸性比碳酸强,也可能因生成NaHCO3而无气泡,故结论不准确,故A错误;
B.NaOH不足,检验-CHO应在碱性条件下,该实验不能检验Y中是否含-CHO,故B错误;
C.反应后溶液分层,下层呈橙红色,说明氯气与NaBr反应生成溴单质,发生反应:,根据还原剂的还原性大于还原产物的还原性,可知Br-还原性强于Cl-,故C正确;
D.Na2S与硫酸铜直接反应生成CuS沉淀,不发生沉淀的转化,不能比较Ksp,故D错误;
故选D。
12.B
【分析】常温下,溶液中逐滴加入溶液,发生反应:、,存在难溶物溶解平衡及水解平衡:、,根据,则,,,,温度不变,是定值,则随的增大而增大,表示随的变化,代表随的变化关系。
【详解】A.根据上述分析可知,代表随的变化关系,A错误;
B.图中b点是曲线与曲线交点,即代表当时,=,则,B正确;
C.a点在曲线上,代表,即;c点在曲线上,代表,即,根据,溶液中,故和两点溶液中浓度不相等,C错误;
D.b点溶液存在=,即=,根据电荷守恒可知,,故溶液中,D错误;
答案选B。
13.C
【详解】A.加水稀释时,=1,即稀释10倍时,一元强酸的pH增大1,弱酸的pH变化小于1,HX即使为强酸,pH变化也不会大于1,而i对应横坐标1时,pH>4,故i代表HX,又,可知HX的酸性强于HY,则ii代表HX,III代表HY,故A错误;
B.升高温度弱酸和水的电离程度均增大,c(H+)增大,a点pH减小,故B错误;
C.从b→c加水过程,酸浓度减小,c(H+)减小,对水电离的抑制程度减小,水的电离程度增大,故C正确;
D.因酸性HX>HY,则pH相同的两种溶液,HY的浓度大于HX,则等体积的两种酸,HY消耗的NaOH对,反应后溶液中,故D错误;
故选:C。
14.AA
【详解】A.酸性KMnO4溶液能氧化生成,可被碱石灰吸收,A项正确;
B.酸性KMnO4溶液能氧化生成,但同时也能氧化,该方法不能检验溶液中是否含有Fe2+,B项错误;
C.溶液和溶液浓度未知,无法比较Ka(CH3COOH)和Ka(HClO)的大小,C项错误;
D.冰醋酸不导电,但溶于水能导电,醋酸属于电解质,D项错误;
故答案为:A。
15.C
【详解】A.由图可知,溶液pH为6.90时,溶液中(CuHL)+的分布系数为48%,Cu(HL)2的分布系数略大于48%,由电离常数可知,溶液中HL—的浓度为=2.75×104.43mol/L,由方程式可知,反应的平衡常数K=≈2.75×104.43,故A错误;
B.由图可知,溶液pH为4.5时,溶液中[CuHL+]小于0.0125 mol/L,由电离常数可知,溶液中HL—的浓度为=2.75×102.03mol/L,则溶液中HL—的浓度大于[CuHL+],故B错误;
C.由图可知,溶液pH为11时,溶液中存在电荷守恒关系,故C正确;
D.由图可知,溶液pH为12时,[CuL(OH)]—的分布系数接近最大,则续增大pH,溶液中[CuL(OH)]—会转化为氢氧化铜而减小,故D错误;
故选C。
16.C
【详解】A.由图可知,P3点时=1.0,则该溶液的溶质为NH4Cl,根据物料守恒得,c(Cl-)=c(NH3·H2O)+c(),故有c(Cl-)>c(NH3·H2O),A正确;
B.P2点c(H+)=c(OH-),由电荷守恒得c()+c(H+)=c(Cl-)+c(OH-),故c()=c(Cl-),B正确;
C.NH3·H2O的Kb=,根据图可知当lgc()=lgc(NH3·H2O),即c()=c(NH3·H2O)时,溶液pH=9.25,则此时c(OH-)=10-4.75mol/L,所以NH3·H2O的电离平衡常数为10-4.75,的水解常数Kh==10-9.25,数量级为10-10,C错误;
D.=0.5时,溶液相当于等浓度的NH3·H2O和NH4Cl混合,根据元素守恒,c(NH3·H2O)+c()=2c(Cl-),D正确;
故选C。
17.A
【分析】钴废料(主要成分为,还含有少量等杂质)中加硫酸、H2O2酸浸,还原为Co2+,转化为对应硫酸盐,二氧化硅不溶解,滤渣为二氧化硅,滤液中加氨水调溶液的pH,沉淀Al3+、Fe3+,过滤,滤液中加碳酸氢铵沉钴,得CoCO3沉淀,然后碳酸钴和碳酸锂高温焙烧生成。
【详解】A.由流程可知,钴废料(主要成分为,还含有少量等杂质)中加硫酸、H2O2酸浸,被H2O2还原为Co2+,所以氧化性:,故A错误;
B.电离常数:碳酸的,所以水解常数,所以溶液显碱性,故B正确;
C.气体为CO2,通入氨水至过量后所得溶液为溶液,溶液可循环利用,故C正确;
D.“高温焙烧”时,碳酸钴和碳酸锂反应生成,钴元素化合价升高,则有氧气参与,反应的化学方程式:,故D正确;
故答案为:A。
18.C
【分析】锡精矿中主要有Fe、S、As、Sb、Pb等杂质元素,焙烧时Fe、S、As、Sb、Pb杂质元素转化为氧化物,焙烧后加入稀盐酸溶解,由于性质稳定,难溶于酸,过滤得到,再使用焦炭还原得到粗锡,最后电解精炼得到精锡,据此分析解题。
【详解】A.焙烧时Fe、S、As、Sb、Pb杂质元素转化为氧化物,由题可知,加入稀盐酸后的滤液经过处理得到Fe和Pb,所以烟尘、烟气中的主要杂质元素是S、As、Sb,故A正确;
B.酸浸时,PbO生成,离子方程式为,浸出过程中添加氯化钠,可促使氯化铅转化成可溶性的离子,提高其浸出效果,故B正确;
C.PbS与熔融NaOH反应的化学方程式为,S元素化合价只有部分升高,故C错误;
D.电解精炼时,与电源的正极相连的是粗锡,故D正确;
故答案选C。
19.C
【分析】在溶液中存在平衡:CH3COOHCH3COO-+H+(①)、Ag++CH3COO-CH3COOAg(aq)(②),Ag+的水解平衡Ag++H2OAgOH+H+(③),随着pH的增大,c(H+)减小,平衡①③正向移动,c(CH3COOH)、c(Ag+)减小,pH较小时(约小于7.8)CH3COO-浓度增大的影响大于Ag+浓度减小的影响,CH3COOAg浓度增大,pH较大时(约大于7.8)CH3COO-浓度增大的影响小于Ag+浓度减小的影响,CH3COOAg浓度减小,故线Ⅰ表示CH3COOH的摩尔分数随pH变化的关系,线Ⅱ表示CH3COO-的摩尔分数随pH变化的关系,线Ⅲ表示CH3COOAg随pH变化的关系。
【详解】A.根据分析,线Ⅱ表示CH3COO-的变化情况,A项错误;
B.由图可知,当c(CH3COOH)=c(CH3COO-)相等时(即线Ⅰ和线Ⅱ的交点),溶液的pH=m,则CH3COOH的电离平衡常数Ka==10-m,B项错误;
C.pH=n时=10-m,c(CH3COO-)==10n-mc(CH3COOH),Ag++CH3COO-CH3COOAg(aq)的K=,c(Ag+)=,由图可知pH=n时,c(CH3COOH)=c(CH3COOAg),代入整理得c(Ag+)=mol/L,C项正确;
D.根据物料守恒,pH=10时溶液中c(Ag+)+c(CH3COOAg)+c(AgOH)=0.08mol/L,D项错误;
答案选C。
20.C
【分析】含少量ZnSO4杂质的1 mol·L 1 MnSO4溶液加入过量MnS除去锌离子,过滤滤液加入氨水、碳酸氢铵溶液得到MnCO3。
【详解】A.“除锌”反应为,的平衡常数K1×1014,A正确;
B.pH=8则水电离出,pOH=6,溶液中总的,则氨水电离出9.9×10 7mol/L,B正确;
C.氨水、NH4HCO3溶液中根据电荷守恒存在:c(H+)+c(NH)= c(OH-)+2c(CO)+c(HCO),氨水溶液显碱性,则c(H+)2c(CO)+c(HCO),C错误;
D.“沉锰”后的滤液成分为硫酸铵、氨水、碳酸氢铵,则由物料守恒可知,存在c(NH)+c(NH3·H2O)>2c(SO),D正确;
故选C。
21.C
【分析】Mn(OH)2、Zn(OH2的物质类型相似,二者的pX随pH的变化曲线应是平行线,则曲线ad代表与pH的关系,由图中a点可知可知pX=0时,溶液的pH=3.3,此时=c(H+)=1×10-3.3;已知:,纵坐标值越大表示阳离子浓度越小,可以判断出b所在曲线表示与pH的关系曲线,c所在的曲线表示与pH的关系曲线
【详解】A.由上述分析可知,,A正确;
B.b所在曲线表示,与pH的关系曲线,根据b点的坐标值,此时c(Zn2+)=1×10-6.15,c(OH-)=1×10-5,,数量级为10-17,B正确;
C.c所在曲线表示,与pH的关系曲线,根据c点的坐标值,此时c(Mn2+)=1×101.3,c(OH-)=1×10-7,,的平衡常数,C错误;
D.d点溶液呈中性,电荷守恒等式为:,根据可得,D正确。
故选C。
22.D
【详解】A.溶液中存在、、,且电离程度依次减小,即,当lgx=0时,,即Ka越大,c(H+)越大,c(OH-)越小,pOH越大,则对应的pOH最大,为曲线Ⅲ,由此可得曲线Ⅰ、Ⅱ、Ⅲ分别代表、、随pOH的变化关系,故A正确;
B.M点时,=1,溶液中存在的溶质为Na2HPO4和Na3PO4,则有电荷守恒:,又因为,所以,故B正确;
C.当溶液pH=7,即pOH=7时,由图象可知,,即,故C正确;
D.由图象计算可得,,的平衡常数=,则平衡常数的数量级10-6,故D错误;
故选D。
23.C
【分析】溶液中pOH越小,溶液碱性越强,磷酸溶液中的浓度越大,因此图中曲线①②③④分别表示、、、随pOH的变化。
【详解】A.根据分析可知,曲线②表示随pOH的变化,故A项正确;
B.c点时,pH=2.02,,则的第一级电离平衡常数;b点时,pH=4.62,,则,因此,当溶液中时,,即pH=7.22,故B项正确;
C.溶液中含磷物质的浓度之和为,即,因此;由图可知,b点时,故,则,故C项错误;
D.的电离程度()大于水解程度(),因此溶液显酸性,其溶液中,故D项正确。
答案选C。
24.C
【详解】A.当在x点时,氢氧化钠溶液恰好被盐酸反应,此时氨水的物质的量浓度为,则,A错误;
B.x点溶质为氯化钠和,从x点到z点,氨水浓度不断降低,逐渐变为氯化铵,水的电离程度不断增大,即水的电离程度:,B错误;
C.x点溶质氯化钠和氨水,且两者物质的量浓度之比为,溶液显碱性,其离子浓度,C正确;
D.y点溶质为氯化钠、氯化铵、且三者物质的量浓度之比为,溶液显碱性,则氨水电离程度大于铵根水解程度,且,存在元素质量守恒:,故,D错误;
故选C。
25.C
【详解】A.氨水显碱性,所以电离强度大于水解强度,又因为电离出的还要水解,根据电荷守恒,所以=+,又因为氨水为弱电解质部分电离,则,故,故A项错误;
B.“转化”后的清液中,CaCO3一定达到沉淀溶解平衡,而CaSO4不一定达到沉淀溶解平衡,则,,故B项错误;
C.“转化”步骤,若通入CO2至溶液pH为6.5时,,,则,故C项正确;
D.“转化”步骤 ,“滤液”中粒子有,根据电荷守恒,过滤后所得滤液中一定存在:,故D项错误;
故本题选C。
26.D
【详解】A.由图,起始时三种碱的浓度相同,pOH的大小关系为ZOH>YOH>XOH,pOH越大,c(OH-)越小,即KZOHB.YOH为弱碱,滴定至M点,溶液中含等量的YOH、YCl,且溶液显碱性说明YOH的电离大于YCl的水解,则c(Y+)>c(Cl )>c(YOH)>c(OH )>c(H+),B错误;
C.pOH=7时,溶液c(H+)=c(OH ),弱碱中消耗的盐酸小于强碱消耗的盐酸,碱性越弱氯离子越少,则三种溶液中:c(X+)>c(Y+)>c(Z+),故C错误;
D.当中和百分数达100%时,将三种溶液混合,溶液遵循质子守恒,则c(OH )+c(XOH)+c(YOH)+c(ZOH)=c(H+),即c(XOH)+c(YOH)+c(ZOH)=c(H+) c(OH ),故D正确;
本题选D。
27.C
【分析】氢氧化钠为强碱,和盐酸恰好反应得到氯化钠溶液为中性,则N、M分别为、的滴定曲线;
【详解】A.,的初始pOH=6,则,A正确;
B.酸、碱都会抑制水的电离、等浓度强碱对水的电离抑制作用更大,abcd溶液溶质分别为、NaCl和NaOH、BCl和、BCl,则d点水的电离程度最大、次之c;为弱碱、NaOH为强碱,结合两点pOH可知,a点的水的电离程度大于b点,B正确;
C.c点溶质为等量的BCl和,由电荷守恒可知,,由物料守恒可知,,则,C错误;
D.a点和d点混合,相当于将溶液与溶液,加入30mL盐酸,反应后溶液中含有NaCl、BCl和BOH,溶液的酸碱性应该与c点相同,即呈酸性,D正确;
故选C。
28.C
【分析】铜和浓硫酸反应(反应Ⅰ)生成二氧化硫气体(气体Ⅰ)和硫酸铜,生成的二氧化硫气体与碳酸钠反应(反应Ⅱ),所得溶液pH在3~4之间,溶液显酸性,根据H2SO3的电离平衡常数Ka1=1.3×10-2,Ka2=6.3×10-8,可知NaHSO3溶液显酸性(电离大于水解),则反应Ⅱ所得溶液成分是NaHSO3,调节溶液pH值至11,使NaHSO3转化为Na2SO3,低温真空蒸发(防止Na2SO3被氧化),故固液分离得到Na2SO3晶体和Na2SO3溶液,Na2SO3和CuSO4反应的离子方程式是+2Cu2++2H2O=+Cu2O+4H+,反应过程中酸性越来越强,使Na2SO3转化成SO2气体,总反应方程式是2CuSO4+3Na2SO3=Cu2O+2SO2↑+3Na2SO4,需及时补加NaOH以保持反应在pH=5条件下进行,据此分析解答。
【详解】A.反应Ⅰ是铜和浓硫酸反应,生成二氧化硫,是氧化还原反应,反应Ⅱ是SO2和碳酸钠溶液反应,生成NaHSO3、水和二氧化碳,是非氧化还原反应,反应Ⅲ是Na2SO3和CuSO4反应生成Cu2O,是氧化还原反应,A错误;
B.低温真空蒸发主要目的是防止Na2SO3被氧化,而不是NaHSO3,B错误;
C.经分析溶液Y的成分是Na2SO3溶液,可循环用于反应Ⅱ的操作单元吸收SO2气体(气体Ⅰ),C正确;
D.制取Cu2O总反应方程式是2CuSO4+3Na2SO3=Cu2O+2SO2↑+3Na2SO4,化合物X是指Na2SO3,若Cu2O产量不变,增大比,多的Na2SO3会消耗氢离子,用于控制pH值,可减少NaOH的量,D错误;
故答案为:C。
29.D
【分析】根据图象,常温下,中和百分数为0,也就是没有滴入NaOH溶液时0.1mol/L的HX、HY、HZ的pH由大到小的顺序为:HX>HY>HZ,同温同浓度的HX、HY、HZ电离出H+的能力:HZ>HY>HX,故三种酸的电离平衡常数:。
【详解】A.根据分析,三种酸的电离平衡常数:,故A错误;
B.T点,中和百分数为50%,所得溶液为等物质的量浓度的NaY和HY的混合液,溶液的pH<7,溶液呈酸性,说明HY的电离程度大于的水解程度,根据物料守恒有: ,根据电荷守恒有:,所以溶液中存在:,故B错误;
C.在滴加NaOH过程中,每种溶液中均存在电荷守恒,、、,当时,,此时 、、,那么将浓度相等的三种酸溶液中和至,由于,因此所需要的NaOH的量一定不同,中和百分数也不相等,根据电离常数可知,水解对应产生的酸的酸性越弱,水解程度越大,可知,说明碱性关系为:,由此可知,HX中加入的碱最少才可达到,因此三种酸溶液中HX溶液中和百分数最小,故C错误;
D.当中和百分数达100%时,根据酸碱中和可知此时溶质分别为:NaX、NaY、NaZ,分别有物料守恒为:、、,那么将三种溶液混合后所得溶液中含有的是NaX、NaY、NaZ,此时钠离子浓度为整个溶液中的浓度,因此物料守恒为,电荷守恒不难得出为,两式整理得,故D正确;
故答案选D。
30.D
【分析】根据图中a点,时,溶液中溶质的物质的量之比为,故③④为磷酸和磷酸二氢钠的曲线,又因为随着pH变大,浓度变小,故③为,④为,又因为pH=2.12时,最小,故②为,①为,据此分析回答。
【详解】A.a点,,溶液中溶质为,即,;c点,,即,,,A正确;
B.a点的溶质为,水的电离被抑制,随着NaOH溶液的滴入,酸性减弱,生成可水解的盐,故水的电离逐渐增大,故水的电离程度:d>c>b>a,B正确;
C.由分析知,③为的与pH的关系,C正确;
D.溶液中存在电荷守恒,c点时,Na元素和P元素之间的关系为,则有,从图中信息可知,c点时,联立三个等式,有,此时溶液显碱性,则,D错误;
故选D。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
专题18弱电解质的电离--2025年高三化学一轮复习【专题专练】(含解析)
1.常温下,用硫酸滴定氨水溶液,所得溶液的和的物质的量分数与滴加硫酸体积的关系如图所示,忽略溶液混合过程中的温度变化。(假设:氨水溶液中的含氮微粒只有和)下列说法不正确的是
A.当滴入硫酸时,溶液中
B.当溶液呈中性时,滴入硫酸的体积小于,且此时溶液中
C.常温下,的水解常数为
D.曲线②代表点溶液中
2.1922年范斯莱克(Vanslyke)提出用缓冲容量来描述缓冲溶液缓冲能力的大小,越大,缓冲能力越大。如图是常温下,和组成缓冲溶液的关系图,其中两条曲线分别对应和。已知常温下,。
下列说法不正确的是
A.向的上述缓冲溶液加水稀释,增大
B.常温下,等浓度、等体积的和溶液混合后大于4.76
C.A曲线上任意一点的溶液中均存在
D.B曲线代表的溶液缓冲能力最大时,溶液中
3.常温下和的两种溶液中,分布系数δ与pH的变化关系如图所示。[比如:]
下列叙述正确的是
A.曲线M表示的变化关系
B.若酸的初始浓度为,则a点对应的溶液中有
C.的电离常数
D.时,
4.用NA表示阿伏加德罗常数。下列说法正确的是
A.1mol N2H4含有π键的数目为NA
B.1L 0.1mol/L CH3COOH溶液含CH3COO-的数目为0.1 NA
C.14g乙烯和丙烯的混合气体含有的极性共价键数为2 NA
D.22.4L(标准状况)Cl2与足量NaOH溶液充分反应,电子转移数为2 NA
5.利用平衡移动原理,分析一定温度下在不同pH的体系中的可能产物。
已知:i.图1中曲线表示体系中各含碳粒子的物质的量分数与pH的关系。
ii.图2中曲线Ⅰ的离子浓度关系符合;曲线Ⅱ的离子浓度关系符合;[注:起始,不同pH下由图1得到]。
iii.。下列说法不正确的是
A.
B.初始状态,时,发生反应:
C.初始状态、,平衡后溶液中存在
D.反应的平衡常数
6.侯氏制碱法是我国化学工程专家侯德榜于1943年创立的,是生产纯碱和氯化铵两种产品的方法。其原理为,,下列说法正确的是
A.氨水加水稀释过程中,逐渐减小
B.NH4Cl溶液中存在:
C.等物质的量浓度的NaHCO3溶液和Na2CO3溶液中水的电离程度:前者大于后者
D.0.1mol·L-1NaHCO3溶液中:
7.电石渣的主要成分为,含少量的、和C等杂质。从中回收制备高纯碳酸钙的工艺流程如下。已知:浸出液的金属阳离子只有。
下列说法错误的是
A.本流程中可以循环使用的物质是氨气和氯化铵
B.系列操作为洗涤和干燥
C.已知:,则属于弱电解质
D.滤渣1的成分为、和C
8.利用氨石灰水法吸收燃煤烟气中的过程如图所示。室温下,用1.0mol/L氨水溶液吸收,通入所引起的溶液体积变化和挥发可忽略,溶液中含硫物种的浓度。已知电离常数;电离常数,。下列说法正确的是
A.“吸收”时,的溶液中:
B.的吸收液中:
C.“转化”时,通入后的溶液增大
D.“再生”后的溶液中:
9.已知H2R的电离常数Ka1=2×10-8、Ka2=3×10-17。常温下,难溶物BaR在不同浓度盐酸(足量)中恰好不再溶解时,测得混合液中lgc(Ba2+)与pH的关系如图所示,下列说法错误的是
A.Ksp(BaR)约为6×10-23
B.M点:c(HR-)约为2×10-7mol·L-1
C.N点:c(Cl-)>c(H+)>c(R2-)
D.直线上任一点均满足c(H+)+2c(Ba2+)=c(OH-)+c(HR-)+2c(R2-)
10.下列有关实验的说法不正确的是
A.利用图①装置可以测算高锰酸钾与草酸反应的速率
B.利用图②的实验操作可观察到钾元素的焰色为紫色
C.利用图③装置可以使用二氧化锰与稀盐酸制备氯气
D.利用图④装置测量乙酸标准溶液的pH值,可以获得乙酸的电离平衡常数
11.室温下进行下列实验,根据实验操作和现象能得出相应结论的是
选项 实验操作 实验现象 结论
A 向饱和溶液中滴加几滴硼酸 无气泡产生 酸性:硼酸<碳酸
B 向1mL1%的NaOH溶液中加入2mL2%的溶液,振荡后再加入0.5mL有机物Y,加热 未出现砖红色沉淀 Y中不含有醛基
C 向NaBr溶液中滴入少量氯水和,振荡、静置 溶液分层,下层呈橙红色 还原性:
D 向含有ZnS和的悬浊液中滴加溶液 生成黑色沉淀 溶度积:
A.A B.B C.C D.D
12.已知是一元弱酸,是难溶盐,且不发生水解。常温下,向某的溶液中逐滴加入溶液后,溶液中和随的变化关系如下图所示。下列说法正确的是
A.曲线表示随的变化
B.
C.和两点溶液中浓度相等
D.点时溶液中存在:
13.已知:,且均为一元弱酸。常温下,向的溶液和HY溶液中分别加水稀释,所得溶液pH与变化的关系如图所示,其中V为稀释后溶液体积,为起始时溶液体积,下列说法正确的是
A.线iii代表HY,线i或ii可代表HX
B.升高温度,点溶液不变
C.水的电离程度
D.向等体积点溶液加入固体恰好中和后,溶液中
14.室温下,下列探究方案能达到实验目的的是
选项 探究方案 实验目的
A 依次通过足量酸性KMnO4溶液、碱石灰 除去C2H6中的C2H4
B 向FeCl2溶液中滴加酸性KMnO4溶液,观察现象 检验溶液中是否含有Fe2+
C 用pH试纸测试CH3COONa溶液和NaClO溶液的pH 比较Ka(CH3COOH)和Ka(HClO)的大小
D 用冰醋酸做导电性实验,电流表指针不偏转 醋酸不是电解质
A.A B.B C.C D.D
15.某氨基酸衍生物AcryMet(简称)的,。常温下构建体系,其中,,体系中含Cu物种分布系数与pH关系如图所示,下列说法正确的是
A.
B.时
C.时,存在
D.后继续增大pH,溶液中的一定继续增大
16.时,用气体调节氨水的,体系中粒子浓度的对数、反应物的物质的量之比与溶液的关系如图所示。若忽略通入气体后溶液体积的变化,下列有关说法错误的是
A.点溶液中:
B.点溶液中:
C.时,的水解平衡常数的数量级为
D.时,
17.一种利用含钴废料(主要成分为,还含有少量等杂质)制备的工艺流程如下。
已知:①常温下,部分金属离子沉淀的如下表:
金属离子
开始沉淀的 8.5 2.2 3.4 7.8
完全沉淀(金属离子)的的 10.0 3.0 4.5 9.4
②的的。
下列说法不正确的是
A.由流程可知氧化性:
B.常温下加入的溶液显碱性
C.气体通入氨水至过量后所得溶液可循环利用
D.“高温焙烧”时的化学方程式:
18.锡在材料、医药、化工等方面有广泛的应用,锡精矿(SnO2)中主要有Fe、S、As、Sb、Pb等杂质元素。下图为锡的冶炼工艺流程:
已知:SnO2性质稳定,难溶于酸。下列说法错误的是
A.焙烧产生的烟尘、烟气中主要杂质元素是S、As、Sb
B.酸浸时,PbO生成,为了提高铅的浸出率,可添加适量NaCl固体
C.的反应2中S元素化合价全部升高
D.电解精炼时,电源的正极与粗锡相连
19.常温下水溶液体系中存在反应:,平衡常数为K。已初始浓度,所有含碳物种的摩尔分数与变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
A.线Ⅱ表示的变化情况
B.的电离平衡常数
C.时,
D.时,
20.室温下,用含少量ZnSO4杂质的1 mol·L 1 MnSO4溶液制备MnCO3的过程如下图所示。下列说法不正确的是
已知:Ksp(MnS)=2×10 10,Ksp(ZnS)=2×10 24,Ka1(H2CO3)=4.5×10 7,Ka2(H2CO3)=4.7×10 11,Kb(NH3·H2O)=1.8×10 5
A.“除锌”反应的平衡常数K=1×1014
B.pH=8的氨水中存在c(NH)=9.9×10 7mol·L 1
C.氨水、NH4HCO3溶液中存在c(NH)<2c(CO)+c(HCO)
D.“沉锰”后的滤液中存在c(NH)+c(NH3·H2O)>2c(SO)
21.常温下,分别在、、溶液中滴加NaOH溶液,溶液pX=-lgX,X代表、、与pH的关系如图所示。
已知:。下列说法不正确的是
A.
B.的数量级为
C.
D.d点存在
22.25℃时,向一定浓度的溶液中滴加NaOH溶液,混合液中随pOH的变化如图所示,下列说法错误的是
已知:①中x表示、、;
②。
A.曲线III表示随pOH的变化关系
B.M点时,
C.当溶液时,
D.的平衡常数为
23.常温下,已知溶液中含磷物质的浓度之和为,溶液中各含磷物质的lgc与pOH的关系如图所示[]。下列说法错误的是
A.曲线②表示随pOH的变化
B.pH=7.22的溶液中:
C.b点时:
D.溶液中:
24.常温下,用浓度为的盐酸滴定浓度均为的和的混合溶液,滴定过程中溶液的随的变化曲线如图所示,下列说法正确的是
A.该温度下,约为
B.水的电离程度:
C.点
D.点
25.以磷石膏(主要成分,杂质、等)和氨水为原料可实现矿物封存同时制备轻质,转化部分流程如图。
,,
,。
下列说法正确的是
A.氨水中存在:
B.“转化”步骤,通入后清液中始终存在
C.“转化”步骤,若通入至溶液为6.5,此时溶液中
D.“滤液”中存在:
26.室温下,用相同浓度的HCl溶液,分别滴定浓度均为0.1mol/L的三种碱(XOH、YOH和ZOH)溶液,滴定曲线如图所示[已知]。
下列判断正确的是
A.三种碱的电离常数关系:
B.滴定至M点时,溶液中:
C.时,三种溶液中:
D.当中和百分数达100%时,将三种溶液混合后:
27.常温下,盐酸分别滴入溶液与溶液中,测得溶液的随滴入盐酸体积变化的图像如图所示。下列说法不正确的是
A.常温下,的电离常数约为
B.水的电离程度;d>c>a>b
C.c点:
D.b、d点溶液混合后为酸性
28.一种制备的工艺路线如图所示,反应所得溶液pH在3~4之间,反应需及时补加以保持反应在条件下进行。常温下,的电离平衡常数,。下列说法正确的是
A.反应、、均为氧化还原反应
B.低温真空蒸发主要目的是防止被氧化
C.溶液Y可循环用于反应所在操作单元吸收气体
D.若产量不变,参与反应的X与物质的量之比增大时,需补加的量增多
29.常温下,用相同物质的量浓度的溶液分别滴定起始物质的量浓度均为的三种酸溶液,滴定曲线如图所示,下列说法正确的是
A.常温下,三种酸的电离常数:
B.滴定至T点时,溶液中:
C.当时,三种酸溶液中HX溶液中和百分数最大
D.当中和百分数达到时,将三种溶液混合后:
30.NaOH溶液滴定20.00mL溶液时,、各含磷元素微粒的和pH的关系如图。下列说法错误的是
A.的
B.水的电离程度:d>c>b>a
C.③为的与pH的关系
D.c点时,溶液中存在
参考答案:
1.A
【分析】往氨水溶液中加入稀硫酸,随着滴加稀硫酸的体积变化,溶液pH的变化由一个突变过程,逐渐与盐酸反应生成氯化铵和水,含量下降为曲线①,的含量逐渐上升为曲线②,曲线③代表溶液的pH。
【详解】A.当滴入硫酸时,得到溶液溶质为和,且此时两者物质的量之比为2:1,由电荷守恒可知,,由物料守恒可知,,则存在,A错误;
B.得到硫酸铵为强酸弱碱盐,溶液酸性,则当溶液呈中性时,稀硫酸稍微不足,滴入硫酸的体积小于,由电荷守恒可知,,故此时溶液中,B正确;
C.由图可知,时,pH=9.26,pOH=4.74,则的,常温下,的水解常数为,C正确;
D.曲线②代表,a点溶液加入硫酸溶液后溶液体积增大,导致,D正确;
故选A。
2.D
【详解】A.向的上述缓冲溶液加水稀释,溶液酸性减弱,减小,水的离子积不变,故增大,故A正确;
B.,则,则常温下,等浓度、等体积的和溶液中,的电离程度大于的水解程度,则溶液显酸性,,又,,则混合溶液的大于4.76,故B正确;
C.根据电荷守恒,A曲线上任意一点的溶液中均存在,则,故C正确;
D.B曲线代表的溶液缓冲能力最大时,pH=4.76,,所以溶液中,根据电荷守恒,溶液呈酸性,则,所以,故D错误;
故选D。
3.D
【分析】随着pH的增大,、浓度减小,、浓度增大,—Cl为吸电子基团,的酸性强于,即),δ(酸分子)=δ(酸根离子)=0.5时的pH分别约为1.3、2.8,则两种酸的电离常数分别为,,由此分析解题。
【详解】A.根据分析,曲线M表示的变化关系,A错误;
B.根据,初始,若溶液中溶质只有,则,但a点对应的,说明此时溶液中加入了酸性更强的酸,根据电荷守恒,,B错误;
C.根据分析,CH2ClCOOH的电离常数Ka=10-2.8,C错误;
D.电离度,,则=,,时,,,D正确;
故答案选D。
4.C
【详解】
A.N2H4的结构式为,分子中不含有π键,A不正确;
B.CH3COOH 为弱酸,在水溶液中发生部分电离,则1L 0.1mol/L CH3COOH溶液含CH3COO-的数目小于0.1 NA,B不正确;
C.14g乙烯中含极性共价键的物质的量为=2mol,14g丙烯中含极性共价键的物质的量为=2mol,则4g乙烯和丙烯的混合气体含有的极性共价键数为2 NA,C正确;
D.Cl2与足量NaOH溶液发生反应时,存在如下关系式:Cl2——e-,则22.4L(标准状况)Cl2(物质的量为1mol)与足量NaOH溶液充分反应,电子转移数为NA,D不正确;
故选C。
5.C
【详解】A.由碳酸氢根离子和碳酸根离子的交点可知,,A正确;
B.初始状态,存在碳酸氢根离子,、时,由图2可知,该点位于曲线Ⅱ的上方,会生成碳酸镁沉淀,因此反应的离子方程式为,B正确;
C.初始状态、,该点位于曲线Ⅱ的上方,部分碳转化为碳酸镁沉淀,由物料守恒可知,平衡后溶液中存在,C错误;
D.由点(8,0.9)可知,此时pH=8,pOH=6,则,的平衡常数,D正确;
故选C。
6.D
【详解】A.,,氨水加水稀释过程中, 减小,逐渐增大,错误;
B.NH4Cl是强酸弱碱盐,溶液中存在:,B错误;
C.等物质的量浓度的NaHCO3溶液和Na2CO3溶液中水的电离程度:前者小于后者,C错误;
D.0.1mol·L-1NaHCO3溶液中:电荷守恒:,物料守恒:,两式相差得,D正确;
故选D。
7.C
【分析】已知:浸出液的金属阳离子只有,则、和C等杂质成为滤渣1的成分,浸出液中氯化钙和二氧化碳、氨气反应生成碳酸钙沉淀和氯化铵,滤液成分为NH4Cl;
【详解】A.加入氯化铵浸出与反应生成氯化钙、水和氨气,氯化钙和二氧化碳、氨气反应生成碳酸钙沉淀和氯化铵,可以循环使用的物质是氨气和氯化铵,故A正确;
B.滤渣2为碳酸钙沉淀,表面附着可溶性氯化铵,加水洗涤、干燥即可得到高纯碳酸钙,系列操作为洗涤和干燥,故B正确;
C.难溶,溶于水的部分能完全电离,属于强电解质,故C错误;
D.已知:浸出液的金属阳离子只有,则滤渣1的成分为、和C,故D正确;
故答案选C。
8.B
【详解】A.由题干信息可知,用1.0mol/L氨水“吸收”SO2时,当即含氮微粒浓度之和等于含硫微粒浓度之和的2倍,该溶液的溶质为(NH4)2SO3,又由于水解Kh=小于的水解Kh1=,即该溶液呈碱性,则有:,A错误;
B.已知H2SO3的Ka1Ka2=,则的吸收液中:=远大于1,即,B正确;
C. 由题干流程图可知,“转化”时,通入后将(NH4)2SO3转化为(NH4)2SO4,结合A项分析可知,溶液由碱性转化为酸性,故溶液减小,C错误;
D.由题干流程图可知,“再生”发生的反应为:Ca(OH)2+(NH4)2SO4=CaSO4+2NH3 H2O,此过程中生成了CaSO4沉淀,故溶液中:,D错误;
故答案为:B。
9.D
【详解】A.直线上,lgc(Ba2+)+pH=1,即=10;难溶物BaR与足量盐酸发生反应BaS+2H+Ba2++H2R,溶液中存在c(Ba2+)≈c(H2R),Ka1 Ka2=,Ksp(BaR)= c(Ba2+) c(R2-)= Ka1 Ka2×=2×10-8×3×10-17×100=6×10-23,A正确;
B.M点,c(H+)=10-0.6mol/L,c(Ba2+)≈c(H2R)=100.4mol/L,c(HR-)===2×10-7mol·L-1,B正确;
C.溶液中溶质为BaCl2、H2R、HCl,Ka1 Ka2=,N点时,c(H+)=10-0.8mol/L,c(Ba2+)≈c(H2R)=100.2mol/L,则c(R2-)==mol/L=6×10-23.2mol/L,c(Cl-)最大,所以N点:c(Cl-)>c(H+)>c(R2-),C正确;
D.直线上任一点均满足电荷守恒c(H+)+2c(Ba2+)=c(OH-)+c(HR-)+2c(R2-)+c(Cl-),所以c(H+)+2c(Ba2+)>c(OH-)+c(HR-)+2c(R2-),D错误;
故选D。
10.C
【详解】A.观察试管内溶液的颜色变化并计时,可以测算高锰酸钾与草酸反应的速率,A正确;
B.进行焰色试验时,通常使用铂丝(或铁丝)作为载体,将蘸有待检测溶液的金属丝置于火焰上灼烧,隔蓝色钴玻璃观察燃烧时火焰的颜色,钾的焰色反应呈紫色,B正确;
C.实验室制氯气可以用二氧化锰与浓盐酸加热反应制得,稀盐酸无法制得,C错误;
D.用电子pH计测量乙酸标准溶液的pH值,根据乙酸电离方程式得出电离平衡常数表达式,可以算得乙酸的电离平衡常数,D正确;
故选C。
11.C
【详解】A.向饱和Na2CO3溶液中滴加几滴硼酸,即使硼酸的酸性比碳酸强,也可能因生成NaHCO3而无气泡,故结论不准确,故A错误;
B.NaOH不足,检验-CHO应在碱性条件下,该实验不能检验Y中是否含-CHO,故B错误;
C.反应后溶液分层,下层呈橙红色,说明氯气与NaBr反应生成溴单质,发生反应:,根据还原剂的还原性大于还原产物的还原性,可知Br-还原性强于Cl-,故C正确;
D.Na2S与硫酸铜直接反应生成CuS沉淀,不发生沉淀的转化,不能比较Ksp,故D错误;
故选D。
12.B
【分析】常温下,溶液中逐滴加入溶液,发生反应:、,存在难溶物溶解平衡及水解平衡:、,根据,则,,,,温度不变,是定值,则随的增大而增大,表示随的变化,代表随的变化关系。
【详解】A.根据上述分析可知,代表随的变化关系,A错误;
B.图中b点是曲线与曲线交点,即代表当时,=,则,B正确;
C.a点在曲线上,代表,即;c点在曲线上,代表,即,根据,溶液中,故和两点溶液中浓度不相等,C错误;
D.b点溶液存在=,即=,根据电荷守恒可知,,故溶液中,D错误;
答案选B。
13.C
【详解】A.加水稀释时,=1,即稀释10倍时,一元强酸的pH增大1,弱酸的pH变化小于1,HX即使为强酸,pH变化也不会大于1,而i对应横坐标1时,pH>4,故i代表HX,又,可知HX的酸性强于HY,则ii代表HX,III代表HY,故A错误;
B.升高温度弱酸和水的电离程度均增大,c(H+)增大,a点pH减小,故B错误;
C.从b→c加水过程,酸浓度减小,c(H+)减小,对水电离的抑制程度减小,水的电离程度增大,故C正确;
D.因酸性HX>HY,则pH相同的两种溶液,HY的浓度大于HX,则等体积的两种酸,HY消耗的NaOH对,反应后溶液中,故D错误;
故选:C。
14.AA
【详解】A.酸性KMnO4溶液能氧化生成,可被碱石灰吸收,A项正确;
B.酸性KMnO4溶液能氧化生成,但同时也能氧化,该方法不能检验溶液中是否含有Fe2+,B项错误;
C.溶液和溶液浓度未知,无法比较Ka(CH3COOH)和Ka(HClO)的大小,C项错误;
D.冰醋酸不导电,但溶于水能导电,醋酸属于电解质,D项错误;
故答案为:A。
15.C
【详解】A.由图可知,溶液pH为6.90时,溶液中(CuHL)+的分布系数为48%,Cu(HL)2的分布系数略大于48%,由电离常数可知,溶液中HL—的浓度为=2.75×104.43mol/L,由方程式可知,反应的平衡常数K=≈2.75×104.43,故A错误;
B.由图可知,溶液pH为4.5时,溶液中[CuHL+]小于0.0125 mol/L,由电离常数可知,溶液中HL—的浓度为=2.75×102.03mol/L,则溶液中HL—的浓度大于[CuHL+],故B错误;
C.由图可知,溶液pH为11时,溶液中存在电荷守恒关系,故C正确;
D.由图可知,溶液pH为12时,[CuL(OH)]—的分布系数接近最大,则续增大pH,溶液中[CuL(OH)]—会转化为氢氧化铜而减小,故D错误;
故选C。
16.C
【详解】A.由图可知,P3点时=1.0,则该溶液的溶质为NH4Cl,根据物料守恒得,c(Cl-)=c(NH3·H2O)+c(),故有c(Cl-)>c(NH3·H2O),A正确;
B.P2点c(H+)=c(OH-),由电荷守恒得c()+c(H+)=c(Cl-)+c(OH-),故c()=c(Cl-),B正确;
C.NH3·H2O的Kb=,根据图可知当lgc()=lgc(NH3·H2O),即c()=c(NH3·H2O)时,溶液pH=9.25,则此时c(OH-)=10-4.75mol/L,所以NH3·H2O的电离平衡常数为10-4.75,的水解常数Kh==10-9.25,数量级为10-10,C错误;
D.=0.5时,溶液相当于等浓度的NH3·H2O和NH4Cl混合,根据元素守恒,c(NH3·H2O)+c()=2c(Cl-),D正确;
故选C。
17.A
【分析】钴废料(主要成分为,还含有少量等杂质)中加硫酸、H2O2酸浸,还原为Co2+,转化为对应硫酸盐,二氧化硅不溶解,滤渣为二氧化硅,滤液中加氨水调溶液的pH,沉淀Al3+、Fe3+,过滤,滤液中加碳酸氢铵沉钴,得CoCO3沉淀,然后碳酸钴和碳酸锂高温焙烧生成。
【详解】A.由流程可知,钴废料(主要成分为,还含有少量等杂质)中加硫酸、H2O2酸浸,被H2O2还原为Co2+,所以氧化性:,故A错误;
B.电离常数:碳酸的,所以水解常数,所以溶液显碱性,故B正确;
C.气体为CO2,通入氨水至过量后所得溶液为溶液,溶液可循环利用,故C正确;
D.“高温焙烧”时,碳酸钴和碳酸锂反应生成,钴元素化合价升高,则有氧气参与,反应的化学方程式:,故D正确;
故答案为:A。
18.C
【分析】锡精矿中主要有Fe、S、As、Sb、Pb等杂质元素,焙烧时Fe、S、As、Sb、Pb杂质元素转化为氧化物,焙烧后加入稀盐酸溶解,由于性质稳定,难溶于酸,过滤得到,再使用焦炭还原得到粗锡,最后电解精炼得到精锡,据此分析解题。
【详解】A.焙烧时Fe、S、As、Sb、Pb杂质元素转化为氧化物,由题可知,加入稀盐酸后的滤液经过处理得到Fe和Pb,所以烟尘、烟气中的主要杂质元素是S、As、Sb,故A正确;
B.酸浸时,PbO生成,离子方程式为,浸出过程中添加氯化钠,可促使氯化铅转化成可溶性的离子,提高其浸出效果,故B正确;
C.PbS与熔融NaOH反应的化学方程式为,S元素化合价只有部分升高,故C错误;
D.电解精炼时,与电源的正极相连的是粗锡,故D正确;
故答案选C。
19.C
【分析】在溶液中存在平衡:CH3COOHCH3COO-+H+(①)、Ag++CH3COO-CH3COOAg(aq)(②),Ag+的水解平衡Ag++H2OAgOH+H+(③),随着pH的增大,c(H+)减小,平衡①③正向移动,c(CH3COOH)、c(Ag+)减小,pH较小时(约小于7.8)CH3COO-浓度增大的影响大于Ag+浓度减小的影响,CH3COOAg浓度增大,pH较大时(约大于7.8)CH3COO-浓度增大的影响小于Ag+浓度减小的影响,CH3COOAg浓度减小,故线Ⅰ表示CH3COOH的摩尔分数随pH变化的关系,线Ⅱ表示CH3COO-的摩尔分数随pH变化的关系,线Ⅲ表示CH3COOAg随pH变化的关系。
【详解】A.根据分析,线Ⅱ表示CH3COO-的变化情况,A项错误;
B.由图可知,当c(CH3COOH)=c(CH3COO-)相等时(即线Ⅰ和线Ⅱ的交点),溶液的pH=m,则CH3COOH的电离平衡常数Ka==10-m,B项错误;
C.pH=n时=10-m,c(CH3COO-)==10n-mc(CH3COOH),Ag++CH3COO-CH3COOAg(aq)的K=,c(Ag+)=,由图可知pH=n时,c(CH3COOH)=c(CH3COOAg),代入整理得c(Ag+)=mol/L,C项正确;
D.根据物料守恒,pH=10时溶液中c(Ag+)+c(CH3COOAg)+c(AgOH)=0.08mol/L,D项错误;
答案选C。
20.C
【分析】含少量ZnSO4杂质的1 mol·L 1 MnSO4溶液加入过量MnS除去锌离子,过滤滤液加入氨水、碳酸氢铵溶液得到MnCO3。
【详解】A.“除锌”反应为,的平衡常数K1×1014,A正确;
B.pH=8则水电离出,pOH=6,溶液中总的,则氨水电离出9.9×10 7mol/L,B正确;
C.氨水、NH4HCO3溶液中根据电荷守恒存在:c(H+)+c(NH)= c(OH-)+2c(CO)+c(HCO),氨水溶液显碱性,则c(H+)
D.“沉锰”后的滤液成分为硫酸铵、氨水、碳酸氢铵,则由物料守恒可知,存在c(NH)+c(NH3·H2O)>2c(SO),D正确;
故选C。
21.C
【分析】Mn(OH)2、Zn(OH2的物质类型相似,二者的pX随pH的变化曲线应是平行线,则曲线ad代表与pH的关系,由图中a点可知可知pX=0时,溶液的pH=3.3,此时=c(H+)=1×10-3.3;已知:,纵坐标值越大表示阳离子浓度越小,可以判断出b所在曲线表示与pH的关系曲线,c所在的曲线表示与pH的关系曲线
【详解】A.由上述分析可知,,A正确;
B.b所在曲线表示,与pH的关系曲线,根据b点的坐标值,此时c(Zn2+)=1×10-6.15,c(OH-)=1×10-5,,数量级为10-17,B正确;
C.c所在曲线表示,与pH的关系曲线,根据c点的坐标值,此时c(Mn2+)=1×101.3,c(OH-)=1×10-7,,的平衡常数,C错误;
D.d点溶液呈中性,电荷守恒等式为:,根据可得,D正确。
故选C。
22.D
【详解】A.溶液中存在、、,且电离程度依次减小,即,当lgx=0时,,即Ka越大,c(H+)越大,c(OH-)越小,pOH越大,则对应的pOH最大,为曲线Ⅲ,由此可得曲线Ⅰ、Ⅱ、Ⅲ分别代表、、随pOH的变化关系,故A正确;
B.M点时,=1,溶液中存在的溶质为Na2HPO4和Na3PO4,则有电荷守恒:,又因为,所以,故B正确;
C.当溶液pH=7,即pOH=7时,由图象可知,,即,故C正确;
D.由图象计算可得,,的平衡常数=,则平衡常数的数量级10-6,故D错误;
故选D。
23.C
【分析】溶液中pOH越小,溶液碱性越强,磷酸溶液中的浓度越大,因此图中曲线①②③④分别表示、、、随pOH的变化。
【详解】A.根据分析可知,曲线②表示随pOH的变化,故A项正确;
B.c点时,pH=2.02,,则的第一级电离平衡常数;b点时,pH=4.62,,则,因此,当溶液中时,,即pH=7.22,故B项正确;
C.溶液中含磷物质的浓度之和为,即,因此;由图可知,b点时,故,则,故C项错误;
D.的电离程度()大于水解程度(),因此溶液显酸性,其溶液中,故D项正确。
答案选C。
24.C
【详解】A.当在x点时,氢氧化钠溶液恰好被盐酸反应,此时氨水的物质的量浓度为,则,A错误;
B.x点溶质为氯化钠和,从x点到z点,氨水浓度不断降低,逐渐变为氯化铵,水的电离程度不断增大,即水的电离程度:,B错误;
C.x点溶质氯化钠和氨水,且两者物质的量浓度之比为,溶液显碱性,其离子浓度,C正确;
D.y点溶质为氯化钠、氯化铵、且三者物质的量浓度之比为,溶液显碱性,则氨水电离程度大于铵根水解程度,且,存在元素质量守恒:,故,D错误;
故选C。
25.C
【详解】A.氨水显碱性,所以电离强度大于水解强度,又因为电离出的还要水解,根据电荷守恒,所以=+,又因为氨水为弱电解质部分电离,则,故,故A项错误;
B.“转化”后的清液中,CaCO3一定达到沉淀溶解平衡,而CaSO4不一定达到沉淀溶解平衡,则,,故B项错误;
C.“转化”步骤,若通入CO2至溶液pH为6.5时,,,则,故C项正确;
D.“转化”步骤 ,“滤液”中粒子有,根据电荷守恒,过滤后所得滤液中一定存在:,故D项错误;
故本题选C。
26.D
【详解】A.由图,起始时三种碱的浓度相同,pOH的大小关系为ZOH>YOH>XOH,pOH越大,c(OH-)越小,即KZOH
C.pOH=7时,溶液c(H+)=c(OH ),弱碱中消耗的盐酸小于强碱消耗的盐酸,碱性越弱氯离子越少,则三种溶液中:c(X+)>c(Y+)>c(Z+),故C错误;
D.当中和百分数达100%时,将三种溶液混合,溶液遵循质子守恒,则c(OH )+c(XOH)+c(YOH)+c(ZOH)=c(H+),即c(XOH)+c(YOH)+c(ZOH)=c(H+) c(OH ),故D正确;
本题选D。
27.C
【分析】氢氧化钠为强碱,和盐酸恰好反应得到氯化钠溶液为中性,则N、M分别为、的滴定曲线;
【详解】A.,的初始pOH=6,则,A正确;
B.酸、碱都会抑制水的电离、等浓度强碱对水的电离抑制作用更大,abcd溶液溶质分别为、NaCl和NaOH、BCl和、BCl,则d点水的电离程度最大、次之c;为弱碱、NaOH为强碱,结合两点pOH可知,a点的水的电离程度大于b点,B正确;
C.c点溶质为等量的BCl和,由电荷守恒可知,,由物料守恒可知,,则,C错误;
D.a点和d点混合,相当于将溶液与溶液,加入30mL盐酸,反应后溶液中含有NaCl、BCl和BOH,溶液的酸碱性应该与c点相同,即呈酸性,D正确;
故选C。
28.C
【分析】铜和浓硫酸反应(反应Ⅰ)生成二氧化硫气体(气体Ⅰ)和硫酸铜,生成的二氧化硫气体与碳酸钠反应(反应Ⅱ),所得溶液pH在3~4之间,溶液显酸性,根据H2SO3的电离平衡常数Ka1=1.3×10-2,Ka2=6.3×10-8,可知NaHSO3溶液显酸性(电离大于水解),则反应Ⅱ所得溶液成分是NaHSO3,调节溶液pH值至11,使NaHSO3转化为Na2SO3,低温真空蒸发(防止Na2SO3被氧化),故固液分离得到Na2SO3晶体和Na2SO3溶液,Na2SO3和CuSO4反应的离子方程式是+2Cu2++2H2O=+Cu2O+4H+,反应过程中酸性越来越强,使Na2SO3转化成SO2气体,总反应方程式是2CuSO4+3Na2SO3=Cu2O+2SO2↑+3Na2SO4,需及时补加NaOH以保持反应在pH=5条件下进行,据此分析解答。
【详解】A.反应Ⅰ是铜和浓硫酸反应,生成二氧化硫,是氧化还原反应,反应Ⅱ是SO2和碳酸钠溶液反应,生成NaHSO3、水和二氧化碳,是非氧化还原反应,反应Ⅲ是Na2SO3和CuSO4反应生成Cu2O,是氧化还原反应,A错误;
B.低温真空蒸发主要目的是防止Na2SO3被氧化,而不是NaHSO3,B错误;
C.经分析溶液Y的成分是Na2SO3溶液,可循环用于反应Ⅱ的操作单元吸收SO2气体(气体Ⅰ),C正确;
D.制取Cu2O总反应方程式是2CuSO4+3Na2SO3=Cu2O+2SO2↑+3Na2SO4,化合物X是指Na2SO3,若Cu2O产量不变,增大比,多的Na2SO3会消耗氢离子,用于控制pH值,可减少NaOH的量,D错误;
故答案为:C。
29.D
【分析】根据图象,常温下,中和百分数为0,也就是没有滴入NaOH溶液时0.1mol/L的HX、HY、HZ的pH由大到小的顺序为:HX>HY>HZ,同温同浓度的HX、HY、HZ电离出H+的能力:HZ>HY>HX,故三种酸的电离平衡常数:。
【详解】A.根据分析,三种酸的电离平衡常数:,故A错误;
B.T点,中和百分数为50%,所得溶液为等物质的量浓度的NaY和HY的混合液,溶液的pH<7,溶液呈酸性,说明HY的电离程度大于的水解程度,根据物料守恒有: ,根据电荷守恒有:,所以溶液中存在:,故B错误;
C.在滴加NaOH过程中,每种溶液中均存在电荷守恒,、、,当时,,此时 、、,那么将浓度相等的三种酸溶液中和至,由于,因此所需要的NaOH的量一定不同,中和百分数也不相等,根据电离常数可知,水解对应产生的酸的酸性越弱,水解程度越大,可知,说明碱性关系为:,由此可知,HX中加入的碱最少才可达到,因此三种酸溶液中HX溶液中和百分数最小,故C错误;
D.当中和百分数达100%时,根据酸碱中和可知此时溶质分别为:NaX、NaY、NaZ,分别有物料守恒为:、、,那么将三种溶液混合后所得溶液中含有的是NaX、NaY、NaZ,此时钠离子浓度为整个溶液中的浓度,因此物料守恒为,电荷守恒不难得出为,两式整理得,故D正确;
故答案选D。
30.D
【分析】根据图中a点,时,溶液中溶质的物质的量之比为,故③④为磷酸和磷酸二氢钠的曲线,又因为随着pH变大,浓度变小,故③为,④为,又因为pH=2.12时,最小,故②为,①为,据此分析回答。
【详解】A.a点,,溶液中溶质为,即,;c点,,即,,,A正确;
B.a点的溶质为,水的电离被抑制,随着NaOH溶液的滴入,酸性减弱,生成可水解的盐,故水的电离逐渐增大,故水的电离程度:d>c>b>a,B正确;
C.由分析知,③为的与pH的关系,C正确;
D.溶液中存在电荷守恒,c点时,Na元素和P元素之间的关系为,则有,从图中信息可知,c点时,联立三个等式,有,此时溶液显碱性,则,D错误;
故选D。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
