2025鲁科版高中化学选择性必修2同步--分层作业16 金属晶体与离子晶体(含解析)
文档属性
| 名称 | 2025鲁科版高中化学选择性必修2同步--分层作业16 金属晶体与离子晶体(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 610.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-27 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025鲁科版高中化学选择性必修2
分层作业16 金属晶体与离子晶体
A级必备知识基础练
题组1.金属晶体
1.金属晶体中金属原子有三种常见的堆积方式,六方最密堆积、面心立方最密堆积和体心立方堆积,如图分别代表着三种晶体的晶体结构,其晶胞内金属原子个数比为( )
A.1∶2∶1 B.11∶8∶4
C.9∶8∶4 D.9∶14∶9
2.下列关于金属晶体的六方最密堆积结构的叙述中,正确的是( )
A.晶胞是六棱柱结构
B.晶胞是平行六面体结构
C.每个晶胞中含有6个原子
D.每个晶胞中含有17个原子
3.下列各组金属熔点高低顺序正确的是( )
A.Mg>Al>Ca B.Al>Na>Li
C.Al>Mg>Ca D.Mg>Ba>Al
4.(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在如图所示的半径相等的圆球的排列中,A属于 层,配位数是 ;B属于 层,配位数是 。
(2)辽宁号航母飞行甲板等都是由铁及其合金制造的。铁有δ、γ、α三种同素异形体,其晶胞结构分别如图所示。
①γ-Fe、δ-Fe晶胞中含有的铁原子数之比为 。
②δ-Fe、α-Fe两种晶体中铁原子的配位数之比为 。
③若α-Fe晶胞的边长为a cm,γ-Fe晶胞的边长为b cm,则两种晶体的密度之比为 。
题组2.离子晶体
5.离子晶体一般不具有的特征是( )
A.熔点较高,硬度较大
B.易溶于水而难溶于有机溶剂
C.固体时不能导电
D.离子间距离较大,其密度较大
6.已知CaF2是离子晶体,如果用“”表示F-,用“”表示Ca2+,在如图所示中,符合CaF2晶体结构的是( )
7.如图为NaCl晶体的一个晶胞,测知氯化钠晶体中相邻的Na+与Cl-的距离为a cm,该晶体密度为d g·cm-3,则阿伏加德罗常数可表示为( )
A. mol-1 B. mol-1
C. mol-1 D. mol-1
8.科学家通过X射线证明,MgO、CaO、NiO、FeO的晶体结构与NaCl的晶体结构相似。
(1)某同学画出的MgO晶胞结构示意图如下图所示,请改正图中的错误: 。
(2)MgO是优良的耐高温材料,MgO的熔点比CaO的高,其原因是 。
B级关键能力提升练
以下选择题中,有1~2个选项符合题意。
9.下列关于CsCl晶体结构的说法不正确的是( )
A.CsCl晶体中,每个Cs+周围吸引8个Cl-
B.CsCl晶体中,每个Cl-周围吸引8个Cs+
C.一个CsCl晶胞中有1个Cs+、1个Cl-
D.CsCl晶体中,Cs+的配位数为6
10.几种离子晶体的晶胞如图所示,下列说法正确的是( )
A.NaCl晶体中阳离子的配位数比CsCl晶体中阳离子的配位数大
B.ZnS晶胞中,Zn2+呈面心立方最密堆积,S2-填充正四面体空隙
C.若ZnS的晶胞边长为a pm,则Zn2+与S2-之间的最近距离为a pm
D.上述三种晶胞中,阴离子的配位数:ZnS11.CaF2晶体的晶胞结构如图所示,其中Ca2+以表示,F-以表示。下列关于该离子晶体的说法正确的是( )
A.CaF2与BaF2的晶体类型相同,CaF2的熔点比BaF2的大
B.CaF2中每个F-周围有4个与它等距且最近的Ca2+
C.每个晶胞中含6个Ca2+
D.每个Ca2+周围有4个与它等距且最近的Ca2+
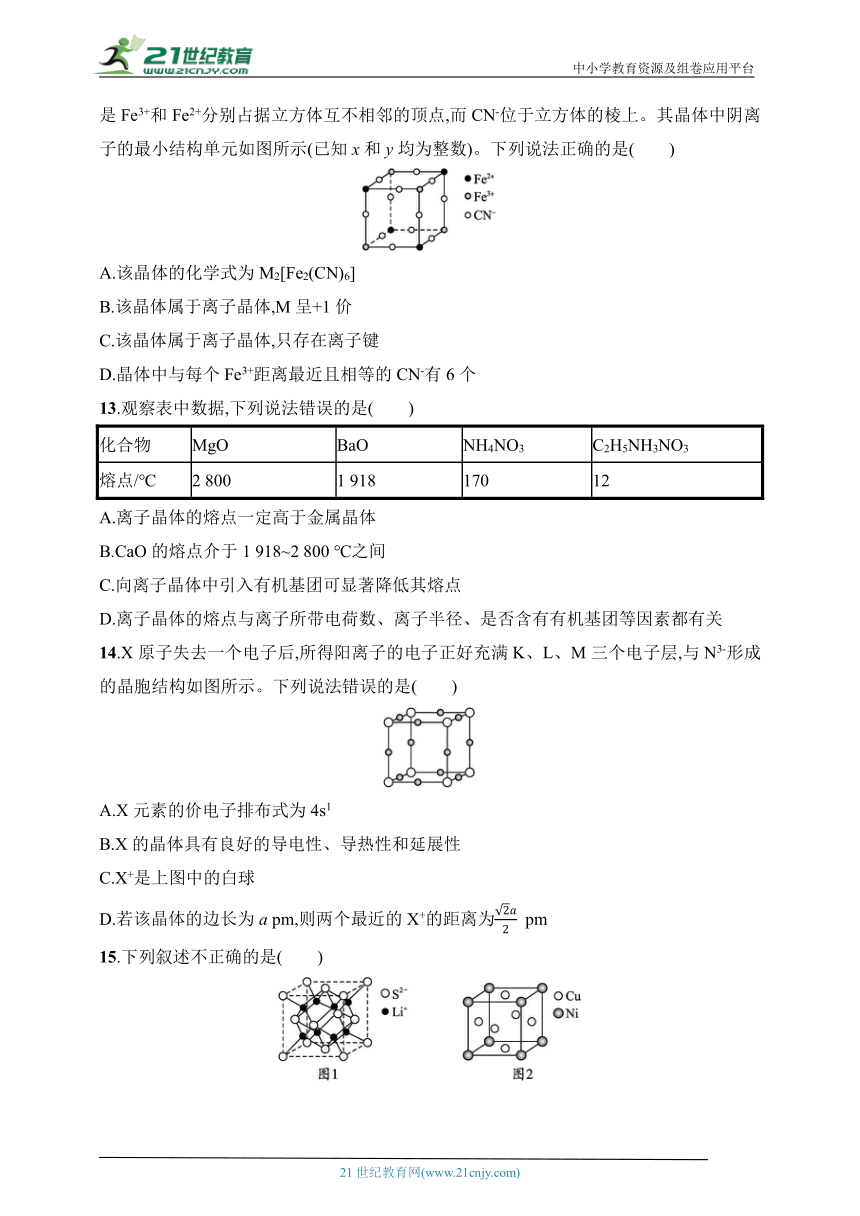
12.有一种蓝色晶体,化学式可表示为Mx[Fey(CN)6],经X射线衍射实验发现,它的结构特征是Fe3+和Fe2+分别占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如图所示(已知x和y均为整数)。下列说法正确的是( )
A.该晶体的化学式为M2[Fe2(CN)6]
B.该晶体属于离子晶体,M呈+1价
C.该晶体属于离子晶体,只存在离子键
D.晶体中与每个Fe3+距离最近且相等的CN-有6个
13.观察表中数据,下列说法错误的是( )
化合物 MgO BaO NH4NO3 C2H5NH3NO3
熔点/℃ 2 800 1 918 170 12
A.离子晶体的熔点一定高于金属晶体
B.CaO的熔点介于1 918~2 800 ℃之间
C.向离子晶体中引入有机基团可显著降低其熔点
D.离子晶体的熔点与离子所带电荷数、离子半径、是否含有有机基团等因素都有关
14.X原子失去一个电子后,所得阳离子的电子正好充满K、L、M三个电子层,与N3-形成的晶胞结构如图所示。下列说法错误的是( )
A.X元素的价电子排布式为4s1
B.X的晶体具有良好的导电性、导热性和延展性
C.X+是上图中的白球
D.若该晶体的边长为a pm,则两个最近的X+的距离为 pm
15.下列叙述不正确的是( )
A.Li2S晶胞结构如图1,S2-的配位数是8
B.某镍白铜合金的立方晶胞结构如图2,距离Ni最近的Cu有12个
C.氯化钠晶胞如图3,Cl-填充在Na+构成的正四面体空隙里
D.铜与氧元素形成的晶胞如图4,晶胞中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(),则d的坐标参数为()
16.(1)元素金(Au)处于周期表中的第6周期,与Cu同族,一种铜金合金晶体的晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数目之比为 ;该晶体中的作用力是 。
(2)某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。
①用A、B、O表示这类特殊晶体的化学式: 。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3 (x<0.1),此时一部分锰转变为+4价,导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为
。
③下列有关说法正确的是 。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧元素的第一电离能比氮元素的第一电离能大
C.锰的电负性为1.59,铬的电负性为1.66,说明锰的金属性比铬强
D.铬的价电子排布与钾相同
17.ZnS、NaCl、CsCl、CaF2分别代表四种常见的离子晶体结构模型,根据图示回答下列问题:
(1)试写出图中三种结构分别对应的化学式:图甲 、图乙 、图丙 。在这三种晶体中,每个阳离子周围的阴离子在空间构成的空间结构分别为 。
(2)在NaCl、CsCl晶体中,每个Cl-的周围与它等距离且最近的Cl-分别有 个、
个。
(3)下图所示是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是 (填字母)。
A.Ⅰ和Ⅲ B.Ⅱ和Ⅲ
C.Ⅰ和Ⅳ D.只有Ⅳ
C级学科素养拔高练
18.钛(Ti)、钒(V)、镍(Ni)、镧(La)等在储氢材料方面具有广泛的用途。如图Ⅰ、Ⅱ是一些晶体材料的结构示意图。
请回答下列问题:
(1)写出基态镍原子的核外电子排布式: 。
(2)镧系合金是稀土系储氢合金的典型代表。某合金储氢后的晶胞如图Ⅰ所示,该合金的化学式为 ,1 mol镧形成的该合金能储存 mol氢气。
(3)“嫦娥三号”卫星上的PTC元件(热敏电阻)的主要成分——钡钛矿晶体的晶胞结构如图Ⅱ所示,该晶体经X射线分析鉴定,重复单元为立方体,边长为a cm。顶点位置被Ti4+所占据,体心位置被Ba2+所占据,所有棱心位置被O2-所占据。
①该晶体中的O元素与H元素形成的简单化合物的中心原子的杂化类型为 ,其分子的空间结构为 。
②写出该晶体的化学式: 。
③若该晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则a= 。
答案:
1.A 解析 根据“切割法”可推知,第一个为六方最密堆积的晶胞,此晶胞中有2个金属原子;第二个为面心立方最密堆积的晶胞,此晶胞中有4个金属原子;第三个为体心立方堆积的晶胞,此晶胞中有2个金属原子。所以原子个数比为2∶4∶2=1∶2∶1。
2.B 解析 金属晶体的六方最密堆积的晶胞是平行六面体结构,每个晶胞中含有的原子数为4×+4×+1=2。
3.C 解析 金属键的强弱决定金属晶体的熔点高低,金属阳离子所带电荷越多,金属阳离子半径越小,金属键越强,金属晶体的熔点越高,金属阳离子所带电荷数: Al3+>Mg2+=Ca2+=Ba2+>Li+=Na+,金属阳离子半径: r(Ba2+)>r(Ca2+)>r(Na+)>r(Mg2+)>r(Al3+)>r(Li+),故C正确。
4.答案 (1)非密置 4 密置 6
(2)①2∶1 ②4∶3 ③b3∶4a3
解析 (1)密置层的排列最紧密,靠得最近,空隙最少,在如图所示的半径相等的圆球的排列中,A中的排布不是最紧密,A属于非密置层,一个中心圆球周围有四个圆球,配位数是4;B中排布是最紧密的结构,B属于密置层,一个中心圆球周围有六个圆球,配位数是6。
(2)①γ-Fe晶胞中,Fe原子位于晶胞的8个顶点和6个面心,则含有的铁原子数为8×+6×=4;δ-Fe晶胞中,Fe原子位于晶胞的8个顶点和1个体心,则含有的铁原子数为8×+1=2。②δ-Fe晶体中铁原子的配位数为8,α-Fe晶体中铁原子的配位数为6,故二者铁原子的配位数之比为8∶6=4∶3。③若α-Fe晶胞的边长为a cm,其晶胞只含1个Fe原子,则晶体的密度为ρα=,若γ-Fe晶胞的边长为b cm,其晶胞中含有4个Fe原子,则晶体的密度为ργ=,则两种晶体的密度之比ρα∶ργ=b3∶4a3。
5.D 解析 离子晶体的结构决定着离子晶体具有一系列特性,这些特性包括A、B、C项所述;离子间的距离取决于离子半径的大小及晶体的密堆积方式等。
6.B 解析 Ca2+占据体心位置,个数为1,F-占据顶点位置,个数为4×,Ca2+和F-个数比为2∶1,A错误;B项正好与A项相反,B正确;Ca2+占据体心位置,个数为1,F-占据顶点位置,个数为8×=1,Ca2+和F-个数比为1∶1,C错误;Ca2+位于体心和棱上,个数为12×+1=4,F-占据顶点和面心位置,个数为8×+6×=4,Ca2+和F-个数比为1∶1,D错误。
7.C 解析 一个NaCl晶胞中含Na+:8×+6×=4个,含Cl-:12×+1=4个,一个NaCl晶胞的体积为V=8a3 cm3,由d g·cm-3×V×NA=4×58.5 g·mol-1,得NA= mol-1。
8.答案 (1)空心球应为O2-,实心球应为Mg2+;8号空心球应改为实心球
(2)Mg2+半径比Ca2+小,MgO的晶格能大
解析 (1)Mg2+的半径小于O2-,故空心球应为O2-,实心球应为Mg2+;图中黑、白球应该交替出现,故8号球应为实心球。
(2)MgO与CaO的离子所带电荷数相同,Mg2+半径比Ca2+小,MgO晶格能大,熔点高。
9.D 解析 CsCl晶胞为体心立方结构,Cs+在体心,Cl-在顶点,每个Cs+周围吸引8个Cl-,A正确;CsCl晶体中,每个Cl-周围吸引8个Cs+,B正确;位于顶点离子的个数为8×=1,位于体心离子的个数为1,C正确;CsCl晶体中,与体心Cs+距离最近且相等的Cl-有8个,Cs+的配位数应为8,D错误。
10.BD 解析 NaCl晶体中阳离子的配位数为6,CsCl晶体中阳离子的配位数为8,A错误;由ZnS晶胞图可知,Zn2+呈面心立方最密堆积,S2-填充在Zn2+围成的正四面体空隙里,B正确;若ZnS的晶胞边长为a pm,则Zn2+与S2-之间的最近距离为体对角线的,即 pm,C错误;ZnS中阴离子配位数为4,NaCl中阴离子配位数为6,CsCl中阴离子配位数为8,D正确。
11.AB 解析 CaF2与BaF2均属于离子晶体,Ca2+和Ba2+所带电荷数相等,且离子半径:Ca2+BaF2,A正确;CaF2中每个F-周围有4个与它等距且最近的Ca2+,B正确;每个晶胞中所含Ca2+数为8×+6×=4,C错误;根据题图,Ca2+位于晶胞的顶点和面心,每个Ca2+周围有12个与它等距且最近的Ca2+,D错误。
12.BD 解析 由题图可得出,晶体中阴离子的最小结构单元中Fe2+及Fe3+个数均为4×,CN-的个数为12×=3,因此阴离子的化学式为[Fe2(CN)6]-,由于x和y均为整数,则该晶体的化学式为M[Fe2(CN)6],A项错误;由阴、阳离子形成的晶体为离子晶体,M的化合价为+1,B项正确;CN-中C、N之间存在共价键,C项错误;由题图可看出与每个Fe3+距离最近且相等的CN-有6个,D项正确。
13.A 解析 离子晶体和金属晶体的熔点都有高有低,离子晶体的熔点不一定都比金属晶体高,故A错误;Mg、Ca、Ba属于同一主族,氧化物同属于离子晶体,Mg2+、Ca2+、Ba2+所带电荷数相同,离子半径大小关系:Mg2+14.AC 解析 X+中所有电子正好充满K、L、M三个电子层,X+的K、L、M层依次排有2、8、18个电子,X+核外有28个电子,X原子核外有29个电子,X为Cu,其价电子排布式为3d104s1,A项错误;Cu属于金属晶体,金属晶体具有良好的导电性、导热性和延展性,B项正确;用“切割法”计算,白球在顶点上:8×=1个,灰球在棱上:12×=3个,根据正负化合价代数和为0,X+与N3-的个数比为3∶1,X+是图中的灰球,C项错误;如图可知,两个相互垂直的棱上的Cu+的距离最近,距离为 pm,D项正确。
15.C 解析 Li+与S2-的个数比为2∶1,则Li+与S2-的配位数之比为1∶2,由Li2S的晶胞结构可知,Li+的配位数为4,S2-的配位数是8,A正确;如图2晶胞为面心立方最密堆积,以任一顶点处的Ni为研究对象,三个相互垂直且交于该顶点的面心上的Cu与它最近,该顶点的Ni为8个晶胞共用,面心上的Cu为两个晶胞共用,根据“切割法”计算与Ni最近的Cu有3×8×=12个,B正确;以体心Cl-为研究对象,在6个面心处的Na+构成正八面体,Cl-填充在Na+构成的正八面体空隙里,C错误;晶胞中Cu均匀地分散在立方体内部,由晶胞可知Cu位于体对角线上、与体心O的距离为体对角线的,a、b的坐标参数依次为(0,0,0)、(),则d的坐标参数为(),D正确。
16.答案 (1)3∶1 金属键
(2)①ABO3 ②(1-x)∶x ③AC
解析 (1)在晶胞中Cu原子处于面心,N(Cu)=6×=3,Au原子处于顶点,N(Au)=8×=1,则该合金中Cu原子与Au原子数目之比为3∶1,金属晶体中的作用力为金属键。
(2)①由题图可知,晶胞中A位于顶点,数目为8×=1,B位于体心,数目为1,O(氧)位于面心,数目为6×=3,则化学式为ABO3;②设La1-xAxMnO3中三价锰与四价锰的物质的量分别为m和n,则有3(1-x)+2x+3m+4n=6,m+n=1,解得m=1-x,n=x,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为(1-x)∶x;③由金属在周期表中的位置可知镧、锰、氧分别位于周期表f、d、p区,A正确;氮元素的2p轨道电子处于半充满状态,稳定性强,因此氮元素的第一电离能大于氧元素的第一电离能,B错误;元素的电负性越大,金属性越弱,C正确;铬的价电子排布式为3d54s1,钾的价电子排布式为4s1,D错误。
17.答案 (1)CsCl NaCl ZnS 立方体、正八面体、正四面体 (2)12 6 (3)C
解析 在ZnS晶体中,阴、阳离子的配位数都是4,故图丙可表示该晶体结构,在Zn2+周围的S2-构成正四面体结构;在NaCl晶体中,每个Na+周围有6个Cl-,每个Cl-周围有6个Na+,故图乙可表示该晶体结构,在Na+周围的6个Cl-形成正八面体,每个Cl-周围与它等距离且最近的Cl-有12个;在CsCl晶体中,每个Cs+周围的8个Cl-形成立方体,图甲可表示该晶体结构,设定图甲中心离子为Cl-,该Cl-周围与它等距离且最近的Cl-位于该立方体前、后、左、右、上、下的6个立方体的体心。(3)根据NaCl和CsCl两种典型离子晶体的结构特点分析图示。图Ⅰ中与黑球最近的白球有6个,图Ⅳ为简单立方结构,故Ⅰ和Ⅳ应表示NaCl的晶体结构。图Ⅱ中与黑球最近的白球有8个,图Ⅲ为体心立方结构,故Ⅱ和Ⅲ应表示CsCl的晶体结构。
18.答案 (1)1s22s22p63s23p63d84s2(或[Ar]3d84s2)
(2)LaNi5 3
(3)①sp3杂化 角形 ②BaTiO3 ③
解析 (1)Ni是28号元素,其基态原子的核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2。
(2)根据某合金储氢后的晶胞结构示意图可知,该晶胞中含有La:8×=1、Ni:8×+1=5,
所以合金的化学式为LaNi5;1 mol该合金吸附氢气的物质的量是8 mol×+2 mol×=3 mol。
(3)①该晶体中的O元素与H元素形成的简单化合物是H2O,中心原子O原子的杂化类型为sp3杂化,其分子空间结构为角形;②根据晶胞结构示意图可知,一个晶胞中Ba2+的数目为1,Ti4+的数目为8×=1,O2-的数目为12×=3,所以该晶体的化学式是BaTiO3;③由于晶胞为立方体,边长为a cm,1 mol晶胞中含有1 mol BaTiO3,若该晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则根据晶体的密度ρ= g·cm-3,可得a=。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025鲁科版高中化学选择性必修2
分层作业16 金属晶体与离子晶体
A级必备知识基础练
题组1.金属晶体
1.金属晶体中金属原子有三种常见的堆积方式,六方最密堆积、面心立方最密堆积和体心立方堆积,如图分别代表着三种晶体的晶体结构,其晶胞内金属原子个数比为( )
A.1∶2∶1 B.11∶8∶4
C.9∶8∶4 D.9∶14∶9
2.下列关于金属晶体的六方最密堆积结构的叙述中,正确的是( )
A.晶胞是六棱柱结构
B.晶胞是平行六面体结构
C.每个晶胞中含有6个原子
D.每个晶胞中含有17个原子
3.下列各组金属熔点高低顺序正确的是( )
A.Mg>Al>Ca B.Al>Na>Li
C.Al>Mg>Ca D.Mg>Ba>Al
4.(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在如图所示的半径相等的圆球的排列中,A属于 层,配位数是 ;B属于 层,配位数是 。
(2)辽宁号航母飞行甲板等都是由铁及其合金制造的。铁有δ、γ、α三种同素异形体,其晶胞结构分别如图所示。
①γ-Fe、δ-Fe晶胞中含有的铁原子数之比为 。
②δ-Fe、α-Fe两种晶体中铁原子的配位数之比为 。
③若α-Fe晶胞的边长为a cm,γ-Fe晶胞的边长为b cm,则两种晶体的密度之比为 。
题组2.离子晶体
5.离子晶体一般不具有的特征是( )
A.熔点较高,硬度较大
B.易溶于水而难溶于有机溶剂
C.固体时不能导电
D.离子间距离较大,其密度较大
6.已知CaF2是离子晶体,如果用“”表示F-,用“”表示Ca2+,在如图所示中,符合CaF2晶体结构的是( )
7.如图为NaCl晶体的一个晶胞,测知氯化钠晶体中相邻的Na+与Cl-的距离为a cm,该晶体密度为d g·cm-3,则阿伏加德罗常数可表示为( )
A. mol-1 B. mol-1
C. mol-1 D. mol-1
8.科学家通过X射线证明,MgO、CaO、NiO、FeO的晶体结构与NaCl的晶体结构相似。
(1)某同学画出的MgO晶胞结构示意图如下图所示,请改正图中的错误: 。
(2)MgO是优良的耐高温材料,MgO的熔点比CaO的高,其原因是 。
B级关键能力提升练
以下选择题中,有1~2个选项符合题意。
9.下列关于CsCl晶体结构的说法不正确的是( )
A.CsCl晶体中,每个Cs+周围吸引8个Cl-
B.CsCl晶体中,每个Cl-周围吸引8个Cs+
C.一个CsCl晶胞中有1个Cs+、1个Cl-
D.CsCl晶体中,Cs+的配位数为6
10.几种离子晶体的晶胞如图所示,下列说法正确的是( )
A.NaCl晶体中阳离子的配位数比CsCl晶体中阳离子的配位数大
B.ZnS晶胞中,Zn2+呈面心立方最密堆积,S2-填充正四面体空隙
C.若ZnS的晶胞边长为a pm,则Zn2+与S2-之间的最近距离为a pm
D.上述三种晶胞中,阴离子的配位数:ZnS
A.CaF2与BaF2的晶体类型相同,CaF2的熔点比BaF2的大
B.CaF2中每个F-周围有4个与它等距且最近的Ca2+
C.每个晶胞中含6个Ca2+
D.每个Ca2+周围有4个与它等距且最近的Ca2+
12.有一种蓝色晶体,化学式可表示为Mx[Fey(CN)6],经X射线衍射实验发现,它的结构特征是Fe3+和Fe2+分别占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如图所示(已知x和y均为整数)。下列说法正确的是( )
A.该晶体的化学式为M2[Fe2(CN)6]
B.该晶体属于离子晶体,M呈+1价
C.该晶体属于离子晶体,只存在离子键
D.晶体中与每个Fe3+距离最近且相等的CN-有6个
13.观察表中数据,下列说法错误的是( )
化合物 MgO BaO NH4NO3 C2H5NH3NO3
熔点/℃ 2 800 1 918 170 12
A.离子晶体的熔点一定高于金属晶体
B.CaO的熔点介于1 918~2 800 ℃之间
C.向离子晶体中引入有机基团可显著降低其熔点
D.离子晶体的熔点与离子所带电荷数、离子半径、是否含有有机基团等因素都有关
14.X原子失去一个电子后,所得阳离子的电子正好充满K、L、M三个电子层,与N3-形成的晶胞结构如图所示。下列说法错误的是( )
A.X元素的价电子排布式为4s1
B.X的晶体具有良好的导电性、导热性和延展性
C.X+是上图中的白球
D.若该晶体的边长为a pm,则两个最近的X+的距离为 pm
15.下列叙述不正确的是( )
A.Li2S晶胞结构如图1,S2-的配位数是8
B.某镍白铜合金的立方晶胞结构如图2,距离Ni最近的Cu有12个
C.氯化钠晶胞如图3,Cl-填充在Na+构成的正四面体空隙里
D.铜与氧元素形成的晶胞如图4,晶胞中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(),则d的坐标参数为()
16.(1)元素金(Au)处于周期表中的第6周期,与Cu同族,一种铜金合金晶体的晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数目之比为 ;该晶体中的作用力是 。
(2)某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。
①用A、B、O表示这类特殊晶体的化学式: 。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3 (x<0.1),此时一部分锰转变为+4价,导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为
。
③下列有关说法正确的是 。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧元素的第一电离能比氮元素的第一电离能大
C.锰的电负性为1.59,铬的电负性为1.66,说明锰的金属性比铬强
D.铬的价电子排布与钾相同
17.ZnS、NaCl、CsCl、CaF2分别代表四种常见的离子晶体结构模型,根据图示回答下列问题:
(1)试写出图中三种结构分别对应的化学式:图甲 、图乙 、图丙 。在这三种晶体中,每个阳离子周围的阴离子在空间构成的空间结构分别为 。
(2)在NaCl、CsCl晶体中,每个Cl-的周围与它等距离且最近的Cl-分别有 个、
个。
(3)下图所示是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是 (填字母)。
A.Ⅰ和Ⅲ B.Ⅱ和Ⅲ
C.Ⅰ和Ⅳ D.只有Ⅳ
C级学科素养拔高练
18.钛(Ti)、钒(V)、镍(Ni)、镧(La)等在储氢材料方面具有广泛的用途。如图Ⅰ、Ⅱ是一些晶体材料的结构示意图。
请回答下列问题:
(1)写出基态镍原子的核外电子排布式: 。
(2)镧系合金是稀土系储氢合金的典型代表。某合金储氢后的晶胞如图Ⅰ所示,该合金的化学式为 ,1 mol镧形成的该合金能储存 mol氢气。
(3)“嫦娥三号”卫星上的PTC元件(热敏电阻)的主要成分——钡钛矿晶体的晶胞结构如图Ⅱ所示,该晶体经X射线分析鉴定,重复单元为立方体,边长为a cm。顶点位置被Ti4+所占据,体心位置被Ba2+所占据,所有棱心位置被O2-所占据。
①该晶体中的O元素与H元素形成的简单化合物的中心原子的杂化类型为 ,其分子的空间结构为 。
②写出该晶体的化学式: 。
③若该晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则a= 。
答案:
1.A 解析 根据“切割法”可推知,第一个为六方最密堆积的晶胞,此晶胞中有2个金属原子;第二个为面心立方最密堆积的晶胞,此晶胞中有4个金属原子;第三个为体心立方堆积的晶胞,此晶胞中有2个金属原子。所以原子个数比为2∶4∶2=1∶2∶1。
2.B 解析 金属晶体的六方最密堆积的晶胞是平行六面体结构,每个晶胞中含有的原子数为4×+4×+1=2。
3.C 解析 金属键的强弱决定金属晶体的熔点高低,金属阳离子所带电荷越多,金属阳离子半径越小,金属键越强,金属晶体的熔点越高,金属阳离子所带电荷数: Al3+>Mg2+=Ca2+=Ba2+>Li+=Na+,金属阳离子半径: r(Ba2+)>r(Ca2+)>r(Na+)>r(Mg2+)>r(Al3+)>r(Li+),故C正确。
4.答案 (1)非密置 4 密置 6
(2)①2∶1 ②4∶3 ③b3∶4a3
解析 (1)密置层的排列最紧密,靠得最近,空隙最少,在如图所示的半径相等的圆球的排列中,A中的排布不是最紧密,A属于非密置层,一个中心圆球周围有四个圆球,配位数是4;B中排布是最紧密的结构,B属于密置层,一个中心圆球周围有六个圆球,配位数是6。
(2)①γ-Fe晶胞中,Fe原子位于晶胞的8个顶点和6个面心,则含有的铁原子数为8×+6×=4;δ-Fe晶胞中,Fe原子位于晶胞的8个顶点和1个体心,则含有的铁原子数为8×+1=2。②δ-Fe晶体中铁原子的配位数为8,α-Fe晶体中铁原子的配位数为6,故二者铁原子的配位数之比为8∶6=4∶3。③若α-Fe晶胞的边长为a cm,其晶胞只含1个Fe原子,则晶体的密度为ρα=,若γ-Fe晶胞的边长为b cm,其晶胞中含有4个Fe原子,则晶体的密度为ργ=,则两种晶体的密度之比ρα∶ργ=b3∶4a3。
5.D 解析 离子晶体的结构决定着离子晶体具有一系列特性,这些特性包括A、B、C项所述;离子间的距离取决于离子半径的大小及晶体的密堆积方式等。
6.B 解析 Ca2+占据体心位置,个数为1,F-占据顶点位置,个数为4×,Ca2+和F-个数比为2∶1,A错误;B项正好与A项相反,B正确;Ca2+占据体心位置,个数为1,F-占据顶点位置,个数为8×=1,Ca2+和F-个数比为1∶1,C错误;Ca2+位于体心和棱上,个数为12×+1=4,F-占据顶点和面心位置,个数为8×+6×=4,Ca2+和F-个数比为1∶1,D错误。
7.C 解析 一个NaCl晶胞中含Na+:8×+6×=4个,含Cl-:12×+1=4个,一个NaCl晶胞的体积为V=8a3 cm3,由d g·cm-3×V×NA=4×58.5 g·mol-1,得NA= mol-1。
8.答案 (1)空心球应为O2-,实心球应为Mg2+;8号空心球应改为实心球
(2)Mg2+半径比Ca2+小,MgO的晶格能大
解析 (1)Mg2+的半径小于O2-,故空心球应为O2-,实心球应为Mg2+;图中黑、白球应该交替出现,故8号球应为实心球。
(2)MgO与CaO的离子所带电荷数相同,Mg2+半径比Ca2+小,MgO晶格能大,熔点高。
9.D 解析 CsCl晶胞为体心立方结构,Cs+在体心,Cl-在顶点,每个Cs+周围吸引8个Cl-,A正确;CsCl晶体中,每个Cl-周围吸引8个Cs+,B正确;位于顶点离子的个数为8×=1,位于体心离子的个数为1,C正确;CsCl晶体中,与体心Cs+距离最近且相等的Cl-有8个,Cs+的配位数应为8,D错误。
10.BD 解析 NaCl晶体中阳离子的配位数为6,CsCl晶体中阳离子的配位数为8,A错误;由ZnS晶胞图可知,Zn2+呈面心立方最密堆积,S2-填充在Zn2+围成的正四面体空隙里,B正确;若ZnS的晶胞边长为a pm,则Zn2+与S2-之间的最近距离为体对角线的,即 pm,C错误;ZnS中阴离子配位数为4,NaCl中阴离子配位数为6,CsCl中阴离子配位数为8,D正确。
11.AB 解析 CaF2与BaF2均属于离子晶体,Ca2+和Ba2+所带电荷数相等,且离子半径:Ca2+
12.BD 解析 由题图可得出,晶体中阴离子的最小结构单元中Fe2+及Fe3+个数均为4×,CN-的个数为12×=3,因此阴离子的化学式为[Fe2(CN)6]-,由于x和y均为整数,则该晶体的化学式为M[Fe2(CN)6],A项错误;由阴、阳离子形成的晶体为离子晶体,M的化合价为+1,B项正确;CN-中C、N之间存在共价键,C项错误;由题图可看出与每个Fe3+距离最近且相等的CN-有6个,D项正确。
13.A 解析 离子晶体和金属晶体的熔点都有高有低,离子晶体的熔点不一定都比金属晶体高,故A错误;Mg、Ca、Ba属于同一主族,氧化物同属于离子晶体,Mg2+、Ca2+、Ba2+所带电荷数相同,离子半径大小关系:Mg2+
15.C 解析 Li+与S2-的个数比为2∶1,则Li+与S2-的配位数之比为1∶2,由Li2S的晶胞结构可知,Li+的配位数为4,S2-的配位数是8,A正确;如图2晶胞为面心立方最密堆积,以任一顶点处的Ni为研究对象,三个相互垂直且交于该顶点的面心上的Cu与它最近,该顶点的Ni为8个晶胞共用,面心上的Cu为两个晶胞共用,根据“切割法”计算与Ni最近的Cu有3×8×=12个,B正确;以体心Cl-为研究对象,在6个面心处的Na+构成正八面体,Cl-填充在Na+构成的正八面体空隙里,C错误;晶胞中Cu均匀地分散在立方体内部,由晶胞可知Cu位于体对角线上、与体心O的距离为体对角线的,a、b的坐标参数依次为(0,0,0)、(),则d的坐标参数为(),D正确。
16.答案 (1)3∶1 金属键
(2)①ABO3 ②(1-x)∶x ③AC
解析 (1)在晶胞中Cu原子处于面心,N(Cu)=6×=3,Au原子处于顶点,N(Au)=8×=1,则该合金中Cu原子与Au原子数目之比为3∶1,金属晶体中的作用力为金属键。
(2)①由题图可知,晶胞中A位于顶点,数目为8×=1,B位于体心,数目为1,O(氧)位于面心,数目为6×=3,则化学式为ABO3;②设La1-xAxMnO3中三价锰与四价锰的物质的量分别为m和n,则有3(1-x)+2x+3m+4n=6,m+n=1,解得m=1-x,n=x,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为(1-x)∶x;③由金属在周期表中的位置可知镧、锰、氧分别位于周期表f、d、p区,A正确;氮元素的2p轨道电子处于半充满状态,稳定性强,因此氮元素的第一电离能大于氧元素的第一电离能,B错误;元素的电负性越大,金属性越弱,C正确;铬的价电子排布式为3d54s1,钾的价电子排布式为4s1,D错误。
17.答案 (1)CsCl NaCl ZnS 立方体、正八面体、正四面体 (2)12 6 (3)C
解析 在ZnS晶体中,阴、阳离子的配位数都是4,故图丙可表示该晶体结构,在Zn2+周围的S2-构成正四面体结构;在NaCl晶体中,每个Na+周围有6个Cl-,每个Cl-周围有6个Na+,故图乙可表示该晶体结构,在Na+周围的6个Cl-形成正八面体,每个Cl-周围与它等距离且最近的Cl-有12个;在CsCl晶体中,每个Cs+周围的8个Cl-形成立方体,图甲可表示该晶体结构,设定图甲中心离子为Cl-,该Cl-周围与它等距离且最近的Cl-位于该立方体前、后、左、右、上、下的6个立方体的体心。(3)根据NaCl和CsCl两种典型离子晶体的结构特点分析图示。图Ⅰ中与黑球最近的白球有6个,图Ⅳ为简单立方结构,故Ⅰ和Ⅳ应表示NaCl的晶体结构。图Ⅱ中与黑球最近的白球有8个,图Ⅲ为体心立方结构,故Ⅱ和Ⅲ应表示CsCl的晶体结构。
18.答案 (1)1s22s22p63s23p63d84s2(或[Ar]3d84s2)
(2)LaNi5 3
(3)①sp3杂化 角形 ②BaTiO3 ③
解析 (1)Ni是28号元素,其基态原子的核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2。
(2)根据某合金储氢后的晶胞结构示意图可知,该晶胞中含有La:8×=1、Ni:8×+1=5,
所以合金的化学式为LaNi5;1 mol该合金吸附氢气的物质的量是8 mol×+2 mol×=3 mol。
(3)①该晶体中的O元素与H元素形成的简单化合物是H2O,中心原子O原子的杂化类型为sp3杂化,其分子空间结构为角形;②根据晶胞结构示意图可知,一个晶胞中Ba2+的数目为1,Ti4+的数目为8×=1,O2-的数目为12×=3,所以该晶体的化学式是BaTiO3;③由于晶胞为立方体,边长为a cm,1 mol晶胞中含有1 mol BaTiO3,若该晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则根据晶体的密度ρ= g·cm-3,可得a=。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
