2.2.1化学平衡状态 课件(共25张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2.1化学平衡状态 课件(共25张ppt)化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 12.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-27 07:36:33 | ||
图片预览







文档简介
(共25张PPT)
第二节 化学平衡
第1课时 化学平衡状态
人教版(2019版) 选择性必修1《化学反应原理》
第二章 化学反应速率与化学平衡
1.从可逆反应化学平衡状态的建立过程,认识化学平衡是一种动态平衡。
2.熟知化学平衡状态的特征,建立化学平衡状态判断方法的思维模型。
核心素养发展目标
学习目标
教学重点:化学平衡状态的建立。
教学难点:化学平衡状态的判断。
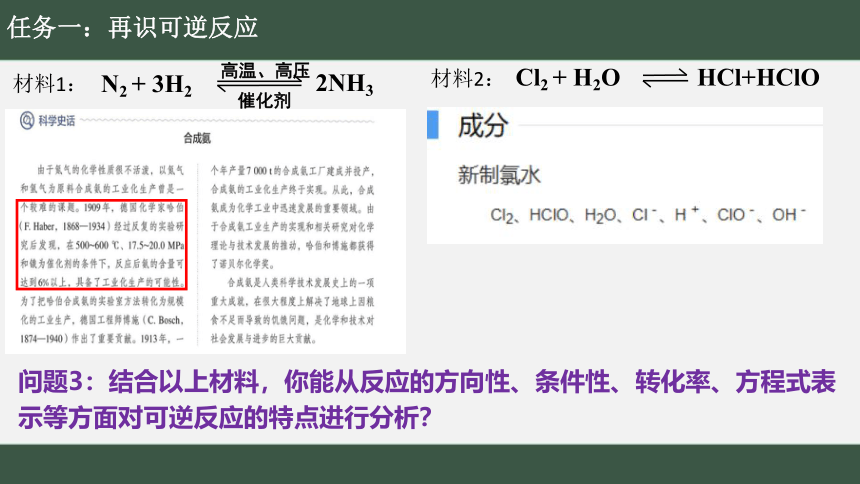
1918年,德国化学家弗里茨·哈伯,“由于从单质合成氨的研究”获奖。
1931年,德国化学家卡尔·博施“由于他发明和发展化学合成氨高压技术”获奖。
2007年,德国化学家格哈德·埃特尔“由于他对固体表面化学合成氨反应的研究”
获奖。
合成氨领域有三位科学家获得诺贝尔化学奖
情境导入:“从空气中制造面包的圣人”。
工业合成氨
自1784年氨被发现以来,人们一直在研究如何利用化学方法由氮气和氢气合成氨,直到1913年才实现了合成氨的工业化生产。化学反应N2(g)+3H2(g) 2NH3(g)看起来十分简单,合成氨的工业化生产却经历了漫长的发展过程。
化工生产中,我们需要考虑哪些因素呢?
——化学反应进行的限度
使原料尽可能快地转化为产品
使原料尽可能多地转化为产品
——化学反应速率
(即化学平衡)
情境导入:“从空气中制造面包的圣人”。
任务一:再识可逆反应
25℃时,合成氨反应的热化学方程式为:
N2 (g) +3H2 (g) 2NH3 (g) △H= - 92.4kJ/mol
在该温度时,取1mol N2和3mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总小于92.4kJ。其原因是_______________________________________________________________________________________
该反应是可逆反应,1 mol N2和3 mol H2不能完全化合生成2 mol NH3,所以反应放出的热量总是小于92.4 kJ。
反应物的转化率不能达到100%
Ag++Cl-=AgCl
2Mg+O2====2MgO
点燃
对于以上反应,我们在进行化学计算时,从未关心过反应能否进行彻底的问题,即限度问题。某种反应物会“消耗殆尽”。它们不存在限度,即反应能进行彻底。
2Na+2H2O=2NaOH+H2↑
任务一:再识可逆反应
任务一:再识可逆反应
一、可逆反应:在相同条件下,能向正反应方向进行同时又能向逆反应方向进行的反应称为可逆反应。
2NH3
N2 + 3H2
催化剂
高温、高压
正反应
逆反应
2Na+2H2O=2NaOH+H2↑
问题1:对比以上两类反应,你认为什么样的反应是可逆反应?
问题2:2H2+O2 2H2O 与 2H2O 2H2↑+O2↑互为可逆反应吗?
正反应
2NH3
N2 + 3H2
催化剂
高温、高压
HCl+HClO
Cl2 + H2O
任务一:再识可逆反应
材料1:
材料2:
问题3:结合以上材料,你能从反应的方向性、条件性、转化率、方程式表示等方面对可逆反应的特点进行分析?
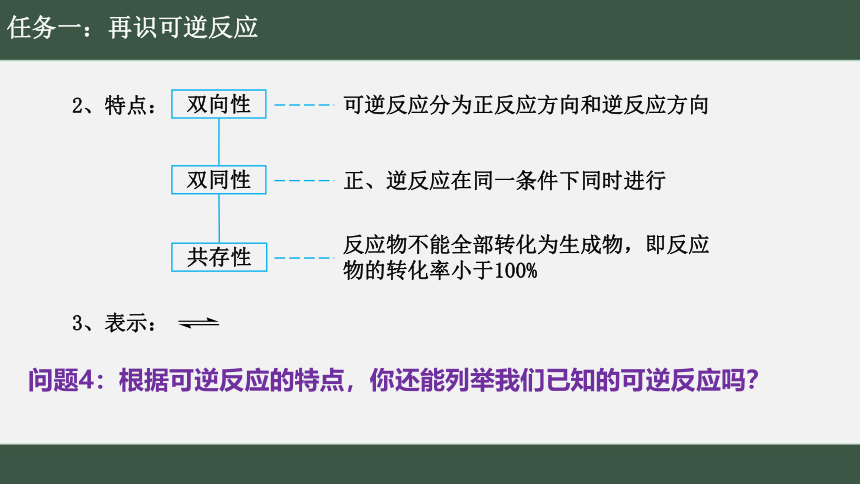
2、特点:
3、表示:
双向性
可逆反应分为正反应方向和逆反应方向
双同性
正、逆反应在同一条件下同时进行
共存性
反应物不能全部转化为生成物,即反应物的转化率小于100%
任务一:再识可逆反应
问题4:根据可逆反应的特点,你还能列举我们已知的可逆反应吗?
回顾常见的可逆反应:
2SO3
2SO2 + O2
△
催化剂
2NH3
N2 + 3H2
催化剂
高温、高压
2HI
H2 + I2
H2CO3
CO2 + H2O
H2SO3
SO2 + H2O
NH3.H2O
NH3 + H2O
HCl+HClO
Cl2 + H2O
N2O4
2NO2
任务一:再识可逆反应
B
D
评价任务1:再识可逆反应
在一定条件下的容积不变的密闭容器中:
【思考4】请根据图示分析速率的变化,并画出v-t图像。
任务二:图解化学平衡状态
正向建立
逆向建立
正向建立
逆向建立
v-t图
v-t图
任务二:图解化学平衡状态
【交流与讨论】工业合成氨。在一定条件下,在密闭容器中加1molN2和3mol H2发生反应:
(1)反应刚开始时:
反应物浓度————,正反应速率———— ,
生成物浓度为———,逆反应速率为——。
(2)反应过程中:
反应物浓度——————,正反应速率——————— ,
生成物浓度——————,逆反应速率———————
最大
最大
0
0
逐渐减小
逐渐减小
逐渐增大
逐渐增大
任务二:深研化学平衡状态
(3)反应进行到什么时候会“停止”?
v(正)=v(逆)≠ 0
(4)此时,反应物和生成物浓度如何变化?
(5)反应真的停止了吗?
不再改变
不是
处于动态平衡
任务二:图解化学平衡状态
任务二:图解化学平衡状态
二、化学平衡:在一定条件下的可逆反应体系中,当正、逆反应的速率相等时,反应物和生成物的浓度均保持不变,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了“限度”,这时的状态称之为化学平衡状态,简称化学平衡。
标志
本质
【思考2】请根据合成氨c-t图和v-t图分析化学平衡状态的特征?
任务二:图解化学平衡状态
条件改变,原平衡被破坏,发生移动,在新的条件下
建立新的化学平衡
v(正)= v(逆)
动
动态平衡,v(正)= v(逆) ≠0
定
条件一定,平衡混合物中各物质的浓度一定(不是相等)
变
【交流讨论】这几个特征中,哪几个可作为化学平衡状态的判断标志?
研究对象为可逆反应
逆
等
任务三:深研化学平衡状态
①同一物质:生成速率=消耗速率,即v正(A)=v逆(A)。
②不同物质:符合:bv正(A)=av逆(B)
正逆相等
同一个物质,消耗速率(量)等于生成速率(量)
③反应物与生成物在单位时间物质的量、质量、化学键的断裂和生成等的变化也能体现速率。
如:aA (g) +bB (g) cC (g)
1、直接依据 —— 根据速率关系
√
×
任务三:深研化学平衡状态
2、间接依据——根据各组分的量
首先分析该量是“变量”还是“恒量”,如为“恒量”,即随反应的进行永远不变,则不能作为判断平衡状态的依据;如为“变量”,即该量随反应进行而改变,当其“不变”时,则为平衡状态。
(1)各组分的质量、物质的量、物质的量浓度(或颜色)、质量分数、转化率、绝热容器温度等不随时间的延长而改变(一定可以)。
(2)混合气体的总压强、总体积、总物质的量、混合气体的密度、平均摩尔质量不随时间的延长而改变(具体情况具体分析)。
变量不变
从反应开始到平衡之前始终变化,平衡后不再变
任务三:深研化学平衡状态
这些都不是某一种物质的数据,而是所有气体的整体量。
对于这三个量,若反应为等体反应,不能作为判断依据,若反应为非等体反应,则可以作为判断依据。
第一类:气体的总物质的量n、体积V、压强P ,要具体分析:
A(g) + B(g) 2C(g)
A(g) + B(g) C(g)
气体的总物质的量n
恒温恒容时的压强P
减少
不变
不变
减少
不变
减少
恒温恒压时的体积V
等体反应
缩体反应
恒容时,凡是有固体参与的气体反应,其气体密度都会变,此时ρ是变量,可以作为判断依据。
第二类:恒温恒容时,气体的密度ρ 不再变化时,要具体分析
ρ=
m总
v
不会变
气体质量增加,ρ是变量,可以作为判断依据。
对于反应:A(s)+B(g) C(g)
mA+m B= mC (质量守恒)
找固体,若方程式中有固体,则气体总质量会变化
对于反应:A(g)+B(g) C(g)
质量守恒,气体质量不变,
ρ是不变量,不能作为判断依据。
任务三:深研化学平衡状态
找非气体
看气体系数
第三类:混合气体的平均摩尔质量M,不再变化时,要具体分析
M=
m总
n总
分子、分母只要有一个是变量,
M即可作为判断平衡的依据
A(g)+B(g) 2C(g)
A(g)+B(g) C(g)
A(s)+B(g) C(g)
m总
n总
M
不变
不变
不变
不变
变
变
变
变
不变
等体反应
缩体反应
有固体参加的等体反应
任务三:深研化学平衡状态
3.一定条件下,下列方法能证明可逆反应N2+3H2 2NH3,一定达到平衡状态的是________________________。
(1)温度和体积一定时,N2的浓度不再变化;
(2)c(N2)∶c(H2)∶c(NH3)=1∶3∶2;
(3)NH3的物质的量不再变化;
(4)N2的体积分数与NH3的相等;
(5)温度和体积一定时,混合气体的总压强不再变化;
(6)温度和压强一定时,混合气体的总体积不再变化;
(7)混合气体的平均摩尔质量不再变化;
(8)温度和体积一定时,混合气体的密度不再变化。
(1)(3)(5)(6)(7)
【学习任务2】化学平衡状态的判断
动态标志
静态标志
ν (正) = ν (逆)
≠0
变量不变
同一物质: ν生成(A) = ν消耗(A)
不同物质: v正(A) : v逆(B) = 化学计量数之比
① 各物质的 m 、n 或 c 不变
② 各物质的百分含量不变
(物质的量分数、质量分数、转化率、产率等)
③ 颜色、温度(绝热体系)不再改变
“正逆相等,变量不变”
课堂小结
化
学
平
衡
思考:如何从定量的角度来判断可逆反应达到平衡状态呢?
再见
第二节 化学平衡
第1课时 化学平衡状态
人教版(2019版) 选择性必修1《化学反应原理》
第二章 化学反应速率与化学平衡
1.从可逆反应化学平衡状态的建立过程,认识化学平衡是一种动态平衡。
2.熟知化学平衡状态的特征,建立化学平衡状态判断方法的思维模型。
核心素养发展目标
学习目标
教学重点:化学平衡状态的建立。
教学难点:化学平衡状态的判断。
1918年,德国化学家弗里茨·哈伯,“由于从单质合成氨的研究”获奖。
1931年,德国化学家卡尔·博施“由于他发明和发展化学合成氨高压技术”获奖。
2007年,德国化学家格哈德·埃特尔“由于他对固体表面化学合成氨反应的研究”
获奖。
合成氨领域有三位科学家获得诺贝尔化学奖
情境导入:“从空气中制造面包的圣人”。
工业合成氨
自1784年氨被发现以来,人们一直在研究如何利用化学方法由氮气和氢气合成氨,直到1913年才实现了合成氨的工业化生产。化学反应N2(g)+3H2(g) 2NH3(g)看起来十分简单,合成氨的工业化生产却经历了漫长的发展过程。
化工生产中,我们需要考虑哪些因素呢?
——化学反应进行的限度
使原料尽可能快地转化为产品
使原料尽可能多地转化为产品
——化学反应速率
(即化学平衡)
情境导入:“从空气中制造面包的圣人”。
任务一:再识可逆反应
25℃时,合成氨反应的热化学方程式为:
N2 (g) +3H2 (g) 2NH3 (g) △H= - 92.4kJ/mol
在该温度时,取1mol N2和3mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总小于92.4kJ。其原因是_______________________________________________________________________________________
该反应是可逆反应,1 mol N2和3 mol H2不能完全化合生成2 mol NH3,所以反应放出的热量总是小于92.4 kJ。
反应物的转化率不能达到100%
Ag++Cl-=AgCl
2Mg+O2====2MgO
点燃
对于以上反应,我们在进行化学计算时,从未关心过反应能否进行彻底的问题,即限度问题。某种反应物会“消耗殆尽”。它们不存在限度,即反应能进行彻底。
2Na+2H2O=2NaOH+H2↑
任务一:再识可逆反应
任务一:再识可逆反应
一、可逆反应:在相同条件下,能向正反应方向进行同时又能向逆反应方向进行的反应称为可逆反应。
2NH3
N2 + 3H2
催化剂
高温、高压
正反应
逆反应
2Na+2H2O=2NaOH+H2↑
问题1:对比以上两类反应,你认为什么样的反应是可逆反应?
问题2:2H2+O2 2H2O 与 2H2O 2H2↑+O2↑互为可逆反应吗?
正反应
2NH3
N2 + 3H2
催化剂
高温、高压
HCl+HClO
Cl2 + H2O
任务一:再识可逆反应
材料1:
材料2:
问题3:结合以上材料,你能从反应的方向性、条件性、转化率、方程式表示等方面对可逆反应的特点进行分析?
2、特点:
3、表示:
双向性
可逆反应分为正反应方向和逆反应方向
双同性
正、逆反应在同一条件下同时进行
共存性
反应物不能全部转化为生成物,即反应物的转化率小于100%
任务一:再识可逆反应
问题4:根据可逆反应的特点,你还能列举我们已知的可逆反应吗?
回顾常见的可逆反应:
2SO3
2SO2 + O2
△
催化剂
2NH3
N2 + 3H2
催化剂
高温、高压
2HI
H2 + I2
H2CO3
CO2 + H2O
H2SO3
SO2 + H2O
NH3.H2O
NH3 + H2O
HCl+HClO
Cl2 + H2O
N2O4
2NO2
任务一:再识可逆反应
B
D
评价任务1:再识可逆反应
在一定条件下的容积不变的密闭容器中:
【思考4】请根据图示分析速率的变化,并画出v-t图像。
任务二:图解化学平衡状态
正向建立
逆向建立
正向建立
逆向建立
v-t图
v-t图
任务二:图解化学平衡状态
【交流与讨论】工业合成氨。在一定条件下,在密闭容器中加1molN2和3mol H2发生反应:
(1)反应刚开始时:
反应物浓度————,正反应速率———— ,
生成物浓度为———,逆反应速率为——。
(2)反应过程中:
反应物浓度——————,正反应速率——————— ,
生成物浓度——————,逆反应速率———————
最大
最大
0
0
逐渐减小
逐渐减小
逐渐增大
逐渐增大
任务二:深研化学平衡状态
(3)反应进行到什么时候会“停止”?
v(正)=v(逆)≠ 0
(4)此时,反应物和生成物浓度如何变化?
(5)反应真的停止了吗?
不再改变
不是
处于动态平衡
任务二:图解化学平衡状态
任务二:图解化学平衡状态
二、化学平衡:在一定条件下的可逆反应体系中,当正、逆反应的速率相等时,反应物和生成物的浓度均保持不变,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了“限度”,这时的状态称之为化学平衡状态,简称化学平衡。
标志
本质
【思考2】请根据合成氨c-t图和v-t图分析化学平衡状态的特征?
任务二:图解化学平衡状态
条件改变,原平衡被破坏,发生移动,在新的条件下
建立新的化学平衡
v(正)= v(逆)
动
动态平衡,v(正)= v(逆) ≠0
定
条件一定,平衡混合物中各物质的浓度一定(不是相等)
变
【交流讨论】这几个特征中,哪几个可作为化学平衡状态的判断标志?
研究对象为可逆反应
逆
等
任务三:深研化学平衡状态
①同一物质:生成速率=消耗速率,即v正(A)=v逆(A)。
②不同物质:符合:bv正(A)=av逆(B)
正逆相等
同一个物质,消耗速率(量)等于生成速率(量)
③反应物与生成物在单位时间物质的量、质量、化学键的断裂和生成等的变化也能体现速率。
如:aA (g) +bB (g) cC (g)
1、直接依据 —— 根据速率关系
√
×
任务三:深研化学平衡状态
2、间接依据——根据各组分的量
首先分析该量是“变量”还是“恒量”,如为“恒量”,即随反应的进行永远不变,则不能作为判断平衡状态的依据;如为“变量”,即该量随反应进行而改变,当其“不变”时,则为平衡状态。
(1)各组分的质量、物质的量、物质的量浓度(或颜色)、质量分数、转化率、绝热容器温度等不随时间的延长而改变(一定可以)。
(2)混合气体的总压强、总体积、总物质的量、混合气体的密度、平均摩尔质量不随时间的延长而改变(具体情况具体分析)。
变量不变
从反应开始到平衡之前始终变化,平衡后不再变
任务三:深研化学平衡状态
这些都不是某一种物质的数据,而是所有气体的整体量。
对于这三个量,若反应为等体反应,不能作为判断依据,若反应为非等体反应,则可以作为判断依据。
第一类:气体的总物质的量n、体积V、压强P ,要具体分析:
A(g) + B(g) 2C(g)
A(g) + B(g) C(g)
气体的总物质的量n
恒温恒容时的压强P
减少
不变
不变
减少
不变
减少
恒温恒压时的体积V
等体反应
缩体反应
恒容时,凡是有固体参与的气体反应,其气体密度都会变,此时ρ是变量,可以作为判断依据。
第二类:恒温恒容时,气体的密度ρ 不再变化时,要具体分析
ρ=
m总
v
不会变
气体质量增加,ρ是变量,可以作为判断依据。
对于反应:A(s)+B(g) C(g)
mA+m B= mC (质量守恒)
找固体,若方程式中有固体,则气体总质量会变化
对于反应:A(g)+B(g) C(g)
质量守恒,气体质量不变,
ρ是不变量,不能作为判断依据。
任务三:深研化学平衡状态
找非气体
看气体系数
第三类:混合气体的平均摩尔质量M,不再变化时,要具体分析
M=
m总
n总
分子、分母只要有一个是变量,
M即可作为判断平衡的依据
A(g)+B(g) 2C(g)
A(g)+B(g) C(g)
A(s)+B(g) C(g)
m总
n总
M
不变
不变
不变
不变
变
变
变
变
不变
等体反应
缩体反应
有固体参加的等体反应
任务三:深研化学平衡状态
3.一定条件下,下列方法能证明可逆反应N2+3H2 2NH3,一定达到平衡状态的是________________________。
(1)温度和体积一定时,N2的浓度不再变化;
(2)c(N2)∶c(H2)∶c(NH3)=1∶3∶2;
(3)NH3的物质的量不再变化;
(4)N2的体积分数与NH3的相等;
(5)温度和体积一定时,混合气体的总压强不再变化;
(6)温度和压强一定时,混合气体的总体积不再变化;
(7)混合气体的平均摩尔质量不再变化;
(8)温度和体积一定时,混合气体的密度不再变化。
(1)(3)(5)(6)(7)
【学习任务2】化学平衡状态的判断
动态标志
静态标志
ν (正) = ν (逆)
≠0
变量不变
同一物质: ν生成(A) = ν消耗(A)
不同物质: v正(A) : v逆(B) = 化学计量数之比
① 各物质的 m 、n 或 c 不变
② 各物质的百分含量不变
(物质的量分数、质量分数、转化率、产率等)
③ 颜色、温度(绝热体系)不再改变
“正逆相等,变量不变”
课堂小结
化
学
平
衡
思考:如何从定量的角度来判断可逆反应达到平衡状态呢?
再见
