3.2.1水的电离和溶液的酸碱性 课件(共27张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2.1水的电离和溶液的酸碱性 课件(共27张ppt)化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 412.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-27 07:39:42 | ||
图片预览





文档简介
(共27张PPT)
第三章 水溶液中的离子平衡
化学反应原理
2 水的电离和溶液的酸碱性
学习目标
1、了解水的电离平衡及影响因素
2、掌握水的离子积—Kw
3、知道溶液的酸碱性与pH的关系
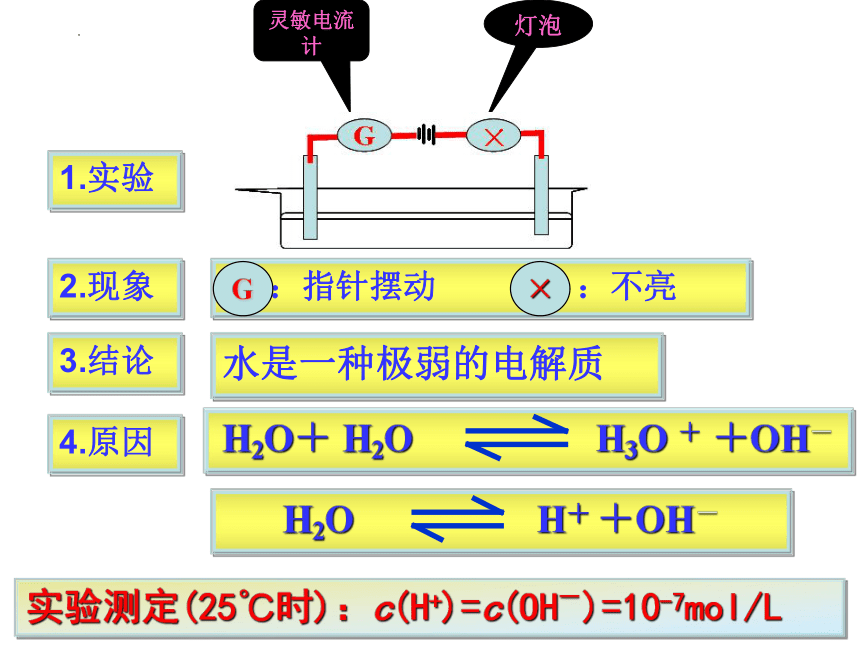
1.实验
2.现象
:指针摆动 :不亮
G
×
3.结论
水是一种极弱的电解质
4.原因
H2O H+ +OH-
H2O+ H2O H3O + +OH-
实验测定(25℃时):c(H+)=c(OH-)=10-7mol/L
灵敏电流计
灯泡
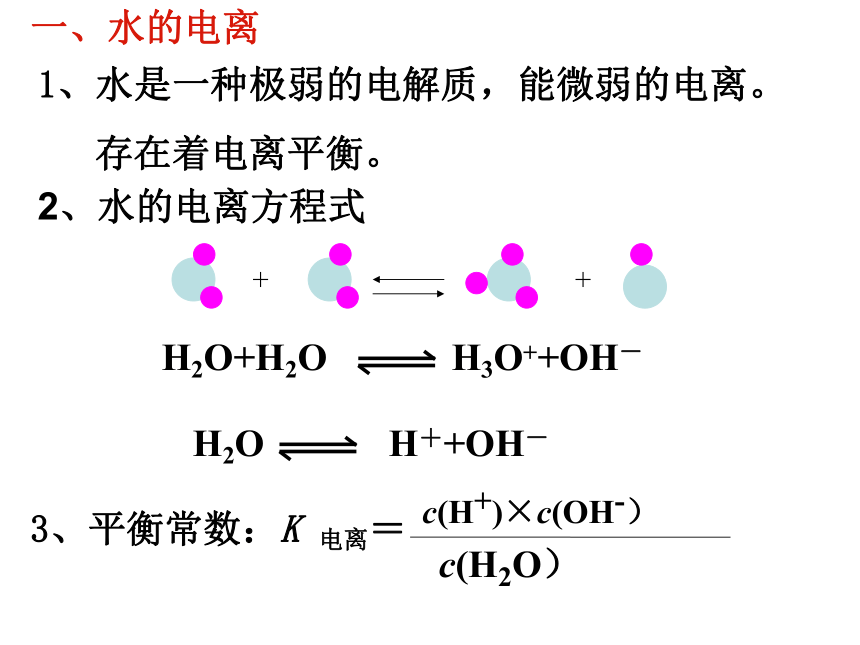
一、水的电离
1、水是一种极弱的电解质,能微弱的电离。
存在着电离平衡。
+
+
H2O+H2O H3O++OH-
3、平衡常数:K 电离=
c(H+)×c(OH-)
c(H2O)
H2O H++OH-
2、水的电离方程式
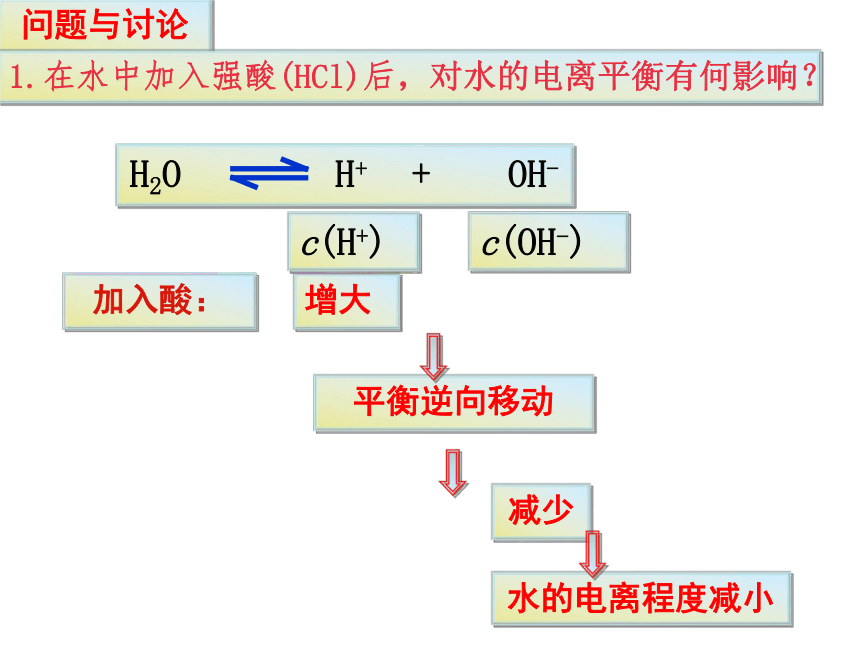
加入酸:
增大
减少
平衡逆向移动
水的电离程度减小
H2O H+ + OH-
c(H+)
c(OH-)
问题与讨论
1.在水中加入强酸(HCl)后,对水的电离平衡有何影响?
加入碱:
c(H+)减小
增大
平衡逆向移动
水的电离程度减小
H2O H+ + OH-
c(H+)
c(OH-)
2.在水中加入强碱(NaOH)后,对水的电离平衡有何影响?
问题与讨论
(1)电离是一个吸热过程,升高温度,促进
水的电离。
(2)加入酸或碱,抑制水的电离,
(3)加入能消耗H+或OH-的物质,促进水的电
离。
二、影响水电离平衡的因素
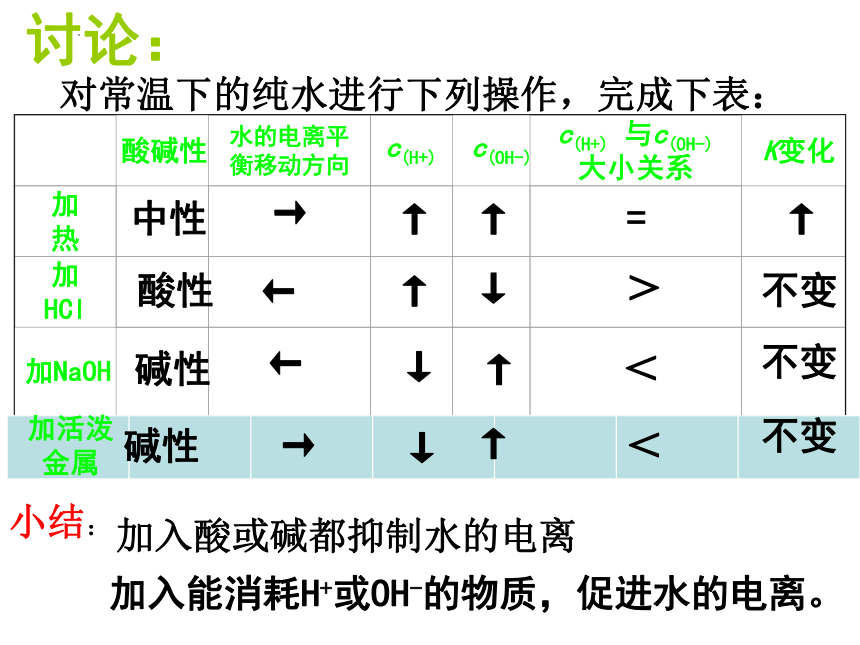
讨论:
对常温下的纯水进行下列操作,完成下表:
酸碱性
水的电离平衡移动方向
c(H+)
c(OH-)
c(H+) 与c(OH-)
大小关系
K变化
加 热
加HCl
加NaOH
中性
→
↑
↑
=
↑
酸性
←
↑
↓
>
不变
碱性
←
↓
↑
<
不变
小结:
加入酸或碱都抑制水的电离
加活泼金属
碱性
→
↓
↑
<
不变
加入能消耗H+或OH-的物质,促进水的电离。
P45
在室温(25℃)时,1L纯水( )molH2O
只有 molH2O发生电离
55.6
在室温(25℃)时1LH2O中
c(H+)=c(OH-)=________ mol/L
1×10-7
1×10-7
平衡常数:K 电离=_____________
c(H+)×c(OH-)
c(H2O)
c(H2O) ·K 电离= c(H+)×c(OH-)
提示:c=n/V
ρ水:1g/ml
算一算
读一读
=常数
=1×10-14
三、水的离子积常数
1、定义:在一定温度下的稀溶液中c(H+)×c(OH-)
为一常数。
2、符号:
Kw
表达式:
Kw= c(H+) . c(OH-)
注:常数无单位
分析下表中的数据有何规律,并解释之
讨论:
温度
0℃
20℃
25℃
50℃
100℃
Kw
1.14×10-15
6.81×10-15
1×10-14
5.47×10-14
1×10-12
结论:
3、影响KW的因素:温度
温度越高,KW越大,水的电离是一个吸热过程
如: 25℃ KW=10-14 100℃ KW=10-12
4、注意
①KW只与温度有关,温度越高,KW越大。
25℃ KW=10-14 100℃ KW=10-12
②KW与溶液的酸碱性无关,在25℃时,酸性、碱性或中性稀溶液中KW=10-14
③水的离子积常数揭示了任何水溶液中均存在水的电离平衡,所以任何水溶液中均含有c(H+)·c(OH-)。
但有水电离产生的c(H+) 和c(OH-)永远相等。
④KW= c(H+)·c(OH-)式中c(H+) 和c(OH-)均表示整个溶液中的c(H+) 和c(OH-)的总的物质的量浓度,因此要分清酸溶液中c(H+) 和酸溶液中水电离出来的c(H+) 。碱溶液中c(OH-)和酸溶液中水电离出来的c(OH-) 。
⑤水的离子积常数不仅适用于纯水,也适用于稀的(酸、碱、盐)电解质溶液。
⑥酸溶液中电离出的c(H+)和水中电离出的c(H+)区别。
c(H+)溶液= c(H+)酸+c(H+)水,由于酸中c(H+)大于水中的c(H+),即水中的c(H+)可忽略。
同理碱溶液也一样。
1、0.01mol/L盐酸溶液中,c(H+)、 c(OH-)分别为多少?由水电离出的 c(H+) H2O 、 c(OH-) H2O分别是多少?
c(H+)= 0.01mol/L
c(OH-)
=1×10-12mol/L
c(H+)H2O= c(OH-) H2O
=1×10-12mol/L
c
利用Kw的定量计算
根据室温时水的电离平衡,运用平衡移动原理分析
下列问题。
1.酸或碱的稀溶液的密度与纯水相近,1L酸或碱的稀
溶液约为1000 g,其中,H2O的物质的量近似为1000 g
/ 18 g /mol =55.6 mol。此时,发生电离的水是否仍为
纯水状态时的1×10-7mol ?
因酸电离出来的H+或碱电离出来的OH-对水的电离有抑制作用,所以发生电离的水的物质的量小于纯水状态时的1×10-7mol 。
P46思考与交流
2.比较下列情况下,c (H+)和c (OH-)的值或变化趋势(增加或减少):
纯水 加少量盐酸 加少量氢氧化钠
c (H+)
c (OH-)
c(H+)和c(OH-)大小比较
10-7mol/L
10-7mol/L
c(H+)=c(OH-)
变大
变小
c(H+)>c(OH-)
变小
变大
c(H+)3.酸性溶液中是否有OH-存在?碱性溶液中是否有H+存
在?
任何溶液中均含有H+和OH-
c (H+)与c (OH-)关系 25℃, c(H+)/mol·L-1 溶液酸碱性
c (H+) =c (OH-)
=1×10-7
中性
c (H+)>c (OH-)
> 1×10-7
酸性
c (H+)<1×10-7
碱性
二、溶液的酸碱性与pH值
+
-
1、溶液的酸、碱性跟c(H+)、c(OH-)的关系
(1)实质:溶液中c (H+) 和c (OH-)的相对大小
(2)判断依据:
任何情况下
在25℃ 时
讨论:KW100℃=10-12
在100 ℃ 时,纯水中[H+] 为多少?
[H+] >1×10-7mol/L是否说明100 ℃ 时纯水溶液呈酸性?
不能用 [H+] 等于多少来判断溶液酸、碱性,只能通过两者相对大小比较
100℃ 时,[H+] = 1×10-7mol/L溶液呈酸性还是碱性?
[H+] =1×10-6mol/L
否
碱性
c(H+) ﹥1mol/L或c(OH-) ﹥1mol/L时,可直接用c(H+) 或c(OH-)表示溶液的酸碱性。一定温度下c(H+)越大,溶液酸性越强。 c(OH-)越大,溶液碱性越强,酸性越弱。
c(H+) ﹤1mol/L时,常用PH表示溶液的酸碱性。
2、溶液的酸碱性的表示方法
溶液的pH
(1)pH的定义:
c(H+)的负对数
(2)使用范围:
c(H+)<1mol/L
例:c(H+)=0.001 mol /L
pH=-lg 10-3 = 3
例:c(OH-) = 0.01mol /L
c(H+)=1×10-14 / 10-2 = 1×10-12 mol /L
pH=-lg 1×10-12 = 12
pH=-lg c (H+)
lg2=0.3
lg3=0.477
溶液的酸碱性 c(H+)和c(OH-)的关系 常温下:c(H+) 常温下:pH
中性溶液 1×10-7mol/L
[H+]>[OH-]
>7
酸性溶液
碱性溶液
[H+]=[OH-]
[H+] >1×10-7mol/L
<7
=7
[H+]<[OH-]
[H+] <1×10-7mol/L
(3)、溶液的酸、碱性跟pH的关系
注意:用pH判断溶液酸碱性时需注意条件:温度
溶液的pH值
0 100
1 10—1
2 10—2
3 10—3
4 10—4
5 10—5
6 10—6
7 10—7
8 10—8
9 10—9
10 10—10
11 10—11
12 10—12
13 10—13
14 10—14
酸性增强
碱性增强
即pH越小酸性越强
pH越大碱性越强
3、溶液酸碱性的测定方法
测定方法:酸碱指示剂法、pH试纸法、pH计法等。
酸碱指示剂一般是弱的有机酸或弱的有机碱,他们的颜色变化是在一定的pH值范围内发生的。我们把指示剂发生颜色变化的pH值范围叫做指示剂的变色范围。
pH 1 2 3 4 5 6 7 8 9 10 11 12 13 14 甲基橙 (3.1—4.4) 红色 橙色 黄色 石蕊(5.0—8.0) 红色 紫色 蓝色 酚酞(8.2—10.0) 无色 浅红色 红色
pH测定:
①pH试纸测定:不可先润湿,不可直接塞进试剂瓶。与比色卡对照
② pH 计(酸度计)。
4、pH值的简单计算
【例1 】计算下列溶液的pH
(1)求0.05mol/LH2SO4溶液的pH。
(2)求0.5mol/LBa(OH)2溶液中c(H+)及pH。
(1)pH=1
(2) c(H+) =10-14mol/L pH=14
谢谢聆听!
第三章 水溶液中的离子平衡
化学反应原理
2 水的电离和溶液的酸碱性
学习目标
1、了解水的电离平衡及影响因素
2、掌握水的离子积—Kw
3、知道溶液的酸碱性与pH的关系
1.实验
2.现象
:指针摆动 :不亮
G
×
3.结论
水是一种极弱的电解质
4.原因
H2O H+ +OH-
H2O+ H2O H3O + +OH-
实验测定(25℃时):c(H+)=c(OH-)=10-7mol/L
灵敏电流计
灯泡
一、水的电离
1、水是一种极弱的电解质,能微弱的电离。
存在着电离平衡。
+
+
H2O+H2O H3O++OH-
3、平衡常数:K 电离=
c(H+)×c(OH-)
c(H2O)
H2O H++OH-
2、水的电离方程式
加入酸:
增大
减少
平衡逆向移动
水的电离程度减小
H2O H+ + OH-
c(H+)
c(OH-)
问题与讨论
1.在水中加入强酸(HCl)后,对水的电离平衡有何影响?
加入碱:
c(H+)减小
增大
平衡逆向移动
水的电离程度减小
H2O H+ + OH-
c(H+)
c(OH-)
2.在水中加入强碱(NaOH)后,对水的电离平衡有何影响?
问题与讨论
(1)电离是一个吸热过程,升高温度,促进
水的电离。
(2)加入酸或碱,抑制水的电离,
(3)加入能消耗H+或OH-的物质,促进水的电
离。
二、影响水电离平衡的因素
讨论:
对常温下的纯水进行下列操作,完成下表:
酸碱性
水的电离平衡移动方向
c(H+)
c(OH-)
c(H+) 与c(OH-)
大小关系
K变化
加 热
加HCl
加NaOH
中性
→
↑
↑
=
↑
酸性
←
↑
↓
>
不变
碱性
←
↓
↑
<
不变
小结:
加入酸或碱都抑制水的电离
加活泼金属
碱性
→
↓
↑
<
不变
加入能消耗H+或OH-的物质,促进水的电离。
P45
在室温(25℃)时,1L纯水( )molH2O
只有 molH2O发生电离
55.6
在室温(25℃)时1LH2O中
c(H+)=c(OH-)=________ mol/L
1×10-7
1×10-7
平衡常数:K 电离=_____________
c(H+)×c(OH-)
c(H2O)
c(H2O) ·K 电离= c(H+)×c(OH-)
提示:c=n/V
ρ水:1g/ml
算一算
读一读
=常数
=1×10-14
三、水的离子积常数
1、定义:在一定温度下的稀溶液中c(H+)×c(OH-)
为一常数。
2、符号:
Kw
表达式:
Kw= c(H+) . c(OH-)
注:常数无单位
分析下表中的数据有何规律,并解释之
讨论:
温度
0℃
20℃
25℃
50℃
100℃
Kw
1.14×10-15
6.81×10-15
1×10-14
5.47×10-14
1×10-12
结论:
3、影响KW的因素:温度
温度越高,KW越大,水的电离是一个吸热过程
如: 25℃ KW=10-14 100℃ KW=10-12
4、注意
①KW只与温度有关,温度越高,KW越大。
25℃ KW=10-14 100℃ KW=10-12
②KW与溶液的酸碱性无关,在25℃时,酸性、碱性或中性稀溶液中KW=10-14
③水的离子积常数揭示了任何水溶液中均存在水的电离平衡,所以任何水溶液中均含有c(H+)·c(OH-)。
但有水电离产生的c(H+) 和c(OH-)永远相等。
④KW= c(H+)·c(OH-)式中c(H+) 和c(OH-)均表示整个溶液中的c(H+) 和c(OH-)的总的物质的量浓度,因此要分清酸溶液中c(H+) 和酸溶液中水电离出来的c(H+) 。碱溶液中c(OH-)和酸溶液中水电离出来的c(OH-) 。
⑤水的离子积常数不仅适用于纯水,也适用于稀的(酸、碱、盐)电解质溶液。
⑥酸溶液中电离出的c(H+)和水中电离出的c(H+)区别。
c(H+)溶液= c(H+)酸+c(H+)水,由于酸中c(H+)大于水中的c(H+),即水中的c(H+)可忽略。
同理碱溶液也一样。
1、0.01mol/L盐酸溶液中,c(H+)、 c(OH-)分别为多少?由水电离出的 c(H+) H2O 、 c(OH-) H2O分别是多少?
c(H+)= 0.01mol/L
c(OH-)
=1×10-12mol/L
c(H+)H2O= c(OH-) H2O
=1×10-12mol/L
c
利用Kw的定量计算
根据室温时水的电离平衡,运用平衡移动原理分析
下列问题。
1.酸或碱的稀溶液的密度与纯水相近,1L酸或碱的稀
溶液约为1000 g,其中,H2O的物质的量近似为1000 g
/ 18 g /mol =55.6 mol。此时,发生电离的水是否仍为
纯水状态时的1×10-7mol ?
因酸电离出来的H+或碱电离出来的OH-对水的电离有抑制作用,所以发生电离的水的物质的量小于纯水状态时的1×10-7mol 。
P46思考与交流
2.比较下列情况下,c (H+)和c (OH-)的值或变化趋势(增加或减少):
纯水 加少量盐酸 加少量氢氧化钠
c (H+)
c (OH-)
c(H+)和c(OH-)大小比较
10-7mol/L
10-7mol/L
c(H+)=c(OH-)
变大
变小
c(H+)>c(OH-)
变小
变大
c(H+)
在?
任何溶液中均含有H+和OH-
c (H+)与c (OH-)关系 25℃, c(H+)/mol·L-1 溶液酸碱性
c (H+) =c (OH-)
=1×10-7
中性
c (H+)>c (OH-)
> 1×10-7
酸性
c (H+)
碱性
二、溶液的酸碱性与pH值
+
-
1、溶液的酸、碱性跟c(H+)、c(OH-)的关系
(1)实质:溶液中c (H+) 和c (OH-)的相对大小
(2)判断依据:
任何情况下
在25℃ 时
讨论:KW100℃=10-12
在100 ℃ 时,纯水中[H+] 为多少?
[H+] >1×10-7mol/L是否说明100 ℃ 时纯水溶液呈酸性?
不能用 [H+] 等于多少来判断溶液酸、碱性,只能通过两者相对大小比较
100℃ 时,[H+] = 1×10-7mol/L溶液呈酸性还是碱性?
[H+] =1×10-6mol/L
否
碱性
c(H+) ﹥1mol/L或c(OH-) ﹥1mol/L时,可直接用c(H+) 或c(OH-)表示溶液的酸碱性。一定温度下c(H+)越大,溶液酸性越强。 c(OH-)越大,溶液碱性越强,酸性越弱。
c(H+) ﹤1mol/L时,常用PH表示溶液的酸碱性。
2、溶液的酸碱性的表示方法
溶液的pH
(1)pH的定义:
c(H+)的负对数
(2)使用范围:
c(H+)<1mol/L
例:c(H+)=0.001 mol /L
pH=-lg 10-3 = 3
例:c(OH-) = 0.01mol /L
c(H+)=1×10-14 / 10-2 = 1×10-12 mol /L
pH=-lg 1×10-12 = 12
pH=-lg c (H+)
lg2=0.3
lg3=0.477
溶液的酸碱性 c(H+)和c(OH-)的关系 常温下:c(H+) 常温下:pH
中性溶液 1×10-7mol/L
[H+]>[OH-]
>7
酸性溶液
碱性溶液
[H+]=[OH-]
[H+] >1×10-7mol/L
<7
=7
[H+]<[OH-]
[H+] <1×10-7mol/L
(3)、溶液的酸、碱性跟pH的关系
注意:用pH判断溶液酸碱性时需注意条件:温度
溶液的pH值
0 100
1 10—1
2 10—2
3 10—3
4 10—4
5 10—5
6 10—6
7 10—7
8 10—8
9 10—9
10 10—10
11 10—11
12 10—12
13 10—13
14 10—14
酸性增强
碱性增强
即pH越小酸性越强
pH越大碱性越强
3、溶液酸碱性的测定方法
测定方法:酸碱指示剂法、pH试纸法、pH计法等。
酸碱指示剂一般是弱的有机酸或弱的有机碱,他们的颜色变化是在一定的pH值范围内发生的。我们把指示剂发生颜色变化的pH值范围叫做指示剂的变色范围。
pH 1 2 3 4 5 6 7 8 9 10 11 12 13 14 甲基橙 (3.1—4.4) 红色 橙色 黄色 石蕊(5.0—8.0) 红色 紫色 蓝色 酚酞(8.2—10.0) 无色 浅红色 红色
pH测定:
①pH试纸测定:不可先润湿,不可直接塞进试剂瓶。与比色卡对照
② pH 计(酸度计)。
4、pH值的简单计算
【例1 】计算下列溶液的pH
(1)求0.05mol/LH2SO4溶液的pH。
(2)求0.5mol/LBa(OH)2溶液中c(H+)及pH。
(1)pH=1
(2) c(H+) =10-14mol/L pH=14
谢谢聆听!
