江苏省南京市江宁区2023-2024学年高一下学期期末考试 化学(含答案)
文档属性
| 名称 | 江苏省南京市江宁区2023-2024学年高一下学期期末考试 化学(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 564.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-27 14:42:50 | ||
图片预览


文档简介
2023-2024学年度第二学期期末试卷
高一化学
可能用到的相对原子质量: H-1 C-12 O-16 Fe-56
一、单项选择题(共14题,每题3分,共42分。每题只有一个选项最符合题意。)
1.“碳中和”是指CO2排放总量与吸收处理总量相等。下列措施不利于我国2060年实现“碳中和”目标的是
A.加强化石燃料的开采使用
B.加强植树造林和荒漠绿化
C.加大风、光、水电的投资
D.加强新能源汽车推广使用
2.《神农本草经》中记载的白矾主要成分为KAl(SO4)2 12H2O。下列说法正确的是
A.离子半径:r(Al3+)>r(O2﹣) B.碱性:KOH>Al(OH)3
C.热稳定性:H2S>H2O D.非金属性:S>O
3.下列物质性质与用途具有对应关系的是
A.N2的化学性质稳定,可用于金属焊接保护
B.SO2具有氧化性,可用于漂白织物
C.FeCl3溶液显酸性,可用于刻蚀覆铜板
D.NaHCO3受热易分解,可用于治疗胃酸过多
阅读下列材料,完成4~6题:
NH3、NH4Cl、NO、NO2、HNO3等是氮的重要化合物,工业合成氨的反应为N2(g)+3H2(g)2NH3(g) ΔH=-92.4kJ mol-1。NH3可与酸反应制得铵盐,也可通过催化氧化生成NO,用于生产HNO3。浓氨水加到生石灰中,放出大量热量,促进NH3 H2O分解,可用于实验室制取NH3。
4.在指定条件下,下列选项所示的物质间转化能实现的是
A.NO(g)HNO3(aq) B.稀硝酸NO2
C.NO2(g)HNO3(aq) D.NO(aq)NO(aq)
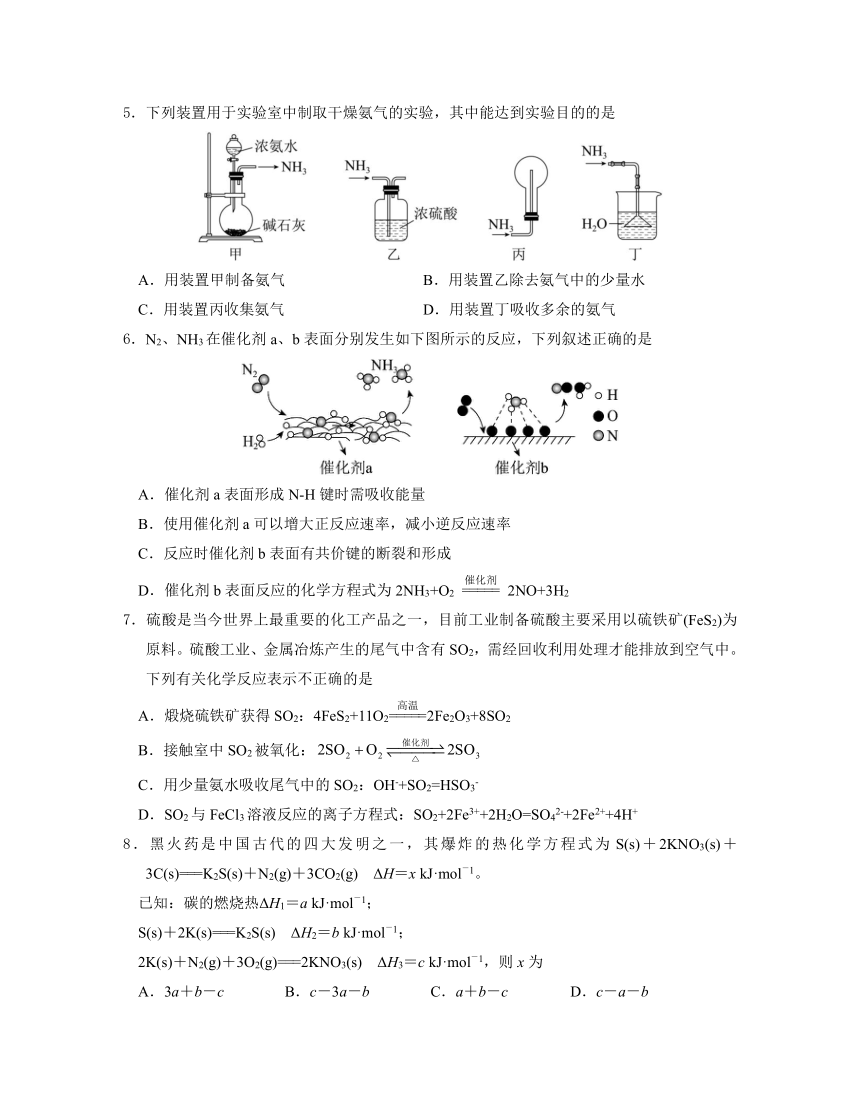
5.下列装置用于实验室中制取干燥氨气的实验,其中能达到实验目的的是
A.用装置甲制备氨气 B.用装置乙除去氨气中的少量水
C.用装置丙收集氨气 D.用装置丁吸收多余的氨气
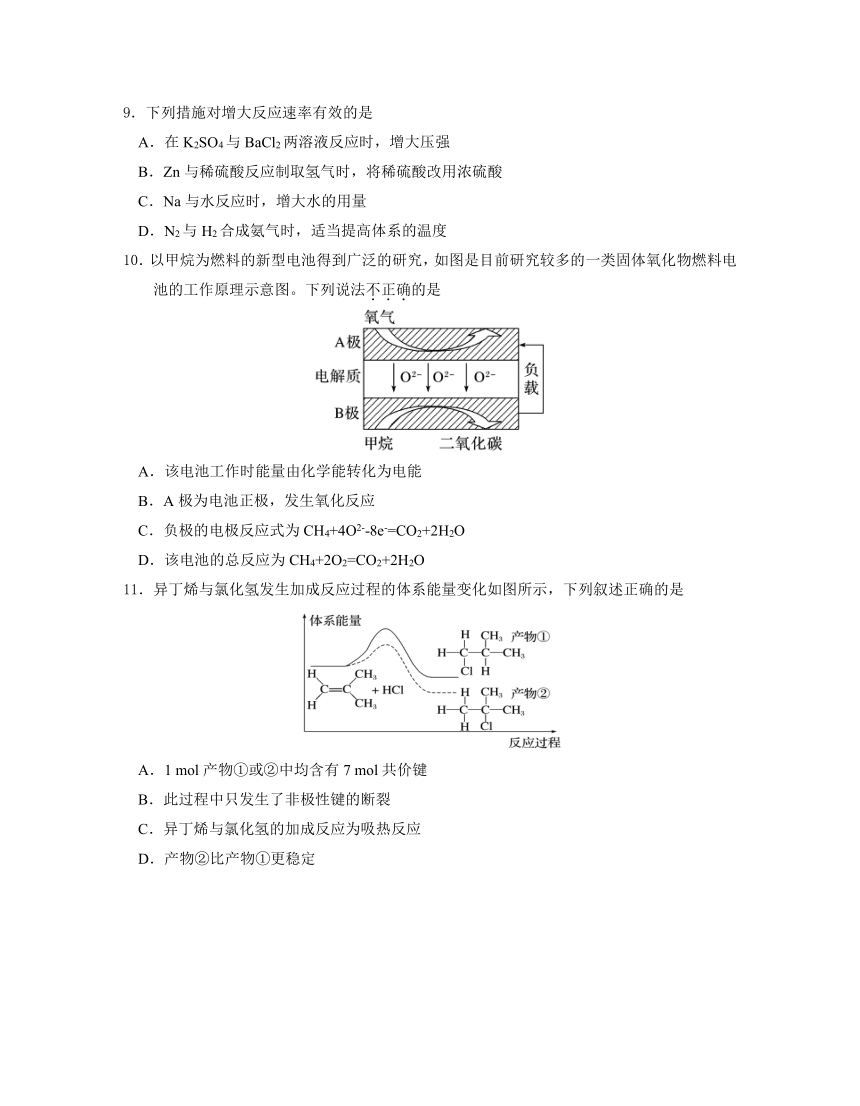
6.N2、NH3在催化剂a、b表面分别发生如下图所示的反应,下列叙述正确的是
A.催化剂a表面形成N-H键时需吸收能量
B.使用催化剂a可以增大正反应速率,减小逆反应速率
C.反应时催化剂b表面有共价键的断裂和形成
D.催化剂b表面反应的化学方程式为2NH3+O2 2NO+3H2
7.硫酸是当今世界上最重要的化工产品之一,目前工业制备硫酸主要采用以硫铁矿(FeS2)为原料。硫酸工业、金属冶炼产生的尾气中含有SO2,需经回收利用处理才能排放到空气中。下列有关化学反应表示不正确的是
A.煅烧硫铁矿获得SO2:4FeS2+11O22Fe2O3+8SO2
B.接触室中SO2被氧化:
C.用少量氨水吸收尾气中的SO2:OH-+SO2=HSO3-
D.SO2与FeCl3溶液反应的离子方程式:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
8.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1。
已知:碳的燃烧热ΔH1=a kJ·mol-1;
S(s)+2K(s)===K2S(s) ΔH2=b kJ·mol-1;
2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·mol-1,则x为
A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b
9.下列措施对增大反应速率有效的是
A.在K2SO4与BaCl2两溶液反应时,增大压强
B.Zn与稀硫酸反应制取氢气时,将稀硫酸改用浓硫酸
C.Na与水反应时,增大水的用量
D.N2与H2合成氨气时,适当提高体系的温度
10.以甲烷为燃料的新型电池得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。下列说法不正确的是
A.该电池工作时能量由化学能转化为电能
B.A极为电池正极,发生氧化反应
C.负极的电极反应式为CH4+4O2--8e-=CO2+2H2O
D.该电池的总反应为CH4+2O2=CO2+2H2O
11.异丁烯与氯化氢发生加成反应过程的体系能量变化如图所示,下列叙述正确的是
A.1 mol产物①或②中均含有7 mol共价键
B.此过程中只发生了非极性键的断裂
C.异丁烯与氯化氢的加成反应为吸热反应
D.产物②比产物①更稳定
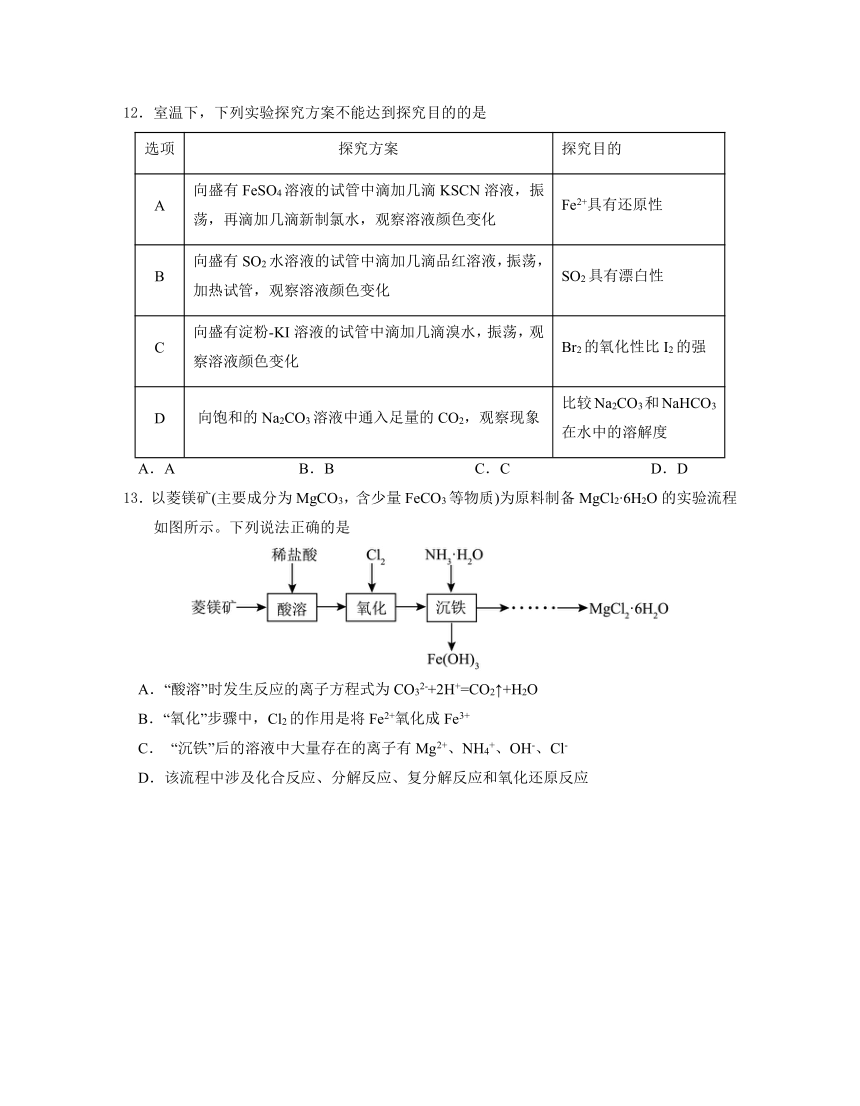
12.室温下,下列实验探究方案不能达到探究目的的是
选项 探究方案 探究目的
A 向盛有FeSO4溶液的试管中滴加几滴KSCN溶液,振 荡,再滴加几滴新制氯水,观察溶液颜色变化 Fe2+具有还原性
B 向盛有SO2水溶液的试管中滴加几滴品红溶液,振荡, 加热试管,观察溶液颜色变化 SO2具有漂白性
C 向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,观 察溶液颜色变化 Br2的氧化性比I2的强
D 向饱和的Na2CO3溶液中通入足量的CO2,观察现象 比较Na2CO3和NaHCO3在水中的溶解度
A.A B.B C.C D.D
13.以菱镁矿(主要成分为MgCO3,含少量FeCO3等物质)为原料制备MgCl2 6H2O的实验流程如图所示。下列说法正确的是
A.“酸溶”时发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
B.“氧化”步骤中,Cl2的作用是将Fe2+氧化成Fe3+
C. “沉铁”后的溶液中大量存在的离子有Mg2+、NH4+、OH-、Cl-
D.该流程中涉及化合反应、分解反应、复分解反应和氧化还原反应
14. 在2L的恒容密闭容器中充入1molCO和2molH2,一定条件下发生反应:CO(g)+2H2(g)=CH3OH(g),测得CO和CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。下列说法正确的是
A.该反应中反应物的总键能大于生成物的总键能
B.升温能增大正反应速率,减小逆反应速率
C.反应开始到3min时,平均反应速率为v(H2)=0.25mol L-1 min-1
D.当反应体系中n(CO):n(H2):n(CH3OH)=1:2:1时,反应一定达到平衡
二、非选择题(共4题,共58分。请将解答填写在答题卡相应的位置。)
15.(14分)现有反应:mA(g)+nB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为 ▲ (填“吸热”或“放热”)反应,且m+n ▲ (填“>”“=”或“<”)p。
(2)减压使容器体积增大时,A的质量分数 ▲ (填“增大”“减小”或“不变”,下同)。
(3)若容积不变加入B,则A的转化率 ▲ ,B的转化率 ▲ 。
(4)若升高温度,则平衡时B、C的浓度之比将 ▲ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量 ▲ 。
16.(15分)NaClO、NaClO2、NaClO3等含氯化合物在生活中有着重要应用。
(1)NaClO的制备。将Cl2通入NaOH溶液中反应生成NaClO,该反应为放热反应,温度过高会有副产物NaClO3生成。
①提高单位时间内NaClO的产率,可以采取的可行措施为 ▲ (填选项字母)。
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水稀释NaOH溶液
②反应结束后,测得溶液中n(NaClO):n(NaClO3)=2:1,则该反应的化学方程式为 ▲ ;
③用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO3-的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。NaClO初始pH越小,NO转化率越高的原因是 ▲ ;
(2)NaClO2的制备。NaClO2是一种高效的消毒剂,其生产工艺流程如下。
①NaClO3和ClO2中Cl的化合价分别为 ▲ 、 ▲ ;
②“吸收”时,H2O2不能用O2代替的理由是 ▲ ;
③实验室可以利用NaClO3与HCl反应可以制得Cl2。若生成1mol Cl2,反应中转移的电子数为 ▲ 。
17.(14分)草酸亚铁晶体(FeC2O4 2H2O)可作为制备汽车电池正极材料磷酸铁锂的原料。以FeSO4溶液制备电池级草酸亚铁晶体的实验流程如图:
(1)“沉淀”步骤的离子反应方程式为 ▲ ,得到的混合体系不宜在空气中久置,其原因是 ▲ 。
(2)检验“洗涤”完全的实验方案是 ▲ 。
(3)以废渣(主要含Fe2O3、Al2O3、SiO2等)为原料制备实验所需的FeSO4溶液。请补充实验方案:向废渣中分批加入稀硫酸,边加边搅拌,当固体不再溶解时,过滤:在搅拌下向滤液中滴加NaOH溶液至 ▲ 时,过滤;用蒸馏水洗涤滤渣2~3次后,在搅拌下向滤渣中加入 ▲ 至滤渣完全溶解;在搅拌下向所得溶液中分批加入 ▲ ,直至向取出的少量溶液中滴加 ▲ 溶液不再出现红色,过滤。[实验中可供使用的试剂:稀硫酸、铁粉、NaOH溶液、KSCN溶液、蒸馏水]
(4)测定草酸亚铁样品纯度的方法如下:准确称取0.2500g样品,加入适量水、H2SO4、磷酸,逐滴加入0.04500mol L-1KMnO4溶液至恰好完全反应(草酸亚铁转化为Fe3+和CO2),消耗KMnO4溶液18.00mL。计算样品中FeC2O4 2H2O的纯度 ▲ (写出计算过程)。
(15分)N2O和CO是常见的环境污染气体。
(1)对于反应N2O(g)+CO(g)CO2(g)+N2(g)来说,Fe+可作为此反应的催化剂。其总反应分两步进行:第一步为Fe++N2OFeO++N2;则第二步为 ▲ (写方程式)。
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能 ▲ (填“大于”“小于”或“等于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:2N2O(g)2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示:
①该反应的ΔH ▲ (填“>”或“<”)0。
②若容器Ⅰ的体积为2 L,反应在370 ℃下进行,20 s后达到平衡,则0~20 s内容器Ⅰ中用O2表示的反应速率为 ▲ 。B点对应的平衡常数K= ▲ (结果保留两位有效数字)。
③图中A、C、D三点容器内气体密度由大到小的顺序是 ▲ 。
④若容器Ⅳ体积为1 L,反应在370 ℃下进行,则起始时反应 ▲ (填“向正反应方向”“向逆反应方向”或“不”)进行。
2023-2024学年度第二学期期末试卷
高一化学参考答案
一、单项选择题(本题共14小题,每小题3分,共42分。每小题只有一个选项最符合题目要求。)
1-5 ABACA 6-10 CCADB 11-14 DDBC
二、非选择题(本题共4小题,共计58分。请将解答填写在答题卡相应的位置。)
15.(14分,每空2分)
(1)放热 > (2)增大 (3)增大 减小
(4)减小 (5)不变
16.(15分)
(1)① B (2分) ②5Cl2+10NaOH=7NaCl+2NaClO+NaClO3+5H2O (3分)
③初始pH越小,NaClO溶液氧化NO生成NO3-的反应速率越快 (2分)
(2)①+5 +4 (2分+2分)
②“吸收”时H2O2作还原剂,而O2在此条件下只能作氧化剂 (2分)
③NA (2分)
17.(14分)
(1)Fe2++2NH3 H2O=Fe(OH)2↓+2NH4+; (3分)
Fe(OH)2在空气中易被O2氧化为Fe(OH)3,导致草酸亚铁产率降低; (2分)
(2)取最后一次洗涤滤液少许于试管中,先滴加盐酸酸化,再滴加BaCl2溶液,若无白色沉淀生成,则已洗涤完全; (2分)
(3)沉淀不再减少;稀硫酸;铁粉;KSCN; (1分+1分+1分+1分)
(4)草酸亚铁被酸性高锰酸钾氧化为Fe3+和CO2,根据得失电子守恒,得关系式5FeC2O4 2H2O~3KMnO4(1分),反应消耗0.04500 mol L-1 KMnO4标准溶液18.00 mL,则草酸亚铁的物质的量为mol=0.00135mol(1分),FeC2O4 2H2O的纯度为×100%=97.20%(1分),
故答案为:97.20%。
(注:没有计算过程,只有一个正确答案,给1分;写97.2%也可以,这次不扣分)
18.(15分)
(1)FeO++CO Fe++CO2 (3分) 大于(2分)
(2)① >(2分) ②0.000 5 mol·L-1·s-1 (2分)0.004 4 (2分)
③ D>C>A(2分) ④向逆反应方向 (2分)
高一化学
可能用到的相对原子质量: H-1 C-12 O-16 Fe-56
一、单项选择题(共14题,每题3分,共42分。每题只有一个选项最符合题意。)
1.“碳中和”是指CO2排放总量与吸收处理总量相等。下列措施不利于我国2060年实现“碳中和”目标的是
A.加强化石燃料的开采使用
B.加强植树造林和荒漠绿化
C.加大风、光、水电的投资
D.加强新能源汽车推广使用
2.《神农本草经》中记载的白矾主要成分为KAl(SO4)2 12H2O。下列说法正确的是
A.离子半径:r(Al3+)>r(O2﹣) B.碱性:KOH>Al(OH)3
C.热稳定性:H2S>H2O D.非金属性:S>O
3.下列物质性质与用途具有对应关系的是
A.N2的化学性质稳定,可用于金属焊接保护
B.SO2具有氧化性,可用于漂白织物
C.FeCl3溶液显酸性,可用于刻蚀覆铜板
D.NaHCO3受热易分解,可用于治疗胃酸过多
阅读下列材料,完成4~6题:
NH3、NH4Cl、NO、NO2、HNO3等是氮的重要化合物,工业合成氨的反应为N2(g)+3H2(g)2NH3(g) ΔH=-92.4kJ mol-1。NH3可与酸反应制得铵盐,也可通过催化氧化生成NO,用于生产HNO3。浓氨水加到生石灰中,放出大量热量,促进NH3 H2O分解,可用于实验室制取NH3。
4.在指定条件下,下列选项所示的物质间转化能实现的是
A.NO(g)HNO3(aq) B.稀硝酸NO2
C.NO2(g)HNO3(aq) D.NO(aq)NO(aq)
5.下列装置用于实验室中制取干燥氨气的实验,其中能达到实验目的的是
A.用装置甲制备氨气 B.用装置乙除去氨气中的少量水
C.用装置丙收集氨气 D.用装置丁吸收多余的氨气
6.N2、NH3在催化剂a、b表面分别发生如下图所示的反应,下列叙述正确的是
A.催化剂a表面形成N-H键时需吸收能量
B.使用催化剂a可以增大正反应速率,减小逆反应速率
C.反应时催化剂b表面有共价键的断裂和形成
D.催化剂b表面反应的化学方程式为2NH3+O2 2NO+3H2
7.硫酸是当今世界上最重要的化工产品之一,目前工业制备硫酸主要采用以硫铁矿(FeS2)为原料。硫酸工业、金属冶炼产生的尾气中含有SO2,需经回收利用处理才能排放到空气中。下列有关化学反应表示不正确的是
A.煅烧硫铁矿获得SO2:4FeS2+11O22Fe2O3+8SO2
B.接触室中SO2被氧化:
C.用少量氨水吸收尾气中的SO2:OH-+SO2=HSO3-
D.SO2与FeCl3溶液反应的离子方程式:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
8.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1。
已知:碳的燃烧热ΔH1=a kJ·mol-1;
S(s)+2K(s)===K2S(s) ΔH2=b kJ·mol-1;
2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·mol-1,则x为
A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b
9.下列措施对增大反应速率有效的是
A.在K2SO4与BaCl2两溶液反应时,增大压强
B.Zn与稀硫酸反应制取氢气时,将稀硫酸改用浓硫酸
C.Na与水反应时,增大水的用量
D.N2与H2合成氨气时,适当提高体系的温度
10.以甲烷为燃料的新型电池得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。下列说法不正确的是
A.该电池工作时能量由化学能转化为电能
B.A极为电池正极,发生氧化反应
C.负极的电极反应式为CH4+4O2--8e-=CO2+2H2O
D.该电池的总反应为CH4+2O2=CO2+2H2O
11.异丁烯与氯化氢发生加成反应过程的体系能量变化如图所示,下列叙述正确的是
A.1 mol产物①或②中均含有7 mol共价键
B.此过程中只发生了非极性键的断裂
C.异丁烯与氯化氢的加成反应为吸热反应
D.产物②比产物①更稳定
12.室温下,下列实验探究方案不能达到探究目的的是
选项 探究方案 探究目的
A 向盛有FeSO4溶液的试管中滴加几滴KSCN溶液,振 荡,再滴加几滴新制氯水,观察溶液颜色变化 Fe2+具有还原性
B 向盛有SO2水溶液的试管中滴加几滴品红溶液,振荡, 加热试管,观察溶液颜色变化 SO2具有漂白性
C 向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,观 察溶液颜色变化 Br2的氧化性比I2的强
D 向饱和的Na2CO3溶液中通入足量的CO2,观察现象 比较Na2CO3和NaHCO3在水中的溶解度
A.A B.B C.C D.D
13.以菱镁矿(主要成分为MgCO3,含少量FeCO3等物质)为原料制备MgCl2 6H2O的实验流程如图所示。下列说法正确的是
A.“酸溶”时发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
B.“氧化”步骤中,Cl2的作用是将Fe2+氧化成Fe3+
C. “沉铁”后的溶液中大量存在的离子有Mg2+、NH4+、OH-、Cl-
D.该流程中涉及化合反应、分解反应、复分解反应和氧化还原反应
14. 在2L的恒容密闭容器中充入1molCO和2molH2,一定条件下发生反应:CO(g)+2H2(g)=CH3OH(g),测得CO和CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。下列说法正确的是
A.该反应中反应物的总键能大于生成物的总键能
B.升温能增大正反应速率,减小逆反应速率
C.反应开始到3min时,平均反应速率为v(H2)=0.25mol L-1 min-1
D.当反应体系中n(CO):n(H2):n(CH3OH)=1:2:1时,反应一定达到平衡
二、非选择题(共4题,共58分。请将解答填写在答题卡相应的位置。)
15.(14分)现有反应:mA(g)+nB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为 ▲ (填“吸热”或“放热”)反应,且m+n ▲ (填“>”“=”或“<”)p。
(2)减压使容器体积增大时,A的质量分数 ▲ (填“增大”“减小”或“不变”,下同)。
(3)若容积不变加入B,则A的转化率 ▲ ,B的转化率 ▲ 。
(4)若升高温度,则平衡时B、C的浓度之比将 ▲ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量 ▲ 。
16.(15分)NaClO、NaClO2、NaClO3等含氯化合物在生活中有着重要应用。
(1)NaClO的制备。将Cl2通入NaOH溶液中反应生成NaClO,该反应为放热反应,温度过高会有副产物NaClO3生成。
①提高单位时间内NaClO的产率,可以采取的可行措施为 ▲ (填选项字母)。
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水稀释NaOH溶液
②反应结束后,测得溶液中n(NaClO):n(NaClO3)=2:1,则该反应的化学方程式为 ▲ ;
③用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO3-的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。NaClO初始pH越小,NO转化率越高的原因是 ▲ ;
(2)NaClO2的制备。NaClO2是一种高效的消毒剂,其生产工艺流程如下。
①NaClO3和ClO2中Cl的化合价分别为 ▲ 、 ▲ ;
②“吸收”时,H2O2不能用O2代替的理由是 ▲ ;
③实验室可以利用NaClO3与HCl反应可以制得Cl2。若生成1mol Cl2,反应中转移的电子数为 ▲ 。
17.(14分)草酸亚铁晶体(FeC2O4 2H2O)可作为制备汽车电池正极材料磷酸铁锂的原料。以FeSO4溶液制备电池级草酸亚铁晶体的实验流程如图:
(1)“沉淀”步骤的离子反应方程式为 ▲ ,得到的混合体系不宜在空气中久置,其原因是 ▲ 。
(2)检验“洗涤”完全的实验方案是 ▲ 。
(3)以废渣(主要含Fe2O3、Al2O3、SiO2等)为原料制备实验所需的FeSO4溶液。请补充实验方案:向废渣中分批加入稀硫酸,边加边搅拌,当固体不再溶解时,过滤:在搅拌下向滤液中滴加NaOH溶液至 ▲ 时,过滤;用蒸馏水洗涤滤渣2~3次后,在搅拌下向滤渣中加入 ▲ 至滤渣完全溶解;在搅拌下向所得溶液中分批加入 ▲ ,直至向取出的少量溶液中滴加 ▲ 溶液不再出现红色,过滤。[实验中可供使用的试剂:稀硫酸、铁粉、NaOH溶液、KSCN溶液、蒸馏水]
(4)测定草酸亚铁样品纯度的方法如下:准确称取0.2500g样品,加入适量水、H2SO4、磷酸,逐滴加入0.04500mol L-1KMnO4溶液至恰好完全反应(草酸亚铁转化为Fe3+和CO2),消耗KMnO4溶液18.00mL。计算样品中FeC2O4 2H2O的纯度 ▲ (写出计算过程)。
(15分)N2O和CO是常见的环境污染气体。
(1)对于反应N2O(g)+CO(g)CO2(g)+N2(g)来说,Fe+可作为此反应的催化剂。其总反应分两步进行:第一步为Fe++N2OFeO++N2;则第二步为 ▲ (写方程式)。
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能 ▲ (填“大于”“小于”或“等于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:2N2O(g)2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示:
①该反应的ΔH ▲ (填“>”或“<”)0。
②若容器Ⅰ的体积为2 L,反应在370 ℃下进行,20 s后达到平衡,则0~20 s内容器Ⅰ中用O2表示的反应速率为 ▲ 。B点对应的平衡常数K= ▲ (结果保留两位有效数字)。
③图中A、C、D三点容器内气体密度由大到小的顺序是 ▲ 。
④若容器Ⅳ体积为1 L,反应在370 ℃下进行,则起始时反应 ▲ (填“向正反应方向”“向逆反应方向”或“不”)进行。
2023-2024学年度第二学期期末试卷
高一化学参考答案
一、单项选择题(本题共14小题,每小题3分,共42分。每小题只有一个选项最符合题目要求。)
1-5 ABACA 6-10 CCADB 11-14 DDBC
二、非选择题(本题共4小题,共计58分。请将解答填写在答题卡相应的位置。)
15.(14分,每空2分)
(1)放热 > (2)增大 (3)增大 减小
(4)减小 (5)不变
16.(15分)
(1)① B (2分) ②5Cl2+10NaOH=7NaCl+2NaClO+NaClO3+5H2O (3分)
③初始pH越小,NaClO溶液氧化NO生成NO3-的反应速率越快 (2分)
(2)①+5 +4 (2分+2分)
②“吸收”时H2O2作还原剂,而O2在此条件下只能作氧化剂 (2分)
③NA (2分)
17.(14分)
(1)Fe2++2NH3 H2O=Fe(OH)2↓+2NH4+; (3分)
Fe(OH)2在空气中易被O2氧化为Fe(OH)3,导致草酸亚铁产率降低; (2分)
(2)取最后一次洗涤滤液少许于试管中,先滴加盐酸酸化,再滴加BaCl2溶液,若无白色沉淀生成,则已洗涤完全; (2分)
(3)沉淀不再减少;稀硫酸;铁粉;KSCN; (1分+1分+1分+1分)
(4)草酸亚铁被酸性高锰酸钾氧化为Fe3+和CO2,根据得失电子守恒,得关系式5FeC2O4 2H2O~3KMnO4(1分),反应消耗0.04500 mol L-1 KMnO4标准溶液18.00 mL,则草酸亚铁的物质的量为mol=0.00135mol(1分),FeC2O4 2H2O的纯度为×100%=97.20%(1分),
故答案为:97.20%。
(注:没有计算过程,只有一个正确答案,给1分;写97.2%也可以,这次不扣分)
18.(15分)
(1)FeO++CO Fe++CO2 (3分) 大于(2分)
(2)① >(2分) ②0.000 5 mol·L-1·s-1 (2分)0.004 4 (2分)
③ D>C>A(2分) ④向逆反应方向 (2分)
同课章节目录
