2025人教版高中化学选择性必修1同步--分层作业23 电解原理(含解析)
文档属性
| 名称 | 2025人教版高中化学选择性必修1同步--分层作业23 电解原理(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 524.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-28 16:31:39 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2025人教版高中化学选择性必修1
分层作业23 电解原理
A级 必备知识基础练
题组1.电解池的构成及工作原理
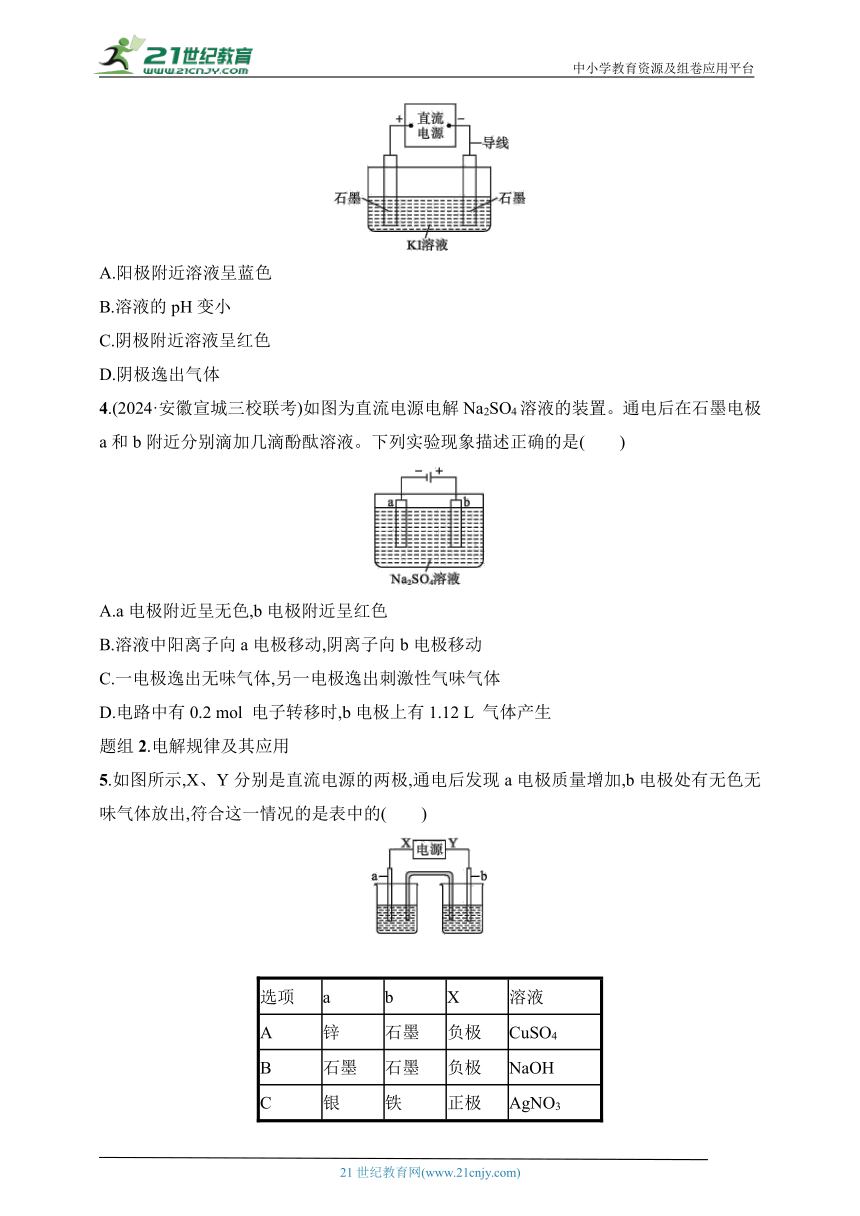
1.某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在下图中。下列有关分析完全正确的是( )
选项 A B C D
a电极 阳极 阴极 阳极 阴极
d电极 正极 正极 负极 负极
Q离子 阳离子 阳离子 阴离子 阴离子
2.(2024·陕西宝鸡联考)如图,设计电解饱和食盐水的装置,通电后两极均有气泡产生。下列叙述正确的是( )
A.铜电极附近观察到黄绿色气体
B.石墨电极附近溶液显红色
C.溶液中的Na+向石墨电极移动
D.铜电极上发生还原反应
3.以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉)的装置如图所示。下列说法错误的是( )
A.阳极附近溶液呈蓝色
B.溶液的pH变小
C.阴极附近溶液呈红色
D.阴极逸出气体
4.(2024·安徽宣城三校联考)如图为直流电源电解Na2SO4溶液的装置。通电后在石墨电极a和b附近分别滴加几滴酚酞溶液。下列实验现象描述正确的是( )
A.a电极附近呈无色,b电极附近呈红色
B.溶液中阳离子向a电极移动,阴离子向b电极移动
C.一电极逸出无味气体,另一电极逸出刺激性气味气体
D.电路中有0.2 mol 电子转移时,b电极上有1.12 L 气体产生
题组2.电解规律及其应用
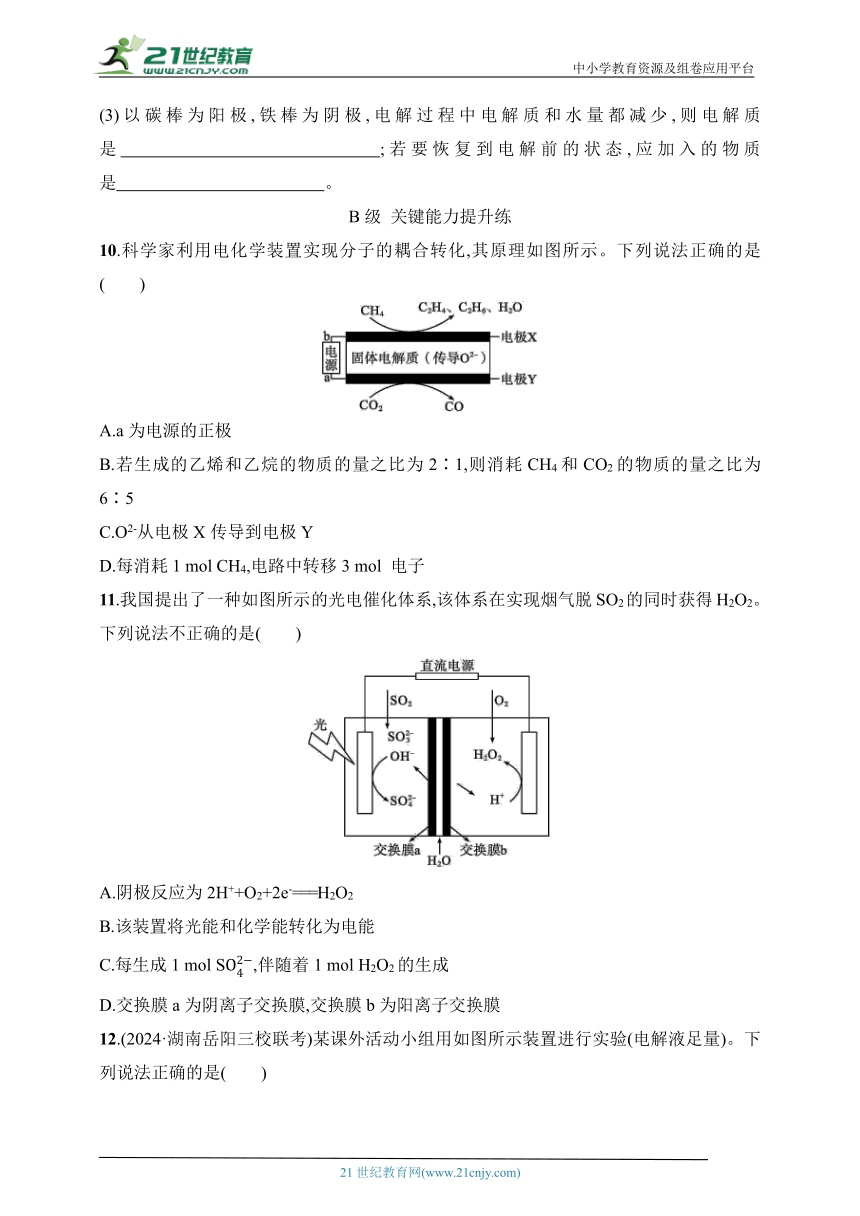
5.如图所示,X、Y分别是直流电源的两极,通电后发现a电极质量增加,b电极处有无色无味气体放出,符合这一情况的是表中的( )
选项 a b X 溶液
A 锌 石墨 负极 CuSO4
B 石墨 石墨 负极 NaOH
C 银 铁 正极 AgNO3
D 铜 石墨 负极 CuCl2
6.用惰性电极电解下列溶液,一段时间后,再加入一定量的另一种物质(括号内物质),电解质溶液基本不变的是( )
A.CuCl2(CuSO4) B.NaOH(H2O)
C.NaCl(NaCl) D.CuSO4[Cu(OH)2]
7.用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是( )
A.AgNO3、CuCl2、Cu(NO3)2
B.KCl、Na2SO4、CuSO4
C.CaCl2、KOH、NaNO3
D.HCl、HNO3、K2SO4
8.按图甲装置进行实验,若图乙中横坐标x表示通过电极的电子的物质的量,下列叙述正确的是( )
A.F表示反应生成Cu的物质的量
B.F表示反应生成H2SO4的物质的量
C.E表示反应生成O2的物质的量
D.E表示反应消耗H2O的物质的量
9.为了加深对电解规律的理解,某同学做了以下探究,要求从H+、Cu2+、Na+、S、Cl-5种离子中两两组成电解质,按下列要求进行电解:
(1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则采用的电解质是 (填化学式,下同);若要恢复到电解前的状态,应加入的物质是 。
(2)以碳棒为电极,电解过程中电解质质量不变,水量减少,则采用的电解质是 ;若要恢复到电解前的状态,应加入的物质是 。
(3)以碳棒为阳极,铁棒为阴极,电解过程中电解质和水量都减少,则电解质是 ;若要恢复到电解前的状态,应加入的物质是 。
B级 关键能力提升练
10.科学家利用电化学装置实现分子的耦合转化,其原理如图所示。下列说法正确的是( )
A.a为电源的正极
B.若生成的乙烯和乙烷的物质的量之比为2∶1,则消耗CH4和CO2的物质的量之比为6∶5
C.O2-从电极X传导到电极Y
D.每消耗1 mol CH4,电路中转移3 mol 电子
11.我国提出了一种如图所示的光电催化体系,该体系在实现烟气脱SO2的同时获得H2O2。下列说法不正确的是( )
A.阴极反应为2H++O2+2e-===H2O2
B.该装置将光能和化学能转化为电能
C.每生成1 mol S,伴随着1 mol H2O2的生成
D.交换膜a为阴离子交换膜,交换膜b为阳离子交换膜
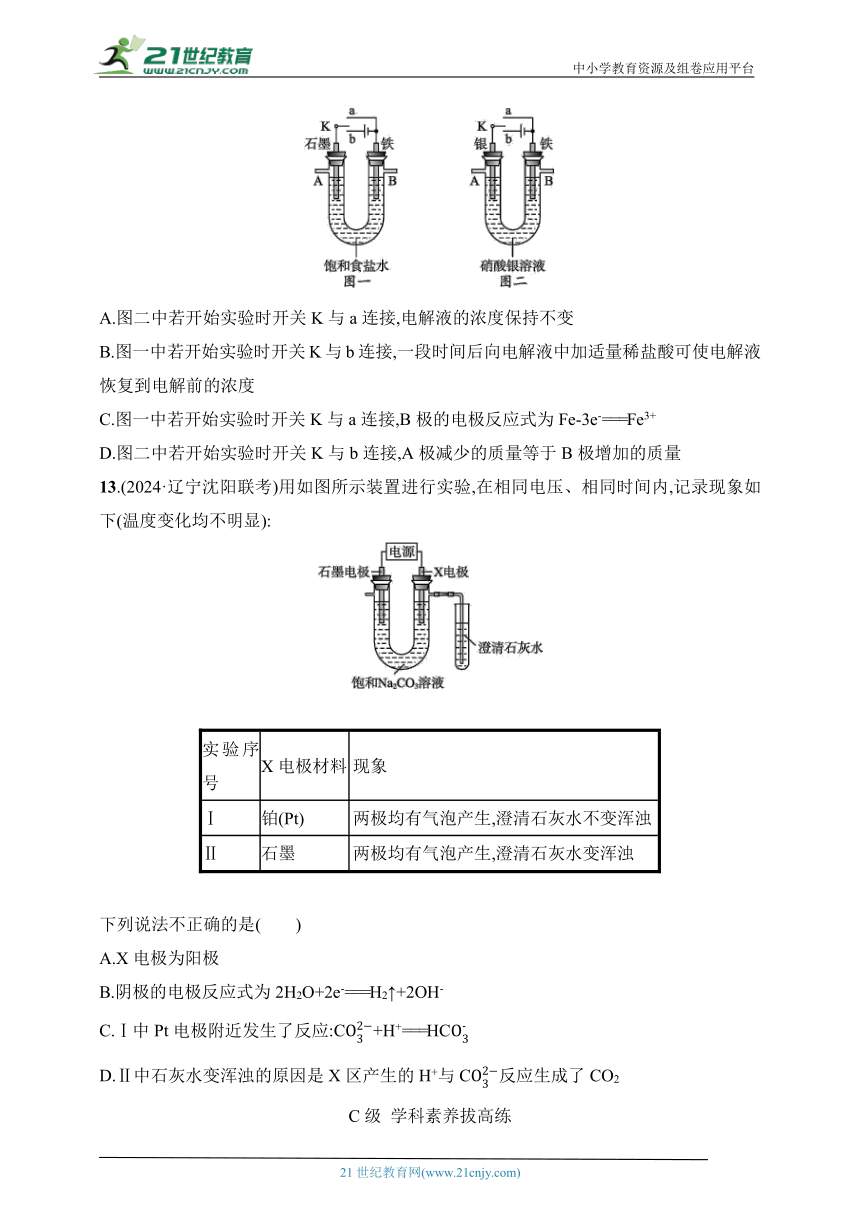
12.(2024·湖南岳阳三校联考)某课外活动小组用如图所示装置进行实验(电解液足量)。下列说法正确的是( )
A.图二中若开始实验时开关K与a连接,电解液的浓度保持不变
B.图一中若开始实验时开关K与b连接,一段时间后向电解液中加适量稀盐酸可使电解液恢复到电解前的浓度
C.图一中若开始实验时开关K与a连接,B极的电极反应式为Fe-3e-===Fe3+
D.图二中若开始实验时开关K与b连接,A极减少的质量等于B极增加的质量
13.(2024·辽宁沈阳联考)用如图所示装置进行实验,在相同电压、相同时间内,记录现象如下(温度变化均不明显):
实验序号 X电极材料 现象
Ⅰ 铂(Pt) 两极均有气泡产生,澄清石灰水不变浑浊
Ⅱ 石墨 两极均有气泡产生,澄清石灰水变浑浊
下列说法不正确的是( )
A.X电极为阳极
B.阴极的电极反应式为2H2O+2e-===H2↑+2OH-
C.Ⅰ中Pt电极附近发生了反应:C+H+===HC
D.Ⅱ中石灰水变浑浊的原因是X区产生的H+与C反应生成了CO2
C级 学科素养拔高练
14.某课外小组进一步研究电解原理,实验记录如下:
实验Ⅰ:探究电解质溶液中电极材料(Fe)是否参与放电
如图所示进行实验,两极均为石墨,溶液为煮沸过的饱和NaCl溶液,滴加2~3滴酚酞溶液,U形管底部放一个铁钉,电解一段时间,a、b、d处均有气体生成,b处和d处变红。
(1)结合实验现象回答下列问题:
①结合电极反应解释b处酚酞变红的原因: 。
②写出c处的电极反应: 。
实验发现:电解质溶液中的铁钉参与放电
实验Ⅱ:探究电压对电极反应的影响
某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol·L-1FeCl2溶液,实验记录如下(a、b、c代表电压值,a>c>b):
序号 电压/V 阳极现象 检验阳极产物
ⅰ x≥a 电极附近出现黄色,有气泡产生 有Fe3+、有Cl2
ⅱ a>x≥b 电极附近出现黄色,无气泡产生 有Fe3+、无Cl2
ⅲ b>x>0 无明显现象 无Fe3+、无Cl2
(2)ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化,写出Cl-在阳极放电的电极反应: 。
(3)由ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有 (填“氧化”或“还原”)性。
(4)ⅱ中虽未检测出Cl2,但Cl-在阳极是否放电仍需进一步验证,电解pH=1的NaCl溶液做对照实验,记录如下:
序号 电压/V 阳极现象 检验阳极产物
ⅳ a>x≥c 无明显现象 有Cl2
ⅴ c>x≥b 无明显现象 无Cl2
①NaCl溶液的浓度是 mol·L-1。
②ⅳ中检测Cl2的实验方法是取少量阳极附近的溶液,滴在碘化钾淀粉试纸上,试纸 证明生成氯气,否则无氯气生成。
③与ⅱ相比,可以得出以下结论:pH=1的0.1 mol·L-1 FeCl2溶液,电压(V)x≥c时,Cl-才能在阳极放电产生Cl2;pH=1的0.1 mol·L-1 FeCl2溶液,电压(V)c>x≥b时,阳极的电极反应为 。
分层作业23 电解原理
1.B 解析 电子由电源的负极流出,故a电极是阴极、d电极是正极;溶液中阳离子移向阴极,故Q离子是阳离子。
2.D 解析 据“通电后两极均有气泡产生”推测,铜电极是阴极,电极反应为2H++2e-===H2↑,铜电极附近观察到无色气体,A错误;石墨电极是阳极,电极反应为2Cl--2e-===Cl2↑,可以观察到黄绿色气体产生,B错误;电解池中,阳离子移向阴极,即Na+移向铜电极,C错误;铜电极是阴极,电极反应为2H++2e-===H2↑,属于还原反应,D正确。
3.B 解析 以石墨为电极电解KI溶液时,阳极上是碘离子失电子发生氧化反应生成I2,淀粉遇到I2变蓝色,A正确;以石墨为电极电解KI溶液时,在阴极上是水提供的氢离子得电子发生还原反应生成氢气,消耗氢离子则促进水电离,c(OH-)增大,该极区碱性增强,溶液的pH变大,B错误;阴极产生的氢氧根离子使溶液呈碱性,酚酞在碱性溶液中变红色,在阴极逸出的气体是氢气,C、D正确。
4.B 解析 该装置有外接电源,属于电解池装置,溶液中含有的离子是Na+、S、H+、OH-,根据电解原理,b为阳极,电极反应式为2H2O-4e-===4H++O2↑,a极为阴极,电极反应式为2H2O+2e-===2OH-+H2↑。电解一段时间后,a极附近显碱性,b极附近显酸性,A错误;根据电解原理,阴离子向阳极移动,即向b电极移动,阳离子向阴极移动,即向a电极移动,B正确;a、b两极产生的气体为H2、O2,两种气体均为无色无味气体,C错误;题中没有说明是否处在标准状况下,无法计算气体的体积,D错误。
5.A 解析 通电后发现a电极质量增加,金属阳离子在a电极上得电子,a电极是阴极,溶液中金属元素在金属活动性顺序表中处于氢元素后边;b极是阳极,b电极处有无色无味气体放出,即溶液中OH-放电生成氧气,b电极必须是惰性电极,电解质溶液中的阴离子必须是OH-或含氧酸根离子。综上,A符合题意。
6.B 解析 加入某种物质,使电解质溶液恢复到电解前的浓度,可加入两极析出气体(或气体与金属)化合的产物。电解氯化铜溶液时,阳极产生氯气,阴极生成金属铜,应加氯化铜让电解质溶液复原,A错误;电解氢氧化钠溶液时,阳极产生氧气,阴极产生氢气,本质是电解水,应加水让电解质溶液复原,B正确;电解氯化钠溶液时,阳极产生氯气,阴极产生氢气,应加氯化氢让电解质溶液复原,C错误;电解硫酸铜溶液时,阳极产生氧气,阴极产生金属铜,应加氧化铜让电解质溶液复原,D错误。
7.B 解析 AgNO3、Cu(NO3)2、CuSO4溶液随电解的进行,有酸产生,溶液pH均降低;KCl、CaCl2溶液随电解的进行,有碱产生,溶液pH均升高;CuCl2、HCl溶液电解的是电解质本身,溶液中CuCl2、HCl减少,对应的H+减少,溶液的pH均升高;电解KOH、HNO3溶液相当于电解H2O,电解质浓度增大,对应的碱溶液碱性更强,酸溶液酸性更强。
8.D 解析 由图甲可得Cu为阴极,C为阳极,电解质溶液为CuSO4溶液,总反应为2CuSO4+2H2O2Cu+2H2SO4+O2↑,各物质及电子转移关系为2H2O~2Cu~2H2SO4~O2~4e-,再根据图乙,所以E可以表示H2O、Cu和H2SO4的物质的量,F表示O2的物质的量。
9.答案 (1)HCl、CuCl2 HCl、CuCl2
(2)Na2SO4、H2SO4 H2O
(3)CuSO4(或NaCl) CuO或CuCO3(或HCl)
解析 (1)以碳棒为电极,电解过程中电解质质量减少,水量不变,电解质可为无氧酸或不活泼金属的无氧酸盐,则阳离子只能为H+、C,阴离子只能是Cl-,其电解质是HCl、CuCl2。
(2)以碳棒为电极,电解过程中电解质质量不变,水量减少,实质上是电解水,H+、OH-分别在两极上放电,其电解质是Na2SO4、H2SO4。
(3)若电解质是CuSO4,2CuSO4+2H2O2H2SO4+2Cu+O2↑,若恢复到原状态,可加入CuO,也可加入CuCO3;若电解质是NaCl,2NaCl+2H2O2NaOH+H2↑+Cl2↑,要恢复到原状态可通入HCl。
10.B 解析 由图可知,电极Y上CO2→CO,发生还原反应,则电极Y是阴极,电极X是阳极,故a为电源的负极,A错误;设生成乙烯和乙烷的物质的量分别为2 mol 、1 mol,由碳原子个数守恒可知,消耗甲烷的物质的量为6 mol,由得失电子守恒可知,消耗二氧化碳的物质的量为=5 mol,则相同条件下,消耗甲烷和二氧化碳的体积比为6∶5,B正确;电解池中阴离子向阳极移动,故O2-从电极Y传导到电极X,C错误;消耗甲烷但不确定生成乙烯还是乙烷,无法计算转移电子数,D错误。
11.B 解析 右侧是阴极,氧气得电子发生还原反应转化为过氧化氢,电极反应为2H++O2+2e-===H2O2,A正确。该装置将光能和电能转化为化学能,B错误。SO2转化为S,每生成1 mol S,伴随2 mol 电子转移,根据转移电子守恒,有1 mol H2O2生成,C正确。根据装置知道,OH-通过交换膜a进入阳极参加反应,交换膜a应该为阴离子交换膜;H+通过交换膜b进入阴极参加反应,交换膜b应该为阳离子交换膜,D正确。
12.D 解析 图二中若开始实验时开关K与a连接,则形成原电池,电池的总反应式为Fe+2AgNO3===Fe+2Ag,电解液的浓度减小,A错误;图一中若开始实验时开关K与b连接,则形成电解池,铁棒作阴极,电解的总反应式为2NaCl+2H2O2NaOH+H2↑+Cl2↑,根据质量守恒可知一段时间后向电解液中通入适量的HCl可使电解液恢复到电解前的浓度,B错误;图一中若开始实验时开关K与a连接,形成原电池,B极的电极反应式应为Fe-2e-===Fe2+,C错误;图二中若开始实验时开关K与b连接,相当于电镀装置,根据电镀原理可知,D正确。
13.D 解析 实验Ⅰ中澄清石灰水不变浑浊,实验Ⅱ中澄清石灰水变浑浊,说明实验Ⅱ中X电极上生成了CO2,即X电极中的石墨与O2反应生成了CO2,则X电极为阳极,电极反应式为2H2O-4e-===O2↑+4H+,A正确、D错误;左侧石墨电极为阴极,水放电生成氢气,阴极的电极反应式为2H2O+2e-===H2↑+2OH-,B正确;Ⅰ中Pt电极为阳极,电极反应式为2H2O-4e-===O2↑+4H+,生成的H+与C反应生成HC,反应为C+H+===HC,C正确。
14.答案 (1)①2H2O+2e-===2OH-+H2↑,水电离产生的H+放电促进水的电离,溶液显碱性 ②Fe-2e-==Fe2+ (2)2Cl--2e-===Cl2↑ (3)还原 (4)①0.2 ②变蓝
③Fe2+-e-===Fe3+
解析 (3)由Fe2+生成F,Fe元素的化合价升高,Fe2+作还原剂,Fe2+具有还原性。
(4)①该实验是为了检验实验ⅱ中Cl-在阳极是否放电,所以该实验中氯离子浓度应与实验ⅱ中氯离子浓度相同,实验ⅱ中电解质溶液为0.1 mol·L-1FeCl2溶液,含有0.2 mol·L-1Cl-,所以NaCl的浓度为0.2 mol·L-1。
②氯气与碘化钾反应生成碘单质,淀粉遇碘单质变蓝。③通过实验数据可以看出,电解0.1 mol·L-1FeCl2溶液,当电压x的取值范围在x≥a、a>x≥b时,会有Fe3+生成,在c>x≥b时,无Cl2生成,在c>x≥b时,阳极发生的反应为Fe2+→e3+,电极反应式为Fe2+-e-===Fe3+。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025人教版高中化学选择性必修1
分层作业23 电解原理
A级 必备知识基础练
题组1.电解池的构成及工作原理
1.某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在下图中。下列有关分析完全正确的是( )
选项 A B C D
a电极 阳极 阴极 阳极 阴极
d电极 正极 正极 负极 负极
Q离子 阳离子 阳离子 阴离子 阴离子
2.(2024·陕西宝鸡联考)如图,设计电解饱和食盐水的装置,通电后两极均有气泡产生。下列叙述正确的是( )
A.铜电极附近观察到黄绿色气体
B.石墨电极附近溶液显红色
C.溶液中的Na+向石墨电极移动
D.铜电极上发生还原反应
3.以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉)的装置如图所示。下列说法错误的是( )
A.阳极附近溶液呈蓝色
B.溶液的pH变小
C.阴极附近溶液呈红色
D.阴极逸出气体
4.(2024·安徽宣城三校联考)如图为直流电源电解Na2SO4溶液的装置。通电后在石墨电极a和b附近分别滴加几滴酚酞溶液。下列实验现象描述正确的是( )
A.a电极附近呈无色,b电极附近呈红色
B.溶液中阳离子向a电极移动,阴离子向b电极移动
C.一电极逸出无味气体,另一电极逸出刺激性气味气体
D.电路中有0.2 mol 电子转移时,b电极上有1.12 L 气体产生
题组2.电解规律及其应用
5.如图所示,X、Y分别是直流电源的两极,通电后发现a电极质量增加,b电极处有无色无味气体放出,符合这一情况的是表中的( )
选项 a b X 溶液
A 锌 石墨 负极 CuSO4
B 石墨 石墨 负极 NaOH
C 银 铁 正极 AgNO3
D 铜 石墨 负极 CuCl2
6.用惰性电极电解下列溶液,一段时间后,再加入一定量的另一种物质(括号内物质),电解质溶液基本不变的是( )
A.CuCl2(CuSO4) B.NaOH(H2O)
C.NaCl(NaCl) D.CuSO4[Cu(OH)2]
7.用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是( )
A.AgNO3、CuCl2、Cu(NO3)2
B.KCl、Na2SO4、CuSO4
C.CaCl2、KOH、NaNO3
D.HCl、HNO3、K2SO4
8.按图甲装置进行实验,若图乙中横坐标x表示通过电极的电子的物质的量,下列叙述正确的是( )
A.F表示反应生成Cu的物质的量
B.F表示反应生成H2SO4的物质的量
C.E表示反应生成O2的物质的量
D.E表示反应消耗H2O的物质的量
9.为了加深对电解规律的理解,某同学做了以下探究,要求从H+、Cu2+、Na+、S、Cl-5种离子中两两组成电解质,按下列要求进行电解:
(1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则采用的电解质是 (填化学式,下同);若要恢复到电解前的状态,应加入的物质是 。
(2)以碳棒为电极,电解过程中电解质质量不变,水量减少,则采用的电解质是 ;若要恢复到电解前的状态,应加入的物质是 。
(3)以碳棒为阳极,铁棒为阴极,电解过程中电解质和水量都减少,则电解质是 ;若要恢复到电解前的状态,应加入的物质是 。
B级 关键能力提升练
10.科学家利用电化学装置实现分子的耦合转化,其原理如图所示。下列说法正确的是( )
A.a为电源的正极
B.若生成的乙烯和乙烷的物质的量之比为2∶1,则消耗CH4和CO2的物质的量之比为6∶5
C.O2-从电极X传导到电极Y
D.每消耗1 mol CH4,电路中转移3 mol 电子
11.我国提出了一种如图所示的光电催化体系,该体系在实现烟气脱SO2的同时获得H2O2。下列说法不正确的是( )
A.阴极反应为2H++O2+2e-===H2O2
B.该装置将光能和化学能转化为电能
C.每生成1 mol S,伴随着1 mol H2O2的生成
D.交换膜a为阴离子交换膜,交换膜b为阳离子交换膜
12.(2024·湖南岳阳三校联考)某课外活动小组用如图所示装置进行实验(电解液足量)。下列说法正确的是( )
A.图二中若开始实验时开关K与a连接,电解液的浓度保持不变
B.图一中若开始实验时开关K与b连接,一段时间后向电解液中加适量稀盐酸可使电解液恢复到电解前的浓度
C.图一中若开始实验时开关K与a连接,B极的电极反应式为Fe-3e-===Fe3+
D.图二中若开始实验时开关K与b连接,A极减少的质量等于B极增加的质量
13.(2024·辽宁沈阳联考)用如图所示装置进行实验,在相同电压、相同时间内,记录现象如下(温度变化均不明显):
实验序号 X电极材料 现象
Ⅰ 铂(Pt) 两极均有气泡产生,澄清石灰水不变浑浊
Ⅱ 石墨 两极均有气泡产生,澄清石灰水变浑浊
下列说法不正确的是( )
A.X电极为阳极
B.阴极的电极反应式为2H2O+2e-===H2↑+2OH-
C.Ⅰ中Pt电极附近发生了反应:C+H+===HC
D.Ⅱ中石灰水变浑浊的原因是X区产生的H+与C反应生成了CO2
C级 学科素养拔高练
14.某课外小组进一步研究电解原理,实验记录如下:
实验Ⅰ:探究电解质溶液中电极材料(Fe)是否参与放电
如图所示进行实验,两极均为石墨,溶液为煮沸过的饱和NaCl溶液,滴加2~3滴酚酞溶液,U形管底部放一个铁钉,电解一段时间,a、b、d处均有气体生成,b处和d处变红。
(1)结合实验现象回答下列问题:
①结合电极反应解释b处酚酞变红的原因: 。
②写出c处的电极反应: 。
实验发现:电解质溶液中的铁钉参与放电
实验Ⅱ:探究电压对电极反应的影响
某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol·L-1FeCl2溶液,实验记录如下(a、b、c代表电压值,a>c>b):
序号 电压/V 阳极现象 检验阳极产物
ⅰ x≥a 电极附近出现黄色,有气泡产生 有Fe3+、有Cl2
ⅱ a>x≥b 电极附近出现黄色,无气泡产生 有Fe3+、无Cl2
ⅲ b>x>0 无明显现象 无Fe3+、无Cl2
(2)ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化,写出Cl-在阳极放电的电极反应: 。
(3)由ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有 (填“氧化”或“还原”)性。
(4)ⅱ中虽未检测出Cl2,但Cl-在阳极是否放电仍需进一步验证,电解pH=1的NaCl溶液做对照实验,记录如下:
序号 电压/V 阳极现象 检验阳极产物
ⅳ a>x≥c 无明显现象 有Cl2
ⅴ c>x≥b 无明显现象 无Cl2
①NaCl溶液的浓度是 mol·L-1。
②ⅳ中检测Cl2的实验方法是取少量阳极附近的溶液,滴在碘化钾淀粉试纸上,试纸 证明生成氯气,否则无氯气生成。
③与ⅱ相比,可以得出以下结论:pH=1的0.1 mol·L-1 FeCl2溶液,电压(V)x≥c时,Cl-才能在阳极放电产生Cl2;pH=1的0.1 mol·L-1 FeCl2溶液,电压(V)c>x≥b时,阳极的电极反应为 。
分层作业23 电解原理
1.B 解析 电子由电源的负极流出,故a电极是阴极、d电极是正极;溶液中阳离子移向阴极,故Q离子是阳离子。
2.D 解析 据“通电后两极均有气泡产生”推测,铜电极是阴极,电极反应为2H++2e-===H2↑,铜电极附近观察到无色气体,A错误;石墨电极是阳极,电极反应为2Cl--2e-===Cl2↑,可以观察到黄绿色气体产生,B错误;电解池中,阳离子移向阴极,即Na+移向铜电极,C错误;铜电极是阴极,电极反应为2H++2e-===H2↑,属于还原反应,D正确。
3.B 解析 以石墨为电极电解KI溶液时,阳极上是碘离子失电子发生氧化反应生成I2,淀粉遇到I2变蓝色,A正确;以石墨为电极电解KI溶液时,在阴极上是水提供的氢离子得电子发生还原反应生成氢气,消耗氢离子则促进水电离,c(OH-)增大,该极区碱性增强,溶液的pH变大,B错误;阴极产生的氢氧根离子使溶液呈碱性,酚酞在碱性溶液中变红色,在阴极逸出的气体是氢气,C、D正确。
4.B 解析 该装置有外接电源,属于电解池装置,溶液中含有的离子是Na+、S、H+、OH-,根据电解原理,b为阳极,电极反应式为2H2O-4e-===4H++O2↑,a极为阴极,电极反应式为2H2O+2e-===2OH-+H2↑。电解一段时间后,a极附近显碱性,b极附近显酸性,A错误;根据电解原理,阴离子向阳极移动,即向b电极移动,阳离子向阴极移动,即向a电极移动,B正确;a、b两极产生的气体为H2、O2,两种气体均为无色无味气体,C错误;题中没有说明是否处在标准状况下,无法计算气体的体积,D错误。
5.A 解析 通电后发现a电极质量增加,金属阳离子在a电极上得电子,a电极是阴极,溶液中金属元素在金属活动性顺序表中处于氢元素后边;b极是阳极,b电极处有无色无味气体放出,即溶液中OH-放电生成氧气,b电极必须是惰性电极,电解质溶液中的阴离子必须是OH-或含氧酸根离子。综上,A符合题意。
6.B 解析 加入某种物质,使电解质溶液恢复到电解前的浓度,可加入两极析出气体(或气体与金属)化合的产物。电解氯化铜溶液时,阳极产生氯气,阴极生成金属铜,应加氯化铜让电解质溶液复原,A错误;电解氢氧化钠溶液时,阳极产生氧气,阴极产生氢气,本质是电解水,应加水让电解质溶液复原,B正确;电解氯化钠溶液时,阳极产生氯气,阴极产生氢气,应加氯化氢让电解质溶液复原,C错误;电解硫酸铜溶液时,阳极产生氧气,阴极产生金属铜,应加氧化铜让电解质溶液复原,D错误。
7.B 解析 AgNO3、Cu(NO3)2、CuSO4溶液随电解的进行,有酸产生,溶液pH均降低;KCl、CaCl2溶液随电解的进行,有碱产生,溶液pH均升高;CuCl2、HCl溶液电解的是电解质本身,溶液中CuCl2、HCl减少,对应的H+减少,溶液的pH均升高;电解KOH、HNO3溶液相当于电解H2O,电解质浓度增大,对应的碱溶液碱性更强,酸溶液酸性更强。
8.D 解析 由图甲可得Cu为阴极,C为阳极,电解质溶液为CuSO4溶液,总反应为2CuSO4+2H2O2Cu+2H2SO4+O2↑,各物质及电子转移关系为2H2O~2Cu~2H2SO4~O2~4e-,再根据图乙,所以E可以表示H2O、Cu和H2SO4的物质的量,F表示O2的物质的量。
9.答案 (1)HCl、CuCl2 HCl、CuCl2
(2)Na2SO4、H2SO4 H2O
(3)CuSO4(或NaCl) CuO或CuCO3(或HCl)
解析 (1)以碳棒为电极,电解过程中电解质质量减少,水量不变,电解质可为无氧酸或不活泼金属的无氧酸盐,则阳离子只能为H+、C,阴离子只能是Cl-,其电解质是HCl、CuCl2。
(2)以碳棒为电极,电解过程中电解质质量不变,水量减少,实质上是电解水,H+、OH-分别在两极上放电,其电解质是Na2SO4、H2SO4。
(3)若电解质是CuSO4,2CuSO4+2H2O2H2SO4+2Cu+O2↑,若恢复到原状态,可加入CuO,也可加入CuCO3;若电解质是NaCl,2NaCl+2H2O2NaOH+H2↑+Cl2↑,要恢复到原状态可通入HCl。
10.B 解析 由图可知,电极Y上CO2→CO,发生还原反应,则电极Y是阴极,电极X是阳极,故a为电源的负极,A错误;设生成乙烯和乙烷的物质的量分别为2 mol 、1 mol,由碳原子个数守恒可知,消耗甲烷的物质的量为6 mol,由得失电子守恒可知,消耗二氧化碳的物质的量为=5 mol,则相同条件下,消耗甲烷和二氧化碳的体积比为6∶5,B正确;电解池中阴离子向阳极移动,故O2-从电极Y传导到电极X,C错误;消耗甲烷但不确定生成乙烯还是乙烷,无法计算转移电子数,D错误。
11.B 解析 右侧是阴极,氧气得电子发生还原反应转化为过氧化氢,电极反应为2H++O2+2e-===H2O2,A正确。该装置将光能和电能转化为化学能,B错误。SO2转化为S,每生成1 mol S,伴随2 mol 电子转移,根据转移电子守恒,有1 mol H2O2生成,C正确。根据装置知道,OH-通过交换膜a进入阳极参加反应,交换膜a应该为阴离子交换膜;H+通过交换膜b进入阴极参加反应,交换膜b应该为阳离子交换膜,D正确。
12.D 解析 图二中若开始实验时开关K与a连接,则形成原电池,电池的总反应式为Fe+2AgNO3===Fe+2Ag,电解液的浓度减小,A错误;图一中若开始实验时开关K与b连接,则形成电解池,铁棒作阴极,电解的总反应式为2NaCl+2H2O2NaOH+H2↑+Cl2↑,根据质量守恒可知一段时间后向电解液中通入适量的HCl可使电解液恢复到电解前的浓度,B错误;图一中若开始实验时开关K与a连接,形成原电池,B极的电极反应式应为Fe-2e-===Fe2+,C错误;图二中若开始实验时开关K与b连接,相当于电镀装置,根据电镀原理可知,D正确。
13.D 解析 实验Ⅰ中澄清石灰水不变浑浊,实验Ⅱ中澄清石灰水变浑浊,说明实验Ⅱ中X电极上生成了CO2,即X电极中的石墨与O2反应生成了CO2,则X电极为阳极,电极反应式为2H2O-4e-===O2↑+4H+,A正确、D错误;左侧石墨电极为阴极,水放电生成氢气,阴极的电极反应式为2H2O+2e-===H2↑+2OH-,B正确;Ⅰ中Pt电极为阳极,电极反应式为2H2O-4e-===O2↑+4H+,生成的H+与C反应生成HC,反应为C+H+===HC,C正确。
14.答案 (1)①2H2O+2e-===2OH-+H2↑,水电离产生的H+放电促进水的电离,溶液显碱性 ②Fe-2e-==Fe2+ (2)2Cl--2e-===Cl2↑ (3)还原 (4)①0.2 ②变蓝
③Fe2+-e-===Fe3+
解析 (3)由Fe2+生成F,Fe元素的化合价升高,Fe2+作还原剂,Fe2+具有还原性。
(4)①该实验是为了检验实验ⅱ中Cl-在阳极是否放电,所以该实验中氯离子浓度应与实验ⅱ中氯离子浓度相同,实验ⅱ中电解质溶液为0.1 mol·L-1FeCl2溶液,含有0.2 mol·L-1Cl-,所以NaCl的浓度为0.2 mol·L-1。
②氯气与碘化钾反应生成碘单质,淀粉遇碘单质变蓝。③通过实验数据可以看出,电解0.1 mol·L-1FeCl2溶液,当电压x的取值范围在x≥a、a>x≥b时,会有Fe3+生成,在c>x≥b时,无Cl2生成,在c>x≥b时,阳极发生的反应为Fe2+→e3+,电极反应式为Fe2+-e-===Fe3+。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
