2025人教版高中化学选择性必修1同步--第三章测评(含解析)
文档属性
| 名称 | 2025人教版高中化学选择性必修1同步--第三章测评(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 553.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-28 16:35:15 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025人教版高中化学选择性必修1
第三章测评
一、选择题:本题包括15小题,每小题3分,共45分。每小题只有1个选项符合题意。
1.下列物质的用途或事实与盐类的水解无关的是( )
A.用浓Na2CO3溶液处理锅炉水垢中的CaSO4
B.明矾[KAl(SO4)2·12H2O]用于净水
C.用热饱和Na2CO3溶液清洗试管壁上附着的植物油
D.由FeCl3·6H2O制取无水FeCl3固体时,需在HCl气流中蒸发
2.常温下,下列各离子组在指定溶液中能大量存在的是( )
A.由水电离出的c(H+)=10-14 mol·L-1:K+、、Fe3+、Cl-
B.c(Fe3+)=0.1 mol·L-1的溶液中:H+、I-、Br-、S
C.使石蕊变蓝的溶液中:Na+、[Al(OH)4]-、N、S
D.无色溶液中:Na+、Al3+、S2-、S
3.常温下,下列事实不能说明某一元酸HX是弱酸的是( )
A.0.1 mol·L-1HX溶液的pH=4
B.0.1 mol·L-1NaX溶液pH>7
C.0.1 mol·L-1HX溶液比0.1 mol·L-1硝酸导电能力弱
D.10 mL 0.1 mol·L-1NaOH溶液与10 mL 0.1 mol·L-1HX溶液恰好中和
4.现有常温下的四份溶液:①0.01 mol·L-1 CH3COOH溶液 ②0.01 mol·L-1HCl溶液
③pH=12的氨水 ④pH=12的NaOH溶液。下列说法正确的是( )
A.①中水的电离程度最小,③中水的电离程度最大
B.将②、③混合,若pH=7,则消耗溶液的体积:②=③
C.将四份溶液稀释相同倍数后,溶液的pH③>④,①>②
D.将①、④混合,若有c(CH3COO-)>c(Na+),则混合液一定呈碱性
5.25 ℃时,有关下列电解质溶液的叙述正确的是( )
A.pH=3的盐酸与pH=11的氨水等体积混合,溶液显酸性
B.将0.02 mol·L-1氨水与0.01 mol·L-1盐酸等体积混合:c(NH3·H2O)+c(OH-)=c()+c(H+)
C.0.1 mol·L-1的CH3COOH溶液中,水电离出的c(H+)=1.0×10-13 mol·L-1
D.HA为弱酸,往HA溶液中加入NaA固体,不变
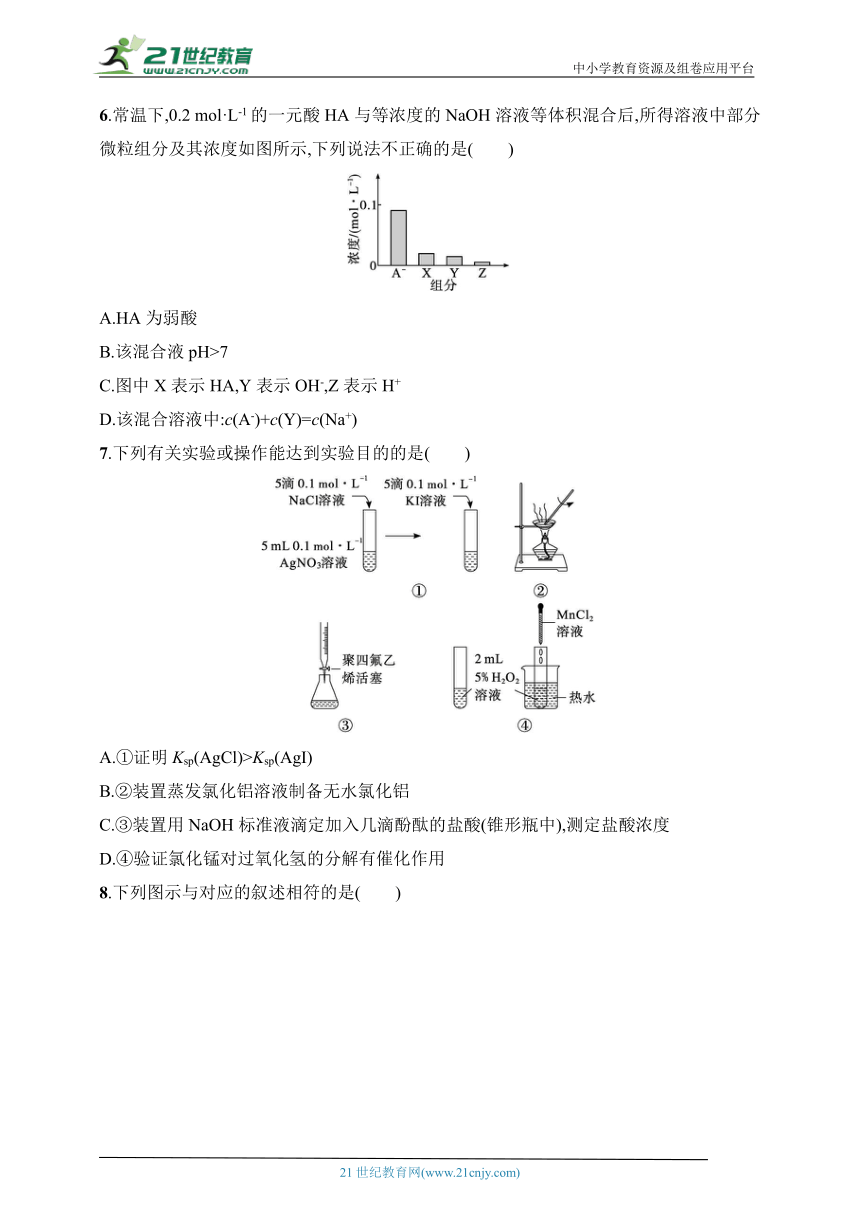
6.常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及其浓度如图所示,下列说法不正确的是( )
A.HA为弱酸
B.该混合液pH>7
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
7.下列有关实验或操作能达到实验目的的是( )
A.①证明Ksp(AgCl)>Ksp(AgI)
B.②装置蒸发氯化铝溶液制备无水氯化铝
C.③装置用NaOH标准液滴定加入几滴酚酞的盐酸(锥形瓶中),测定盐酸浓度
D.④验证氯化锰对过氧化氢的分解有催化作用
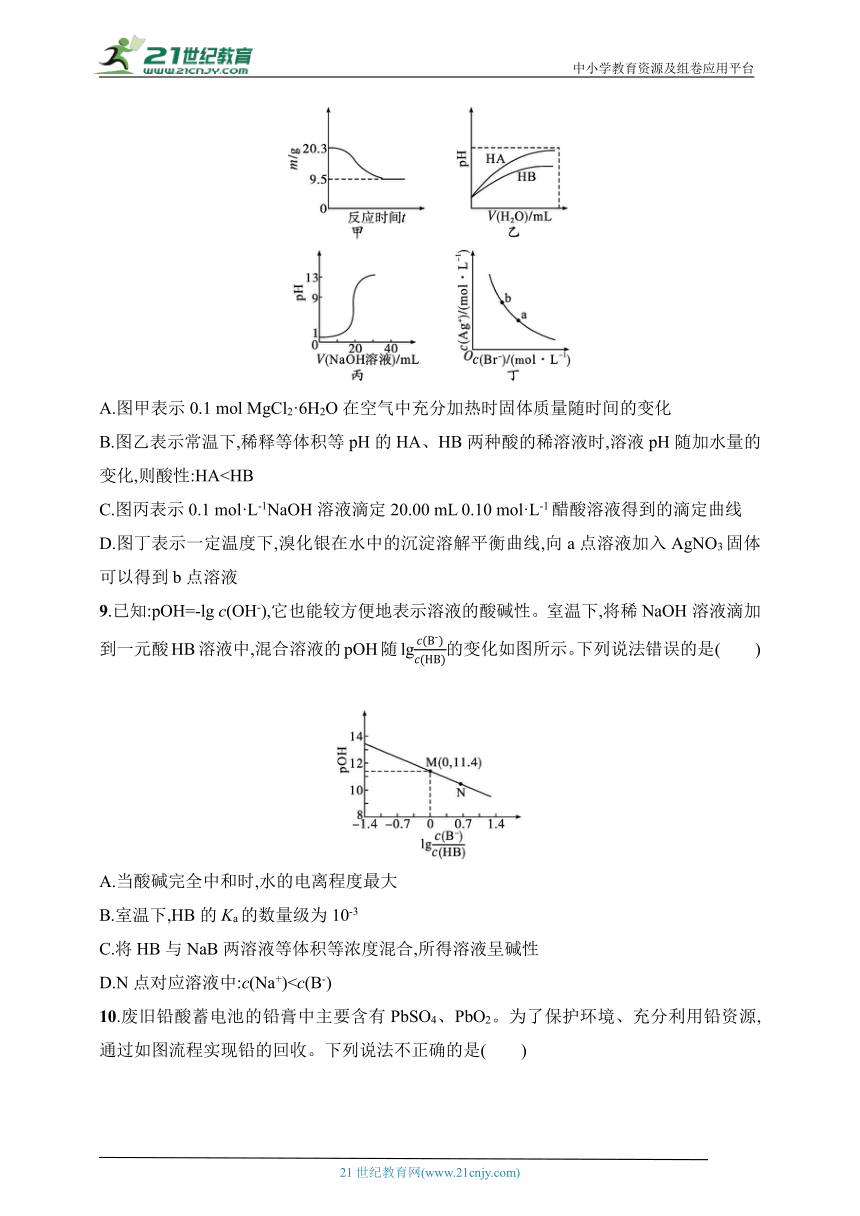
8.下列图示与对应的叙述相符的是( )
A.图甲表示0.1 mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B.图乙表示常温下,稀释等体积等pH的HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则酸性:HAC.图丙表示0.1 mol·L-1NaOH溶液滴定20.00 mL 0.10 mol·L-1醋酸溶液得到的滴定曲线
D.图丁表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,向a点溶液加入AgNO3固体可以得到b点溶液
9.已知:pOH=-lg c(OH-),它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随lg的变化如图所示。下列说法错误的是( )
A.当酸碱完全中和时,水的电离程度最大
B.室温下,HB的Ka的数量级为10-3
C.将HB与NaB两溶液等体积等浓度混合,所得溶液呈碱性
D.N点对应溶液中:c(Na+)10.废旧铅酸蓄电池的铅膏中主要含有PbSO4、PbO2。为了保护环境、充分利用铅资源,通过如图流程实现铅的回收。下列说法不正确的是( )
A.“铅膏”中PbO2主要来源于该电池的正极材料
B.“脱硫”是利用了Ksp(PbSO4)>Ksp(PbCO3)
C.“酸浸”后溶液中的主要阳离子为Pb2+和H+
D.“沉铅”后的滤液中存在:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
11.室温下,通过下列实验探究NaHSO3溶液的性质。下列有关说法正确的是( )
实验 实验操作和现象
1 用pH计测定0.5 mol·L-1 NaHSO3溶液的pH,测得pH约为6.4
2 向0.05 mol·L-1 NaHSO3溶液中滴加过量0.1 mol·L-1 Ca(OH)2溶液,产生白色沉淀
3 向10 mL 0.05 mol·L-1 NaHSO3溶液中滴加10 mL 0.05 mol·L-1盐酸,反应结束,测得pH约为3.2
4 向10 mL 0.05 mol·L-1 NaHSO3溶液中滴加10 mL 0.05 mol·L-1 NaOH溶液,反应结束,测得pH约为9.3
A.实验1中:NaHSO3溶液中满足HS的水解程度大于其电离程度
B.实验2反应静置后的上层清液中:c(Ca2+)·c(S)C.实验3滴加过程中:c(Na+)+c(H+)=c(HS)+2c(S)+c(OH-)
D.实验4滴加过程中:c(HS)+2c(S)+c(OH-)逐渐减小
12.25 ℃时,等体积两种一元酸HA和HB溶液分别用等浓度的NaOH溶液滴定,滴定曲线如图所示。下列说法正确的是( )
A.酸性:HAB.酸HB的电离度约为0.5%
C.起始浓度:c(HA)=0.1 mol·L-1,c(HB)=10-3 mol·L-1
D.用NaOH溶液滴定HB可用甲基橙作指示剂
13.T ℃时,Ksp(CaSO4)=4.0×10-6、Ksp(CaCO3)=4.0×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lg c(阴离子)、pN=-lg c(阳离子)。下列说法错误的是( )
A.c线是PbCO3沉淀溶解平衡曲线
B.T ℃时,向0.001 mol CaCO3沉淀中加入Na2SO4溶液(反应后溶液为1 L),使CaCO3沉淀能转化为CaSO4沉淀,所需Na2SO4的物质的量至少为1.001 mol
C.T ℃时,向10 mL 水中加入CaCO3和PbCO3至二者均饱和,溶液中
D.若d点表示CaCO3的饱和溶液与饱和CaSO4溶液等体积混合,则c(C)14.25 ℃时,用0.10 mol·L-1的氨水滴定10.00 mL 0.05 mol·L-1的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中lg的关系如图所示。下列说法正确的是( )
A.H2A的电离方程式为H2AH++HA-
B.B点溶液中,水电离出的氢离子浓度为1.0×10-8 mol·L-1
C.C点溶液中,c(N)+c(NH3·H2O)=2c(A2-)
D.25 ℃时,NH3·H2O的电离平衡常数为Kb=
15.已知H2A为二元酸,其电离过程为:H2AH++HA-,HA-H++A2-。常温时,向10 mL 0.1 mol·L-1 H2A水溶液中逐滴滴加0.1 mol·L-1NaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法错误的是( )
A.H2A的的数量级为10-3
B.当溶液中c(H2A)=c(A2-)时,pH=2.7
C.当溶液中c(Na+)=2c(A2-)+c(HA-)时,加入NaOH溶液体积大于10 mL
D.向pH=4.2的溶液中继续滴加NaOH溶液,水的电离程度先变大后减小
二、非选择题:本题包括4小题,共55分。
16.(13分)根据化学平衡理论,请回答下列问题:
(1)向含有酚酞的0.1 mol·L-1的氨水中加入少量NH4Cl固体,观察到的现象是 ,
请结合离子方程式分析产生该现象的主要原因是
。
(2)将体积相等的NaOH稀溶液和CH3COOH溶液混合,若混合溶液呈中性,则溶液中c(Na+) (填“>”“<”或“=”,下同)c(CH3COO-),则混合前c(NaOH) c(CH3COOH)。
(3)为配制SbCl3溶液,取少量SbCl3固体溶于2~3 mL水中,观察到有白色沉淀生成,为避免出现该现象,配制SbCl3溶液的正确方法是 。
(4)25 ℃时,已知Ksp[Cu(OH)2]=2×10-20,要使c(Cu2+)=0.2 mol·L-1溶液中的Cu2+沉淀较完全[残留在溶液中的c(Cu2+)降低到2×10-4 mol·L-1],则应加入NaOH溶液调节pH为 。
(5)用可溶性碳酸盐可以浸取CaSO4固体,则溶液浸取过程中会发生反应:CaSO4(s)+C(aq)CaCO3(s)+S(aq)。已知298 K时,
Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K= (计算结果保留三位有效数字)。
17.(14分)醋是中国古代劳动人民发明的传统调味品,老陈醋是中国四大名醋之一。
(1)老陈醋的主要成分是醋酸。若使0.1 mol·L-1的醋酸溶液中c(CH3COO-)增大,c(H+)减小,可以采取的措施是
(任写一条措施)。
(2)室温条件下,用电位滴定法模拟测定某醋酸溶液样品中醋酸的含量,操作如下:
ⅰ.准确量取10.00 mL 醋酸溶液样品,加入蒸馏水至总体积为100 mL,取其中20 mL 进行滴定实验,用酸度计检测pH变化:
ⅱ.逐滴滴入0.100 0 mol·L-1的NaOH溶液,酸度计显示pH=8.7(此时醋酸和NaOH以物质的量1∶1反应)达到滴定终点,记录消耗的NaOH溶液的体积V(NaOH溶液);
ⅲ.平行测定多次(数据见表1);
ⅳ.分析处理数据。
表1 实验数据记录表格
编号 1 2 3 4
V(NaOH溶液)/mL 24.99 25.00 25.01 24.00
①第1次滴定曲线如图所示,下列说法正确的是 。
a.a点溶液:
c(CH3COO-)>c(H+)
b.b点溶液:c(Na+)=c(CH3COO-)
c.c点溶液:c(Na+)>c(CH3COO-)+c(CH3COOH)
②计算c点水电离出的c(OH-)= mol·L-1。
③滴定过程中,从a点到c点水电离出的c(OH-)逐渐增大,用平衡移动原理解释: 。
④根据表1中的有效数据,计算该醋酸溶液样品中醋酸的含量是 g·100 mL-1。
⑤若进行滴定实验时,没有用NaOH溶液润洗碱式滴定管,会导致的结果是 。
18.(14分)含氮、含硫化合物在工业、农业生产中应用广泛,氮、硫的氧化物对环境不友好经常采用碱液吸收法消除氮、硫的氧化物。
(1)硫酸肼(N2H6SO4)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与(NH4)2SO4类似,写出硫酸肼第一步水解反应的离子方程式: 。
(2)利用氢氧化钠溶液吸收SO2。吸收SO2的过程中,溶液中H2SO3、、S三者所占物质的量分数(a)随pH变化的关系
如图所示:
①图中pH=7时,溶液中离子浓度关系正确的是 (填字母)。
A.c(Na+)>2c(S)>c()
B.c(Na+)=c(S)+c()+c(H2SO3)
C.c(OH-)=c(H+)+c(H2SO3)+c()
D.c(Na+)>c()>c(S)>c(H+)=c(OH-)
②利用图中数据,求H2SO3H++的平衡常数为 。
③用NaOH吸收SO2,并用CaO使NaOH再生:Na2SO3(aq)NaOH(aq)。CaO在水中存在如下转化:CaO(s)+H2O(l)Ca(OH)2(s)Ca2+(aq)+2OH-(aq),从平衡移动的角度,简述NaOH再生的原理: 。
(3)利用氢氧化钠溶液吸收NO2,反应为2NO2+2NaOHNaNO3+NaNO2+H2O。已知25 ℃电离常数Ka(HNO2)=5.6×10-4、Ka(CH3COOH)=1.75×10-5,现有溶液A:含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液;溶液B:0.1 mol·L-1CH3COONa溶液。两份溶液中c()、c()和c(CH3COO-)由大到小的顺序为 。
19.(14分)氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.01 mol ·L-1酸性KMnO4溶液和未知浓度的无色NaHSO3溶液。反应离子方程式是2Mn+5HS+H+2Mn2++5S+3H2O。填空回答问题:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少 。
(2)不用 (填“酸”或“碱”)式滴定管盛放高锰酸钾溶液,试分析原因: 。
(3)选何种指示剂,说明理由 ,
到达终点时颜色变化为 。
(4)当用酸滴定碱时,下列操作使测定结果(碱的浓度)偏高的是 。
①酸式滴定管滴至终点,俯视读数
②碱液移入锥形瓶后,加入10 mL 蒸馏水
③酸式滴定管注入酸溶液后,尖嘴有气泡时便开始滴定,滴定后无气泡
④酸式滴定管用蒸馏水润洗后,未用标准液润洗
(5)实验有关数据记录如下:
实验 序号 待测液体 积/mL 所消耗酸性KMnO4溶液的体积/mL
滴定前 滴定后
1 20 0.50 20.60
2 20 6.00 25.90
3 20 1.40 24.20
则NaHSO3溶液的物质的量浓度为 mol ·L-1。
第三章测评
1.A 解析 CaSO4存在溶解平衡,用浓Na2CO3溶液处理,使离子积Q=c(Ca2+)·c(C)>Ksp(CaCO3),能将CaSO4转化为CaCO3,再用稀盐酸除去CaCO3,与盐类水解无关,A错误;明矾[KAl(SO4)2·12H2O]用于净水是由于Al3+水解产生Al(OH)3胶体,使悬浊物沉降,可以净水,B正确;碳酸钠是强碱弱酸盐,水解显碱性,故能使植物油水解,和盐类水解有关,C正确;Fe3+在水中会水解,加热会促进Fe3+的水解,故由FeCl3·6H2O制取无水FeCl3需在HCl气流中蒸发,抑制Fe3+的水解,D正确。
2.C 解析 常温下,由水电离出的c(H+)=10-14 mol·L-1的溶液中水的电离受到抑制,可能加入了酸或碱溶液,酸性条件下、Cl-发生氧化还原反应而不能大量共存,A错误;c(Fe3+)=0.1 mol·L-1的溶液中,Fe3+与I-发生氧化还原反应而不能大量共存,B错误;无色溶液中,Al3+、S2-发生相互促进的水解反应生成Al(OH)3沉淀和H2S气体,不能大量共存,D错误。
3.D 解析 0.1 mol·L-1HX溶液的pH=4,说明该溶液中c(H+)=10-4 mol·L-17,溶液显碱性,说明NaX是强碱弱酸盐,能说明HX是弱酸,B不符合题意;0.1 mol·L-1HX溶液比0.1 mol·L-1硝酸导电能力弱,说明HX的酸性弱于硝酸,能说明HX是弱酸,C不符合题意;10 mL 0.1 mol·L-1NaOH溶液与10 mL 0.1 mol·L-1HX溶液恰好中和,只能说明HX为一元酸,不能说明HX是弱酸,D符合题意。
4.C 解析 ①0.01 mol·L-1CH3COOH溶液中CH3COOH发生部分电离,溶液中的c(H+)<10-2 mol·L-1;②0.01 mol·L-1HCl溶液中c(H+)=10-2 mol·L-1;③pH=12的氨水,c(OH-)=10-2 mol·L-1;④pH=12的NaOH溶液,c(OH-)=10-2 mol·L-1。①H+对水电离的抑制作用最弱,水的电离程度最大,②中酸电离出的c(H+)与③、④中碱电离出的c(OH-)相同,对水电离的抑制作用相同,水的电离程度一样大,A错误;将②③等体积混合后溶液呈碱性,碱过量,要使混合后溶液pH=7,则消耗溶液的体积:②>③,B错误;稀释促进弱电解质的电离,将四份溶液稀释相同倍数后,溶液的pH:③>④,①>②,C正确;①、④混合,当溶液中存在c(CH3COO-)>c(Na+)时,根据电荷守恒可得:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),则c(H+)>c(OH-),溶液一定显酸性,D错误。
5.D 解析 pH=3的盐酸中c(HCl)=10-3 mol·L-1,pH=11的氨水中c(NH3·H2O)大于10-3 mol·L-1,等体积混合后氨水过量,所得混合溶液显碱性,A错误;将0.02 mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,充分反应所得溶液是等浓度NH4Cl和氨水的混合溶液,存在质子守恒关系:c(NH3·H2O)+2c(OH-)=c()+2c(H+),B错误;0.1 mol·L-1的CH3COOH溶液中,c(H+)<0.1 mol·L-1,故水电离出的c(H+)>1.0×10-13 mol·L-1,C错误;由于,水的离子积常数和弱酸的电离平衡常数都只受温度影响,温度不变,比值不变,D正确。
6.C 解析 常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合,溶液中溶质为NaA,则由图像可知HA为弱酸,A正确;NaA溶液中A-水解使溶液呈碱性,B正确;溶液中粒子有Na+、A-、HA、H+、OH-,且大小关系为c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+),故X表示OH-,Y表示HA,Z表示H+,C错误;溶液中存在元素质量守恒:c(Na+)=c(A-)+c(HA),D正确。
7.C 解析 ①中硝酸银过量,过量硝酸银会与碘化钾反应生成碘化银沉淀,不能证明Ksp(AgCl)>Ksp(AgI),A错误;铝离子容易水解生成氢氧化铝,另一水解产物是易挥发的盐酸,故不能蒸发氯化铝溶液制备无水氯化铝,B错误;用NaOH标准液滴定加入几滴酚酞的盐酸(锥形瓶中),当最后半滴标准液滴入后溶液变红色且半分钟内不褪色,说明达到滴定终点,聚四氟乙烯活塞滴定管可以酸碱两用,C正确;实验中变量不唯一,不能验证氯化锰对过氧化氢的分解有催化作用,D错误。
8.D 解析 0.1 mol MgCl2·6H2O在空气中充分加热时最终得到固体为0.1 mol MgO,其质量为0.1 mol×40 g·mol-1=4 g,A错误。稀释等体积等pH的HA、HB两种酸的稀溶液时,加入等量水时,HA的pH变化幅度大,故酸性:HA>HB,B错误。醋酸为弱酸,在水中部分电离,0.10 mol·L-1醋酸溶液的pH>1,C错误。图丁表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,向a点溶液加入AgNO3固体,银离子浓度增大,溴离子反应浓度减小,则可以得到b点溶液,D正确。
9.C 解析 当酸碱恰好完全中和时生成盐NaB,此时水的电离程度最大,A正确;室温下,M点pOH=11.4,则HB的Ka==c(H+)=10-2.6=100.4×10-3,其数量级为10-3,B正确;将HB与NaB两溶液等体积等浓度混合,Ka(HB)=10-2.6,Kh(B-)=10-11.47,溶液显酸性,根据电荷守恒得到N点对应溶液中:c(Na+)10.D 解析 铅酸蓄电池中Pb为负极,PbO2为正极,PbO2主要来源于电池的正极材料,A正确;脱硫中,碳酸钠溶液与硫酸铅反应生成碳酸铅和硫酸钠,反应的离子方程式为PbSO4(s)+C(aq)PbCO3(s)+S(aq),因为PbSO4的溶度积大于PbCO3,故能实现脱硫,B正确;“酸浸”时醋酸与碳酸铅反应生成Pb2+,过氧化氢作还原剂将+4价的铅转化为+2价的Pb2+,因此“酸浸”后溶液中的阳离子主要为Pb2+和H+,C正确;氢氧化铅存在沉淀溶解平衡,“沉铅”后的滤液中还含有少量的Pb2+,据电荷守恒可知,溶液中存在:c(Na+)+c(H+)+2c(Pb2+)=c(CH3COO-)+c(OH-),D错误。
11.D 解析 实验1中0.05 mol·L-1 NaHSO3溶液的pH约为6.4,溶液呈酸性,故NaHSO3溶液中HS的水解程度小于其电离程度,A错误;实验2上层清液中已经达到CaSO3溶解平衡,故c(Ca2+)·c(S)=Ksp(CaSO3),B错误;实验3滴加过程中,根据电荷守恒可知,c(Na+)+c(H+)=c(HS)+2c(S)+c(OH-)+c(Cl-),C错误;根据电荷守恒:c(Na+)+c(H+)=c(HS)+2c(S)+c(OH-),c(Na+)+c(H+)逐渐减小,D正确。
12.B 解析 滴定达终点时,HB消耗NaOH溶液的体积大,则表明c(HB)>c(HA),而起始时pH(HB)>pH(HA),则酸性:HA>HB,A错误;滴定HA的终点pH=7,则HA是强酸,c(HA)=c(H+)=0.1 mol·L-1,HB是弱酸,部分电离,其溶液的pH=3,则电离部分c电离(HB)≈c(H+)=10-3 mol·L-1,滴定等体积的两种酸时,滴定HB消耗的氢氧化钠是滴定HA的两倍,则起始时c(HB)=2c(HA)≈0.2 mol·L-1,则酸HB的电离度为×100%=0.5%,B正确;初始时,HB的pH为3,而酸性HA>HB,说明HB是弱酸部分电离,则有c(HB)>10-3 mol·L-1,C错误;甲基橙变色范围为3.1~4.4,由图可知该pH范围内NaOH滴定HB未发生突跃,不可用甲基橙作指示剂,D错误。
13.D 解析 由图可知,a线表示的Ksp数值最大,则为CaSO4沉淀溶解平衡曲线;b、c分别表示CaCO3、PbCO3沉淀溶解平衡曲线,A正确;T ℃时,向0.001 mol CaCO3沉淀中加入Na2SO4溶液(反应后溶液为1 L),使CaCO3沉淀能转化为CaSO4沉淀:CaCO3(s)+SCaSO4(s)+C,则需要消耗硫酸根离子0.001 mol,同时生成碳酸根离子0.001 mol,则溶液中钙离子的浓度为mol·L-1=4.0×10-6 mol·L-1,则溶液中硫酸根离子浓度至少为mol·L-1=1.0 mol·L-1,物质的量为1.0 mol,故所需Na2SO4的物质的量至少为1.001 mol,B正确;T ℃时,向10 mL 水中加入CaCO3和PbCO3至二者均饱和,溶液中,C正确;d点表示CaCO3的饱和溶液中钙离子浓度大于碳酸根离子浓度,由图可知,钙离子浓度约为10-2 mol·L-1,则碳酸根离子浓度约为4×10-7 mol·L-1;加入CaSO4饱和溶液中钙离子、硫酸根离子浓度约为2×10-3 mol·L-1,两者等体积混合后,仍然为钙离子浓度最大、碳酸根离子浓度最小,故c(C)14.D 解析 25 ℃时,A点lg=-12,结合KW=c(OH-)·c(H+)=1×10-14,解得c(H+)=0.1 mol·L-1,说明0.05 mol·L-1 H2A完全电离,则电离方程式为H2A2H++A2-,A错误。B点加入10 mL 氨水,恰好完全反应生成(NH4)2A,此时lg=-2,则有c(H+)=1×10-6 mol·L-1,而H+全部来源于水的电离,故水电离出的c(H+)=1×10-6 mol·L-1,B错误。C点溶液是(NH4)2A和NH3·H2O的混合溶液,lg=0,则有c(OH-)=c(H+),根据电荷守恒可得:c(H+)+c(N)=c(OH-)+2c(A2-),则有c(N)=2c(A2-),C错误。C点溶液中c(N)=2c(A2-)=0.1 mol·L-1×,由c(N)+c(NH3·H2O)=0.1 mol·L-1×可得,c(NH3·H2O)=0.1 mol·L-1×;C点溶液lg=0,c(OH-)=c(H+)=10-7 mol·L-1,求出25 ℃时NH3·H2O的电离常数为Kb=,D正确。
15.A 解析 据题给信息推知,Ⅰ为H2A含量变化曲线,Ⅱ为HA-含量变化曲线,Ⅲ为A2-含量变化曲线。Ⅱ与Ⅲ交点处氢离子浓度即为此二元酸的第二级电离常数值,其数量级为10-5,A错误;(H2A)=10-1.2时,同理(H2A)=10-4.2,当c(H2A)=c(A2-)时,=c2(H+),此时c(H+)=1×10-2.7 mol·L-1,pH=2.7,B正确;当溶液中c(Na+)=2c(A2-)+c(HA-)时,由电荷守恒分析此时溶液呈现中性,向10 mL 0.1 mol·L-1 H2A水溶液中逐滴滴加0.1 mol·L-1NaOH溶液,若加入NaOH溶液体积等于10 mL,此时形成NaHA溶液,其电离大于水解,溶液呈现酸性,故应在10 mL 的基础上多加NaOH,溶液才有可能呈现中性,C正确;向pH=4.2的溶液中继续滴加NaOH溶液,结合图分析,HA-含量再减小,A2-含量增大,故水的电离程度再增大,而氢氧化钠溶液过量则会导致水的电离受到抑制,故水的电离程度先变大后减小,D正确。
16.答案 (1)红色溶液颜色变浅 NH3·H2ON+OH-,加入NH4Cl固体,c(N)增大,平衡向左移动,c(OH-)减小,因此溶液颜色由红色变浅 (2)= < (3)先将SbCl3固体溶解在较浓的盐酸中,再加水稀释到所需浓度 (4)6 (5)1.75×104
解析 (1)向含有酚酞的0.1 mol·L-1的氨水中加入少量NH4Cl固体,铵根离子浓度增大,氨水电离平衡逆向移动,氢氧根浓度减小,红色的溶液颜色变浅。
(2)将体积相等的NaOH稀溶液和CH3COOH溶液混合,混合后溶液呈中性,再根据电荷守恒得到溶液中c(Na+)=c(CH3COO-);若浓度相等、体积相等混合,则生成醋酸钠,醋酸钠中醋酸根水解显碱性,而要使混合溶液呈中性,则还需加酸,由于体积相等,混合前c(NaOH)(3)根据题意为配制SbCl3溶液,要避免出现有白色沉淀,主要是加盐酸来抑制SbCl3水解,配制SbCl3溶液的正确方法是先将SbCl3固体溶解在较浓的盐酸中,再加水稀释到所需浓度。
(4)根据题意得出Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)=2×10-4×c2(OH-)=2×10-20,c(OH-)=1×10-8 mol·L-1,c(H+)=mol·L-1=1×10-6 mol·L-1,则pH=6。
(5)溶浸过程中会发生:CaSO4(s)+C(aq)CaCO3(s)+S(aq)。依据硫酸钙、碳酸钙溶度积常数的计算表达式,则该反应的平衡常数K==1.75×104。
17.答案 (1)加入氢氧化钠固体或加入碳酸钠固体或加入醋酸钠固体 (2)①b ②10-5.3 ③溶液中存在水的电离平衡H2OOH-+H+,随着NaOH加入,CH3COOH浓度降低,醋酸对水电离的抑制程度减弱 ④7.5 ⑤测得的醋酸溶液样品中醋酸的含量偏高
解析 (1)加入氢氧化钠固体或者碳酸钠固体与氢离子反应,电离平衡正向移动,可以达到目的;加入醋酸钠固体,因为加入了醋酸根离子使其浓度增大,平衡逆向移动氢离子浓度会减小。
(2)①a、b、c点溶液的溶质分别为:醋酸、醋酸钠和醋酸、醋酸钠,对于a点醋酸同时电离出等浓度的醋酸根离子和氢离子,水也会电离出少量氢离子,则c(CH3COO-)18.答案 (1)N2+H2O+H+ (2)①A ②10-1.8 ③S与Ca2+生成CaSO3沉淀,平衡正向移动,有NaOH生成 (3)c()>c()>c(CH3COO-)
解析 (1)因水解原理与SO4类似,则N2水解结合H2O电离生成的OH-,水解离子方程式为N2+H2O+H+。
(2)①c(OH-)=c(H+)、c(S)=c(),根据电荷守恒c(H+)+c(Na+)=2c(S)+c()+c(OH-),则c(Na+)>2c(S),c(Na+)>2c(S)>c(),A正确;c(Na+)=2c(S)+c(),因为c(S)≠c(H2SO3),B错误;溶液呈中性,则c(OH-)=c(H+),存在c(OH-)(3)根据方程式2NO2+2NaOHNaNO3+NaNO2+H2O知,0.2 mol NaOH和0.2 mol NO2恰好完全反应生成0.1 mol NaNO3和0.1 mol NaNO2,溶液的体积为1 L,则溶液A中含有0.1 mol·L-1的NaNO3、0.1 mol·L-1的NaNO2;溶液B中含有0.1 mol·L-1的CH3COONa,NaNO3是强酸强碱盐,不水解,c()最大;Ka(HNO2)>Ka(CH3COOH),则水解程度:c(CH3COO-),故有c()>c()>c(CH3COO-)。
19.答案 (1)锥形瓶
(2)碱 高锰酸钾具有强氧化性,能够腐蚀碱式滴定管的橡胶管,因此量取高锰酸钾溶液用酸式滴定管
(3)不用指示剂,高锰酸钾本身是有颜色,能作指示剂 颜色由无色变成浅红色
(4)③④
(5)0.025
解析 (2)高锰酸钾具有强氧化性,碱式滴定管的下端有一段橡胶,橡胶里面有碳碳双键,高锰酸钾能氧化橡胶,因此盛放高锰酸钾应用酸式滴定管,不能用碱式滴定管。
(3)选用指示剂的目的是便于观察滴定到终点,本实验中高锰酸钾溶液是紫红色的,可以作为指示剂,当滴入最后半滴标准溶液,溶液由无色变成浅红色,且半分钟内不褪色,说明达到了终点。
(4)根据c(OH-)=分析,俯视读数,消耗酸的体积减小,测定结果偏低,①错误;碱液移入锥形瓶,加入10 mL 蒸馏水,溶质的物质的量不变,对实验测定结果无影响,②错误;尖嘴有气泡时便开始滴定,滴定后无气泡,消耗的酸的体积偏多,测定结果偏高,③正确;酸式滴定管用蒸馏水润洗后,未用标准液润洗,相当于对标准液稀释,消耗酸溶液的体积增多,测定结果偏高,④正确。
(5)去掉误差较大的数据,则消耗的KMnO4溶液的平均体积是20 mL,根据关系式2~5,c(NaHSO3)=mol·L-1=0.025 mol·L-1。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025人教版高中化学选择性必修1
第三章测评
一、选择题:本题包括15小题,每小题3分,共45分。每小题只有1个选项符合题意。
1.下列物质的用途或事实与盐类的水解无关的是( )
A.用浓Na2CO3溶液处理锅炉水垢中的CaSO4
B.明矾[KAl(SO4)2·12H2O]用于净水
C.用热饱和Na2CO3溶液清洗试管壁上附着的植物油
D.由FeCl3·6H2O制取无水FeCl3固体时,需在HCl气流中蒸发
2.常温下,下列各离子组在指定溶液中能大量存在的是( )
A.由水电离出的c(H+)=10-14 mol·L-1:K+、、Fe3+、Cl-
B.c(Fe3+)=0.1 mol·L-1的溶液中:H+、I-、Br-、S
C.使石蕊变蓝的溶液中:Na+、[Al(OH)4]-、N、S
D.无色溶液中:Na+、Al3+、S2-、S
3.常温下,下列事实不能说明某一元酸HX是弱酸的是( )
A.0.1 mol·L-1HX溶液的pH=4
B.0.1 mol·L-1NaX溶液pH>7
C.0.1 mol·L-1HX溶液比0.1 mol·L-1硝酸导电能力弱
D.10 mL 0.1 mol·L-1NaOH溶液与10 mL 0.1 mol·L-1HX溶液恰好中和
4.现有常温下的四份溶液:①0.01 mol·L-1 CH3COOH溶液 ②0.01 mol·L-1HCl溶液
③pH=12的氨水 ④pH=12的NaOH溶液。下列说法正确的是( )
A.①中水的电离程度最小,③中水的电离程度最大
B.将②、③混合,若pH=7,则消耗溶液的体积:②=③
C.将四份溶液稀释相同倍数后,溶液的pH③>④,①>②
D.将①、④混合,若有c(CH3COO-)>c(Na+),则混合液一定呈碱性
5.25 ℃时,有关下列电解质溶液的叙述正确的是( )
A.pH=3的盐酸与pH=11的氨水等体积混合,溶液显酸性
B.将0.02 mol·L-1氨水与0.01 mol·L-1盐酸等体积混合:c(NH3·H2O)+c(OH-)=c()+c(H+)
C.0.1 mol·L-1的CH3COOH溶液中,水电离出的c(H+)=1.0×10-13 mol·L-1
D.HA为弱酸,往HA溶液中加入NaA固体,不变
6.常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及其浓度如图所示,下列说法不正确的是( )
A.HA为弱酸
B.该混合液pH>7
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
7.下列有关实验或操作能达到实验目的的是( )
A.①证明Ksp(AgCl)>Ksp(AgI)
B.②装置蒸发氯化铝溶液制备无水氯化铝
C.③装置用NaOH标准液滴定加入几滴酚酞的盐酸(锥形瓶中),测定盐酸浓度
D.④验证氯化锰对过氧化氢的分解有催化作用
8.下列图示与对应的叙述相符的是( )
A.图甲表示0.1 mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B.图乙表示常温下,稀释等体积等pH的HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则酸性:HA
D.图丁表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,向a点溶液加入AgNO3固体可以得到b点溶液
9.已知:pOH=-lg c(OH-),它也能较方便地表示溶液的酸碱性。室温下,将稀NaOH溶液滴加到一元酸HB溶液中,混合溶液的pOH随lg的变化如图所示。下列说法错误的是( )
A.当酸碱完全中和时,水的电离程度最大
B.室温下,HB的Ka的数量级为10-3
C.将HB与NaB两溶液等体积等浓度混合,所得溶液呈碱性
D.N点对应溶液中:c(Na+)
A.“铅膏”中PbO2主要来源于该电池的正极材料
B.“脱硫”是利用了Ksp(PbSO4)>Ksp(PbCO3)
C.“酸浸”后溶液中的主要阳离子为Pb2+和H+
D.“沉铅”后的滤液中存在:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
11.室温下,通过下列实验探究NaHSO3溶液的性质。下列有关说法正确的是( )
实验 实验操作和现象
1 用pH计测定0.5 mol·L-1 NaHSO3溶液的pH,测得pH约为6.4
2 向0.05 mol·L-1 NaHSO3溶液中滴加过量0.1 mol·L-1 Ca(OH)2溶液,产生白色沉淀
3 向10 mL 0.05 mol·L-1 NaHSO3溶液中滴加10 mL 0.05 mol·L-1盐酸,反应结束,测得pH约为3.2
4 向10 mL 0.05 mol·L-1 NaHSO3溶液中滴加10 mL 0.05 mol·L-1 NaOH溶液,反应结束,测得pH约为9.3
A.实验1中:NaHSO3溶液中满足HS的水解程度大于其电离程度
B.实验2反应静置后的上层清液中:c(Ca2+)·c(S)
D.实验4滴加过程中:c(HS)+2c(S)+c(OH-)逐渐减小
12.25 ℃时,等体积两种一元酸HA和HB溶液分别用等浓度的NaOH溶液滴定,滴定曲线如图所示。下列说法正确的是( )
A.酸性:HA
C.起始浓度:c(HA)=0.1 mol·L-1,c(HB)=10-3 mol·L-1
D.用NaOH溶液滴定HB可用甲基橙作指示剂
13.T ℃时,Ksp(CaSO4)=4.0×10-6、Ksp(CaCO3)=4.0×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lg c(阴离子)、pN=-lg c(阳离子)。下列说法错误的是( )
A.c线是PbCO3沉淀溶解平衡曲线
B.T ℃时,向0.001 mol CaCO3沉淀中加入Na2SO4溶液(反应后溶液为1 L),使CaCO3沉淀能转化为CaSO4沉淀,所需Na2SO4的物质的量至少为1.001 mol
C.T ℃时,向10 mL 水中加入CaCO3和PbCO3至二者均饱和,溶液中
D.若d点表示CaCO3的饱和溶液与饱和CaSO4溶液等体积混合,则c(C)
A.H2A的电离方程式为H2AH++HA-
B.B点溶液中,水电离出的氢离子浓度为1.0×10-8 mol·L-1
C.C点溶液中,c(N)+c(NH3·H2O)=2c(A2-)
D.25 ℃时,NH3·H2O的电离平衡常数为Kb=
15.已知H2A为二元酸,其电离过程为:H2AH++HA-,HA-H++A2-。常温时,向10 mL 0.1 mol·L-1 H2A水溶液中逐滴滴加0.1 mol·L-1NaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列说法错误的是( )
A.H2A的的数量级为10-3
B.当溶液中c(H2A)=c(A2-)时,pH=2.7
C.当溶液中c(Na+)=2c(A2-)+c(HA-)时,加入NaOH溶液体积大于10 mL
D.向pH=4.2的溶液中继续滴加NaOH溶液,水的电离程度先变大后减小
二、非选择题:本题包括4小题,共55分。
16.(13分)根据化学平衡理论,请回答下列问题:
(1)向含有酚酞的0.1 mol·L-1的氨水中加入少量NH4Cl固体,观察到的现象是 ,
请结合离子方程式分析产生该现象的主要原因是
。
(2)将体积相等的NaOH稀溶液和CH3COOH溶液混合,若混合溶液呈中性,则溶液中c(Na+) (填“>”“<”或“=”,下同)c(CH3COO-),则混合前c(NaOH) c(CH3COOH)。
(3)为配制SbCl3溶液,取少量SbCl3固体溶于2~3 mL水中,观察到有白色沉淀生成,为避免出现该现象,配制SbCl3溶液的正确方法是 。
(4)25 ℃时,已知Ksp[Cu(OH)2]=2×10-20,要使c(Cu2+)=0.2 mol·L-1溶液中的Cu2+沉淀较完全[残留在溶液中的c(Cu2+)降低到2×10-4 mol·L-1],则应加入NaOH溶液调节pH为 。
(5)用可溶性碳酸盐可以浸取CaSO4固体,则溶液浸取过程中会发生反应:CaSO4(s)+C(aq)CaCO3(s)+S(aq)。已知298 K时,
Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K= (计算结果保留三位有效数字)。
17.(14分)醋是中国古代劳动人民发明的传统调味品,老陈醋是中国四大名醋之一。
(1)老陈醋的主要成分是醋酸。若使0.1 mol·L-1的醋酸溶液中c(CH3COO-)增大,c(H+)减小,可以采取的措施是
(任写一条措施)。
(2)室温条件下,用电位滴定法模拟测定某醋酸溶液样品中醋酸的含量,操作如下:
ⅰ.准确量取10.00 mL 醋酸溶液样品,加入蒸馏水至总体积为100 mL,取其中20 mL 进行滴定实验,用酸度计检测pH变化:
ⅱ.逐滴滴入0.100 0 mol·L-1的NaOH溶液,酸度计显示pH=8.7(此时醋酸和NaOH以物质的量1∶1反应)达到滴定终点,记录消耗的NaOH溶液的体积V(NaOH溶液);
ⅲ.平行测定多次(数据见表1);
ⅳ.分析处理数据。
表1 实验数据记录表格
编号 1 2 3 4
V(NaOH溶液)/mL 24.99 25.00 25.01 24.00
①第1次滴定曲线如图所示,下列说法正确的是 。
a.a点溶液:
c(CH3COO-)>c(H+)
b.b点溶液:c(Na+)=c(CH3COO-)
c.c点溶液:c(Na+)>c(CH3COO-)+c(CH3COOH)
②计算c点水电离出的c(OH-)= mol·L-1。
③滴定过程中,从a点到c点水电离出的c(OH-)逐渐增大,用平衡移动原理解释: 。
④根据表1中的有效数据,计算该醋酸溶液样品中醋酸的含量是 g·100 mL-1。
⑤若进行滴定实验时,没有用NaOH溶液润洗碱式滴定管,会导致的结果是 。
18.(14分)含氮、含硫化合物在工业、农业生产中应用广泛,氮、硫的氧化物对环境不友好经常采用碱液吸收法消除氮、硫的氧化物。
(1)硫酸肼(N2H6SO4)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与(NH4)2SO4类似,写出硫酸肼第一步水解反应的离子方程式: 。
(2)利用氢氧化钠溶液吸收SO2。吸收SO2的过程中,溶液中H2SO3、、S三者所占物质的量分数(a)随pH变化的关系
如图所示:
①图中pH=7时,溶液中离子浓度关系正确的是 (填字母)。
A.c(Na+)>2c(S)>c()
B.c(Na+)=c(S)+c()+c(H2SO3)
C.c(OH-)=c(H+)+c(H2SO3)+c()
D.c(Na+)>c()>c(S)>c(H+)=c(OH-)
②利用图中数据,求H2SO3H++的平衡常数为 。
③用NaOH吸收SO2,并用CaO使NaOH再生:Na2SO3(aq)NaOH(aq)。CaO在水中存在如下转化:CaO(s)+H2O(l)Ca(OH)2(s)Ca2+(aq)+2OH-(aq),从平衡移动的角度,简述NaOH再生的原理: 。
(3)利用氢氧化钠溶液吸收NO2,反应为2NO2+2NaOHNaNO3+NaNO2+H2O。已知25 ℃电离常数Ka(HNO2)=5.6×10-4、Ka(CH3COOH)=1.75×10-5,现有溶液A:含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液;溶液B:0.1 mol·L-1CH3COONa溶液。两份溶液中c()、c()和c(CH3COO-)由大到小的顺序为 。
19.(14分)氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.01 mol ·L-1酸性KMnO4溶液和未知浓度的无色NaHSO3溶液。反应离子方程式是2Mn+5HS+H+2Mn2++5S+3H2O。填空回答问题:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少 。
(2)不用 (填“酸”或“碱”)式滴定管盛放高锰酸钾溶液,试分析原因: 。
(3)选何种指示剂,说明理由 ,
到达终点时颜色变化为 。
(4)当用酸滴定碱时,下列操作使测定结果(碱的浓度)偏高的是 。
①酸式滴定管滴至终点,俯视读数
②碱液移入锥形瓶后,加入10 mL 蒸馏水
③酸式滴定管注入酸溶液后,尖嘴有气泡时便开始滴定,滴定后无气泡
④酸式滴定管用蒸馏水润洗后,未用标准液润洗
(5)实验有关数据记录如下:
实验 序号 待测液体 积/mL 所消耗酸性KMnO4溶液的体积/mL
滴定前 滴定后
1 20 0.50 20.60
2 20 6.00 25.90
3 20 1.40 24.20
则NaHSO3溶液的物质的量浓度为 mol ·L-1。
第三章测评
1.A 解析 CaSO4存在溶解平衡,用浓Na2CO3溶液处理,使离子积Q=c(Ca2+)·c(C)>Ksp(CaCO3),能将CaSO4转化为CaCO3,再用稀盐酸除去CaCO3,与盐类水解无关,A错误;明矾[KAl(SO4)2·12H2O]用于净水是由于Al3+水解产生Al(OH)3胶体,使悬浊物沉降,可以净水,B正确;碳酸钠是强碱弱酸盐,水解显碱性,故能使植物油水解,和盐类水解有关,C正确;Fe3+在水中会水解,加热会促进Fe3+的水解,故由FeCl3·6H2O制取无水FeCl3需在HCl气流中蒸发,抑制Fe3+的水解,D正确。
2.C 解析 常温下,由水电离出的c(H+)=10-14 mol·L-1的溶液中水的电离受到抑制,可能加入了酸或碱溶液,酸性条件下、Cl-发生氧化还原反应而不能大量共存,A错误;c(Fe3+)=0.1 mol·L-1的溶液中,Fe3+与I-发生氧化还原反应而不能大量共存,B错误;无色溶液中,Al3+、S2-发生相互促进的水解反应生成Al(OH)3沉淀和H2S气体,不能大量共存,D错误。
3.D 解析 0.1 mol·L-1HX溶液的pH=4,说明该溶液中c(H+)=10-4 mol·L-1
4.C 解析 ①0.01 mol·L-1CH3COOH溶液中CH3COOH发生部分电离,溶液中的c(H+)<10-2 mol·L-1;②0.01 mol·L-1HCl溶液中c(H+)=10-2 mol·L-1;③pH=12的氨水,c(OH-)=10-2 mol·L-1;④pH=12的NaOH溶液,c(OH-)=10-2 mol·L-1。①H+对水电离的抑制作用最弱,水的电离程度最大,②中酸电离出的c(H+)与③、④中碱电离出的c(OH-)相同,对水电离的抑制作用相同,水的电离程度一样大,A错误;将②③等体积混合后溶液呈碱性,碱过量,要使混合后溶液pH=7,则消耗溶液的体积:②>③,B错误;稀释促进弱电解质的电离,将四份溶液稀释相同倍数后,溶液的pH:③>④,①>②,C正确;①、④混合,当溶液中存在c(CH3COO-)>c(Na+)时,根据电荷守恒可得:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),则c(H+)>c(OH-),溶液一定显酸性,D错误。
5.D 解析 pH=3的盐酸中c(HCl)=10-3 mol·L-1,pH=11的氨水中c(NH3·H2O)大于10-3 mol·L-1,等体积混合后氨水过量,所得混合溶液显碱性,A错误;将0.02 mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,充分反应所得溶液是等浓度NH4Cl和氨水的混合溶液,存在质子守恒关系:c(NH3·H2O)+2c(OH-)=c()+2c(H+),B错误;0.1 mol·L-1的CH3COOH溶液中,c(H+)<0.1 mol·L-1,故水电离出的c(H+)>1.0×10-13 mol·L-1,C错误;由于,水的离子积常数和弱酸的电离平衡常数都只受温度影响,温度不变,比值不变,D正确。
6.C 解析 常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合,溶液中溶质为NaA,则由图像可知HA为弱酸,A正确;NaA溶液中A-水解使溶液呈碱性,B正确;溶液中粒子有Na+、A-、HA、H+、OH-,且大小关系为c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+),故X表示OH-,Y表示HA,Z表示H+,C错误;溶液中存在元素质量守恒:c(Na+)=c(A-)+c(HA),D正确。
7.C 解析 ①中硝酸银过量,过量硝酸银会与碘化钾反应生成碘化银沉淀,不能证明Ksp(AgCl)>Ksp(AgI),A错误;铝离子容易水解生成氢氧化铝,另一水解产物是易挥发的盐酸,故不能蒸发氯化铝溶液制备无水氯化铝,B错误;用NaOH标准液滴定加入几滴酚酞的盐酸(锥形瓶中),当最后半滴标准液滴入后溶液变红色且半分钟内不褪色,说明达到滴定终点,聚四氟乙烯活塞滴定管可以酸碱两用,C正确;实验中变量不唯一,不能验证氯化锰对过氧化氢的分解有催化作用,D错误。
8.D 解析 0.1 mol MgCl2·6H2O在空气中充分加热时最终得到固体为0.1 mol MgO,其质量为0.1 mol×40 g·mol-1=4 g,A错误。稀释等体积等pH的HA、HB两种酸的稀溶液时,加入等量水时,HA的pH变化幅度大,故酸性:HA>HB,B错误。醋酸为弱酸,在水中部分电离,0.10 mol·L-1醋酸溶液的pH>1,C错误。图丁表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,向a点溶液加入AgNO3固体,银离子浓度增大,溴离子反应浓度减小,则可以得到b点溶液,D正确。
9.C 解析 当酸碱恰好完全中和时生成盐NaB,此时水的电离程度最大,A正确;室温下,M点pOH=11.4,则HB的Ka==c(H+)=10-2.6=100.4×10-3,其数量级为10-3,B正确;将HB与NaB两溶液等体积等浓度混合,Ka(HB)=10-2.6,Kh(B-)=10-11.4
11.D 解析 实验1中0.05 mol·L-1 NaHSO3溶液的pH约为6.4,溶液呈酸性,故NaHSO3溶液中HS的水解程度小于其电离程度,A错误;实验2上层清液中已经达到CaSO3溶解平衡,故c(Ca2+)·c(S)=Ksp(CaSO3),B错误;实验3滴加过程中,根据电荷守恒可知,c(Na+)+c(H+)=c(HS)+2c(S)+c(OH-)+c(Cl-),C错误;根据电荷守恒:c(Na+)+c(H+)=c(HS)+2c(S)+c(OH-),c(Na+)+c(H+)逐渐减小,D正确。
12.B 解析 滴定达终点时,HB消耗NaOH溶液的体积大,则表明c(HB)>c(HA),而起始时pH(HB)>pH(HA),则酸性:HA>HB,A错误;滴定HA的终点pH=7,则HA是强酸,c(HA)=c(H+)=0.1 mol·L-1,HB是弱酸,部分电离,其溶液的pH=3,则电离部分c电离(HB)≈c(H+)=10-3 mol·L-1,滴定等体积的两种酸时,滴定HB消耗的氢氧化钠是滴定HA的两倍,则起始时c(HB)=2c(HA)≈0.2 mol·L-1,则酸HB的电离度为×100%=0.5%,B正确;初始时,HB的pH为3,而酸性HA>HB,说明HB是弱酸部分电离,则有c(HB)>10-3 mol·L-1,C错误;甲基橙变色范围为3.1~4.4,由图可知该pH范围内NaOH滴定HB未发生突跃,不可用甲基橙作指示剂,D错误。
13.D 解析 由图可知,a线表示的Ksp数值最大,则为CaSO4沉淀溶解平衡曲线;b、c分别表示CaCO3、PbCO3沉淀溶解平衡曲线,A正确;T ℃时,向0.001 mol CaCO3沉淀中加入Na2SO4溶液(反应后溶液为1 L),使CaCO3沉淀能转化为CaSO4沉淀:CaCO3(s)+SCaSO4(s)+C,则需要消耗硫酸根离子0.001 mol,同时生成碳酸根离子0.001 mol,则溶液中钙离子的浓度为mol·L-1=4.0×10-6 mol·L-1,则溶液中硫酸根离子浓度至少为mol·L-1=1.0 mol·L-1,物质的量为1.0 mol,故所需Na2SO4的物质的量至少为1.001 mol,B正确;T ℃时,向10 mL 水中加入CaCO3和PbCO3至二者均饱和,溶液中,C正确;d点表示CaCO3的饱和溶液中钙离子浓度大于碳酸根离子浓度,由图可知,钙离子浓度约为10-2 mol·L-1,则碳酸根离子浓度约为4×10-7 mol·L-1;加入CaSO4饱和溶液中钙离子、硫酸根离子浓度约为2×10-3 mol·L-1,两者等体积混合后,仍然为钙离子浓度最大、碳酸根离子浓度最小,故c(C)
15.A 解析 据题给信息推知,Ⅰ为H2A含量变化曲线,Ⅱ为HA-含量变化曲线,Ⅲ为A2-含量变化曲线。Ⅱ与Ⅲ交点处氢离子浓度即为此二元酸的第二级电离常数值,其数量级为10-5,A错误;(H2A)=10-1.2时,同理(H2A)=10-4.2,当c(H2A)=c(A2-)时,=c2(H+),此时c(H+)=1×10-2.7 mol·L-1,pH=2.7,B正确;当溶液中c(Na+)=2c(A2-)+c(HA-)时,由电荷守恒分析此时溶液呈现中性,向10 mL 0.1 mol·L-1 H2A水溶液中逐滴滴加0.1 mol·L-1NaOH溶液,若加入NaOH溶液体积等于10 mL,此时形成NaHA溶液,其电离大于水解,溶液呈现酸性,故应在10 mL 的基础上多加NaOH,溶液才有可能呈现中性,C正确;向pH=4.2的溶液中继续滴加NaOH溶液,结合图分析,HA-含量再减小,A2-含量增大,故水的电离程度再增大,而氢氧化钠溶液过量则会导致水的电离受到抑制,故水的电离程度先变大后减小,D正确。
16.答案 (1)红色溶液颜色变浅 NH3·H2ON+OH-,加入NH4Cl固体,c(N)增大,平衡向左移动,c(OH-)减小,因此溶液颜色由红色变浅 (2)= < (3)先将SbCl3固体溶解在较浓的盐酸中,再加水稀释到所需浓度 (4)6 (5)1.75×104
解析 (1)向含有酚酞的0.1 mol·L-1的氨水中加入少量NH4Cl固体,铵根离子浓度增大,氨水电离平衡逆向移动,氢氧根浓度减小,红色的溶液颜色变浅。
(2)将体积相等的NaOH稀溶液和CH3COOH溶液混合,混合后溶液呈中性,再根据电荷守恒得到溶液中c(Na+)=c(CH3COO-);若浓度相等、体积相等混合,则生成醋酸钠,醋酸钠中醋酸根水解显碱性,而要使混合溶液呈中性,则还需加酸,由于体积相等,混合前c(NaOH)
(4)根据题意得出Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)=2×10-4×c2(OH-)=2×10-20,c(OH-)=1×10-8 mol·L-1,c(H+)=mol·L-1=1×10-6 mol·L-1,则pH=6。
(5)溶浸过程中会发生:CaSO4(s)+C(aq)CaCO3(s)+S(aq)。依据硫酸钙、碳酸钙溶度积常数的计算表达式,则该反应的平衡常数K==1.75×104。
17.答案 (1)加入氢氧化钠固体或加入碳酸钠固体或加入醋酸钠固体 (2)①b ②10-5.3 ③溶液中存在水的电离平衡H2OOH-+H+,随着NaOH加入,CH3COOH浓度降低,醋酸对水电离的抑制程度减弱 ④7.5 ⑤测得的醋酸溶液样品中醋酸的含量偏高
解析 (1)加入氢氧化钠固体或者碳酸钠固体与氢离子反应,电离平衡正向移动,可以达到目的;加入醋酸钠固体,因为加入了醋酸根离子使其浓度增大,平衡逆向移动氢离子浓度会减小。
(2)①a、b、c点溶液的溶质分别为:醋酸、醋酸钠和醋酸、醋酸钠,对于a点醋酸同时电离出等浓度的醋酸根离子和氢离子,水也会电离出少量氢离子,则c(CH3COO-)
解析 (1)因水解原理与SO4类似,则N2水解结合H2O电离生成的OH-,水解离子方程式为N2+H2O+H+。
(2)①c(OH-)=c(H+)、c(S)=c(),根据电荷守恒c(H+)+c(Na+)=2c(S)+c()+c(OH-),则c(Na+)>2c(S),c(Na+)>2c(S)>c(),A正确;c(Na+)=2c(S)+c(),因为c(S)≠c(H2SO3),B错误;溶液呈中性,则c(OH-)=c(H+),存在c(OH-)
19.答案 (1)锥形瓶
(2)碱 高锰酸钾具有强氧化性,能够腐蚀碱式滴定管的橡胶管,因此量取高锰酸钾溶液用酸式滴定管
(3)不用指示剂,高锰酸钾本身是有颜色,能作指示剂 颜色由无色变成浅红色
(4)③④
(5)0.025
解析 (2)高锰酸钾具有强氧化性,碱式滴定管的下端有一段橡胶,橡胶里面有碳碳双键,高锰酸钾能氧化橡胶,因此盛放高锰酸钾应用酸式滴定管,不能用碱式滴定管。
(3)选用指示剂的目的是便于观察滴定到终点,本实验中高锰酸钾溶液是紫红色的,可以作为指示剂,当滴入最后半滴标准溶液,溶液由无色变成浅红色,且半分钟内不褪色,说明达到了终点。
(4)根据c(OH-)=分析,俯视读数,消耗酸的体积减小,测定结果偏低,①错误;碱液移入锥形瓶,加入10 mL 蒸馏水,溶质的物质的量不变,对实验测定结果无影响,②错误;尖嘴有气泡时便开始滴定,滴定后无气泡,消耗的酸的体积偏多,测定结果偏高,③正确;酸式滴定管用蒸馏水润洗后,未用标准液润洗,相当于对标准液稀释,消耗酸溶液的体积增多,测定结果偏高,④正确。
(5)去掉误差较大的数据,则消耗的KMnO4溶液的平均体积是20 mL,根据关系式2~5,c(NaHSO3)=mol·L-1=0.025 mol·L-1。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
