2025人教版高中化学选择性必修1同步--分层作业2 热化学方程式(含解析)
文档属性
| 名称 | 2025人教版高中化学选择性必修1同步--分层作业2 热化学方程式(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 422.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-28 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025人教版高中化学选择性必修1
分层作业2 热化学方程式
A级 必备知识基础练
题组1.热化学方程式及其书写
1.CO(g)与H2O(g)反应过程的能量变化如图所示,下列说法正确的是( )
A.该反应为吸热反应
B.1 mol CO(g)和1 mol H2O(g)的总能量大于1 mol CO2(g)和1 mol H2(g)的总能量
C.该反应的热化学方程式为CO(g)+H2O(g) ===CO2(g)+H2(g) ΔH=+41 kJ·mol-1
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ的热量
2.火箭发射时常用肼(N2H4,液态)作燃料,NO2作氧化剂,二者反应生成N2和水蒸气。已知在此条件下1 mol液态肼完全反应放出567.2 kJ的热量,下列关于该反应的热化学方程式书写正确的是( )
A.N2H4+NO2===N2+H2O ΔH=+567.2 kJ
B.2N2H4(l)+2NO2(g) ===3N2(g)+4H2O(g) ΔH=-567.2 kJ·mol-1
C.2N2H4(l)+2NO2(g) ===3N2(g)+4H2O(l) ΔH=+1 134.4 kJ·mol-1
D.2N2H4(l)+2NO2(g) ===3N2(g)+4H2O(g) ΔH=-1 134.4 kJ·mol-1
3.实验测得:101 kPa时,1 mol H2完全燃烧生成液态水放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2放出890.3 kJ的热量。下列热化学方程式的书写正确的是( )
①CH4(g)+2O2(g) ===CO2(g)+2H2O(l)
ΔH=+890.3 kJ·mol-1
②CH4(g)+2O2(g) ===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1
③CH4(g)+2O2(g) ===CO2(g)+2H2O(g)
ΔH=-890.3 kJ·mol-1
④2H2(g)+O2(g) ===2H2O(l) ΔH=-571.6 kJ·mol-1
A.仅有① B.仅有②④
C.仅有② D.①②③④
4.(2024·四川南充四校联考)写出下列反应的热化学方程式。
(1)1 mol C2H4(g)与适量O2(g)反应,生成CO2(g)和H2O(l),放出1 411 kJ的热量: 。
(2)0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量: 。
(3)1 g碳单质与适量水蒸气反应生成CO和H2,吸收10.94 kJ热量: 。
(4)如图是25 ℃、101 kPa时,CO2和NH3合成尿素[CO(NH2)2]的能量变化图,写出该反应的热化学方程式: 。
题组2.反应热的大小比较
5.(2024·辽宁营口五校联考)根据以下热化学方程式,ΔH1和ΔH2的大小比较错误的是( )
A.2H2S(g)+3O2(g) ===2SO2(g)+2H2O(l) ΔH1
2H2S(g)+O2(g) ===2S(s)+2H2O(l) ΔH2,则有ΔH1>ΔH2
B.Br2(g)+H2(g) ===2HBr(g) ΔH1
Br2(l)+H2(g) ===2HBr(g) ΔH2,则有ΔH1<ΔH2
C.4Al(s)+3O2(g) ===2Al2O3(s) ΔH1
2Al2O3(s) ===4Al(s)+3O2(g) ΔH2,则有ΔH1<ΔH2
D.Cl2(g)+H2(g) ===2HCl(g) ΔH1
Br2(g)+H2(g) ===2HBr(g) ΔH2,则有ΔH1<ΔH2
6.下列各组热化学方程式中,ΔH1>ΔH2的是( )
①C(s)+O2(g) ===CO2(g) ΔH1 C(s)+O2(g) ===CO(g) ΔH2
②S(s)+O2(g) ===SO2(g) ΔH1 S(g)+O2(g) ===SO2(g) ΔH2
③H2(g)+O2(g) ===H2O(l) ΔH1 2H2(g)+O2(g) ===2H2O(l) ΔH2
④CaCO3(s) ===CaO(s)+CO2(g) ΔH1 CaO(s)+H2O(l) ===Ca(OH)2(s) ΔH2
A.① B.④
C.②③④ D.①②③
B级 关键能力提升练
7.化学反应不仅有物质的变化还伴随能量的变化,下列说法错误的是( )
A.已知3H2(g)+N2(g)2NH3(g) ΔH<0,则其逆反应的ΔH>0
B.热化学方程式和化学方程式的化学计量数的意义相同
C.常温常压下,1 mol S(s)完全燃烧比1 mol S(g)完全燃烧时的焓变大
D.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量,则Fe(s)+S(s) ===FeS(s) ΔH=-95.6 kJ·mol-1
8.在一定条件下,SO2气体被O2氧化成SO3气体达到平衡时转化率为80%。在此条件下,充入32 g SO2气体和适量O2,达到平衡时共放出热量39.32 kJ。据此可知,下列热化学方程式正确的是( )
A.SO2(g)+O2(g) ===SO3(g)
ΔH=+98.3 kJ·mol-1
B.2SO2(g)+O2(g) ===2SO3(g)
ΔH=+196.6 kJ·mol-1
C.SO2(g)+O2(g) ===SO3(g)
ΔH=-98.3 kJ·mol-1
D.2SO2(g)+O2(g) ===2SO3(g)
ΔH=-245.75 kJ·mol-1
9.(2024·湖北黄冈中学调研)已知下列几种含碳化合物的转化及能量变化关系如图所示。
下列说法正确的是( )
A.C(s)+2H2(g) ===CH4(g) ΔH=+74.8 kJ·mol-1
B.1 mol C(s)完全燃烧可释放779.7 kJ能量
C.CH4(g)+2O2(g) ===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1
D.1 mol CO(g)具有的能量大于1 mol CO2(g)具有的能量
10.(2024·福建漳州模拟)下列关于热化学方程式说法正确的是( )
A.若31 g白磷的能量比31 g红磷多b kJ,则红磷转化为白磷的热化学方程式为4P(红磷,s) ===P4(白磷,s) ΔH=+4b kJ·mol-1
B.若1 mol SO2和0.5 mol O2充分反应放热98.3 kJ,则该反应的热化学方程式为2SO2(g)+O2(g)2SO3(g) ΔH=-98.3 kJ·mol-1
C.若H+(aq)+OH-(aq) ===H2O(l) ΔH=-57.3 kJ·mol-1,则稀硫酸与稀Ba(OH)2溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq) ===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
D.1 mol H2与足量Cl2(g)完全反应放出a kJ热量,则热化学方程式为H2+Cl2===2HCl ΔH=-a kJ·mol-1
11.H2和I2在一定条件下能发生反应:H2(g)+I2(g)2HI(g),1 mol H2(g)和1 mol I2(g)完全反应生成2 mol HI(g)的焓变ΔH=-a kJ·mol-1。
已知:(a、b、c均大于零)
下列说法不正确的是( )
A.反应物的总能量高于生成物的总能量
B.断裂1 mol H—H和1 mol I—I所需能量大于断裂2 mol H—I所需能量
C.断裂2 mol H—I所需能量为(c+b+a) kJ
D.向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量小于2a kJ
12.下列说法中正确的是( )
A.1 mol CH4完全燃烧生成CO2(g)和液态水放出890.3 kJ热量,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g) ===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.当反应物的总能量低于生成物的总能量时,该反应必须加热才能发生
C.上图是25 ℃、101 kPa时,CO和H2合成CH3OH(g)反应过程中的能量变化图,则该反应的热化学方程式为CO(g)+2H2(g)CH3OH(g) ΔH=+91 kJ·mol-1
D.已知:2Zn(s)+O2(g) ===2ZnO(s) ΔH=-701.0 kJ·mol-1,则2 mol ZnO分解成Zn(s)和O2(g)时需吸收701.0 kJ的热量
13.根据所给信息,写出对应的热化学方程式。
(1)已知4.4 g CO2气体与足量H2(g)经催化生成CH3OH(g)和H2O(g)时放出4.95 kJ的热量,其热化学方程式为 。
(2)我国“长征”系列火箭所用燃料为液态偏二甲基肼(C2H8N2)。已知1 mol偏二甲基肼完全燃烧生成N2(g)、CO2(g)和H2O(l)放出的热量为2 000 kJ。写出偏二甲基肼完全燃烧的热化学方程式: 。
C级 学科素养拔高练
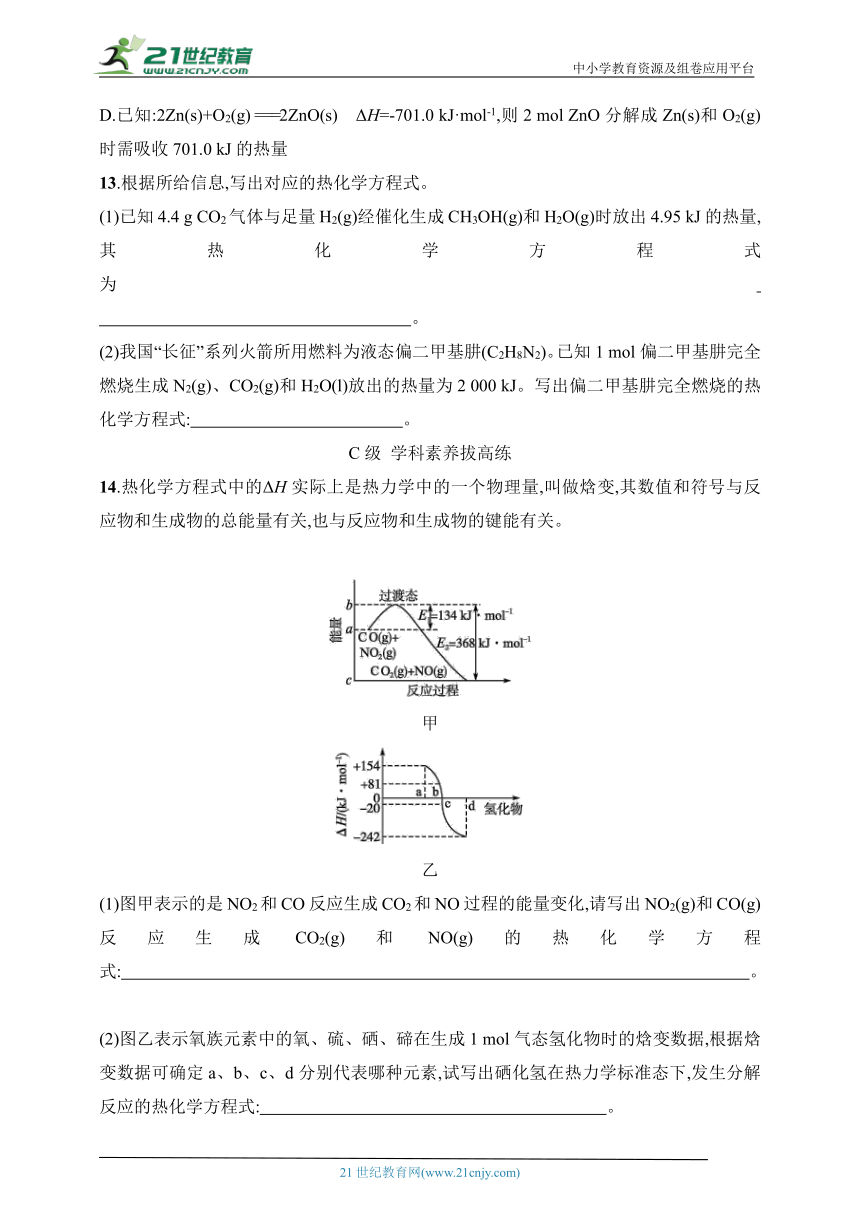
14.热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。
甲
乙
(1)图甲表示的是NO2和CO反应生成CO2和NO过程的能量变化,请写出NO2(g)和CO(g)反应生成CO2(g)和NO(g)的热化学方程式: 。
(2)图乙表示氧族元素中的氧、硫、硒、碲在生成1 mol气态氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准态下,发生分解反应的热化学方程式: 。
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s)可放热44.4 kJ,该反应的热化学方程式为 。
分层作业2 热化学方程式
1.B 解析 由图像中的信息可知,该反应的ΔH<0,为放热反应,A错误;该反应中1 mol CO(g)与1 mol H2O(g)所具有的总能量大于1 mol CO2(g)与1 mol H2(g)所具有的总能量,B正确;该反应的ΔH<0,反应的热化学方程式为CO(g)+H2O(g) ===CO2(g)+H2(g) ΔH=-41 kJ·mol-1,C错误;该反应为放热反应,则其逆反应为吸热反应,则1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要吸收41 kJ热量,D错误。
2.D 解析 A项,方程式未配平,且未注明物质的存在状态,ΔH单位应为kJ·mol-1,错误;B项,发生反应的反应物越多,反应放出的热量也越多,反应热要与反应物质的物质的量相对应,错误;C项,放热反应ΔH<0,且反应产生的是水蒸气,不是液体水,错误。
3.B 解析 由101 kPa时,1 mol氢气完全燃烧生成液态水放出285.8 kJ的热量可得热化学方程式2H2(g)+O2(g) ===2H2O(l) ΔH=-571.6 kJ·mol-1。由101 kPa时,1 mol甲烷完全燃烧生成液态水和二氧化碳放出890.3 kJ的热量可得热化学方程式CH4(g)+2O2(g) ===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,则②④正确。
4.答案 (1)C2H4(g)+3O2(g) ===2CO2(g)+2H2O(l) ΔH=-1 411 kJ·mol-1
(2)N2H4(g)+O2(g) ===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
(3)C(s)+H2O(g) ===CO(g)+H2(g) ΔH=+131.28 kJ·mol-1
(4)2NH3(g)+CO2(g) ===CO(NH2)2(s)+H2O(g)
ΔH=-86.98 kJ·mol-1
解析 (1)1 mol C2H4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出1 411 kJ的热量,则热化学方程式为C2H4(g)+3O2(g) ===2CO2(g)+2H2O(l) ΔH=-1 411 kJ·mol-1。
(2)0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量,则1 mol N2H4完全燃烧生成氮气和气态水时,放出4×133.5 kJ=534 kJ热量。
(3)1 g碳单质的物质的量为 mol,与适量水蒸气反应生成CO和H2,吸收10.94 kJ热量,则1 mol碳单质与适量水蒸气反应生成CO和H2,吸收10.94 kJ×12=131.28 kJ热量。
(4)由图可知,1 mol CO2和2 mol NH3合成尿素[CO(NH2)2]放出(159.47-72.49) kJ=86.98 kJ能量,则该反应的热化学方程式为2NH3(g)+CO2(g) ===CO(NH2)2(s)+H2O(g) ΔH=-86.98 kJ·mol-1。
5.A 解析 等量H2S(g)完全燃烧生成SO2(g)放出热量比生成S(s)放出热量多,则有ΔH1<ΔH2,A错误;等物质的量时,Br2(g)具有的能量高于Br2(l)具有的能量,故1 mol Br2(g)与H2(g)反应生成HBr(g)放出的热量比1 mol Br2(l)与H2(g)反应生成HBr(g)放出的热量多,则有ΔH1<ΔH2,B正确;Al(s)与O2(g)反应生成Al2O3(s)时放热,其逆反应吸热,C正确;等物质的量时,Cl2(g)具有的能量高于Br2(g)具有的能量,等物质的量的Cl2(g)、Br2(g)分别与H2(g)反应时,Cl2(g)放出热量更多,则有ΔH1<ΔH2,D正确。
6.C 解析 ①等质量的C完全燃烧产生CO2放出的热量比不完全燃烧产生CO放出的热量多,反应放出热量越多,ΔH越小,则有ΔH1<ΔH2,①不符合题意;等物质的量时,S(g)的能量比S(s)多,S(g)燃烧放出的热量比S(s)燃烧放出的热量要多,反应放出的热量越多,ΔH越小,则有ΔH1>ΔH2,②符合题意;相同条件下,发生反应的H2越多,反应放出的热量就越多,则反应的ΔH越小,则反应热:ΔH1>ΔH2,③符合题意;固态CaCO3分解反应是吸热反应,ΔH1>0;CaO与H2O反应产生Ca(OH)2的反应是放热反应,ΔH2<0,两个反应的反应热:ΔH1>ΔH2,④符合题意。
7.B 解析 热化学方程式中的化学计量数只表示物质的量的关系,而化学方程式的化学计量数可以表示个数,B错误。等物质的量时,同种物质的气态能量高于固态能量,因此1 mol S(g)完全燃烧时放出的热量比1 mol S(s)完全燃烧放出的热量多,放热越多焓变越小,C正确。
8.C 解析 32 g SO2的物质的量为0.5 mol,平衡时SO2的转化率为80%,则0.5 mol×80%=0.4 mol的SO2被O2氧化为SO3时放出39.32 kJ热量,故1 mol SO2完全被氧化时反应放出的热量为=98.3 kJ。该反应是放热反应,则ΔH<0,故反应的热化学方程式为SO2(g)+O2(g) ===SO3(g) ΔH=-98.3 kJ·mol-1,A、B错误,C正确。2 mol SO2完全反应时ΔH=-98.3 kJ·mol-1×2=-196.6 kJ·mol-1,D错误。
9.C 解析 根据图中信息可得,C(s)+2H2(g) ===CH4(g)的ΔH=(890.3-965.1) kJ·mol-1=-74.8 kJ·mol-1,A错误;根据本题所给信息,无法得出1 mol C(s)完全燃烧释放的能量,B错误;根据图示,1 mol CH4(g)和2 mol O2(g)具有的能量比1 mol CO2(g)和2 mol H2O(l)具有的能量多890.3 kJ,由此可得热化学方程式为CH4(g)+2O2(g) ===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,C正确;根据图示可以得出1 mol CO(g)和 mol O2(g)具有的能量大于1 mol CO2(g)的能量,但不能得出1 mol CO(g)具有的能量大于1 mol CO2(g)具有的能量,D错误。
10.A 解析 1 mol白磷的质量为124 g,若31 g白磷的能量比31 g红磷多b kJ,则1 mol白磷的能量比等质量的红磷的能量多4b kJ,故红磷转化为白磷的热化学方程式为4P(红磷,s) ===P4(白磷,s) ΔH=+4b kJ·mol-1,A正确;若1 mol SO2和0.5 mol O2充分反应放热98.3 kJ,由于该反应为可逆反应,则2 mol SO2和1 mol O2反应生成2 mol SO3时放出热量要大于196.6 kJ,则2SO2(g)+O2(g)2SO3(g)的ΔH<-196.6 kJ·mol-1,B错误;稀硫酸与稀Ba(OH)2溶液反应除了发生反应H+(aq)+OH-(aq) ===H2O(l)放热外,还有Ba2+与S生成BaSO4沉淀的反应也放出热量,C错误;热化学方程式中应标注物质的聚集状态,D错误。
11.B 解析 ΔH<0,该反应为放热反应,所以反应物的总能量高于生成物的总能量,A项正确;因为该反应为放热反应,所以断裂1 mol H—H和1 mol I—I所需能量小于断裂2 mol H—I 所需能量,B项错误;设断裂2 mol H—I所需的能量为x kJ,则b kJ·mol-1×1 mol+c kJ·mol-1×1 mol-x kJ=-a kJ,所以x=a+b+c,C项正确;因为该反应为可逆反应,所以反应不能进行彻底,则向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量小于2a kJ,D项正确。
12.D 解析 1 mol CH4完全燃烧生成CO2(g)和液态水放出890.3 kJ热量,相应的热化学方程式中H2O的状态应为液态,A错误;反应物总能量低于生成物总能量,对应的反应为吸热反应,但吸热反应不一定需要加热才能发生,B错误;由图可知,CO和H2合成1 mol CH3OH(g)的反应过程中放出热量为510 kJ-419 kJ=91 kJ,则热化学方程式为CO(g)+2H2(g)CH3OH(g) ΔH=-91 kJ·mol-1,C错误;已知:2Zn(s)+O2(g) ===2ZnO(s) ΔH=-701.0 kJ·mol-1,则其逆反应为吸热反应,2 mol ZnO分解成Zn(s)和O2(g),需吸收701.0 kJ的热量,D正确。
13.答案 (1)CO2(g)+3H2(g) ===CH3OH(g)+H2O(g) ΔH=-49.5 kJ·mol-1
(2)C2H8N2(l)+4O2(g) ===N2(g)+2CO2(g)+4H2O(l) ΔH=-2 000 kJ·mol-1
解析 书写热化学方程式时应注意标注物质的状态,同时要注意ΔH的符号。
14.答案 (1)NO2(g)+CO(g) ===NO(g)+CO2(g)
ΔH=-234 kJ·mol-1
(2)H2Se(g) ===Se(s)+H2(g) ΔH=-81 kJ·mol-1
(3)4CuCl(s)+O2(g) ===2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·mol-1
解析 (1)根据图甲可知,此反应是放热反应,热化学方程式为NO2(g)+CO(g) ===CO2(g)+NO(g) ΔH=(134-368) kJ·mol-1=-234 kJ·mol-1。
(2)同主族元素从上到下非金属性逐渐减弱,其气态氢化物的稳定性降低、能量增大,则可确定a、b、c、d分别代表碲、硒、硫、氧元素。b代表硒元素,生成1 mol H2Se(g)的ΔH=+81 kJ·mol-1,则分解反应的热化学方程式为H2Se(g) ===Se(s)+H2(g) ΔH=-81 kJ·mol-1。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025人教版高中化学选择性必修1
分层作业2 热化学方程式
A级 必备知识基础练
题组1.热化学方程式及其书写
1.CO(g)与H2O(g)反应过程的能量变化如图所示,下列说法正确的是( )
A.该反应为吸热反应
B.1 mol CO(g)和1 mol H2O(g)的总能量大于1 mol CO2(g)和1 mol H2(g)的总能量
C.该反应的热化学方程式为CO(g)+H2O(g) ===CO2(g)+H2(g) ΔH=+41 kJ·mol-1
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ的热量
2.火箭发射时常用肼(N2H4,液态)作燃料,NO2作氧化剂,二者反应生成N2和水蒸气。已知在此条件下1 mol液态肼完全反应放出567.2 kJ的热量,下列关于该反应的热化学方程式书写正确的是( )
A.N2H4+NO2===N2+H2O ΔH=+567.2 kJ
B.2N2H4(l)+2NO2(g) ===3N2(g)+4H2O(g) ΔH=-567.2 kJ·mol-1
C.2N2H4(l)+2NO2(g) ===3N2(g)+4H2O(l) ΔH=+1 134.4 kJ·mol-1
D.2N2H4(l)+2NO2(g) ===3N2(g)+4H2O(g) ΔH=-1 134.4 kJ·mol-1
3.实验测得:101 kPa时,1 mol H2完全燃烧生成液态水放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2放出890.3 kJ的热量。下列热化学方程式的书写正确的是( )
①CH4(g)+2O2(g) ===CO2(g)+2H2O(l)
ΔH=+890.3 kJ·mol-1
②CH4(g)+2O2(g) ===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1
③CH4(g)+2O2(g) ===CO2(g)+2H2O(g)
ΔH=-890.3 kJ·mol-1
④2H2(g)+O2(g) ===2H2O(l) ΔH=-571.6 kJ·mol-1
A.仅有① B.仅有②④
C.仅有② D.①②③④
4.(2024·四川南充四校联考)写出下列反应的热化学方程式。
(1)1 mol C2H4(g)与适量O2(g)反应,生成CO2(g)和H2O(l),放出1 411 kJ的热量: 。
(2)0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量: 。
(3)1 g碳单质与适量水蒸气反应生成CO和H2,吸收10.94 kJ热量: 。
(4)如图是25 ℃、101 kPa时,CO2和NH3合成尿素[CO(NH2)2]的能量变化图,写出该反应的热化学方程式: 。
题组2.反应热的大小比较
5.(2024·辽宁营口五校联考)根据以下热化学方程式,ΔH1和ΔH2的大小比较错误的是( )
A.2H2S(g)+3O2(g) ===2SO2(g)+2H2O(l) ΔH1
2H2S(g)+O2(g) ===2S(s)+2H2O(l) ΔH2,则有ΔH1>ΔH2
B.Br2(g)+H2(g) ===2HBr(g) ΔH1
Br2(l)+H2(g) ===2HBr(g) ΔH2,则有ΔH1<ΔH2
C.4Al(s)+3O2(g) ===2Al2O3(s) ΔH1
2Al2O3(s) ===4Al(s)+3O2(g) ΔH2,则有ΔH1<ΔH2
D.Cl2(g)+H2(g) ===2HCl(g) ΔH1
Br2(g)+H2(g) ===2HBr(g) ΔH2,则有ΔH1<ΔH2
6.下列各组热化学方程式中,ΔH1>ΔH2的是( )
①C(s)+O2(g) ===CO2(g) ΔH1 C(s)+O2(g) ===CO(g) ΔH2
②S(s)+O2(g) ===SO2(g) ΔH1 S(g)+O2(g) ===SO2(g) ΔH2
③H2(g)+O2(g) ===H2O(l) ΔH1 2H2(g)+O2(g) ===2H2O(l) ΔH2
④CaCO3(s) ===CaO(s)+CO2(g) ΔH1 CaO(s)+H2O(l) ===Ca(OH)2(s) ΔH2
A.① B.④
C.②③④ D.①②③
B级 关键能力提升练
7.化学反应不仅有物质的变化还伴随能量的变化,下列说法错误的是( )
A.已知3H2(g)+N2(g)2NH3(g) ΔH<0,则其逆反应的ΔH>0
B.热化学方程式和化学方程式的化学计量数的意义相同
C.常温常压下,1 mol S(s)完全燃烧比1 mol S(g)完全燃烧时的焓变大
D.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量,则Fe(s)+S(s) ===FeS(s) ΔH=-95.6 kJ·mol-1
8.在一定条件下,SO2气体被O2氧化成SO3气体达到平衡时转化率为80%。在此条件下,充入32 g SO2气体和适量O2,达到平衡时共放出热量39.32 kJ。据此可知,下列热化学方程式正确的是( )
A.SO2(g)+O2(g) ===SO3(g)
ΔH=+98.3 kJ·mol-1
B.2SO2(g)+O2(g) ===2SO3(g)
ΔH=+196.6 kJ·mol-1
C.SO2(g)+O2(g) ===SO3(g)
ΔH=-98.3 kJ·mol-1
D.2SO2(g)+O2(g) ===2SO3(g)
ΔH=-245.75 kJ·mol-1
9.(2024·湖北黄冈中学调研)已知下列几种含碳化合物的转化及能量变化关系如图所示。
下列说法正确的是( )
A.C(s)+2H2(g) ===CH4(g) ΔH=+74.8 kJ·mol-1
B.1 mol C(s)完全燃烧可释放779.7 kJ能量
C.CH4(g)+2O2(g) ===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1
D.1 mol CO(g)具有的能量大于1 mol CO2(g)具有的能量
10.(2024·福建漳州模拟)下列关于热化学方程式说法正确的是( )
A.若31 g白磷的能量比31 g红磷多b kJ,则红磷转化为白磷的热化学方程式为4P(红磷,s) ===P4(白磷,s) ΔH=+4b kJ·mol-1
B.若1 mol SO2和0.5 mol O2充分反应放热98.3 kJ,则该反应的热化学方程式为2SO2(g)+O2(g)2SO3(g) ΔH=-98.3 kJ·mol-1
C.若H+(aq)+OH-(aq) ===H2O(l) ΔH=-57.3 kJ·mol-1,则稀硫酸与稀Ba(OH)2溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq) ===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
D.1 mol H2与足量Cl2(g)完全反应放出a kJ热量,则热化学方程式为H2+Cl2===2HCl ΔH=-a kJ·mol-1
11.H2和I2在一定条件下能发生反应:H2(g)+I2(g)2HI(g),1 mol H2(g)和1 mol I2(g)完全反应生成2 mol HI(g)的焓变ΔH=-a kJ·mol-1。
已知:(a、b、c均大于零)
下列说法不正确的是( )
A.反应物的总能量高于生成物的总能量
B.断裂1 mol H—H和1 mol I—I所需能量大于断裂2 mol H—I所需能量
C.断裂2 mol H—I所需能量为(c+b+a) kJ
D.向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量小于2a kJ
12.下列说法中正确的是( )
A.1 mol CH4完全燃烧生成CO2(g)和液态水放出890.3 kJ热量,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g) ===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.当反应物的总能量低于生成物的总能量时,该反应必须加热才能发生
C.上图是25 ℃、101 kPa时,CO和H2合成CH3OH(g)反应过程中的能量变化图,则该反应的热化学方程式为CO(g)+2H2(g)CH3OH(g) ΔH=+91 kJ·mol-1
D.已知:2Zn(s)+O2(g) ===2ZnO(s) ΔH=-701.0 kJ·mol-1,则2 mol ZnO分解成Zn(s)和O2(g)时需吸收701.0 kJ的热量
13.根据所给信息,写出对应的热化学方程式。
(1)已知4.4 g CO2气体与足量H2(g)经催化生成CH3OH(g)和H2O(g)时放出4.95 kJ的热量,其热化学方程式为 。
(2)我国“长征”系列火箭所用燃料为液态偏二甲基肼(C2H8N2)。已知1 mol偏二甲基肼完全燃烧生成N2(g)、CO2(g)和H2O(l)放出的热量为2 000 kJ。写出偏二甲基肼完全燃烧的热化学方程式: 。
C级 学科素养拔高练
14.热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。
甲
乙
(1)图甲表示的是NO2和CO反应生成CO2和NO过程的能量变化,请写出NO2(g)和CO(g)反应生成CO2(g)和NO(g)的热化学方程式: 。
(2)图乙表示氧族元素中的氧、硫、硒、碲在生成1 mol气态氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准态下,发生分解反应的热化学方程式: 。
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s)可放热44.4 kJ,该反应的热化学方程式为 。
分层作业2 热化学方程式
1.B 解析 由图像中的信息可知,该反应的ΔH<0,为放热反应,A错误;该反应中1 mol CO(g)与1 mol H2O(g)所具有的总能量大于1 mol CO2(g)与1 mol H2(g)所具有的总能量,B正确;该反应的ΔH<0,反应的热化学方程式为CO(g)+H2O(g) ===CO2(g)+H2(g) ΔH=-41 kJ·mol-1,C错误;该反应为放热反应,则其逆反应为吸热反应,则1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要吸收41 kJ热量,D错误。
2.D 解析 A项,方程式未配平,且未注明物质的存在状态,ΔH单位应为kJ·mol-1,错误;B项,发生反应的反应物越多,反应放出的热量也越多,反应热要与反应物质的物质的量相对应,错误;C项,放热反应ΔH<0,且反应产生的是水蒸气,不是液体水,错误。
3.B 解析 由101 kPa时,1 mol氢气完全燃烧生成液态水放出285.8 kJ的热量可得热化学方程式2H2(g)+O2(g) ===2H2O(l) ΔH=-571.6 kJ·mol-1。由101 kPa时,1 mol甲烷完全燃烧生成液态水和二氧化碳放出890.3 kJ的热量可得热化学方程式CH4(g)+2O2(g) ===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,则②④正确。
4.答案 (1)C2H4(g)+3O2(g) ===2CO2(g)+2H2O(l) ΔH=-1 411 kJ·mol-1
(2)N2H4(g)+O2(g) ===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
(3)C(s)+H2O(g) ===CO(g)+H2(g) ΔH=+131.28 kJ·mol-1
(4)2NH3(g)+CO2(g) ===CO(NH2)2(s)+H2O(g)
ΔH=-86.98 kJ·mol-1
解析 (1)1 mol C2H4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出1 411 kJ的热量,则热化学方程式为C2H4(g)+3O2(g) ===2CO2(g)+2H2O(l) ΔH=-1 411 kJ·mol-1。
(2)0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量,则1 mol N2H4完全燃烧生成氮气和气态水时,放出4×133.5 kJ=534 kJ热量。
(3)1 g碳单质的物质的量为 mol,与适量水蒸气反应生成CO和H2,吸收10.94 kJ热量,则1 mol碳单质与适量水蒸气反应生成CO和H2,吸收10.94 kJ×12=131.28 kJ热量。
(4)由图可知,1 mol CO2和2 mol NH3合成尿素[CO(NH2)2]放出(159.47-72.49) kJ=86.98 kJ能量,则该反应的热化学方程式为2NH3(g)+CO2(g) ===CO(NH2)2(s)+H2O(g) ΔH=-86.98 kJ·mol-1。
5.A 解析 等量H2S(g)完全燃烧生成SO2(g)放出热量比生成S(s)放出热量多,则有ΔH1<ΔH2,A错误;等物质的量时,Br2(g)具有的能量高于Br2(l)具有的能量,故1 mol Br2(g)与H2(g)反应生成HBr(g)放出的热量比1 mol Br2(l)与H2(g)反应生成HBr(g)放出的热量多,则有ΔH1<ΔH2,B正确;Al(s)与O2(g)反应生成Al2O3(s)时放热,其逆反应吸热,C正确;等物质的量时,Cl2(g)具有的能量高于Br2(g)具有的能量,等物质的量的Cl2(g)、Br2(g)分别与H2(g)反应时,Cl2(g)放出热量更多,则有ΔH1<ΔH2,D正确。
6.C 解析 ①等质量的C完全燃烧产生CO2放出的热量比不完全燃烧产生CO放出的热量多,反应放出热量越多,ΔH越小,则有ΔH1<ΔH2,①不符合题意;等物质的量时,S(g)的能量比S(s)多,S(g)燃烧放出的热量比S(s)燃烧放出的热量要多,反应放出的热量越多,ΔH越小,则有ΔH1>ΔH2,②符合题意;相同条件下,发生反应的H2越多,反应放出的热量就越多,则反应的ΔH越小,则反应热:ΔH1>ΔH2,③符合题意;固态CaCO3分解反应是吸热反应,ΔH1>0;CaO与H2O反应产生Ca(OH)2的反应是放热反应,ΔH2<0,两个反应的反应热:ΔH1>ΔH2,④符合题意。
7.B 解析 热化学方程式中的化学计量数只表示物质的量的关系,而化学方程式的化学计量数可以表示个数,B错误。等物质的量时,同种物质的气态能量高于固态能量,因此1 mol S(g)完全燃烧时放出的热量比1 mol S(s)完全燃烧放出的热量多,放热越多焓变越小,C正确。
8.C 解析 32 g SO2的物质的量为0.5 mol,平衡时SO2的转化率为80%,则0.5 mol×80%=0.4 mol的SO2被O2氧化为SO3时放出39.32 kJ热量,故1 mol SO2完全被氧化时反应放出的热量为=98.3 kJ。该反应是放热反应,则ΔH<0,故反应的热化学方程式为SO2(g)+O2(g) ===SO3(g) ΔH=-98.3 kJ·mol-1,A、B错误,C正确。2 mol SO2完全反应时ΔH=-98.3 kJ·mol-1×2=-196.6 kJ·mol-1,D错误。
9.C 解析 根据图中信息可得,C(s)+2H2(g) ===CH4(g)的ΔH=(890.3-965.1) kJ·mol-1=-74.8 kJ·mol-1,A错误;根据本题所给信息,无法得出1 mol C(s)完全燃烧释放的能量,B错误;根据图示,1 mol CH4(g)和2 mol O2(g)具有的能量比1 mol CO2(g)和2 mol H2O(l)具有的能量多890.3 kJ,由此可得热化学方程式为CH4(g)+2O2(g) ===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,C正确;根据图示可以得出1 mol CO(g)和 mol O2(g)具有的能量大于1 mol CO2(g)的能量,但不能得出1 mol CO(g)具有的能量大于1 mol CO2(g)具有的能量,D错误。
10.A 解析 1 mol白磷的质量为124 g,若31 g白磷的能量比31 g红磷多b kJ,则1 mol白磷的能量比等质量的红磷的能量多4b kJ,故红磷转化为白磷的热化学方程式为4P(红磷,s) ===P4(白磷,s) ΔH=+4b kJ·mol-1,A正确;若1 mol SO2和0.5 mol O2充分反应放热98.3 kJ,由于该反应为可逆反应,则2 mol SO2和1 mol O2反应生成2 mol SO3时放出热量要大于196.6 kJ,则2SO2(g)+O2(g)2SO3(g)的ΔH<-196.6 kJ·mol-1,B错误;稀硫酸与稀Ba(OH)2溶液反应除了发生反应H+(aq)+OH-(aq) ===H2O(l)放热外,还有Ba2+与S生成BaSO4沉淀的反应也放出热量,C错误;热化学方程式中应标注物质的聚集状态,D错误。
11.B 解析 ΔH<0,该反应为放热反应,所以反应物的总能量高于生成物的总能量,A项正确;因为该反应为放热反应,所以断裂1 mol H—H和1 mol I—I所需能量小于断裂2 mol H—I 所需能量,B项错误;设断裂2 mol H—I所需的能量为x kJ,则b kJ·mol-1×1 mol+c kJ·mol-1×1 mol-x kJ=-a kJ,所以x=a+b+c,C项正确;因为该反应为可逆反应,所以反应不能进行彻底,则向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量小于2a kJ,D项正确。
12.D 解析 1 mol CH4完全燃烧生成CO2(g)和液态水放出890.3 kJ热量,相应的热化学方程式中H2O的状态应为液态,A错误;反应物总能量低于生成物总能量,对应的反应为吸热反应,但吸热反应不一定需要加热才能发生,B错误;由图可知,CO和H2合成1 mol CH3OH(g)的反应过程中放出热量为510 kJ-419 kJ=91 kJ,则热化学方程式为CO(g)+2H2(g)CH3OH(g) ΔH=-91 kJ·mol-1,C错误;已知:2Zn(s)+O2(g) ===2ZnO(s) ΔH=-701.0 kJ·mol-1,则其逆反应为吸热反应,2 mol ZnO分解成Zn(s)和O2(g),需吸收701.0 kJ的热量,D正确。
13.答案 (1)CO2(g)+3H2(g) ===CH3OH(g)+H2O(g) ΔH=-49.5 kJ·mol-1
(2)C2H8N2(l)+4O2(g) ===N2(g)+2CO2(g)+4H2O(l) ΔH=-2 000 kJ·mol-1
解析 书写热化学方程式时应注意标注物质的状态,同时要注意ΔH的符号。
14.答案 (1)NO2(g)+CO(g) ===NO(g)+CO2(g)
ΔH=-234 kJ·mol-1
(2)H2Se(g) ===Se(s)+H2(g) ΔH=-81 kJ·mol-1
(3)4CuCl(s)+O2(g) ===2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·mol-1
解析 (1)根据图甲可知,此反应是放热反应,热化学方程式为NO2(g)+CO(g) ===CO2(g)+NO(g) ΔH=(134-368) kJ·mol-1=-234 kJ·mol-1。
(2)同主族元素从上到下非金属性逐渐减弱,其气态氢化物的稳定性降低、能量增大,则可确定a、b、c、d分别代表碲、硒、硫、氧元素。b代表硒元素,生成1 mol H2Se(g)的ΔH=+81 kJ·mol-1,则分解反应的热化学方程式为H2Se(g) ===Se(s)+H2(g) ΔH=-81 kJ·mol-1。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
