2025人教版高中化学选择性必修1同步--分层作业22 化学电源(含解析)
文档属性
| 名称 | 2025人教版高中化学选择性必修1同步--分层作业22 化学电源(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 607.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-28 16:46:45 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025人教版高中化学选择性必修1
分层作业22 化学电源
A级 必备知识基础练
题组1.一次电池和二次电池
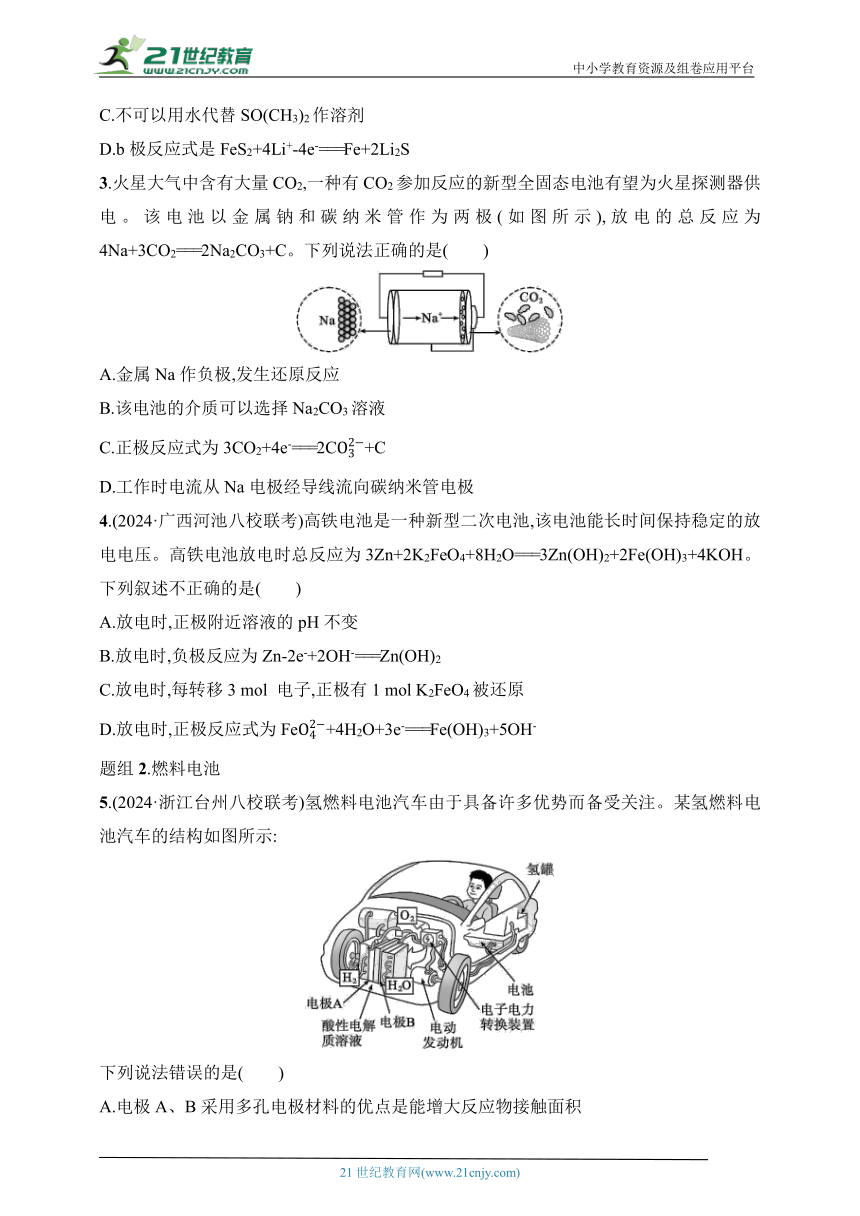
1.下列四个常用电化学装置的叙述正确的是( )
图Ⅰ水果电池 图Ⅱ干电池
图Ⅲ铅酸蓄电池 图Ⅳ氢氧燃料电池
A.图Ⅰ所示电池中,电子从锌片流出经导线流向铜片,再通过番茄内部流回锌片
B.图Ⅱ所示干电池中锌作负极,发生还原反应
C.图Ⅲ所示电池为二次电池,放电时负极的电极反应式为Pb+S-2e-===PbSO4
D.图Ⅳ所示电池中从m处通入O2,a电极为正极,电极反应式为O2+4e-+4H+===2H2O
2.如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2===Fe+2Li2S。下列说法不正确的是( )
A.该装置将化学能转化为电能
B.电子移动方向是由a极流向b极
C.不可以用水代替SO(CH3)2作溶剂
D.b极反应式是FeS2+4Li+-4e-===Fe+2Li2S
3.火星大气中含有大量CO2,一种有CO2参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠和碳纳米管作为两极(如图所示),放电的总反应为4Na+3CO2===2Na2CO3+C。下列说法正确的是( )
A.金属Na作负极,发生还原反应
B.该电池的介质可以选择Na2CO3溶液
C.正极反应式为3CO2+4e-===2C+C
D.工作时电流从Na电极经导线流向碳纳米管电极
4.(2024·广西河池八校联考)高铁电池是一种新型二次电池,该电池能长时间保持稳定的放电电压。高铁电池放电时总反应为3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
A.放电时,正极附近溶液的pH不变
B.放电时,负极反应为Zn-2e-+2OH-===Zn(OH)2
C.放电时,每转移3 mol 电子,正极有1 mol K2FeO4被还原
D.放电时,正极反应式为Fe+4H2O+3e-===Fe(OH)3+5OH-
题组2.燃料电池
5.(2024·浙江台州八校联考)氢燃料电池汽车由于具备许多优势而备受关注。某氢燃料电池汽车的结构如图所示:
下列说法错误的是( )
A.电极A、B采用多孔电极材料的优点是能增大反应物接触面积
B.“电池”能将燃料电池产生的多余电能暂时储存起来
C.电极B的电极反应式为O2+4e-===2O2-
D.质子通过电解质溶液向电极B迁移
6.燃料电池是燃料(如CO、H2、CH4、C2H6等)与氧气(或空气)反应将化学能转变为电能的装置。若电解质溶液是强碱溶液,下面关于乙烷(C2H6)燃料电池的说法正确的是( )
A.该电池工作时,正极附近溶液的碱性增强
B.负极反应式:C2H6+18OH-+14e-===2C+12H2O
C.通入5.6 L O2完全反应后,有1 mol 电子发生转移
D.燃料电池的优点之一是点燃时化学能大部分转化为电能而不是热能和光能
7.(2024·天津部分区联考)含氯苯的废水可通过加入适量乙酸钠,设计成微生物电池将氯苯转化为苯而除去,其原理如图所示。下列叙述正确的是( )
A.氯苯被氧化生成苯
B.N极为电池的负极
C.M极的电极反应式为C6H5Cl+e-===C6H6+Cl-
D.每生成1 mol CO2,由N极区进入M极区的H+的物质的量为3 mol
8.以甲烷燃料电池为例来分析在不同的环境下电极反应式的书写方法。
(1)酸性条件下燃料电池
总反应式: 。
正极反应式: 。
负极反应式: 。
(2)碱性条件下燃料电池
总反应式: 。
正极反应式: 。
负极反应式: 。
(3)固体电解质(高温下能传导O2-)燃料电池
总反应式: 。
正极反应式: 。
负极反应式: 。
(4)熔融碳酸盐(如熔融K2CO3)环境下燃料电池
总反应式: 。
正极反应式: 。
负极反应式: 。
B级 关键能力提升练
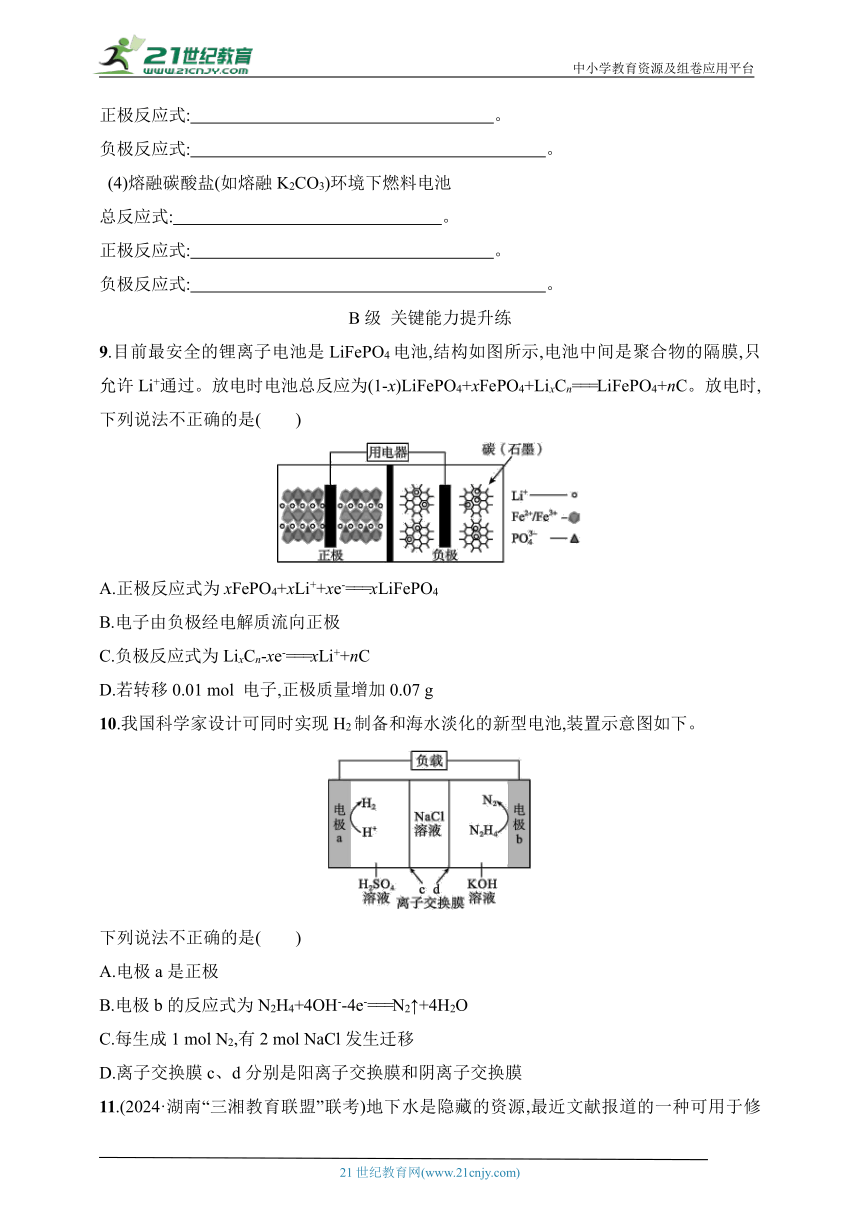
9.目前最安全的锂离子电池是LiFePO4电池,结构如图所示,电池中间是聚合物的隔膜,只允许Li+通过。放电时电池总反应为(1-x)LiFePO4+xFePO4+LixCn===LiFePO4+nC。放电时,下列说法不正确的是( )
A.正极反应式为xFePO4+xLi++xe-===xLiFePO4
B.电子由负极经电解质流向正极
C.负极反应式为LixCn-xe-===xLi++nC
D.若转移0.01 mol 电子,正极质量增加0.07 g
10.我国科学家设计可同时实现H2制备和海水淡化的新型电池,装置示意图如下。
下列说法不正确的是( )
A.电极a是正极
B.电极b的反应式为N2H4+4OH--4e-===N2↑+4H2O
C.每生成1 mol N2,有2 mol NaCl发生迁移
D.离子交换膜c、d分别是阳离子交换膜和阴离子交换膜
11.(2024·湖南“三湘教育联盟”联考)地下水是隐藏的资源,最近文献报道的一种可用于修复被N污染的地下水的模拟装置如图所示,石墨作电极。下列说法错误的是( )
A.乙池中石墨作正极,发生氧化反应
B.装置工作时,电子从甲池中石墨电极经导线流向乙池中石墨电极
C.甲池发生的电极反应式为C6H12O6+6H2O-24e-===6CO2↑+24H+
D.当处理含1 mol N的废水时,有5 mol H+通过质子膜
12.(2024·湖北鄂州名校联考)最近科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )
A.吸附层a是负极,发生氧化反应,吸附层b是正极,发生还原反应
B.“全氢电池”的总反应为H++OH-===H2O
C.NaClO4的作用是传导离子并参与电极反应
D.Na+在装置中从左侧向右侧移动
C级 学科素养拔高练
13.燃料电池是一种将燃料所具有的化学能直接转换成电能的化学装置。
(1)以多孔铂为电极,如图甲装置中A、B口分别通入CH3CH2OH和O2构成乙醇燃料电池,则b电极是 (填“正极”或“负极”),该电池负极的电极反应式为 。
(2)科学家研究了转化温室气体的方法,利用图乙所示装置可以将CO2转化为气体燃料CO,该电池负极的电极反应式为 ,
工作时的总反应式为 。
(3)绿色电源“二甲醚-氧气燃料电池”的工作原理如图丙所示。
①氧气应从c处通入,发生的电极反应式为 。
②二甲醚(CH3OCH3)应从b处加入,电极X上发生的电极反应式为 。
③电池在放电过程中,电极X周围溶液的pH (填“增大”“减小”或“不变”)。
(4)研究HCOOH燃料电池性能的装置如图丁所示,两电极区间用允许阳离子通过的半透膜隔开。
①负极区的电极反应式为 。
②右侧储液池中发生的反应为 。
③放电时,1 mol HCOOH转化为KHCO3时,消耗O2的体积(标准状况下)为 。
分层作业22 化学电源
1.C 解析 图Ⅰ所示电池中锌是负极,铜是正极,电子从锌片流出经导线流向铜片,电子不能通过溶液传递,A错误;图Ⅱ所示干电池中锌作负极,发生氧化反应,B错误;图Ⅲ所示电池为二次电池,放电时铅是负极,电极反应式为Pb+S-2e-===PbSO4,C正确;图Ⅳ所示电池中H+移向b电极,b电极是正极,a电极是负极,从n处通入O2,电极反应式为O2+4H++4e-===2H2O,D错误。
2.D 解析 该装置是原电池,是将化学能转化为电能的装置,A正确;根据反应方程式,锂发生氧化反应,a为负极、b为正极,外电路中电子移动方向为由负极流向正极,即由a极流向b极,B正确;Li能与水反应,故不能用水代替SO(CH3)2作溶剂,C正确;b极上FeS2得电子发生还原反应,电极反应式为FeS2+4Li++4e-===Fe+2Li2S,D错误。
3.C 解析 根据放电的总反应可知,Na作负极,发生氧化反应,电极反应式为Na-e-===Na+,A错误;碳纳米管作正极,CO2通入正极,发生还原反应,电极反应式为3CO2+4e-===2C+C,C正确;Na是活泼金属,能与水剧烈反应,故该电池的介质不能选择Na2CO3溶液,B错误;放电时,Na作负极,碳纳米管作正极,电流从正极流向负极,即从碳纳米管沿外电路流向Na电极,D错误。
4.A 解析 根据电池的总反应可知,Zn作负极,电极反应为Zn-2e-+2OH-===Zn(OH)2,B正确;Fe在正极上得到电子,正极反应式为Fe+3e-+4H2O===Fe(OH)3+5OH-,生成OH-,故正极附近溶液的pH增大,A错误、D正确;由正极反应式可知,每转移3 mol 电子,正极有1 mol K2FeO4被还原,C正确。
5.C 解析 多孔电极材料表面积大,吸附性强,能增大反应物接触面积,A正确;汽车行驶过程中,燃料电池产生的电能转化为动能,当汽车处于怠速等过程中,“电池”能将燃料电池产生的多余电能暂时储存起来,B正确;电解质溶液为酸性溶液,电极B的电极反应式为4H++O2+4e-===2H2O,C错误;电极B通入氧气,发生还原反应,则B为正极,质子(H+)为阳离子,向正极移动,D正确。
6.A 解析 电池工作时,通入氧气的一极为正极,氧气在正极上得到电子发生还原反应生成氢氧根离子,正极附近c(OH-)增大,溶液碱性增强,A正确;通入乙烷的电极为负极,碱性条件下,乙烷在负极失去电子发生氧化反应生成碳酸根离子和水,电极反应式为C2H6+18OH--14e-===2C+12H2O,B错误;未指明是否处于标准状况下,无法计算5.6 L O2完全反应后转移电子的物质的量,C错误;乙烷燃料电池工作时,不需要点燃乙烷,D错误。
7.B 解析 由图可知,H+由N极移向M极,则M极是正极,氯苯被还原生成苯,A错误;CH3COO-在N极上被氧化生成CO2,则N极是电池的负极,B正确;M极是正极,电极反应式为C6H5Cl+H++2e-===C6H6+Cl-,C错误;N极反应式为CH3COO-+2H2O-8e-===2CO2↑+7H+,则生成1 mol CO2时,生成3.5 mol H+,为维持N极区溶液呈电中性,有4 mol H+由N极区进入M极区,D错误。
8.答案 (1)CH4+2O2===CO2+2H2O 2O2+8H++8e-===4H2O CH4-8e-+2H2O===CO2+8H+ (2)CH4+2O2+2OH-===C+3H2O 2O2+4H2O+8e-===8OH- CH4+10OH--8e-===C+7H2O (3)CH4+2O2===CO2+2H2O 2O2+8e-===4O2- CH4+4O2--8e-===CO2+2H2O (4)CH4+2O2===CO2+2H2O 2O2+4CO2+8e-===4C CH4+4C-8e-===5CO2+2H2O
9.B 解析 放电时,石墨负极上Li失去电子生成Li+,从石墨脱嵌,电极反应式为LixCn-xe-===xLi++nC,C正确;由放电时电池总反应式减去负极反应式可得,正极反应为xFePO4+xLi++xe-===xLiFePO4,A正确;原电池中,电子由负极流出,经导线、用电器、导线流向正极,不能进入电解质中,B错误;若转移0.01 mol 电子,正极上有0.01 mol Li+嵌入电极,故正极质量增加0.01 mol×7 g·mol-1=0.07 g,D正确。
10.C 解析 该装置为原电池,电极a上H+发生还原反应生成H2,则电极a是正极,A正确;电极b是负极,电解质溶液是KOH溶液,N2H4→N2,电极反应式为N2H4+4OH--4e-===N2↑+4H2O,B正确;据负极反应式可知,生成1 mol N2时电路中转移4 mol 电子,根据电荷守恒,有4 mol Na+和4 mol Cl-发生迁移,C错误;电极a反应式为2H++2e-===H2↑,为维持电解质溶液呈电中性,NaCl溶液中Na+向左侧移动,同理Cl-向右侧移动,故离子交换膜c、d分别是阳离子交换膜和阴离子交换膜,D正确。
11.A 解析 乙池中石墨作正极,N→N2发生还原反应,A错误;原电池中,电子由负极流向正极,故电子从甲池中石墨电极经导线流向乙池中石墨电极,B正确;甲池中C6H12O6发生氧化反应生成CO2,电极反应式为C6H12O6+6H2O-24e-===6CO2↑+24H+,C正确;正极反应式为2N+12H++10e-===N2↑+6H2O,则处理含1 mol N的废水时,电路中通过5 mol 电子,根据电荷守恒,有5 mol H+通过质子交换膜,D正确。
12.C 解析 由图可知,吸附层a上H2反应生成H2O,发生氧化反应,吸附层b上H+反应生成H2,发生还原反应,则吸附层a是负极,吸附层b是正极,A正确;负极反应式为H2+2OH--2e-===2H2O,正极反应式为2H++2e-===H2↑,综合两极反应式可得电池总反应为H++OH-===H2O,B正确;由图可知,NaClO4的作用仅是传导离子,并未参与电极反应,C错误;原电池中阳离子向正极移动,故Na+从左侧向右侧移动,D正确。
13.答案 (1)正极 CH3CH2OH+16OH--12e-===2C+11H2O (2)2H2O-4e-===O2↑+4H+ 2CO2===2CO+O2 (3)①O2+4e-+4H+===2H2O ②CH3OCH3-12e-+3H2O===2CO2+12H+ ③不变 (4)①HCOO-+2OH--2e-===HC+H2O ②4Fe2++O2+4H+===4Fe3++2H2O ③11.2 L
解析 (1)B口处通入氧气,氧气得到电子发生还原反应,为电源正极;该电池负极的电极反应为乙醇在碱性条件下失去电子发生氧化反应生成碳酸根离子和水。
(2)由图乙可知,M极水生成氧气,发生氧化反应为电源负极,电极反应式为2H2O-4e-===O2↑+4H+;该电池N极二氧化碳发生还原反应生成水和一氧化碳,为电源正极,故电池总反应为二氧化碳生成氧气和一氧化碳。
(3)①氧气应从c处通入,氧气得到电子,发生还原反应生成水,发生的电极反应式为O2+4e-+4H+===2H2O;②二甲醚(CH3OCH3)应从b处加入,在X极上失去电子,发生氧化反应生成二氧化碳,电极X上发生的电极反应式为CH3OCH3-12e-+3H2O===2CO2+12H+;③电池在放电过程中,电极X周围溶液中H+通过质子交换膜扩散到电极Y,氢离子浓度不变,pH不变。
(4)②储液池中发生的反应为亚铁离子被氧化;③放电时,1 mol HCOOH转化为KHCO3时,消耗0.5 mol O2,在标准状况下体积约为11.2 L。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025人教版高中化学选择性必修1
分层作业22 化学电源
A级 必备知识基础练
题组1.一次电池和二次电池
1.下列四个常用电化学装置的叙述正确的是( )
图Ⅰ水果电池 图Ⅱ干电池
图Ⅲ铅酸蓄电池 图Ⅳ氢氧燃料电池
A.图Ⅰ所示电池中,电子从锌片流出经导线流向铜片,再通过番茄内部流回锌片
B.图Ⅱ所示干电池中锌作负极,发生还原反应
C.图Ⅲ所示电池为二次电池,放电时负极的电极反应式为Pb+S-2e-===PbSO4
D.图Ⅳ所示电池中从m处通入O2,a电极为正极,电极反应式为O2+4e-+4H+===2H2O
2.如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2===Fe+2Li2S。下列说法不正确的是( )
A.该装置将化学能转化为电能
B.电子移动方向是由a极流向b极
C.不可以用水代替SO(CH3)2作溶剂
D.b极反应式是FeS2+4Li+-4e-===Fe+2Li2S
3.火星大气中含有大量CO2,一种有CO2参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠和碳纳米管作为两极(如图所示),放电的总反应为4Na+3CO2===2Na2CO3+C。下列说法正确的是( )
A.金属Na作负极,发生还原反应
B.该电池的介质可以选择Na2CO3溶液
C.正极反应式为3CO2+4e-===2C+C
D.工作时电流从Na电极经导线流向碳纳米管电极
4.(2024·广西河池八校联考)高铁电池是一种新型二次电池,该电池能长时间保持稳定的放电电压。高铁电池放电时总反应为3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
A.放电时,正极附近溶液的pH不变
B.放电时,负极反应为Zn-2e-+2OH-===Zn(OH)2
C.放电时,每转移3 mol 电子,正极有1 mol K2FeO4被还原
D.放电时,正极反应式为Fe+4H2O+3e-===Fe(OH)3+5OH-
题组2.燃料电池
5.(2024·浙江台州八校联考)氢燃料电池汽车由于具备许多优势而备受关注。某氢燃料电池汽车的结构如图所示:
下列说法错误的是( )
A.电极A、B采用多孔电极材料的优点是能增大反应物接触面积
B.“电池”能将燃料电池产生的多余电能暂时储存起来
C.电极B的电极反应式为O2+4e-===2O2-
D.质子通过电解质溶液向电极B迁移
6.燃料电池是燃料(如CO、H2、CH4、C2H6等)与氧气(或空气)反应将化学能转变为电能的装置。若电解质溶液是强碱溶液,下面关于乙烷(C2H6)燃料电池的说法正确的是( )
A.该电池工作时,正极附近溶液的碱性增强
B.负极反应式:C2H6+18OH-+14e-===2C+12H2O
C.通入5.6 L O2完全反应后,有1 mol 电子发生转移
D.燃料电池的优点之一是点燃时化学能大部分转化为电能而不是热能和光能
7.(2024·天津部分区联考)含氯苯的废水可通过加入适量乙酸钠,设计成微生物电池将氯苯转化为苯而除去,其原理如图所示。下列叙述正确的是( )
A.氯苯被氧化生成苯
B.N极为电池的负极
C.M极的电极反应式为C6H5Cl+e-===C6H6+Cl-
D.每生成1 mol CO2,由N极区进入M极区的H+的物质的量为3 mol
8.以甲烷燃料电池为例来分析在不同的环境下电极反应式的书写方法。
(1)酸性条件下燃料电池
总反应式: 。
正极反应式: 。
负极反应式: 。
(2)碱性条件下燃料电池
总反应式: 。
正极反应式: 。
负极反应式: 。
(3)固体电解质(高温下能传导O2-)燃料电池
总反应式: 。
正极反应式: 。
负极反应式: 。
(4)熔融碳酸盐(如熔融K2CO3)环境下燃料电池
总反应式: 。
正极反应式: 。
负极反应式: 。
B级 关键能力提升练
9.目前最安全的锂离子电池是LiFePO4电池,结构如图所示,电池中间是聚合物的隔膜,只允许Li+通过。放电时电池总反应为(1-x)LiFePO4+xFePO4+LixCn===LiFePO4+nC。放电时,下列说法不正确的是( )
A.正极反应式为xFePO4+xLi++xe-===xLiFePO4
B.电子由负极经电解质流向正极
C.负极反应式为LixCn-xe-===xLi++nC
D.若转移0.01 mol 电子,正极质量增加0.07 g
10.我国科学家设计可同时实现H2制备和海水淡化的新型电池,装置示意图如下。
下列说法不正确的是( )
A.电极a是正极
B.电极b的反应式为N2H4+4OH--4e-===N2↑+4H2O
C.每生成1 mol N2,有2 mol NaCl发生迁移
D.离子交换膜c、d分别是阳离子交换膜和阴离子交换膜
11.(2024·湖南“三湘教育联盟”联考)地下水是隐藏的资源,最近文献报道的一种可用于修复被N污染的地下水的模拟装置如图所示,石墨作电极。下列说法错误的是( )
A.乙池中石墨作正极,发生氧化反应
B.装置工作时,电子从甲池中石墨电极经导线流向乙池中石墨电极
C.甲池发生的电极反应式为C6H12O6+6H2O-24e-===6CO2↑+24H+
D.当处理含1 mol N的废水时,有5 mol H+通过质子膜
12.(2024·湖北鄂州名校联考)最近科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )
A.吸附层a是负极,发生氧化反应,吸附层b是正极,发生还原反应
B.“全氢电池”的总反应为H++OH-===H2O
C.NaClO4的作用是传导离子并参与电极反应
D.Na+在装置中从左侧向右侧移动
C级 学科素养拔高练
13.燃料电池是一种将燃料所具有的化学能直接转换成电能的化学装置。
(1)以多孔铂为电极,如图甲装置中A、B口分别通入CH3CH2OH和O2构成乙醇燃料电池,则b电极是 (填“正极”或“负极”),该电池负极的电极反应式为 。
(2)科学家研究了转化温室气体的方法,利用图乙所示装置可以将CO2转化为气体燃料CO,该电池负极的电极反应式为 ,
工作时的总反应式为 。
(3)绿色电源“二甲醚-氧气燃料电池”的工作原理如图丙所示。
①氧气应从c处通入,发生的电极反应式为 。
②二甲醚(CH3OCH3)应从b处加入,电极X上发生的电极反应式为 。
③电池在放电过程中,电极X周围溶液的pH (填“增大”“减小”或“不变”)。
(4)研究HCOOH燃料电池性能的装置如图丁所示,两电极区间用允许阳离子通过的半透膜隔开。
①负极区的电极反应式为 。
②右侧储液池中发生的反应为 。
③放电时,1 mol HCOOH转化为KHCO3时,消耗O2的体积(标准状况下)为 。
分层作业22 化学电源
1.C 解析 图Ⅰ所示电池中锌是负极,铜是正极,电子从锌片流出经导线流向铜片,电子不能通过溶液传递,A错误;图Ⅱ所示干电池中锌作负极,发生氧化反应,B错误;图Ⅲ所示电池为二次电池,放电时铅是负极,电极反应式为Pb+S-2e-===PbSO4,C正确;图Ⅳ所示电池中H+移向b电极,b电极是正极,a电极是负极,从n处通入O2,电极反应式为O2+4H++4e-===2H2O,D错误。
2.D 解析 该装置是原电池,是将化学能转化为电能的装置,A正确;根据反应方程式,锂发生氧化反应,a为负极、b为正极,外电路中电子移动方向为由负极流向正极,即由a极流向b极,B正确;Li能与水反应,故不能用水代替SO(CH3)2作溶剂,C正确;b极上FeS2得电子发生还原反应,电极反应式为FeS2+4Li++4e-===Fe+2Li2S,D错误。
3.C 解析 根据放电的总反应可知,Na作负极,发生氧化反应,电极反应式为Na-e-===Na+,A错误;碳纳米管作正极,CO2通入正极,发生还原反应,电极反应式为3CO2+4e-===2C+C,C正确;Na是活泼金属,能与水剧烈反应,故该电池的介质不能选择Na2CO3溶液,B错误;放电时,Na作负极,碳纳米管作正极,电流从正极流向负极,即从碳纳米管沿外电路流向Na电极,D错误。
4.A 解析 根据电池的总反应可知,Zn作负极,电极反应为Zn-2e-+2OH-===Zn(OH)2,B正确;Fe在正极上得到电子,正极反应式为Fe+3e-+4H2O===Fe(OH)3+5OH-,生成OH-,故正极附近溶液的pH增大,A错误、D正确;由正极反应式可知,每转移3 mol 电子,正极有1 mol K2FeO4被还原,C正确。
5.C 解析 多孔电极材料表面积大,吸附性强,能增大反应物接触面积,A正确;汽车行驶过程中,燃料电池产生的电能转化为动能,当汽车处于怠速等过程中,“电池”能将燃料电池产生的多余电能暂时储存起来,B正确;电解质溶液为酸性溶液,电极B的电极反应式为4H++O2+4e-===2H2O,C错误;电极B通入氧气,发生还原反应,则B为正极,质子(H+)为阳离子,向正极移动,D正确。
6.A 解析 电池工作时,通入氧气的一极为正极,氧气在正极上得到电子发生还原反应生成氢氧根离子,正极附近c(OH-)增大,溶液碱性增强,A正确;通入乙烷的电极为负极,碱性条件下,乙烷在负极失去电子发生氧化反应生成碳酸根离子和水,电极反应式为C2H6+18OH--14e-===2C+12H2O,B错误;未指明是否处于标准状况下,无法计算5.6 L O2完全反应后转移电子的物质的量,C错误;乙烷燃料电池工作时,不需要点燃乙烷,D错误。
7.B 解析 由图可知,H+由N极移向M极,则M极是正极,氯苯被还原生成苯,A错误;CH3COO-在N极上被氧化生成CO2,则N极是电池的负极,B正确;M极是正极,电极反应式为C6H5Cl+H++2e-===C6H6+Cl-,C错误;N极反应式为CH3COO-+2H2O-8e-===2CO2↑+7H+,则生成1 mol CO2时,生成3.5 mol H+,为维持N极区溶液呈电中性,有4 mol H+由N极区进入M极区,D错误。
8.答案 (1)CH4+2O2===CO2+2H2O 2O2+8H++8e-===4H2O CH4-8e-+2H2O===CO2+8H+ (2)CH4+2O2+2OH-===C+3H2O 2O2+4H2O+8e-===8OH- CH4+10OH--8e-===C+7H2O (3)CH4+2O2===CO2+2H2O 2O2+8e-===4O2- CH4+4O2--8e-===CO2+2H2O (4)CH4+2O2===CO2+2H2O 2O2+4CO2+8e-===4C CH4+4C-8e-===5CO2+2H2O
9.B 解析 放电时,石墨负极上Li失去电子生成Li+,从石墨脱嵌,电极反应式为LixCn-xe-===xLi++nC,C正确;由放电时电池总反应式减去负极反应式可得,正极反应为xFePO4+xLi++xe-===xLiFePO4,A正确;原电池中,电子由负极流出,经导线、用电器、导线流向正极,不能进入电解质中,B错误;若转移0.01 mol 电子,正极上有0.01 mol Li+嵌入电极,故正极质量增加0.01 mol×7 g·mol-1=0.07 g,D正确。
10.C 解析 该装置为原电池,电极a上H+发生还原反应生成H2,则电极a是正极,A正确;电极b是负极,电解质溶液是KOH溶液,N2H4→N2,电极反应式为N2H4+4OH--4e-===N2↑+4H2O,B正确;据负极反应式可知,生成1 mol N2时电路中转移4 mol 电子,根据电荷守恒,有4 mol Na+和4 mol Cl-发生迁移,C错误;电极a反应式为2H++2e-===H2↑,为维持电解质溶液呈电中性,NaCl溶液中Na+向左侧移动,同理Cl-向右侧移动,故离子交换膜c、d分别是阳离子交换膜和阴离子交换膜,D正确。
11.A 解析 乙池中石墨作正极,N→N2发生还原反应,A错误;原电池中,电子由负极流向正极,故电子从甲池中石墨电极经导线流向乙池中石墨电极,B正确;甲池中C6H12O6发生氧化反应生成CO2,电极反应式为C6H12O6+6H2O-24e-===6CO2↑+24H+,C正确;正极反应式为2N+12H++10e-===N2↑+6H2O,则处理含1 mol N的废水时,电路中通过5 mol 电子,根据电荷守恒,有5 mol H+通过质子交换膜,D正确。
12.C 解析 由图可知,吸附层a上H2反应生成H2O,发生氧化反应,吸附层b上H+反应生成H2,发生还原反应,则吸附层a是负极,吸附层b是正极,A正确;负极反应式为H2+2OH--2e-===2H2O,正极反应式为2H++2e-===H2↑,综合两极反应式可得电池总反应为H++OH-===H2O,B正确;由图可知,NaClO4的作用仅是传导离子,并未参与电极反应,C错误;原电池中阳离子向正极移动,故Na+从左侧向右侧移动,D正确。
13.答案 (1)正极 CH3CH2OH+16OH--12e-===2C+11H2O (2)2H2O-4e-===O2↑+4H+ 2CO2===2CO+O2 (3)①O2+4e-+4H+===2H2O ②CH3OCH3-12e-+3H2O===2CO2+12H+ ③不变 (4)①HCOO-+2OH--2e-===HC+H2O ②4Fe2++O2+4H+===4Fe3++2H2O ③11.2 L
解析 (1)B口处通入氧气,氧气得到电子发生还原反应,为电源正极;该电池负极的电极反应为乙醇在碱性条件下失去电子发生氧化反应生成碳酸根离子和水。
(2)由图乙可知,M极水生成氧气,发生氧化反应为电源负极,电极反应式为2H2O-4e-===O2↑+4H+;该电池N极二氧化碳发生还原反应生成水和一氧化碳,为电源正极,故电池总反应为二氧化碳生成氧气和一氧化碳。
(3)①氧气应从c处通入,氧气得到电子,发生还原反应生成水,发生的电极反应式为O2+4e-+4H+===2H2O;②二甲醚(CH3OCH3)应从b处加入,在X极上失去电子,发生氧化反应生成二氧化碳,电极X上发生的电极反应式为CH3OCH3-12e-+3H2O===2CO2+12H+;③电池在放电过程中,电极X周围溶液中H+通过质子交换膜扩散到电极Y,氢离子浓度不变,pH不变。
(4)②储液池中发生的反应为亚铁离子被氧化;③放电时,1 mol HCOOH转化为KHCO3时,消耗0.5 mol O2,在标准状况下体积约为11.2 L。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
