3.2.1 醇 课件 (共20张ppt) 高中化学人教版(2019)选择性必修3
文档属性
| 名称 | 3.2.1 醇 课件 (共20张ppt) 高中化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 45.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-28 19:30:38 | ||
图片预览





文档简介
(共20张PPT)
第三章 第二节 第1课时
《醇》
环节一 情境导入,认识醇类
请同学们阅读课本59-60页,并回答以下问题:
1.什么是醇,和酚有什么区别?
2.醇根据什么可以分为什么?
3.生活中常见的醇及简单性质用途
任务一
展示与测评
下列物质属于醇类的有 ,属于饱和一元醇的有 ,属于酚类的有 。
①CH3OH;②HOCH2CH2CH3
问题一
④
CH2OH
⑤
OH
CH3
⑥
③CH3CHCH3
OH
醇 :
-OH 与 饱和碳原子 相连的化合物。
酚:
-OH 与 苯环直接相连 相连的化合物。
1.醇的定义
展示与测评
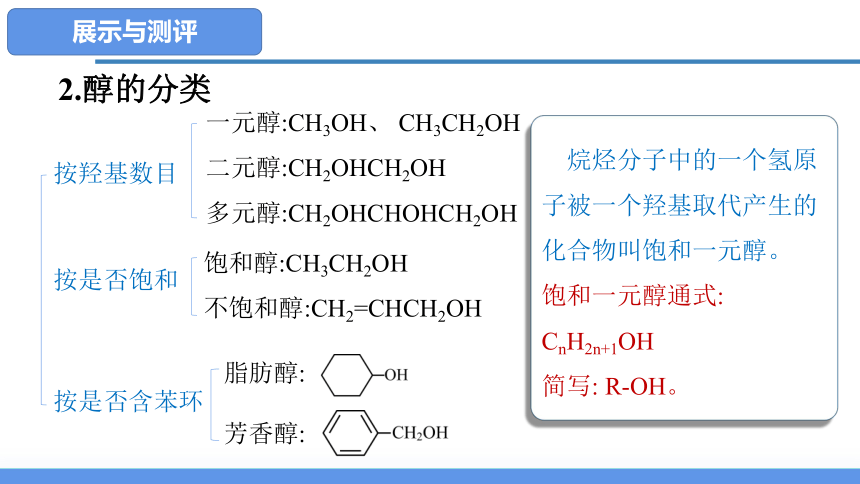
按羟基数目
按是否含苯环
按是否饱和
饱和醇:CH3CH2OH
不饱和醇:CH2=CHCH2OH
脂肪醇:
芳香醇:
一元醇:CH3OH、 CH3CH2OH
二元醇:CH2OHCH2OH
多元醇:CH2OHCHOHCH2OH
2.醇的分类
烷烃分子中的一个氢原子被一个羟基取代产生的化合物叫饱和一元醇。
饱和一元醇通式: CnH2n+1OH
简写: R-OH。
展示与测评
3.常见的醇
甲醇无色、具有挥发性的液体,有毒、易溶于水,沸点65℃。车用燃料;广泛应用于化工生产,如生产甲醛、用于农药的原料。
乙二醇、丙三醇都是无色、粘稠的液体,都易溶于水和乙醇,是重要的化工原料。乙二醇用于生产汽车防冻液。
丙三醇俗称甘油,用于配制化妆品。
环节二 模型推理 认识醇的物理性质
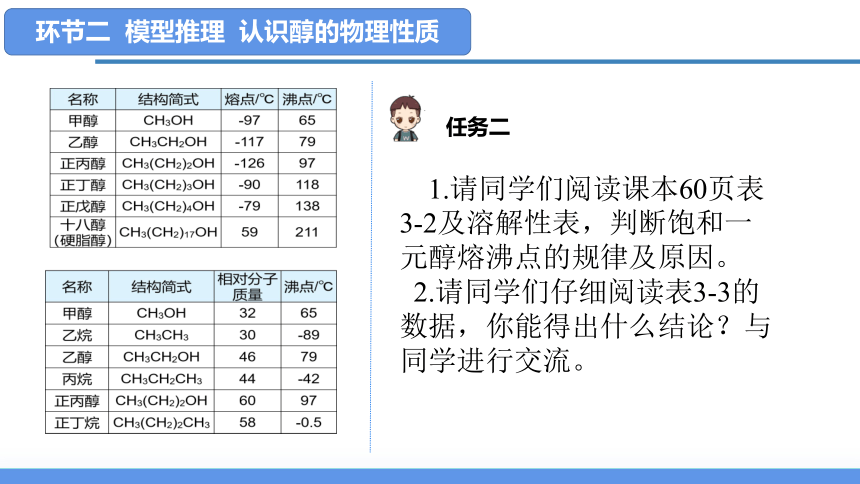
1.请同学们阅读课本60页表3-2及溶解性表,判断饱和一元醇熔沸点的规律及原因。
2.请同学们仔细阅读表3-3的数据,你能得出什么结论?与同学进行交流。
任务二
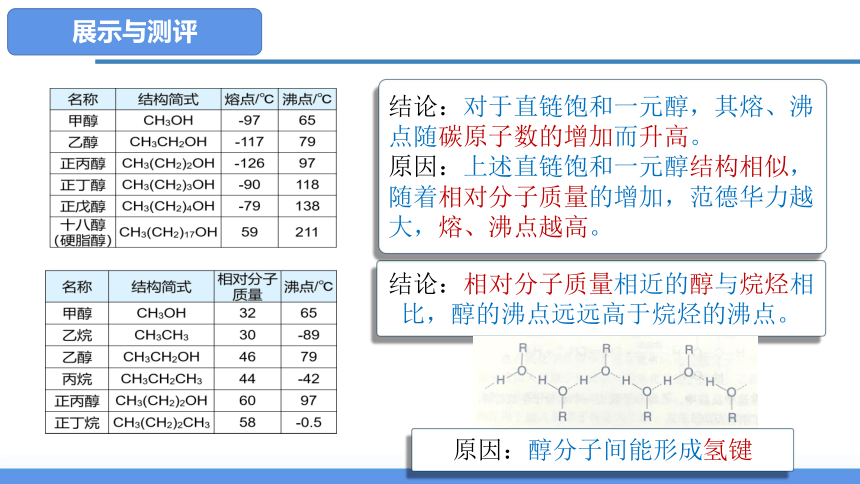
结论:相对分子质量相近的醇与烷烃相比,醇的沸点远远高于烷烃的沸点。
展示与测评
原因:醇分子间能形成氢键
结论:对于直链饱和一元醇,其熔、沸点随碳原子数的增加而升高。
原因:上述直链饱和一元醇结构相似,随着相对分子质量的增加,范德华力越大,熔、沸点越高。
环节三 探究实验 认识醇的化学性质
思考:
分析醇分子结构中的官能团和化学键,预测断键的位置。
乙醇分子的空间填充模型
①
②
③
④
元素符号 C H O
电负性 2.5 2.1 3.5
C—O键、O—H键的电子都向氧原子偏移,均有较强极性,易断裂
乙醇的核磁共振氢谱
复习巩固
(1)置换反应:
(2)取代反应:
乙醇的
化学性质
与活泼金属:Na,K等
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
(3)氧化反应:
→ 酯化反应
①燃烧:
②被强氧化剂氧化:
CH3CH2OH +3O2 2CO2 + 3H2O
点燃
③催化氧化:
酸脱羟基,醇脱氢
CH3COOH + HOCH2CH3 CH3COOCH2CH3 + H2O
浓硫酸
△
CH3CH2OH
CH3COOH
KMnO4(H+)
K2Cr2O7(H+)
2CH3CH2OH + O2 2CH3CHO + 2H2O
Cu
△
断键位置:①
断键位置:①
断键位置:①③
构建概念
氧化反应
还原反应
加入氢原子
或失去氧原子
有机化学反应中的氧化、还原反应
加入氧原子
或失去氢原子
失去2H
加入O
有机化合物分子
CH3CH2OH
CH3CHO
CH3COOH
氧化反应
氧化反应
环节三 探究实验 认识醇的化学性质
H—C—C—O—H
H
H
H
H
④
①
②
③
【预测性质】对比溴乙烷,结合乙醇分子中化学键的极性,推测乙醇还可能具有哪些化学性质。
C
C
Br
H
H
H
H
H
?
环节三 探究实验 认识醇的化学性质
1.怎样验证乙醇的消去反应可以发生?反应条件如何选择?
乙烯
酸性KMnO4溶液褪色
溴水/溴的CCl4溶液褪色
【资料小卡片】乙醇与浓硫酸混合加热到170℃产生乙烯气体。140 ℃时两个乙醇分子间会脱去一分子水生成乙醚。
乙醇中加入浓硫酸,将反应温度迅速升至170 ℃。
2.实验有无干扰?怎样排除?
C + 2H2SO4(浓) CO2↑ + 2SO2↑ + 2H2O
△
2.C2H5OH
C
浓硫酸
脱水性
NaOH溶液
1.验证产物的生成
任务三
环节三 探究实验 认识醇的化学性质
CH3CH2OH CH2=CH2↑ +H2O
浓硫酸
170℃
(4)消去反应
断键位置:反应时乙醇分子断的键是C—H与C—O
实验现象:
①有气体产生,
该气体使溴的CCl4溶液褪色、
酸性KMnO4溶液褪色。
②烧瓶内液体的颜色逐渐加深,
最后变成黑色。
环节三 探究实验 认识醇的化学性质
1.醇发生消去反应的条件?
2.判断下列醇能否发生消去反应,若能发生产物是什么?和小组同学讨论规律
CH3CH2CH2 C CH3
CH2CH3
OH
②
CH3—C—CH2OH
CH3
CH3
①
1.与羟基相连碳原子的邻位碳原子上要有氢原子。
2.①不能发生消去反应
CH3CH2C C C
C CH3
OH
H
2
2
3
H
H
②消去的产物可能有三种
2
问题二
环节三 探究实验 认识醇的化学性质
1.混合乙醇和浓硫酸时应注意什么?
2.浓硫酸的作用是什么?
3.混合液中应放入几片碎瓷片,为什么?
4.温度计水银球应置于什么位置?
5.反应有什么杂质气体生成,如何除去
6.温度要迅速升高并稳定在170℃?
1.先加入乙醇,再加入浓硫酸,乙醇与浓硫酸体积比1:3。
2.催化剂和脱水剂。
3.防止暴沸。
4.置于反应混合液中。
5.往往混有CO2、SO2等气体。其中SO2会干扰后续实验现象,可将气体通过NaOH溶液除去。
6.在140℃时乙醇发生分子间脱水,生成乙醚。
问题三
环节三 探究实验 认识醇的化学性质
1.请写出乙醇发生分子间脱水生成乙醚(C2H5-O-C2H5)的化学反应方程式,并分析反应过程中化学键的断裂与形成特点。
问题四
断键位置:①②
(2)取代反应
与氢溴酸反应:
+ H2O
C2H5—OH
+
H—Br
△
C2H5—Br
断键位置:②
乙醚为无色、易挥发的液体,沸点为34.5 ℃,有特殊气味。乙醚易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机物。
醚:由两个烃基通过一个氧原子连接起来的化合物。
官能团:醚键
醚类物质在化工生产中被广泛用作溶剂,有的醚可被用作麻醉剂。
环节四 交流讨论 归纳总结
CH3CH2ONa
CH3COOCH2CH3
断裂②
CH3CH2Br
C2H5OC2H5
断裂①②
取代
反
应
置换反应
乙醇的化学性质小结
断裂②④
CH2
CH2
断裂①③
CH3CHO
消去反应
氧化反应
断裂①
学以致用
1.调查生活中的醇类,应用了醇类的那些性质
2.如何从1-丙醇制1,2-丙二醇?
3.指出下列转化的反应类型并书写相关化学方程式。
课后作业
同学们再见!
第三章 第二节 第1课时
《醇》
环节一 情境导入,认识醇类
请同学们阅读课本59-60页,并回答以下问题:
1.什么是醇,和酚有什么区别?
2.醇根据什么可以分为什么?
3.生活中常见的醇及简单性质用途
任务一
展示与测评
下列物质属于醇类的有 ,属于饱和一元醇的有 ,属于酚类的有 。
①CH3OH;②HOCH2CH2CH3
问题一
④
CH2OH
⑤
OH
CH3
⑥
③CH3CHCH3
OH
醇 :
-OH 与 饱和碳原子 相连的化合物。
酚:
-OH 与 苯环直接相连 相连的化合物。
1.醇的定义
展示与测评
按羟基数目
按是否含苯环
按是否饱和
饱和醇:CH3CH2OH
不饱和醇:CH2=CHCH2OH
脂肪醇:
芳香醇:
一元醇:CH3OH、 CH3CH2OH
二元醇:CH2OHCH2OH
多元醇:CH2OHCHOHCH2OH
2.醇的分类
烷烃分子中的一个氢原子被一个羟基取代产生的化合物叫饱和一元醇。
饱和一元醇通式: CnH2n+1OH
简写: R-OH。
展示与测评
3.常见的醇
甲醇无色、具有挥发性的液体,有毒、易溶于水,沸点65℃。车用燃料;广泛应用于化工生产,如生产甲醛、用于农药的原料。
乙二醇、丙三醇都是无色、粘稠的液体,都易溶于水和乙醇,是重要的化工原料。乙二醇用于生产汽车防冻液。
丙三醇俗称甘油,用于配制化妆品。
环节二 模型推理 认识醇的物理性质
1.请同学们阅读课本60页表3-2及溶解性表,判断饱和一元醇熔沸点的规律及原因。
2.请同学们仔细阅读表3-3的数据,你能得出什么结论?与同学进行交流。
任务二
结论:相对分子质量相近的醇与烷烃相比,醇的沸点远远高于烷烃的沸点。
展示与测评
原因:醇分子间能形成氢键
结论:对于直链饱和一元醇,其熔、沸点随碳原子数的增加而升高。
原因:上述直链饱和一元醇结构相似,随着相对分子质量的增加,范德华力越大,熔、沸点越高。
环节三 探究实验 认识醇的化学性质
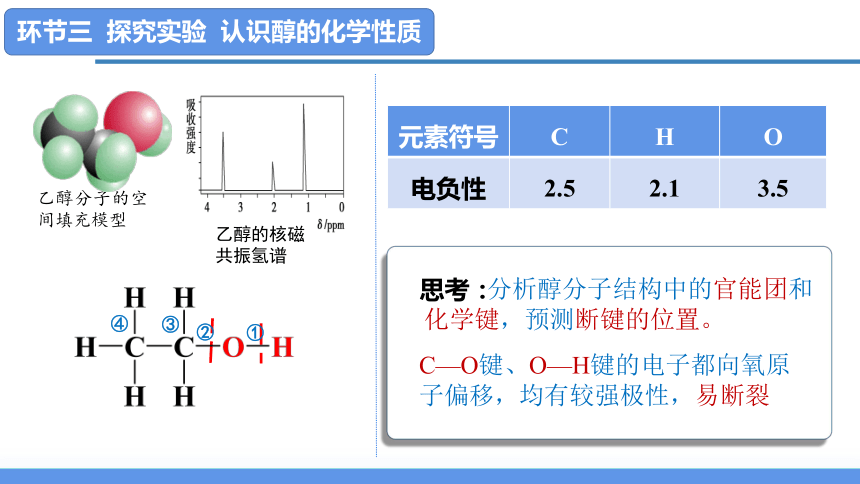
思考:
分析醇分子结构中的官能团和化学键,预测断键的位置。
乙醇分子的空间填充模型
①
②
③
④
元素符号 C H O
电负性 2.5 2.1 3.5
C—O键、O—H键的电子都向氧原子偏移,均有较强极性,易断裂
乙醇的核磁共振氢谱
复习巩固
(1)置换反应:
(2)取代反应:
乙醇的
化学性质
与活泼金属:Na,K等
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
(3)氧化反应:
→ 酯化反应
①燃烧:
②被强氧化剂氧化:
CH3CH2OH +3O2 2CO2 + 3H2O
点燃
③催化氧化:
酸脱羟基,醇脱氢
CH3COOH + HOCH2CH3 CH3COOCH2CH3 + H2O
浓硫酸
△
CH3CH2OH
CH3COOH
KMnO4(H+)
K2Cr2O7(H+)
2CH3CH2OH + O2 2CH3CHO + 2H2O
Cu
△
断键位置:①
断键位置:①
断键位置:①③
构建概念
氧化反应
还原反应
加入氢原子
或失去氧原子
有机化学反应中的氧化、还原反应
加入氧原子
或失去氢原子
失去2H
加入O
有机化合物分子
CH3CH2OH
CH3CHO
CH3COOH
氧化反应
氧化反应
环节三 探究实验 认识醇的化学性质
H—C—C—O—H
H
H
H
H
④
①
②
③
【预测性质】对比溴乙烷,结合乙醇分子中化学键的极性,推测乙醇还可能具有哪些化学性质。
C
C
Br
H
H
H
H
H
?
环节三 探究实验 认识醇的化学性质
1.怎样验证乙醇的消去反应可以发生?反应条件如何选择?
乙烯
酸性KMnO4溶液褪色
溴水/溴的CCl4溶液褪色
【资料小卡片】乙醇与浓硫酸混合加热到170℃产生乙烯气体。140 ℃时两个乙醇分子间会脱去一分子水生成乙醚。
乙醇中加入浓硫酸,将反应温度迅速升至170 ℃。
2.实验有无干扰?怎样排除?
C + 2H2SO4(浓) CO2↑ + 2SO2↑ + 2H2O
△
2.C2H5OH
C
浓硫酸
脱水性
NaOH溶液
1.验证产物的生成
任务三
环节三 探究实验 认识醇的化学性质
CH3CH2OH CH2=CH2↑ +H2O
浓硫酸
170℃
(4)消去反应
断键位置:反应时乙醇分子断的键是C—H与C—O
实验现象:
①有气体产生,
该气体使溴的CCl4溶液褪色、
酸性KMnO4溶液褪色。
②烧瓶内液体的颜色逐渐加深,
最后变成黑色。
环节三 探究实验 认识醇的化学性质
1.醇发生消去反应的条件?
2.判断下列醇能否发生消去反应,若能发生产物是什么?和小组同学讨论规律
CH3CH2CH2 C CH3
CH2CH3
OH
②
CH3—C—CH2OH
CH3
CH3
①
1.与羟基相连碳原子的邻位碳原子上要有氢原子。
2.①不能发生消去反应
CH3CH2C C C
C CH3
OH
H
2
2
3
H
H
②消去的产物可能有三种
2
问题二
环节三 探究实验 认识醇的化学性质
1.混合乙醇和浓硫酸时应注意什么?
2.浓硫酸的作用是什么?
3.混合液中应放入几片碎瓷片,为什么?
4.温度计水银球应置于什么位置?
5.反应有什么杂质气体生成,如何除去
6.温度要迅速升高并稳定在170℃?
1.先加入乙醇,再加入浓硫酸,乙醇与浓硫酸体积比1:3。
2.催化剂和脱水剂。
3.防止暴沸。
4.置于反应混合液中。
5.往往混有CO2、SO2等气体。其中SO2会干扰后续实验现象,可将气体通过NaOH溶液除去。
6.在140℃时乙醇发生分子间脱水,生成乙醚。
问题三
环节三 探究实验 认识醇的化学性质
1.请写出乙醇发生分子间脱水生成乙醚(C2H5-O-C2H5)的化学反应方程式,并分析反应过程中化学键的断裂与形成特点。
问题四
断键位置:①②
(2)取代反应
与氢溴酸反应:
+ H2O
C2H5—OH
+
H—Br
△
C2H5—Br
断键位置:②
乙醚为无色、易挥发的液体,沸点为34.5 ℃,有特殊气味。乙醚易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机物。
醚:由两个烃基通过一个氧原子连接起来的化合物。
官能团:醚键
醚类物质在化工生产中被广泛用作溶剂,有的醚可被用作麻醉剂。
环节四 交流讨论 归纳总结
CH3CH2ONa
CH3COOCH2CH3
断裂②
CH3CH2Br
C2H5OC2H5
断裂①②
取代
反
应
置换反应
乙醇的化学性质小结
断裂②④
CH2
CH2
断裂①③
CH3CHO
消去反应
氧化反应
断裂①
学以致用
1.调查生活中的醇类,应用了醇类的那些性质
2.如何从1-丙醇制1,2-丙二醇?
3.指出下列转化的反应类型并书写相关化学方程式。
课后作业
同学们再见!
