1.1.2反应热与焓变 课件 (共23张PPT) 2024-2025学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.1.2反应热与焓变 课件 (共23张PPT) 2024-2025学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-28 23:07:59 | ||
图片预览





文档简介
(共23张PPT)
第一章 化学反应的热效应
第一节 反应热
第二课时 反应热与焓变
能从能量转化的角度分析吸热和放热反应的原因;
学习目标
理解反应热和焓变的含义、符号及单位;
会通过▲H判断吸、放热反应,会利用键能进行有关反应热的计算。
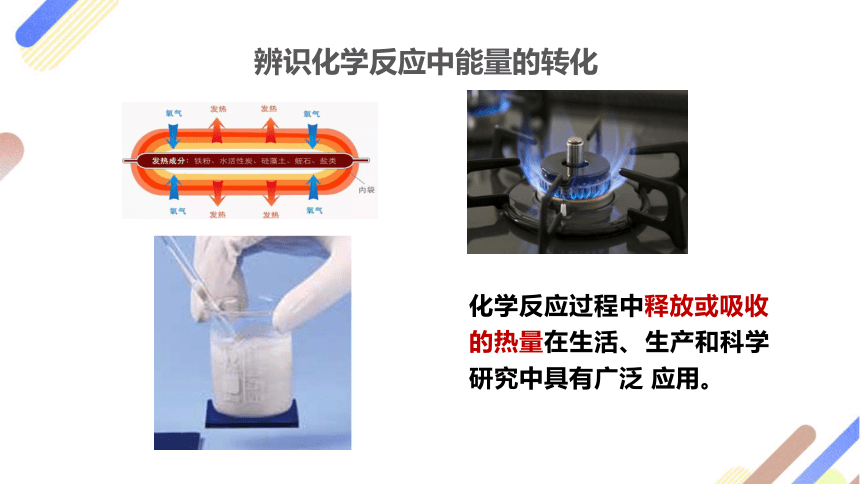
辨识化学反应中能量的转化
化学反应过程中释放或吸收的热量在生活、 生产和科学研究中具有广泛 应用。
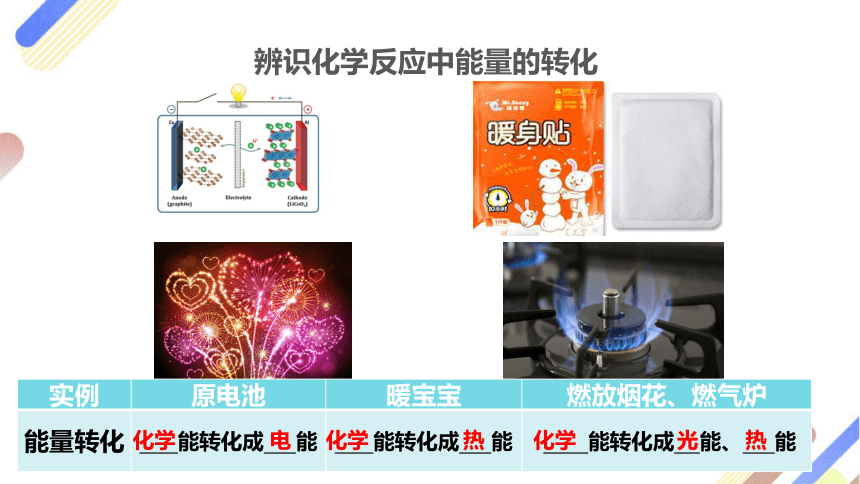
辨识化学反应中能量的转化
实例 原电池 暖宝宝 燃放烟花、燃气炉
能量转化 能转化成 能 能转化成 能 能转化成 能、 能
化学
电
化学
光
热
化学
热
常见的吸热反应和放热反应
神舟 十五 号发 射
鸟巢上空的烟火
放热反应 吸热反应
①所有燃烧反应
②酸碱中和反应
③大多数化合反应
④活泼金属跟水或酸的反应
⑤物质的缓慢氧化
⑥铝热反应
①大多数分解反应
②Ba(OH)2·8H2O与NH4Cl反应
③ C+CO2 2CO
④ C+ H2O CO+H2
⑤ NaHCO3与盐酸反应
宏观角度认识反应热
【思考】为什么化学反应会有能量的变化?
这是因为化学反应前后体系的内能(符号为U)发生了变化。
↓
体系内物质的各种能量的总和 , 受温 度、压强和物质的凝聚状态等影响。
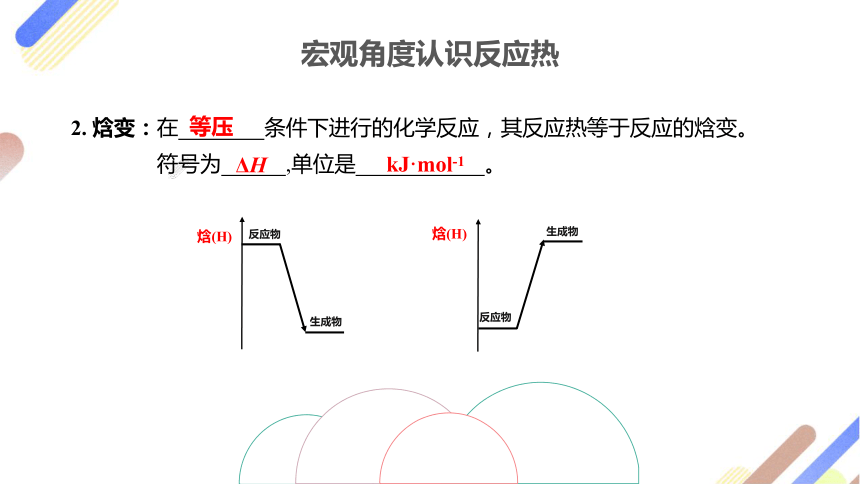
【思考】在科学研究和生产实践中,化学反应通常是在等压条件下进行 的。如何描述等压条件下的反应热?
宏观角度认识反应热
2. 焓变:在 条件下进行的化学反应,其反应热等于反应的焓变。
符号为 ,单位是 。
等压
ΔH
kJ·mol-1
内能(U)
焓(H)
反应物
生成物
内能(U)
反应物
生成物
焓(H)
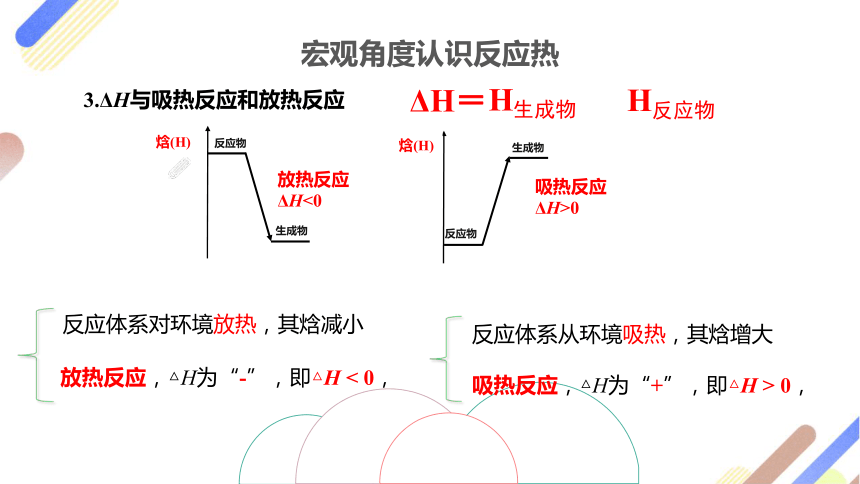
宏观角度认识反应热
3.ΔH与吸热反应和放热反应
ΔH=
H生成物
H反应物
焓(H)
反应物
生成物
放热反应
ΔH<0
反应物
生成物
吸热反应
ΔH>0
焓(H)
放热反应,△H为“-”,即△H < 0,
反应体系对环境放热,其焓减小
吸热反应,△H为“+”,即△H > 0,
反应体系从环境吸热,其焓增大
宏观角度认识反应热
【例1】 在25℃和101 kPa下 , 1 molH2与1 mol Cl2反应生成2 mol HCl时放出184.6 kJ的热量 , 则该反应的反应热为:
ΔH= - 184.6 kJ/mol
【例2】 在25 ℃和101 kPa下 , 1 mol C(如无特别说明 , C均指石墨)与1 mol H2O(g)反应 , 生成1 mol CO和1 mol H2,需要吸收131.5 kJ的热量, 则该反应的反应热为:
ΔH= +131.5 kJ/mol
【注意】ΔH右端的+或-不可省略,单位kJ/mol必须标出。
4.焓变的表示方法
微观角度理解反应热
【思考】化学反应能量是如何转化的?
化学反应的本质:___________________________________
旧化学键的断裂 和 新化学键的形成
吸收能量
放出能量
键能:键能指25℃和101KPa下(常温常压下),断开1mo1共价键所需要的能量或形成1mol共价键所放出的能量(单位为KJ/mol) 。
微观角度理解反应热
以H2(g)+Cl2(g)==== 2HCl(g)为例
H
反应进程
1mol H2(g) +1molCl2(g)
2mol HCl(g)
2mol H(g) +2molCl(g)
(436+243)KJ
862KJ
断开 1mol H—H键吸收能量436kJ
断开 1mol Cl—Cl键吸收能量243kJ
形成 2mol H—Cl键放出能量 862kJ
①断键吸能(E吸)
②成键放能(E放)
微观角度理解反应热
=-183kJ/mol
H=(436kJ/mol+ 243kJ/mol)-431kJ/mol×2
所以:焓变计算公式: H= E断键- E成键=E反键总- E生键总
结论:化学键的断裂和形成时的能量变化是化学反应中能量变化的主要原因。
微观角度理解反应热
【利用键能估算反应热】
反应热 ΔH= 。
E1 - E2
E1:反应物断裂化学键吸收的总能量,
E2:生成物形成化学键放出的总能量,
吸收能量 >放出能量 ΔH > 0
吸收能量 <放出能量 ΔH < 0
反应物
生成物
ΔH
E1
E2
H
微观角度理解反应热
【例1】化学反应N2(g)+3H2(g) 2NH3(g)的能量变化如图所示:
已知N≡N、N—H的键能分别为946 kJ·mol-1、391 kJ·mol-1
(1)该反应为______反应(填“吸热”或“放热”)。
(2)拆开1 mol H2中化学键所需能量为______ kJ。
(3)该反应的反应热ΔH=______________。
放热
436
- 92 kJ·mol-1
微观角度理解反应热
应用:物质稳定性判断
①键能越大,破坏该化学键需要的能量越高,该化学键越难断裂,所以物质越稳定。
②物质总能量越低,物质越稳定。
【例题】C(石墨s)= C(金刚石s) ΔH = +1.9kJ/mol,石墨、金刚石哪个更稳定?试分析物质稳定性与键能的关系。
H > 0,吸热反应,
石墨键能大,总能量低,更稳定。
金刚石
石墨
研究反应热的意义
热能综
合利用
工艺条
件优化
反应热应用
理论
分析
反应热估算
键能估算
能耗
……
给吸热反应加热;
给放热反应及时转移热量;
热能循环利用。
总结
化学反应热效应
表征
反应热
恒压反应热 = 焓变 ΔH
宏观
微观
原因
体系内能的变化
放热反应 ΔH <0
吸热反应 ΔH >0
断键吸热,成键放热
ΔH = E(反应物键能和) -E(生成物键能和)
应用
热能利用
工艺操作
反应的可行性
选择反应条件
随堂训练
1.已知H—H键的键能为436 kJ·mol-1,Cl—Cl键的键能为243 kJ·mol-1,H—Cl键的键能为431 kJ·mol-1,则H2(g)+Cl2(g)=2HCl(g)的反应热(ΔH)等于
( )
A.-183 kJ·mol-1 B.183 kJ·mol-1
C.-862 kJ·mol-1 D.862 kJ·mol-1
A
随堂训练
2.根据下表的键能的数据,可计算出CH4(g)+2O2(g)=CO2(g)+2H2O(g)的ΔH为
( )
化学键 O=O C—H O—H C=O
键能/kJ·mol-1 497 414 463 803
A.-379 kJ·mol-1 B.-808 kJ·mol-1
C.-1656 kJ·mol-1 D.-2532 kJ·mol-1
B
随堂训练
3.CO(g)与H2O(g)反应生成CO2(g)和H2(g)过程中的能量变化如下图所示。下列说法正确的是( )
A.该反应为吸热反应
B.1 mol CO(g)和1 mol H2O(g)具有的总能量大于1 mol CO2(g)和1 mol H2(g) 具有的总能量
C.该反应不需要加热就能进行
D.1 mol CO2(g)和1 mol H2(g)的键能总和比1 molCO(g)与1 mol H2O(g)的键能总和小41 kJ
B
随堂训练
4.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为
180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于
2 molNO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
B
随堂训练
5.最新报道科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如图所示:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
C
THANKS
第一章 化学反应的热效应
第一节 反应热
第二课时 反应热与焓变
能从能量转化的角度分析吸热和放热反应的原因;
学习目标
理解反应热和焓变的含义、符号及单位;
会通过▲H判断吸、放热反应,会利用键能进行有关反应热的计算。
辨识化学反应中能量的转化
化学反应过程中释放或吸收的热量在生活、 生产和科学研究中具有广泛 应用。
辨识化学反应中能量的转化
实例 原电池 暖宝宝 燃放烟花、燃气炉
能量转化 能转化成 能 能转化成 能 能转化成 能、 能
化学
电
化学
光
热
化学
热
常见的吸热反应和放热反应
神舟 十五 号发 射
鸟巢上空的烟火
放热反应 吸热反应
①所有燃烧反应
②酸碱中和反应
③大多数化合反应
④活泼金属跟水或酸的反应
⑤物质的缓慢氧化
⑥铝热反应
①大多数分解反应
②Ba(OH)2·8H2O与NH4Cl反应
③ C+CO2 2CO
④ C+ H2O CO+H2
⑤ NaHCO3与盐酸反应
宏观角度认识反应热
【思考】为什么化学反应会有能量的变化?
这是因为化学反应前后体系的内能(符号为U)发生了变化。
↓
体系内物质的各种能量的总和 , 受温 度、压强和物质的凝聚状态等影响。
【思考】在科学研究和生产实践中,化学反应通常是在等压条件下进行 的。如何描述等压条件下的反应热?
宏观角度认识反应热
2. 焓变:在 条件下进行的化学反应,其反应热等于反应的焓变。
符号为 ,单位是 。
等压
ΔH
kJ·mol-1
内能(U)
焓(H)
反应物
生成物
内能(U)
反应物
生成物
焓(H)
宏观角度认识反应热
3.ΔH与吸热反应和放热反应
ΔH=
H生成物
H反应物
焓(H)
反应物
生成物
放热反应
ΔH<0
反应物
生成物
吸热反应
ΔH>0
焓(H)
放热反应,△H为“-”,即△H < 0,
反应体系对环境放热,其焓减小
吸热反应,△H为“+”,即△H > 0,
反应体系从环境吸热,其焓增大
宏观角度认识反应热
【例1】 在25℃和101 kPa下 , 1 molH2与1 mol Cl2反应生成2 mol HCl时放出184.6 kJ的热量 , 则该反应的反应热为:
ΔH= - 184.6 kJ/mol
【例2】 在25 ℃和101 kPa下 , 1 mol C(如无特别说明 , C均指石墨)与1 mol H2O(g)反应 , 生成1 mol CO和1 mol H2,需要吸收131.5 kJ的热量, 则该反应的反应热为:
ΔH= +131.5 kJ/mol
【注意】ΔH右端的+或-不可省略,单位kJ/mol必须标出。
4.焓变的表示方法
微观角度理解反应热
【思考】化学反应能量是如何转化的?
化学反应的本质:___________________________________
旧化学键的断裂 和 新化学键的形成
吸收能量
放出能量
键能:键能指25℃和101KPa下(常温常压下),断开1mo1共价键所需要的能量或形成1mol共价键所放出的能量(单位为KJ/mol) 。
微观角度理解反应热
以H2(g)+Cl2(g)==== 2HCl(g)为例
H
反应进程
1mol H2(g) +1molCl2(g)
2mol HCl(g)
2mol H(g) +2molCl(g)
(436+243)KJ
862KJ
断开 1mol H—H键吸收能量436kJ
断开 1mol Cl—Cl键吸收能量243kJ
形成 2mol H—Cl键放出能量 862kJ
①断键吸能(E吸)
②成键放能(E放)
微观角度理解反应热
=-183kJ/mol
H=(436kJ/mol+ 243kJ/mol)-431kJ/mol×2
所以:焓变计算公式: H= E断键- E成键=E反键总- E生键总
结论:化学键的断裂和形成时的能量变化是化学反应中能量变化的主要原因。
微观角度理解反应热
【利用键能估算反应热】
反应热 ΔH= 。
E1 - E2
E1:反应物断裂化学键吸收的总能量,
E2:生成物形成化学键放出的总能量,
吸收能量 >放出能量 ΔH > 0
吸收能量 <放出能量 ΔH < 0
反应物
生成物
ΔH
E1
E2
H
微观角度理解反应热
【例1】化学反应N2(g)+3H2(g) 2NH3(g)的能量变化如图所示:
已知N≡N、N—H的键能分别为946 kJ·mol-1、391 kJ·mol-1
(1)该反应为______反应(填“吸热”或“放热”)。
(2)拆开1 mol H2中化学键所需能量为______ kJ。
(3)该反应的反应热ΔH=______________。
放热
436
- 92 kJ·mol-1
微观角度理解反应热
应用:物质稳定性判断
①键能越大,破坏该化学键需要的能量越高,该化学键越难断裂,所以物质越稳定。
②物质总能量越低,物质越稳定。
【例题】C(石墨s)= C(金刚石s) ΔH = +1.9kJ/mol,石墨、金刚石哪个更稳定?试分析物质稳定性与键能的关系。
H > 0,吸热反应,
石墨键能大,总能量低,更稳定。
金刚石
石墨
研究反应热的意义
热能综
合利用
工艺条
件优化
反应热应用
理论
分析
反应热估算
键能估算
能耗
……
给吸热反应加热;
给放热反应及时转移热量;
热能循环利用。
总结
化学反应热效应
表征
反应热
恒压反应热 = 焓变 ΔH
宏观
微观
原因
体系内能的变化
放热反应 ΔH <0
吸热反应 ΔH >0
断键吸热,成键放热
ΔH = E(反应物键能和) -E(生成物键能和)
应用
热能利用
工艺操作
反应的可行性
选择反应条件
随堂训练
1.已知H—H键的键能为436 kJ·mol-1,Cl—Cl键的键能为243 kJ·mol-1,H—Cl键的键能为431 kJ·mol-1,则H2(g)+Cl2(g)=2HCl(g)的反应热(ΔH)等于
( )
A.-183 kJ·mol-1 B.183 kJ·mol-1
C.-862 kJ·mol-1 D.862 kJ·mol-1
A
随堂训练
2.根据下表的键能的数据,可计算出CH4(g)+2O2(g)=CO2(g)+2H2O(g)的ΔH为
( )
化学键 O=O C—H O—H C=O
键能/kJ·mol-1 497 414 463 803
A.-379 kJ·mol-1 B.-808 kJ·mol-1
C.-1656 kJ·mol-1 D.-2532 kJ·mol-1
B
随堂训练
3.CO(g)与H2O(g)反应生成CO2(g)和H2(g)过程中的能量变化如下图所示。下列说法正确的是( )
A.该反应为吸热反应
B.1 mol CO(g)和1 mol H2O(g)具有的总能量大于1 mol CO2(g)和1 mol H2(g) 具有的总能量
C.该反应不需要加热就能进行
D.1 mol CO2(g)和1 mol H2(g)的键能总和比1 molCO(g)与1 mol H2O(g)的键能总和小41 kJ
B
随堂训练
4.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为
180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于
2 molNO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
B
随堂训练
5.最新报道科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如图所示:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
C
THANKS
