1.2.2 反应热的计算 课件(共27张ppt) 2024-2025学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.2.2 反应热的计算 课件(共27张ppt) 2024-2025学年高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 973.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-28 23:27:45 | ||
图片预览







文档简介
(共27张PPT)
第一章 化学反应的热效应
第二节 反应热的计算
第二课时 反应热的计算
新课导入
为什么我们需要进行反应热的计算?
长征五号“身高59.5米起飞重量为643吨,起飞推力为833.8吨。近地轨道25吨,地球同步转移轨道14吨。
它的一级火箭燃料采用的是液氧煤油,为了提供
这么大的能量,我们需要加注多少吨燃料呢?
新课导入
在化学科研中,经常要通过实验测定物质在发生化学反应时所放出或吸收的热量。但是某些物质的反应热,由于种种原因不能直接测得,只能通过化学计算的方式间接获得。在生产中,对燃料的燃烧、反应条件的控制以及废热的利用,也需要反应热计算 。
烧开5 kg常温的水,需要多少升煤气呢?
燃煤工业锅炉正常工作一天可提供多少热能?
反应热的计算
1.根据盖斯定律计算反应热
将两个或两个以上的热化学方程式包括其△H相加或相减,得到一个新的热化学方程式及其△H。
(1)确定待求反应的热化学方程式(确定目标热化学方程式)。
(2)找出待求热化学方程式中只在已知化学方程式中出现一次的物质(多次的不考虑),并依据该物质调整已知化学方程式的方向(同侧相加,异侧相减)和化学计量数。
(3)每个已知化学方程式只能调整一次。
(4)ΔH与化学方程式一对应调整和运算。
反应热的计算
1.根据盖斯定律计算反应热
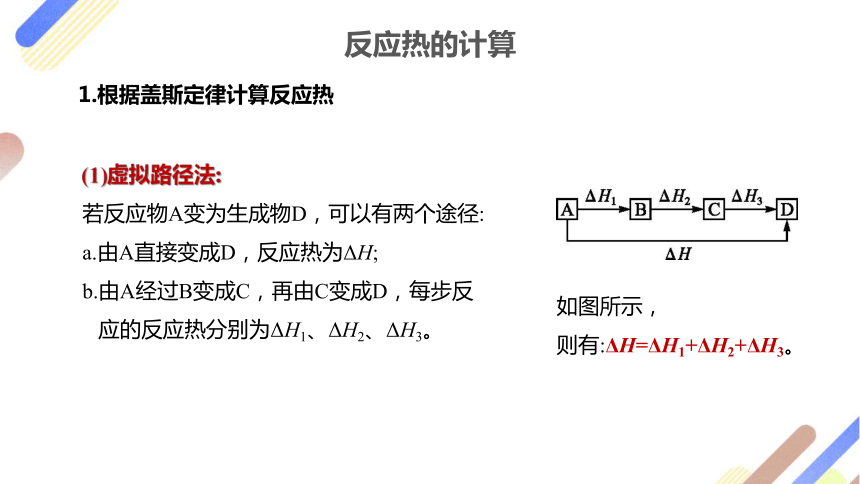
(1)虚拟路径法:
若反应物A变为生成物D,可以有两个途径:
a.由A直接变成D,反应热为ΔH;
b.由A经过B变成C,再由C变成D,每步反
应的反应热分别为ΔH1、ΔH2、ΔH3。
如图所示,
则有:ΔH=ΔH1+ΔH2+ΔH3。
反应热的计算
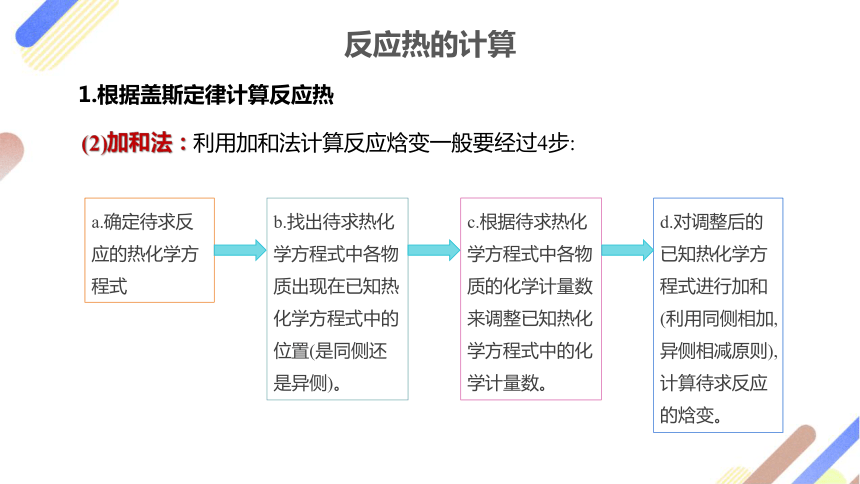
a.确定待求反应的热化学方程式
b.找出待求热化学方程式中各物质出现在已知热化学方程式中的位置(是同侧还是异侧)。
c.根据待求热化学方程式中各物质的化学计量数来调整已知热化学方程式中的化学计量数。
d.对调整后的已知热化学方程式进行加和(利用同侧相加,异侧相减原则),计算待求反应的焓变。
(2)加和法:利用加和法计算反应焓变一般要经过4步:
1.根据盖斯定律计算反应热
反应热的计算
例1:CH4—CO2催化重整反应为CH4(g)+CO2(g)===2CO(g)+2H2(g)。
已知:C(s)+2H2(g)===CH4(g) ΔH1
C(s)+O2(g)===CO2(g) ΔH2
C(s)+ O2(g)===CO(g) ΔH3
该催化重整反应的ΔH= 。
2ΔH3-ΔH1-ΔH2
1.根据盖斯定律计算反应热
反应热的计算
1.根据盖斯定律计算反应热
例2:煤可通过下列两种途径成为燃料:
途径Ⅰ C(s)+O2(g)=CO2(g) ΔH1<0
途径Ⅱ
先制水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH2>0 ①
再燃烧水煤气:
2CO(g)+O2(g)=2CO2(g) ΔH3<0 ②
2H2(g)+O2(g)=2H2O(g) ΔH4<0 ③
(1)判断两种途径放出的热量:途径Ⅰ放出的热量 (填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系是 。
反应热的计算
应用盖斯定律计算反应热时应注意的问题
(1)首先要明确所求反应的始态和终态、各物质的化学计量数及反应的吸、放热情况。
(2)不同途径对应的最终结果应一样。
(3)当热化学方程式乘以或除以某一个数时,ΔH也应乘以或除以同一个数;方程式进行加减运算时,ΔH也同样要进行加减运算,注意各步反应ΔH的正负。
(4)将一个热化学方程式逆向书写时,ΔH的符号也随之改变,但绝对值不变。
(5)在设计反应过程中,可能会遇到同一物质的三态(固、液、气)的相互转化,状态由固→液→气变化时,会吸热;反之会放热。
反应热的计算
2、根据反应物和生成物的键能计算
ΔH=E(反应物的键能总和)-E(生成物的键能总和)
常见物质中的化学键数目
物质 CO2(C=O) CH4 (C-H) P4(P-P) SiO2 (Si-O) 石墨 金刚石 S8 (S-S) Si
键数 2 4 6 4 1.5 2 8 2
反应热的计算
2、根据反应物和生成物的键能计算
例3:根据键能数据计算CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH=___________________。
化学键 C—H C—F H—F F—F
键能/(kJ·mol-1) 414 489 565 155
-1940 kJ·mol-1
解析 ΔH=E(反应物键能总和)-E(生成物键能总和)=(4×414+4×155-4×489-4×565) kJ·mol-1=-1940 kJ·mol-1。
反应热的计算
例4:已知:N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ/mol。若断裂1mol H-H、1mol N-H需要吸收的能量分别为436 kJ、391 kJ,则断裂1molN≡N需要吸收的能量为( )。
A.431 kJ B.945.6 kJ C.649 kJ D.869kJ
-92.4kJ/mol=(EN≡N+ 3×436 - 6×391)kJ/mol
EN≡N=+945.6kJ/mol
B
解析 ΔH=E(反应物键能总和)-E(生成物键能总和)
2、根据反应物和生成物的键能计算
反应热的计算
3、根据热化学方程式计算
热化学方程式中反应热数值与各物质的化学计量数成正比。例如,
aA(g)+bB(g)===cC(g)+dD(g) ΔH
a b c d |ΔH|
n(A) n(B) n(C) n(D) Q
反应热的计算
例5:焦炭与水蒸气反应、甲烷与水蒸气反应均是工业上制取氢气的重要方法。这两个反应的热化学方程式分别为:
①C(s) + H2O(g)==CO(g) + H2(g) △H1=+131.5 kJ/mol
②CH4(g) + H2O(g)==CO(g) + 3H2(g) △H2=+205.9 kJ/mol
试计算CH4(g)==C(s) + 2H2(g)的△H。
解析 分析各化学方程式的关系可以得出,将反应①的逆反应与反应②相加,得到反应: CH4(g)==C(s) + 2H2(g)
CO(g) + H2(g)=C(s) + H2O(g) △H3=-△H1=-131.5 kJ/mol
+) CH4(g) + H2O(g)==CO(g) + 3H2(g) △H2=+205.9 kJ/mol
CH4(g)==C(s) + 2H2(g) △H=+74.4 kJ/mol
3、根据热化学方程式计算
反应热的计算
4、根据物质的燃烧热数值计算
可燃物完全燃烧放出的热量=n(可燃物) × |ΔH|(燃烧热的绝对值)
例6:黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2的途径之一,反应的化学方程式为: 4FeS2+ 11O2 2Fe2O3 + 8SO2
在25 ℃和101 kPa时,1 mol FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)时放出853 kJ的热量。这些热量(工业中叫做“废热”)在生产过程中得到了充分利用,大大降低了生产成本,对于节约资源、能源循环利用具有重要意义。
(1)请写出FeS2燃烧的热化学方程式。
(2)计算理论上1 kg黄铁矿( FeS2的含量为90%)完全燃烧放出的热量。
反应热的计算
4、根据物质的燃烧热数值计算
解析 (1)根据题意,FeS2燃烧的热化学方程式为:
FeS2(s)+ O2(g)=== Fe2O3(s)+2SO2(g) △H= -853 kJ/mol
(2) FeS2的摩尔质量为120 g/mol。
1 kg黄铁矿含FeS2的质量为: 1000 g 90% = 900 g
900 g FeS2的物质的量为:900g 120 g/mol = 7.5 mol
理论上1kg黄铁矿完全燃烧放出的热量为:
7.5 mol 853 kJ/mol = 6398 kJ
答:(1) 根据题意,FeS2燃烧的热化学方程式为:
FeS2(s)+ O2(g)=== Fe2O3(s)+2SO2(g) △H= -853 kJ/mol
(2)理论上1kg黄铁矿完全燃烧放出的热量为 6398 kJ。
反应热的计算
5.根据图像计算
ΔH=E(生成物的总能量)-E(反应物的总能量)
反应热的计算
例7:已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,
放出a kJ能量
B
5.根据图像计算
反应热的大小比较
1.与“符号”相关的反应热比较
对于放热反应来说,ΔH=-Q kJ·mol-1,虽然“-”仅表示放热的意思,但在比较大小时要将其看成真正意义上的“负号”,即:放热越多,ΔH反而越小;放热越少,ΔH反而越大
2.与“化学计量数”相关的反应热比较
如:
H2(g)+1/2O2(g)=H2O(l) ΔH1=-a kJ·mol-1,2H2(g)+O2(g)=2H2O(l) ΔH2=-b kJ·mol-1
aΔH2。放热反应,数值越大,ΔH越小
反应热的大小比较
3、与“物质聚集状态”相关的反应热比较
(1)同一反应,生成物状态不同时
A(g)+B(g)=C(g) ΔH1<0,A(g)+B(g)=C(l) ΔH2<0,
A(g)+B(g)=C(s) ΔH3<0,因为C(g)=C(l) ΔH4<0
C(l)=C(s) ΔH5<0
则ΔH4=ΔH2-ΔH1<0,
所以ΔH2<ΔH1
则ΔH5=ΔH3-ΔH2<0
所以ΔH3<ΔH2
ΔH3<ΔH2<ΔH1
C(s)
同一反应,当反应物状态相同,生成物状态不同
①若是放热反应,则物质越稳定,反应热越小(数字越大)
②若是吸热反应,则物质越不稳定,反应热越大(数字越大)
反应热的计算
(2)同一反应,反应物状态不同时
S(g)+O2(g)=SO2(g) ΔH1<0S(s)+O2(g)=SO2(g) ΔH2<0
ΔH2+ΔH3=ΔH1
则ΔH3=ΔH1-ΔH2
又ΔH3<0,所以ΔH1<ΔH2
同一反应,当生成物状态相同,反应物状态不同
①若是放热反应,则物质越不稳定,反应热越小(数字越大)
②若是吸热反应,则物质越稳定,反应热越大(数字越大)
3、与“物质聚集状态”相关的反应热比较
反应热的计算
C(石墨,s)+O2(g)=CO2(g) ΔH1C(金刚石,s)+O2(g)=CO2(g) ΔH2因为C(石墨,s)=C(金刚石,s) ΔH>0ΔH=ΔH1-ΔH2所以ΔH=ΔH1-ΔH2
ΔH1>ΔH2
4、与“同素异形体”相关的反应热比较
随堂训练
1.通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) ΔH1=+571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH3=+206.1kJ·mol–1
A.反应①中太阳能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)=C(s)+2H2(g)的ΔH3= -74.8kJ·mol–1
D
随堂训练
2.下列各组热化学方程式中,△H1<△H2的是( )
①C(s)+O2(g)===CO2(g) △H1 C(s)+O2(g)===CO(g) △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
④CaCO3(s)==CaO(s)+CO2(g) △H1
CaO(s)+H2O(l)===Ca(OH)2(s) △H2
A.只有① B.只有④ C.只有②③④ D.只有①②③
A
随堂训练
3.已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
B
随堂训练
4.白磷与氧气可发生如下反应:P4(白磷,s)+5O2(g)=P4O10(s)。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
A
THANKS
第一章 化学反应的热效应
第二节 反应热的计算
第二课时 反应热的计算
新课导入
为什么我们需要进行反应热的计算?
长征五号“身高59.5米起飞重量为643吨,起飞推力为833.8吨。近地轨道25吨,地球同步转移轨道14吨。
它的一级火箭燃料采用的是液氧煤油,为了提供
这么大的能量,我们需要加注多少吨燃料呢?
新课导入
在化学科研中,经常要通过实验测定物质在发生化学反应时所放出或吸收的热量。但是某些物质的反应热,由于种种原因不能直接测得,只能通过化学计算的方式间接获得。在生产中,对燃料的燃烧、反应条件的控制以及废热的利用,也需要反应热计算 。
烧开5 kg常温的水,需要多少升煤气呢?
燃煤工业锅炉正常工作一天可提供多少热能?
反应热的计算
1.根据盖斯定律计算反应热
将两个或两个以上的热化学方程式包括其△H相加或相减,得到一个新的热化学方程式及其△H。
(1)确定待求反应的热化学方程式(确定目标热化学方程式)。
(2)找出待求热化学方程式中只在已知化学方程式中出现一次的物质(多次的不考虑),并依据该物质调整已知化学方程式的方向(同侧相加,异侧相减)和化学计量数。
(3)每个已知化学方程式只能调整一次。
(4)ΔH与化学方程式一对应调整和运算。
反应热的计算
1.根据盖斯定律计算反应热
(1)虚拟路径法:
若反应物A变为生成物D,可以有两个途径:
a.由A直接变成D,反应热为ΔH;
b.由A经过B变成C,再由C变成D,每步反
应的反应热分别为ΔH1、ΔH2、ΔH3。
如图所示,
则有:ΔH=ΔH1+ΔH2+ΔH3。
反应热的计算
a.确定待求反应的热化学方程式
b.找出待求热化学方程式中各物质出现在已知热化学方程式中的位置(是同侧还是异侧)。
c.根据待求热化学方程式中各物质的化学计量数来调整已知热化学方程式中的化学计量数。
d.对调整后的已知热化学方程式进行加和(利用同侧相加,异侧相减原则),计算待求反应的焓变。
(2)加和法:利用加和法计算反应焓变一般要经过4步:
1.根据盖斯定律计算反应热
反应热的计算
例1:CH4—CO2催化重整反应为CH4(g)+CO2(g)===2CO(g)+2H2(g)。
已知:C(s)+2H2(g)===CH4(g) ΔH1
C(s)+O2(g)===CO2(g) ΔH2
C(s)+ O2(g)===CO(g) ΔH3
该催化重整反应的ΔH= 。
2ΔH3-ΔH1-ΔH2
1.根据盖斯定律计算反应热
反应热的计算
1.根据盖斯定律计算反应热
例2:煤可通过下列两种途径成为燃料:
途径Ⅰ C(s)+O2(g)=CO2(g) ΔH1<0
途径Ⅱ
先制水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH2>0 ①
再燃烧水煤气:
2CO(g)+O2(g)=2CO2(g) ΔH3<0 ②
2H2(g)+O2(g)=2H2O(g) ΔH4<0 ③
(1)判断两种途径放出的热量:途径Ⅰ放出的热量 (填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系是 。
反应热的计算
应用盖斯定律计算反应热时应注意的问题
(1)首先要明确所求反应的始态和终态、各物质的化学计量数及反应的吸、放热情况。
(2)不同途径对应的最终结果应一样。
(3)当热化学方程式乘以或除以某一个数时,ΔH也应乘以或除以同一个数;方程式进行加减运算时,ΔH也同样要进行加减运算,注意各步反应ΔH的正负。
(4)将一个热化学方程式逆向书写时,ΔH的符号也随之改变,但绝对值不变。
(5)在设计反应过程中,可能会遇到同一物质的三态(固、液、气)的相互转化,状态由固→液→气变化时,会吸热;反之会放热。
反应热的计算
2、根据反应物和生成物的键能计算
ΔH=E(反应物的键能总和)-E(生成物的键能总和)
常见物质中的化学键数目
物质 CO2(C=O) CH4 (C-H) P4(P-P) SiO2 (Si-O) 石墨 金刚石 S8 (S-S) Si
键数 2 4 6 4 1.5 2 8 2
反应热的计算
2、根据反应物和生成物的键能计算
例3:根据键能数据计算CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH=___________________。
化学键 C—H C—F H—F F—F
键能/(kJ·mol-1) 414 489 565 155
-1940 kJ·mol-1
解析 ΔH=E(反应物键能总和)-E(生成物键能总和)=(4×414+4×155-4×489-4×565) kJ·mol-1=-1940 kJ·mol-1。
反应热的计算
例4:已知:N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ/mol。若断裂1mol H-H、1mol N-H需要吸收的能量分别为436 kJ、391 kJ,则断裂1molN≡N需要吸收的能量为( )。
A.431 kJ B.945.6 kJ C.649 kJ D.869kJ
-92.4kJ/mol=(EN≡N+ 3×436 - 6×391)kJ/mol
EN≡N=+945.6kJ/mol
B
解析 ΔH=E(反应物键能总和)-E(生成物键能总和)
2、根据反应物和生成物的键能计算
反应热的计算
3、根据热化学方程式计算
热化学方程式中反应热数值与各物质的化学计量数成正比。例如,
aA(g)+bB(g)===cC(g)+dD(g) ΔH
a b c d |ΔH|
n(A) n(B) n(C) n(D) Q
反应热的计算
例5:焦炭与水蒸气反应、甲烷与水蒸气反应均是工业上制取氢气的重要方法。这两个反应的热化学方程式分别为:
①C(s) + H2O(g)==CO(g) + H2(g) △H1=+131.5 kJ/mol
②CH4(g) + H2O(g)==CO(g) + 3H2(g) △H2=+205.9 kJ/mol
试计算CH4(g)==C(s) + 2H2(g)的△H。
解析 分析各化学方程式的关系可以得出,将反应①的逆反应与反应②相加,得到反应: CH4(g)==C(s) + 2H2(g)
CO(g) + H2(g)=C(s) + H2O(g) △H3=-△H1=-131.5 kJ/mol
+) CH4(g) + H2O(g)==CO(g) + 3H2(g) △H2=+205.9 kJ/mol
CH4(g)==C(s) + 2H2(g) △H=+74.4 kJ/mol
3、根据热化学方程式计算
反应热的计算
4、根据物质的燃烧热数值计算
可燃物完全燃烧放出的热量=n(可燃物) × |ΔH|(燃烧热的绝对值)
例6:黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2的途径之一,反应的化学方程式为: 4FeS2+ 11O2 2Fe2O3 + 8SO2
在25 ℃和101 kPa时,1 mol FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)时放出853 kJ的热量。这些热量(工业中叫做“废热”)在生产过程中得到了充分利用,大大降低了生产成本,对于节约资源、能源循环利用具有重要意义。
(1)请写出FeS2燃烧的热化学方程式。
(2)计算理论上1 kg黄铁矿( FeS2的含量为90%)完全燃烧放出的热量。
反应热的计算
4、根据物质的燃烧热数值计算
解析 (1)根据题意,FeS2燃烧的热化学方程式为:
FeS2(s)+ O2(g)=== Fe2O3(s)+2SO2(g) △H= -853 kJ/mol
(2) FeS2的摩尔质量为120 g/mol。
1 kg黄铁矿含FeS2的质量为: 1000 g 90% = 900 g
900 g FeS2的物质的量为:900g 120 g/mol = 7.5 mol
理论上1kg黄铁矿完全燃烧放出的热量为:
7.5 mol 853 kJ/mol = 6398 kJ
答:(1) 根据题意,FeS2燃烧的热化学方程式为:
FeS2(s)+ O2(g)=== Fe2O3(s)+2SO2(g) △H= -853 kJ/mol
(2)理论上1kg黄铁矿完全燃烧放出的热量为 6398 kJ。
反应热的计算
5.根据图像计算
ΔH=E(生成物的总能量)-E(反应物的总能量)
反应热的计算
例7:已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,
放出a kJ能量
B
5.根据图像计算
反应热的大小比较
1.与“符号”相关的反应热比较
对于放热反应来说,ΔH=-Q kJ·mol-1,虽然“-”仅表示放热的意思,但在比较大小时要将其看成真正意义上的“负号”,即:放热越多,ΔH反而越小;放热越少,ΔH反而越大
2.与“化学计量数”相关的反应热比较
如:
H2(g)+1/2O2(g)=H2O(l) ΔH1=-a kJ·mol-1,2H2(g)+O2(g)=2H2O(l) ΔH2=-b kJ·mol-1
a
反应热的大小比较
3、与“物质聚集状态”相关的反应热比较
(1)同一反应,生成物状态不同时
A(g)+B(g)=C(g) ΔH1<0,A(g)+B(g)=C(l) ΔH2<0,
A(g)+B(g)=C(s) ΔH3<0,因为C(g)=C(l) ΔH4<0
C(l)=C(s) ΔH5<0
则ΔH4=ΔH2-ΔH1<0,
所以ΔH2<ΔH1
则ΔH5=ΔH3-ΔH2<0
所以ΔH3<ΔH2
ΔH3<ΔH2<ΔH1
C(s)
同一反应,当反应物状态相同,生成物状态不同
①若是放热反应,则物质越稳定,反应热越小(数字越大)
②若是吸热反应,则物质越不稳定,反应热越大(数字越大)
反应热的计算
(2)同一反应,反应物状态不同时
S(g)+O2(g)=SO2(g) ΔH1<0S(s)+O2(g)=SO2(g) ΔH2<0
ΔH2+ΔH3=ΔH1
则ΔH3=ΔH1-ΔH2
又ΔH3<0,所以ΔH1<ΔH2
同一反应,当生成物状态相同,反应物状态不同
①若是放热反应,则物质越不稳定,反应热越小(数字越大)
②若是吸热反应,则物质越稳定,反应热越大(数字越大)
3、与“物质聚集状态”相关的反应热比较
反应热的计算
C(石墨,s)+O2(g)=CO2(g) ΔH1C(金刚石,s)+O2(g)=CO2(g) ΔH2因为C(石墨,s)=C(金刚石,s) ΔH>0ΔH=ΔH1-ΔH2所以ΔH=ΔH1-ΔH2
ΔH1>ΔH2
4、与“同素异形体”相关的反应热比较
随堂训练
1.通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) ΔH1=+571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH3=+206.1kJ·mol–1
A.反应①中太阳能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)=C(s)+2H2(g)的ΔH3= -74.8kJ·mol–1
D
随堂训练
2.下列各组热化学方程式中,△H1<△H2的是( )
①C(s)+O2(g)===CO2(g) △H1 C(s)+O2(g)===CO(g) △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
④CaCO3(s)==CaO(s)+CO2(g) △H1
CaO(s)+H2O(l)===Ca(OH)2(s) △H2
A.只有① B.只有④ C.只有②③④ D.只有①②③
A
随堂训练
3.已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
B
随堂训练
4.白磷与氧气可发生如下反应:P4(白磷,s)+5O2(g)=P4O10(s)。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
A
THANKS
