湖北省武汉市部分重点中学联考2023-2024学年高一下学期6月期末考试化学试题(含答案)
文档属性
| 名称 | 湖北省武汉市部分重点中学联考2023-2024学年高一下学期6月期末考试化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-29 14:42:01 | ||
图片预览



文档简介
武汉市部分重点中学2023—2024学年度下学期期末联考
高一化学试卷
命审题单位: 审题单位:
本试卷共8页,19题.满分100分.考试用时75分钟.
考试时间:2024年6月26日上午11:00—12:15
★祝考试顺利★
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将准考证号条形码贴在答题卡上的指定位置.
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑.写在试卷草稿纸和答题卡上的非答题区域均无效.
3.非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内.写在试卷、草稿纸和答题卡上的非答题区域均无效.
4.考试结束后,请将本试卷和答题卡一并上交.
可能用到的相对原子质量:
一、选择题:本题共15小题,每小题3分,共45分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.2024年5月3日,“嫦娥六号”探测器在海南文昌航天发射场由长征五号遥八运载火箭发射升空,并于6月2日成功落月.下列不能作为火箭推进剂的是( )
A.液氮—液氢 B.液氧—液氢 C.液态—肼 D.液氧—煤油
2.建设美丽乡村,守护中华家园,衣食住行皆化学.下列所述化学知识正确且与相关项目有关联的是( )
选项 项目 化学知识
A 千家万户通光纤 光纤的主要材质为
B 乡村农户用沼气 沼气的主要成分是丙烷和丁烷
C 乡村公路铺沥青 沥青可通过石油减压蒸馏获得
D 均衡膳食助健康 淀粉和纤维素互为同分异构体
A.A B.B C.C D.D
3.化学中广泛存在着哲学中“量变引起质变”的规律.下列变化过程不符合这一规律的是( )
A.气体与加热反应 B.与氢氧化钠溶液反应
C.溶液与反应 D.铁粉和硝酸反应
4.设为阿伏加德罗常数的值.下列说法错误的是( )
A.乙烯和丙烯的混合气体中碳氢键总数为
B.标准状况下,与反应后分子总数为
C.的乙醇溶液与足量金属钠充分反应,产生的分子数为
D.铅酸蓄电池的正极质量增加时,电路中通过的电子数目为
5.下列说法正确的有几项( )
①“木与木相摩则然(燃)”的“然”是化学能主要转化为热能
②“浮梁巧烧瓷,颜色比琼玖”的“瓷”是硅酸盐产品
③水玻璃可作黏合剂和木材的防火剂;
④燃料电池的能量转化率比较高,可达100%
⑤可用酸性高锰酸钾溶液鉴别甲烷和乙烯
⑥向煤中加入适量生石灰,可减少对大气的污染
⑦汽车尾气中的氮氧化物是因为汽油或柴油不完全燃烧造成的
⑧二氧化硫可用作葡萄酒的食品添加剂
⑨酸雨是小于7的雨水
⑩农谚“雷雨肥庄稼”中固氮过程属于人工固氮
A.3个 B.4个 C.5个 D.6个
6.类比推理是研究物质性质的常用方法,下列推理正确的是( )
A.与S能直接化合生成,推测与S也可直接化合生成
B.能与溴水反应使之褪色,推测也能与氯水反应使之褪色
C.浓硫酸与反应可制备,推测浓硫酸与反应也可制备
D.与溶液可反应产生沉淀,推测与溶液也可反应产生沉淀
7.下图为氮、硫及其部分化合物的价类二维图.
下列说法正确的是( )
A.c、d、i、j均为酸性氧化物 B.e的浓溶液不能干燥a、c、g
C.g与e反应的产物可以属于f或l D.将k转化为j必须加入合适的还原剂才能实现
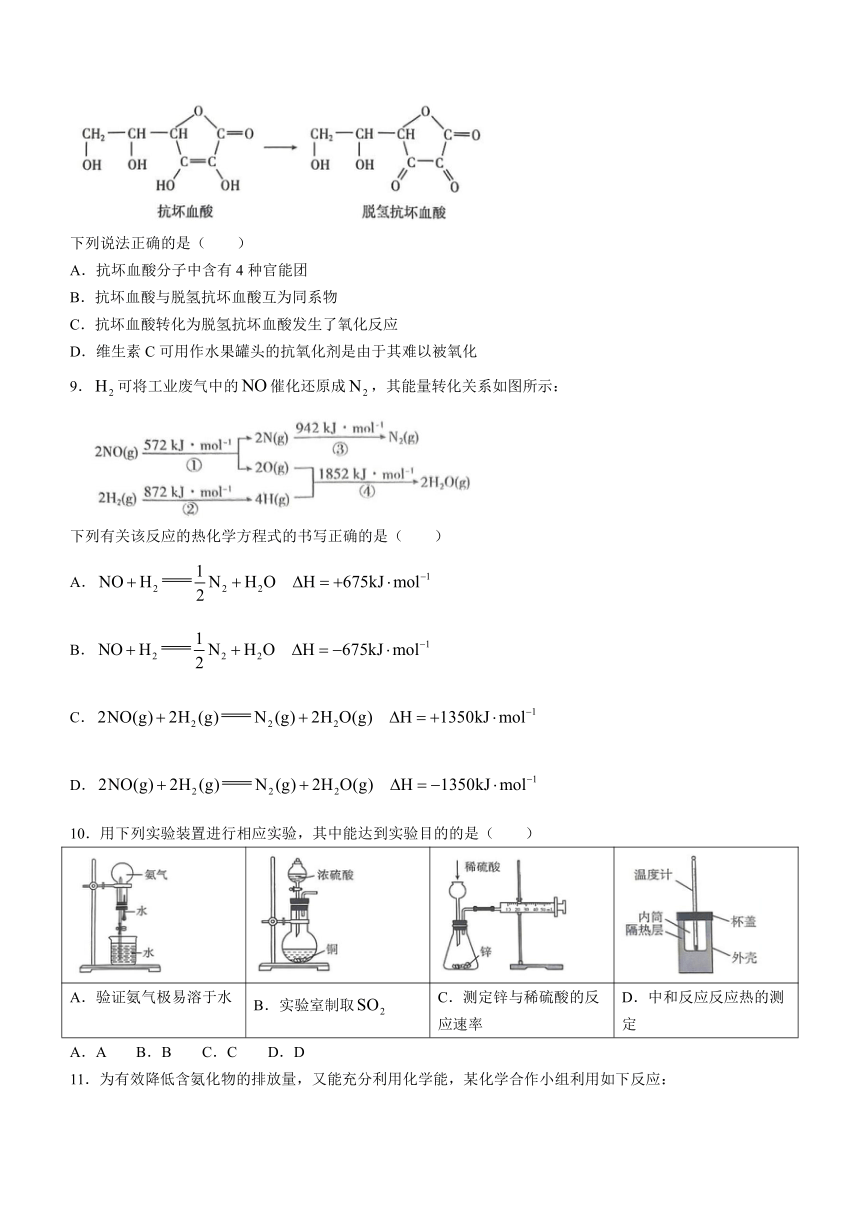
8.抗坏血酸(即维生素C)在一定条件下可转化为脱氢抗坏血酸,过程如下图所示:
下列说法正确的是( )
A.抗坏血酸分子中含有4种官能团
B.抗坏血酸与脱氢抗坏血酸互为同系物
C.抗坏血酸转化为脱氢抗坏血酸发生了氧化反应
D.维生素C可用作水果罐头的抗氧化剂是由于其难以被氧化
9.可将工业废气中的催化还原成,其能量转化关系如图所示:
下列有关该反应的热化学方程式的书写正确的是( )
A.
B.
C.
D.
10.用下列实验装置进行相应实验,其中能达到实验目的的是( )
A.验证氨气极易溶于水 B.实验室制取 C.测定锌与稀硫酸的反应速率 D.中和反应反应热的测定
A.A B.B C.C D.D
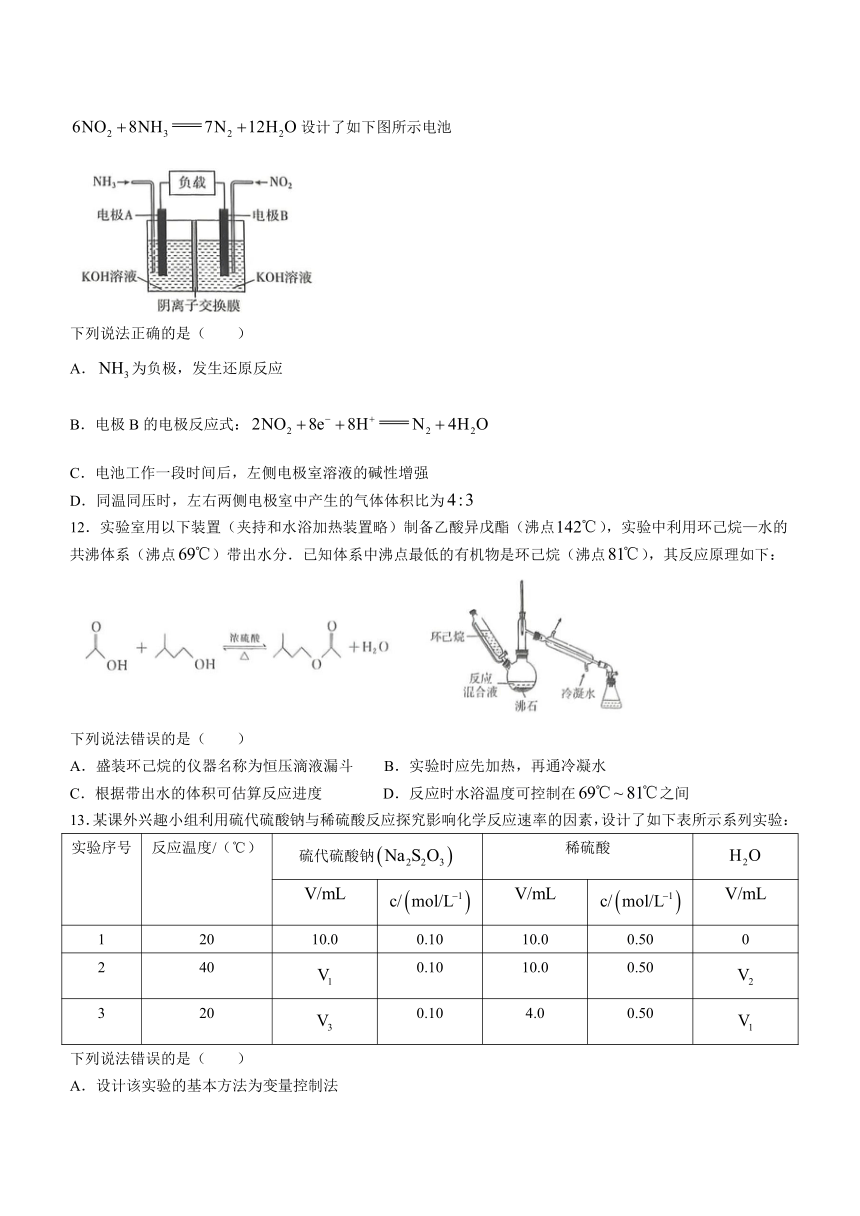
11.为有效降低含氨化物的排放量,又能充分利用化学能,某化学合作小组利用如下反应:设计了如下图所示电池
下列说法正确的是( )
A.为负极,发生还原反应
B.电极B的电极反应式:
C.电池工作一段时间后,左侧电极室溶液的碱性增强
D.同温同压时,左右两侧电极室中产生的气体体积比为
12.实验室用以下装置(夹持和水浴加热装置略)制备乙酸异戊酯(沸点),实验中利用环己烷—水的共沸体系(沸点)带出水分.已知体系中沸点最低的有机物是环己烷(沸点),其反应原理如下:
下列说法错误的是( )
A.盛装环己烷的仪器名称为恒压滴液漏斗 B.实验时应先加热,再通冷凝水
C.根据带出水的体积可估算反应进度 D.反应时水浴温度可控制在之间
13.某课外兴趣小组利用硫代硫酸钠与稀硫酸反应探究影响化学反应速率的因素,设计了如下表所示系列实验:
实验序号 反应温度/(℃) 硫代硫酸钠 稀硫酸
1 20 10.0 0.10 10.0 0.50 0
2 40 0.10 10.0 0.50
3 20 0.10 4.0 0.50
下列说法错误的是( )
A.设计该实验的基本方法为变量控制法
B.该实验的反应方程式为
C.若用实验1和3探究稀硫酸浓度对该反应速率的影响,则
D.可用热的浓溶液或洗掉反应后仪器中的黄色固体,且原理相同
14.乙烯在酸催化下水合制乙醇的反应机理及能量与反应进程的关系如下图所示:
下列说法正确的是( )
A.加入酸作催化剂可降低反应的焓变
B.反应涉及极性键和非极性键的断裂
C.第②步反应速率最快,为该反应的决速步骤
D.第①步反应的中间体比第②步反应的中间体能量更高,更稳定
15.将镁铜合金投入一定浓度的硝酸中,合金完全溶解,产生和混合气体(不考虑其他气体,体积均已折算为标准状况下),反应结束后向溶液中加入溶液,恰好使溶液中的金属阳离子全部转化为沉淀.若将盛有该混合气体的容器倒扣在水中,通入一定体积的氧气,恰好可将该混合气体完全转化为硝酸.下列说法错误的是( )
A.和的物质的量之比为 B.和的体积之比为
C.原硝酸的物质的量浓度为 D.通入的的体积(标准状况下)
二、非选择题:本题共4题,共55分.
16.(14分)
海水中蕴藏着大量资源,从海水中不仅可获得淡水,还可按如图工艺流程提取溴和镁.
回答下列问题:
(1)海水淡化的方法有____________、反渗透法和电渗析法等.
(2)提取溴的过程中,经过两次的转化,其目的是____________.
(3)“吸收塔”中发生反应的离子方程式为____________,工业上也可用溶液吸收吹出的,生成和,对应的化学方程式为____________.
(4)要使海水中的完全转化为沉淀,加入的量应____________.
(5)加入后,能够分离得到沉淀的方法是____________,若要在实验室中完成此操作需用到的主要玻璃仪器有____________.
(6)该流程中制备金属镁的化学方程式为____________.
17.(14分)
乳酸在生命化学中起着重要作用,也是重要的化工原料,因此成为近年来的研究热点.下图是获得乳酸的两种方法,其中A的产量可用来衡量一个国家石油化学工业的发展水平.
回答下列问题:
(1)A的电子式为____________.
(2)的反应类型为____________
(3)反应的化学方程式为____________.
(4)某实验小组用下列装置模拟上述的转化过程:
实验过程中铜网出现黑色和红色交替的现象.
①红色变成黑色的反应是;
②黑色变为红色的化学方程式为____________;甲和乙两个水浴的作用不相同,其中甲装置水浴的作用是____________.
(5)为检验淀粉水解产物,小明同学向淀粉溶液中加入稀硫酸并加热一段时间,冷却后,向溶液中直接加入银氨溶液,并进行水浴加热,无银镜出现.你认为小明同学实验失败的主要原因是____________.
(6)乳酸与足量金属钠反应的化学方程式为____________;两分子乳酸在一定条件下通过酯化反应可生成一分子六元环酯和两分子水,该环酯的结构简式为____________.
18.(14分)
甲烷是一种清洁、高效的能源,也是重要的化工原料.回答下列问题:
(1)已知:下,甲烷完全燃烧生成气体和液态水时放热.表示甲烷燃烧热的热化学方程式为____________.在相同条件下,可燃冰(分子式为)释放的甲烷气体完全燃烧生成气体和液态水,放出的热量为____________.
(2)和在高温下反应可生成甲烷.在体积为的恒容密闭容器中,充入和,一定温度下发生反应:.测得和的转化率随时间变化如图所示.
①从反应开始到,用的浓度变化表示该反应的反应速率为____________;时,的转化率为____________.
②下列情况能说明上述反应达到化学平衡状态的是____________(填标号).
a.容器中混合气体的密度保持不变
b.容器中混合气体的总压强保持不变
c.容器中的体积分数保持不变
d.单位时间内每消耗同时生成
(3)某科研团队设计了如图所示的甲烷燃料电池.电解质是参杂了与的固体,可在高温下传导.
①该电池工作时负极的电极反应式为____________.
②若(标准状况)参与反应,则转移电子数目为____________.
19.(13分)
某兴趣小组设计实验验证铜与浓硝酸、稀硝酸的反应,装置如图所示(夹持装置未画出):
实验1:验证铜与浓硝酸的反应
按图示连接好装置,并关闭,____________后,装入药品.打开,一段时间后,再关闭;再打开,加入足量的浓后关闭.
实验2:验证铜与稀硝酸的反应
待装置B中反应完全后,打开,向C中加入蒸馏水,之后插入铜丝;反应一段时间后,打开C中的止水夹.
回答下列问题:
(1)实验1中的横线上应填入的内容是____________;“发生装置”的名称是____________.
(2)实验1中“关闭,打开”的目的是____________.
(3)装置B中发生反应的离子方程式为____________.
(4)实验2中向C中加入蒸馏水时发生的主要反应的化学方程式为____________.打开止水夹后装置C的具支试管中的现象为____________.
(5)实验结束后,有同学观察到装置B中溶液呈绿色,装置C中溶液呈蓝色.该兴趣小组同学认为颜色不同的原因可能如下:
猜想1:硝酸铜溶液的物质的量浓度不同,溶液颜色不同.浓度大时呈绿色,浓度小时呈蓝色.
猜想2:溶解在硝酸铜溶液中,导致溶液呈绿色.
继续实验,打开,一段时间后,装置B中溶液变为蓝色,说明猜想____________(填“1”或“2”)可能成立,请设计实验验证另一种猜想的可能性:____________.
高一化学试卷参考答案与评分细则
一、选择题:本题共15小题,每小题3分,共45分.在每小题给出的四个选项中,只有一项符合题目要求.
题号 1 2 3 4 5 6 7 8
答案 A C B C D B C C
题号 9 10 11 12 13 14 15
答案 D A D B D B A
二、非选择题:本题共4题,共55分.
16.(14分)
(1)蒸馏法(1分) (2)对溴元素进行富集(或富集溴元素)(2分)
(3)(2分)
(2分)
(4)过量(1分)
(5)过滤(2分) 烧杯、漏斗、玻璃棒(2分)
(6)(熔融)(2分)
17.(14分)
(1)(1分) (2)加成反应(1分)
(3)(2分)
(4)(2分) 加热,使乙醇挥发(2分)
(5)未用碱中和作催化剂的稀硫酸(2分)
(6)(2分)
(2分)
18.(14分)
(1)(2分) 1779.2(2分)
(2)①0.05(2分) 36%(2分) ②bc(2分)
(3)①(2分) ②(2分)
19.(13分)
(1)检查装置的气密性(1分) 启普发生器(1分)
(2)利用产生的排尽装置内的空气,防止与稀硝酸反应生成的被氧化(2分)
(3)(2分)
(4)(2分) 液面上方出现红棕色气体,后颜色又逐渐变浅(2分)
(5)2(1分)
取装置C中的溶液适量于试管中,加入适量固体,若溶液变为绿色,说明猜想1成立(2分)
高一化学试卷
命审题单位: 审题单位:
本试卷共8页,19题.满分100分.考试用时75分钟.
考试时间:2024年6月26日上午11:00—12:15
★祝考试顺利★
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将准考证号条形码贴在答题卡上的指定位置.
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑.写在试卷草稿纸和答题卡上的非答题区域均无效.
3.非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内.写在试卷、草稿纸和答题卡上的非答题区域均无效.
4.考试结束后,请将本试卷和答题卡一并上交.
可能用到的相对原子质量:
一、选择题:本题共15小题,每小题3分,共45分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.2024年5月3日,“嫦娥六号”探测器在海南文昌航天发射场由长征五号遥八运载火箭发射升空,并于6月2日成功落月.下列不能作为火箭推进剂的是( )
A.液氮—液氢 B.液氧—液氢 C.液态—肼 D.液氧—煤油
2.建设美丽乡村,守护中华家园,衣食住行皆化学.下列所述化学知识正确且与相关项目有关联的是( )
选项 项目 化学知识
A 千家万户通光纤 光纤的主要材质为
B 乡村农户用沼气 沼气的主要成分是丙烷和丁烷
C 乡村公路铺沥青 沥青可通过石油减压蒸馏获得
D 均衡膳食助健康 淀粉和纤维素互为同分异构体
A.A B.B C.C D.D
3.化学中广泛存在着哲学中“量变引起质变”的规律.下列变化过程不符合这一规律的是( )
A.气体与加热反应 B.与氢氧化钠溶液反应
C.溶液与反应 D.铁粉和硝酸反应
4.设为阿伏加德罗常数的值.下列说法错误的是( )
A.乙烯和丙烯的混合气体中碳氢键总数为
B.标准状况下,与反应后分子总数为
C.的乙醇溶液与足量金属钠充分反应,产生的分子数为
D.铅酸蓄电池的正极质量增加时,电路中通过的电子数目为
5.下列说法正确的有几项( )
①“木与木相摩则然(燃)”的“然”是化学能主要转化为热能
②“浮梁巧烧瓷,颜色比琼玖”的“瓷”是硅酸盐产品
③水玻璃可作黏合剂和木材的防火剂;
④燃料电池的能量转化率比较高,可达100%
⑤可用酸性高锰酸钾溶液鉴别甲烷和乙烯
⑥向煤中加入适量生石灰,可减少对大气的污染
⑦汽车尾气中的氮氧化物是因为汽油或柴油不完全燃烧造成的
⑧二氧化硫可用作葡萄酒的食品添加剂
⑨酸雨是小于7的雨水
⑩农谚“雷雨肥庄稼”中固氮过程属于人工固氮
A.3个 B.4个 C.5个 D.6个
6.类比推理是研究物质性质的常用方法,下列推理正确的是( )
A.与S能直接化合生成,推测与S也可直接化合生成
B.能与溴水反应使之褪色,推测也能与氯水反应使之褪色
C.浓硫酸与反应可制备,推测浓硫酸与反应也可制备
D.与溶液可反应产生沉淀,推测与溶液也可反应产生沉淀
7.下图为氮、硫及其部分化合物的价类二维图.
下列说法正确的是( )
A.c、d、i、j均为酸性氧化物 B.e的浓溶液不能干燥a、c、g
C.g与e反应的产物可以属于f或l D.将k转化为j必须加入合适的还原剂才能实现
8.抗坏血酸(即维生素C)在一定条件下可转化为脱氢抗坏血酸,过程如下图所示:
下列说法正确的是( )
A.抗坏血酸分子中含有4种官能团
B.抗坏血酸与脱氢抗坏血酸互为同系物
C.抗坏血酸转化为脱氢抗坏血酸发生了氧化反应
D.维生素C可用作水果罐头的抗氧化剂是由于其难以被氧化
9.可将工业废气中的催化还原成,其能量转化关系如图所示:
下列有关该反应的热化学方程式的书写正确的是( )
A.
B.
C.
D.
10.用下列实验装置进行相应实验,其中能达到实验目的的是( )
A.验证氨气极易溶于水 B.实验室制取 C.测定锌与稀硫酸的反应速率 D.中和反应反应热的测定
A.A B.B C.C D.D
11.为有效降低含氨化物的排放量,又能充分利用化学能,某化学合作小组利用如下反应:设计了如下图所示电池
下列说法正确的是( )
A.为负极,发生还原反应
B.电极B的电极反应式:
C.电池工作一段时间后,左侧电极室溶液的碱性增强
D.同温同压时,左右两侧电极室中产生的气体体积比为
12.实验室用以下装置(夹持和水浴加热装置略)制备乙酸异戊酯(沸点),实验中利用环己烷—水的共沸体系(沸点)带出水分.已知体系中沸点最低的有机物是环己烷(沸点),其反应原理如下:
下列说法错误的是( )
A.盛装环己烷的仪器名称为恒压滴液漏斗 B.实验时应先加热,再通冷凝水
C.根据带出水的体积可估算反应进度 D.反应时水浴温度可控制在之间
13.某课外兴趣小组利用硫代硫酸钠与稀硫酸反应探究影响化学反应速率的因素,设计了如下表所示系列实验:
实验序号 反应温度/(℃) 硫代硫酸钠 稀硫酸
1 20 10.0 0.10 10.0 0.50 0
2 40 0.10 10.0 0.50
3 20 0.10 4.0 0.50
下列说法错误的是( )
A.设计该实验的基本方法为变量控制法
B.该实验的反应方程式为
C.若用实验1和3探究稀硫酸浓度对该反应速率的影响,则
D.可用热的浓溶液或洗掉反应后仪器中的黄色固体,且原理相同
14.乙烯在酸催化下水合制乙醇的反应机理及能量与反应进程的关系如下图所示:
下列说法正确的是( )
A.加入酸作催化剂可降低反应的焓变
B.反应涉及极性键和非极性键的断裂
C.第②步反应速率最快,为该反应的决速步骤
D.第①步反应的中间体比第②步反应的中间体能量更高,更稳定
15.将镁铜合金投入一定浓度的硝酸中,合金完全溶解,产生和混合气体(不考虑其他气体,体积均已折算为标准状况下),反应结束后向溶液中加入溶液,恰好使溶液中的金属阳离子全部转化为沉淀.若将盛有该混合气体的容器倒扣在水中,通入一定体积的氧气,恰好可将该混合气体完全转化为硝酸.下列说法错误的是( )
A.和的物质的量之比为 B.和的体积之比为
C.原硝酸的物质的量浓度为 D.通入的的体积(标准状况下)
二、非选择题:本题共4题,共55分.
16.(14分)
海水中蕴藏着大量资源,从海水中不仅可获得淡水,还可按如图工艺流程提取溴和镁.
回答下列问题:
(1)海水淡化的方法有____________、反渗透法和电渗析法等.
(2)提取溴的过程中,经过两次的转化,其目的是____________.
(3)“吸收塔”中发生反应的离子方程式为____________,工业上也可用溶液吸收吹出的,生成和,对应的化学方程式为____________.
(4)要使海水中的完全转化为沉淀,加入的量应____________.
(5)加入后,能够分离得到沉淀的方法是____________,若要在实验室中完成此操作需用到的主要玻璃仪器有____________.
(6)该流程中制备金属镁的化学方程式为____________.
17.(14分)
乳酸在生命化学中起着重要作用,也是重要的化工原料,因此成为近年来的研究热点.下图是获得乳酸的两种方法,其中A的产量可用来衡量一个国家石油化学工业的发展水平.
回答下列问题:
(1)A的电子式为____________.
(2)的反应类型为____________
(3)反应的化学方程式为____________.
(4)某实验小组用下列装置模拟上述的转化过程:
实验过程中铜网出现黑色和红色交替的现象.
①红色变成黑色的反应是;
②黑色变为红色的化学方程式为____________;甲和乙两个水浴的作用不相同,其中甲装置水浴的作用是____________.
(5)为检验淀粉水解产物,小明同学向淀粉溶液中加入稀硫酸并加热一段时间,冷却后,向溶液中直接加入银氨溶液,并进行水浴加热,无银镜出现.你认为小明同学实验失败的主要原因是____________.
(6)乳酸与足量金属钠反应的化学方程式为____________;两分子乳酸在一定条件下通过酯化反应可生成一分子六元环酯和两分子水,该环酯的结构简式为____________.
18.(14分)
甲烷是一种清洁、高效的能源,也是重要的化工原料.回答下列问题:
(1)已知:下,甲烷完全燃烧生成气体和液态水时放热.表示甲烷燃烧热的热化学方程式为____________.在相同条件下,可燃冰(分子式为)释放的甲烷气体完全燃烧生成气体和液态水,放出的热量为____________.
(2)和在高温下反应可生成甲烷.在体积为的恒容密闭容器中,充入和,一定温度下发生反应:.测得和的转化率随时间变化如图所示.
①从反应开始到,用的浓度变化表示该反应的反应速率为____________;时,的转化率为____________.
②下列情况能说明上述反应达到化学平衡状态的是____________(填标号).
a.容器中混合气体的密度保持不变
b.容器中混合气体的总压强保持不变
c.容器中的体积分数保持不变
d.单位时间内每消耗同时生成
(3)某科研团队设计了如图所示的甲烷燃料电池.电解质是参杂了与的固体,可在高温下传导.
①该电池工作时负极的电极反应式为____________.
②若(标准状况)参与反应,则转移电子数目为____________.
19.(13分)
某兴趣小组设计实验验证铜与浓硝酸、稀硝酸的反应,装置如图所示(夹持装置未画出):
实验1:验证铜与浓硝酸的反应
按图示连接好装置,并关闭,____________后,装入药品.打开,一段时间后,再关闭;再打开,加入足量的浓后关闭.
实验2:验证铜与稀硝酸的反应
待装置B中反应完全后,打开,向C中加入蒸馏水,之后插入铜丝;反应一段时间后,打开C中的止水夹.
回答下列问题:
(1)实验1中的横线上应填入的内容是____________;“发生装置”的名称是____________.
(2)实验1中“关闭,打开”的目的是____________.
(3)装置B中发生反应的离子方程式为____________.
(4)实验2中向C中加入蒸馏水时发生的主要反应的化学方程式为____________.打开止水夹后装置C的具支试管中的现象为____________.
(5)实验结束后,有同学观察到装置B中溶液呈绿色,装置C中溶液呈蓝色.该兴趣小组同学认为颜色不同的原因可能如下:
猜想1:硝酸铜溶液的物质的量浓度不同,溶液颜色不同.浓度大时呈绿色,浓度小时呈蓝色.
猜想2:溶解在硝酸铜溶液中,导致溶液呈绿色.
继续实验,打开,一段时间后,装置B中溶液变为蓝色,说明猜想____________(填“1”或“2”)可能成立,请设计实验验证另一种猜想的可能性:____________.
高一化学试卷参考答案与评分细则
一、选择题:本题共15小题,每小题3分,共45分.在每小题给出的四个选项中,只有一项符合题目要求.
题号 1 2 3 4 5 6 7 8
答案 A C B C D B C C
题号 9 10 11 12 13 14 15
答案 D A D B D B A
二、非选择题:本题共4题,共55分.
16.(14分)
(1)蒸馏法(1分) (2)对溴元素进行富集(或富集溴元素)(2分)
(3)(2分)
(2分)
(4)过量(1分)
(5)过滤(2分) 烧杯、漏斗、玻璃棒(2分)
(6)(熔融)(2分)
17.(14分)
(1)(1分) (2)加成反应(1分)
(3)(2分)
(4)(2分) 加热,使乙醇挥发(2分)
(5)未用碱中和作催化剂的稀硫酸(2分)
(6)(2分)
(2分)
18.(14分)
(1)(2分) 1779.2(2分)
(2)①0.05(2分) 36%(2分) ②bc(2分)
(3)①(2分) ②(2分)
19.(13分)
(1)检查装置的气密性(1分) 启普发生器(1分)
(2)利用产生的排尽装置内的空气,防止与稀硝酸反应生成的被氧化(2分)
(3)(2分)
(4)(2分) 液面上方出现红棕色气体,后颜色又逐渐变浅(2分)
(5)2(1分)
取装置C中的溶液适量于试管中,加入适量固体,若溶液变为绿色,说明猜想1成立(2分)
同课章节目录
