湖北省咸宁市2023-2024学年高一下学期期末联考化学试卷(含答案)
文档属性
| 名称 | 湖北省咸宁市2023-2024学年高一下学期期末联考化学试卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 955.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-30 00:00:00 | ||
图片预览



文档简介
咸宁市2023-2024学年高一下学期期末联考
化学试卷
本试卷共8页,时长75分钟,满分100分。
可能用到的相对原子质量:
一、选择题:本题共15小题,每小题3分,共45分。每小题只有一个选项符合题目要求。
1.“舌尖上的安全”成为网络热搜词之一,科学、安全、有效和合理地使用化学品是每一位生产者和消费者的要求和责任。下列说法正确的是( )。
A.用漂白过的银耳不仅色泽美观,而且营养更丰富
B.豆腐制作过程中加入石膏水既能起到凝固剂,又能起到营养强化剂的作用
C.是一种防腐剂和护色剂,可大量用于肉质食材的防腐
D.抗坏血酸(即维生素C)是水果罐头中常用的抗氧化剂,能被还原为脱氢抗坏血酸
2.正确掌握化学用语和化学基本概念是学好化学的基础。下列各项中表达正确的是( )。
A.的分子结构模型:
B.聚丙烯的结构简式为:
C.离子化合物的电子式为:
D.在水中的电离方程式:
3.设为阿伏加德罗常数的值,下列说法正确的是( )。
A.与足量浓盐酸充分反应,转移电子数目一定小于
B.标准状况下,和在光照下充分反应,生成分子数为
C.中含有C—H键的数目一定为
D.乙炔和乙醛蒸气的混合气体,完全燃烧消耗氧气分子
4.下列离子方程式正确的是( )。
A.向氯水中加入少量小苏打可以增强漂白性:
B.向溶液中加入少量溶液:
C.用漂白液脱除废气中少量:
D.用浓溶解固体:
5.材料是科技进步的阶梯。下列关于化学材料说法错误的是( )。
A.氮化硅、氧化铝、碳化硅等新型陶瓷是无机非金属材料
B.有机玻璃可以制成飞机和车辆的风挡、光学仪器等,属于硅酸盐材料
C.量子通信材料螺旋碳纳米管TEM与石墨烯互为同素异形体
D.生铁可以铸造下水井盖,因为生铁中碳含量较钢更高,硬度更大
6.一定条件下,石墨转化为金刚石要吸收能量。在该条件下,下列结论正确的是( )。
A.金刚石比石墨稳定
B.等质量的金刚石和石墨完全燃烧释放的热量相同
C.金刚石转化为石墨是吸热反应
D.(金刚石)比(石墨)的总能量高
7.电池功率大,可用于海上导航,其结构如图所示。下列说法正确的是( )。
A.电池工作时,从交换膜左移向右 B.电子流动方向:铝电极→导线→碳纤维
C.铝电极的反应式为: D.铝电极表面有大量产生
8.常温下,在指定的分散系中下列各组微粒能大量共存的是( )。
A.空气:、、、
B.水玻璃:、、、
C.氨水:、、、
D.加几滴石蕊试液,溶液变红:、、、
9.下列有关化学反应速率说法正确的是( )。
A.与稀盐酸反应制,加入溶液,不会改变反应速率
B.与78%浓硫酸反应制取,若改用98%的浓硫酸,能加快的生成速率
C.锌与稀硫酸反应制备,加入少量硫酸铜固体,不影响反应速率
D.钠与乙醇反应的实验中,加入少量水可以加快产生氢气的速率
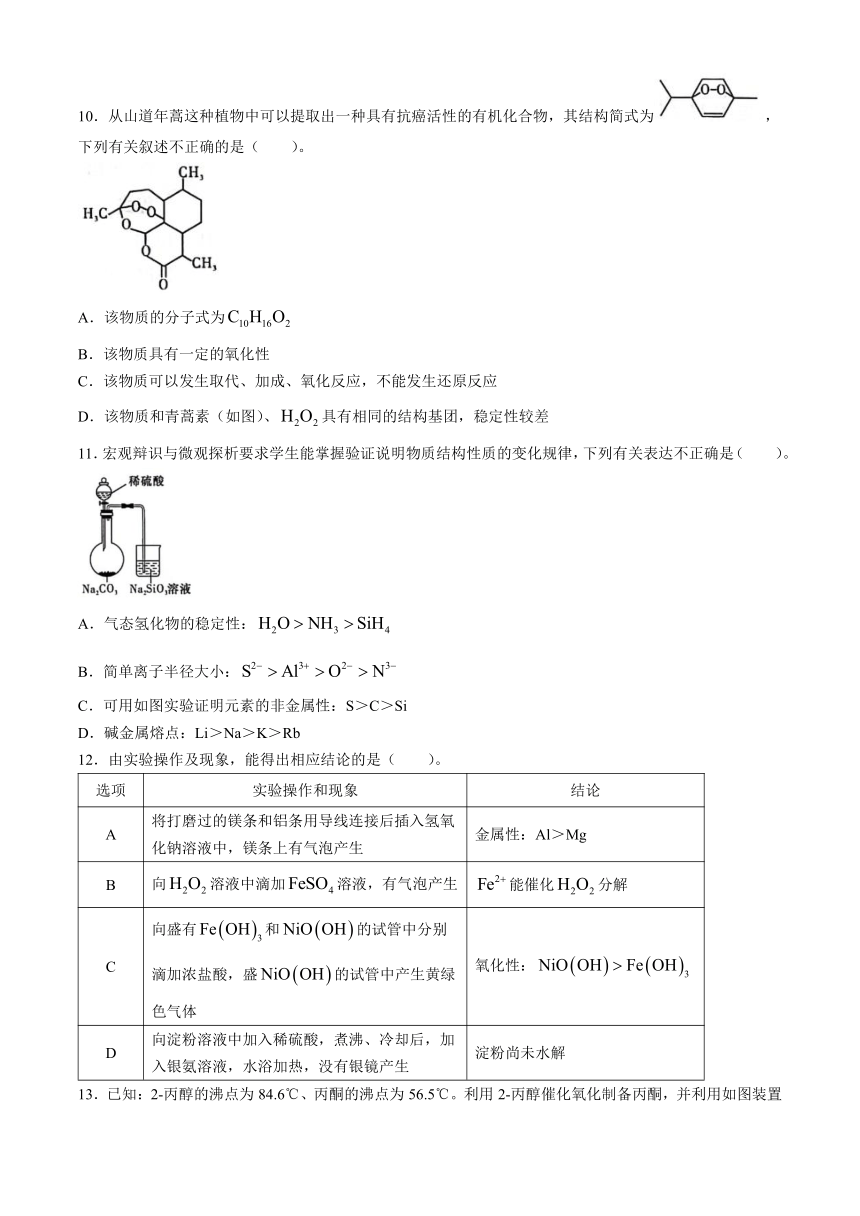
10.从山道年蒿这种植物中可以提取出一种具有抗癌活性的有机化合物,其结构简式为,下列有关叙述不正确的是( )。
A.该物质的分子式为
B.该物质具有一定的氧化性
C.该物质可以发生取代、加成、氧化反应,不能发生还原反应
D.该物质和青蒿素(如图)、具有相同的结构基团,稳定性较差
11.宏观辩识与微观探析要求学生能掌握验证说明物质结构性质的变化规律,下列有关表达不正确是( )。
A.气态氢化物的稳定性:
B.简单离子半径大小:
C.可用如图实验证明元素的非金属性:S>C>Si
D.碱金属熔点:Li>Na>K>Rb
12.由实验操作及现象,能得出相应结论的是( )。
选项 实验操作和现象 结论
A 将打磨过的镁条和铝条用导线连接后插入氢氧化钠溶液中,镁条上有气泡产生 金属性:Al>Mg
B 向溶液中滴加溶液,有气泡产生 能催化分解
C 向盛有和的试管中分别滴加浓盐酸,盛的试管中产生黄绿色气体 氧化性:
D 向淀粉溶液中加入稀硫酸,煮沸、冷却后,加入银氨溶液,水浴加热,没有银镜产生 淀粉尚未水解
13.已知:2-丙醇的沸点为84.6℃、丙酮的沸点为56.5℃。利用2-丙醇催化氧化制备丙酮,并利用如图装置提纯丙酮。下列叙述错误的是( )。
A.毛细玻璃管有平衡气压兼防止爆沸的作用
B.用热水浴加热,有利于控制温度且受热均匀
C.接真空泵是为了更好地完成减压蒸馏操作
D.温度计指示温度为84.6℃
14.某温度下,在恒容密闭容器中投入一定量的A、B发生反应:,时生成C的物质的量为(过程如图所示),下列说法中正确的是( )。
A.时,用A表示反应的速率为
B.
C.时容器内的压强为起始压强的
D.图中m点达到了反应进行的限度
15.水合肼是一种重要的化工原料,其沸点约为118℃,具有强还原性,实验室将稀溶液缓慢滴加到和的混合溶液中制备水合肼,其流程如图所示,下列说法正确的是( )。
A.“氧化”步骤中药品的滴加顺序不能颠倒
B.“蒸馏”操作需要用到的冷凝管的进出水顺序为上口进,下口出
C.“制备”过程中每消耗标准状况下,转移电子
D.“氧化”步骤中发生反应的离子方程式为:
二、非选择题:本题共4小题,共55分,除标注外,其余每空2分。
16.(12分)A、B、C、D、E、F为短周期主族元素,其中C的原子序数最小,它们的最高正价与原子半径关系如图所示。
回答下列问题:
(1)F简单离子结构示意图为__________(1分)。
(2)属于易燃易爆液体,严禁旅客携带,的结构式为__________(1分),写出在足量中燃烧的化学方程式__________。
(3)常用于安全气囊,该化合物含有的化学键类型有__________(填“离子键”、“极性键”或“非极性键”)。
(4)在硝酸工业中,D的氢化物能发生催化氧化反应,该反应的化学方程式为__________。
(5)与E处于同一主族且位于上一周期的元素G,可以与E形成如图离子,则该离子与稀硫酸反应的离子方程式为__________。
(6)化合物在工业上可用于处理废水中的重金属离子。向溶液中滴加酸性溶液,观察到溶液紫色褪去,并有无色无味气体产生,该反应的离子方程式为__________。
17.(13分)丙烯酸乙酯天然存在于菠萝等水果中,是一种食品用合成香料,可以利用有机物A、丙烯等石油化工产品为原料进行合成。
已知:有机物A属气态烃,在标准状况下的密度为。
请回答:
(1)用电子式表示无机物M的形成过程__________。
(2)写出有机物B的同分异构体的结构简式__________。
(3)下列说法正确的是__________(填序号)。
A.有机物B在加热条件下可以使黑色的氧化铜变红
B.有机物A分子中的所有原子在同一平面上
C.有机物B在人体内代谢最终被还原为和
D.有机物B、C均能与溶液反应
(4)有机物C中含有的官能团名称是__________。
(5)写出B与C反应生成丙烯酸乙酯的化学方程式__________,该反应的类型是__________(1分)。
(6)久置的丙烯酸乙酯自身会发生聚合反应,所得聚合物具有较好的弹性,可用于生产织物和皮革处理剂。请写出上述聚合过程的化学方程式__________。
18.(16分)
(1)以反应为原理设计成燃料电池,其能量转化率高,装置如图所示。
①A处加入的是__________,a处的电极反应式是__________。
②当消耗标准状况下时,导线上转移电子的物质的量是__________。
(2)将一定量纯净的氨基甲酸铵置于恒容密闭真空容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:。则以下情况不能说明该反应一定达到化学平衡状态的是__________(填序号)。
① ②密闭容器中总压强不变
③密闭容器中混合气体的密度不变 ④密闭容器中的体积分数不变
⑤密闭容器中混合气体的平均相对分子质量不变
(3)一定条件下,在密闭容器内,发生反应,的物质的量随时间变化如表:
时间/s 0 1 2 3 4 5
0.040 0.020 0.010 0.005 0.005 0.005
用表示内该反应的平均速率为__________;到第末,的转化率为__________。
(4)已知:,不同温度(T)下,分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度消耗一半时所需的相应时间),则__________(填“>”、“=”或“<”)。当温度为、起始压强为,反应至时,此时体系压强__________(用表示)。
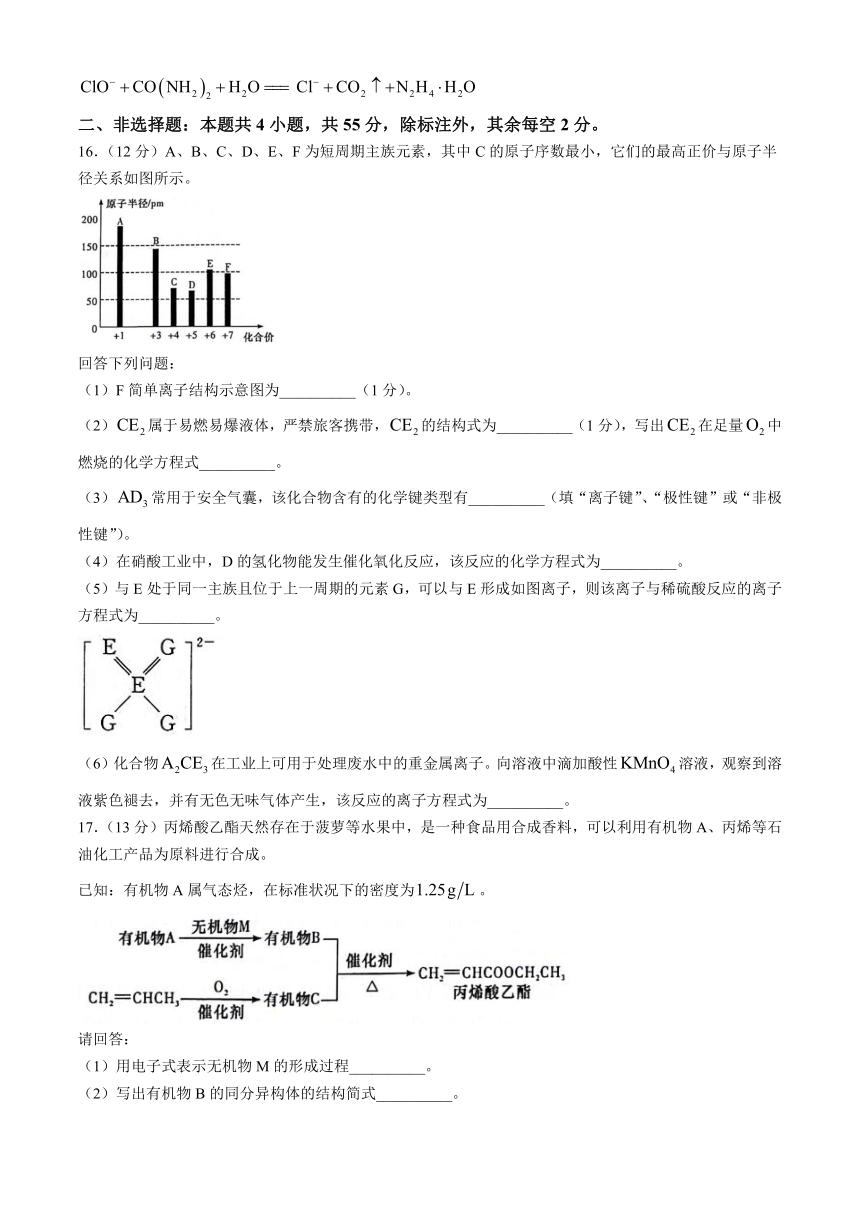
19.(14分)次磷酸钠在食品工业中用作防腐剂、抗氧化剂,也是一种很好的化学镀剂。
(1)中P的化合价为__________价(1分)。
(2)将待镀零件浸泡在和的混合溶液中,可达到化学镀镍(在待镀零件表面形成一层金属镍)的目的,该过程中被氧化为二元弱酸,写出该反应的离子方程式__________。
(3)次磷酸钠的制备
将黄磷和过量烧碱溶液混合加热,生成和(气体),与溶液反应可生成次磷酸,实验装置如图:
①装置A中盛放烧碱溶液的仪器名称为__________(1分)。
②由装置A中发生化学反应可知,次磷酸属于__________元弱酸。
③装置C中发生反应的化学方程式为__________。
④反应结束后,向装置内通入的目的是__________。
⑤已知相关物质的溶解度如表:
25℃ 100℃
充分反应后,将A、C中溶液混合,再将混合液(含极少量)加热浓缩,有大量杂质晶体析出,然后__________(填操作名称),得到含的溶液,进一步处理得到粗产品。
(4)次磷酸钠的纯度测定
先取粗产品配成溶液,再取所配溶液于锥形瓶中,酸化后加入过量的碘水。充分反应后,剩余碘水恰好可消耗溶液(相关反应方程式为:,),则产品纯度为__________。
(已知:相对分子质量为88;纯度=×100%)。
咸宁市2023~2024学年度下学期高中期末考试
高一化学参考答案
一、选择题:本题共15小题,每小题3分,共45分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 B C D A B D B C D C B C D C A
二、非选择题:本题共4小题,共55分,除标注外,其余每空2分。
16.(12分)
(1)(1分)
(2)(1分)
(3)离子键和非极性键
(4)
(5)
(6)
17.(13分)
(1)
(2)
(3)AB
(4)碳碳双键、羧基
(5)
酯化反应(或取代反应)(1分)
(6)
18.(16分)
(1)①
②
(2)④⑤
(3)0.0015 87.5%
(4)>
19.(14分)
(1)(1分)
(2)
(3)①分液漏斗(1分)
②一
③
④将生成的全部排入C中充分吸收,增大次磷酸钠产率
⑤趁热过滤
(4)63.36%
化学试卷
本试卷共8页,时长75分钟,满分100分。
可能用到的相对原子质量:
一、选择题:本题共15小题,每小题3分,共45分。每小题只有一个选项符合题目要求。
1.“舌尖上的安全”成为网络热搜词之一,科学、安全、有效和合理地使用化学品是每一位生产者和消费者的要求和责任。下列说法正确的是( )。
A.用漂白过的银耳不仅色泽美观,而且营养更丰富
B.豆腐制作过程中加入石膏水既能起到凝固剂,又能起到营养强化剂的作用
C.是一种防腐剂和护色剂,可大量用于肉质食材的防腐
D.抗坏血酸(即维生素C)是水果罐头中常用的抗氧化剂,能被还原为脱氢抗坏血酸
2.正确掌握化学用语和化学基本概念是学好化学的基础。下列各项中表达正确的是( )。
A.的分子结构模型:
B.聚丙烯的结构简式为:
C.离子化合物的电子式为:
D.在水中的电离方程式:
3.设为阿伏加德罗常数的值,下列说法正确的是( )。
A.与足量浓盐酸充分反应,转移电子数目一定小于
B.标准状况下,和在光照下充分反应,生成分子数为
C.中含有C—H键的数目一定为
D.乙炔和乙醛蒸气的混合气体,完全燃烧消耗氧气分子
4.下列离子方程式正确的是( )。
A.向氯水中加入少量小苏打可以增强漂白性:
B.向溶液中加入少量溶液:
C.用漂白液脱除废气中少量:
D.用浓溶解固体:
5.材料是科技进步的阶梯。下列关于化学材料说法错误的是( )。
A.氮化硅、氧化铝、碳化硅等新型陶瓷是无机非金属材料
B.有机玻璃可以制成飞机和车辆的风挡、光学仪器等,属于硅酸盐材料
C.量子通信材料螺旋碳纳米管TEM与石墨烯互为同素异形体
D.生铁可以铸造下水井盖,因为生铁中碳含量较钢更高,硬度更大
6.一定条件下,石墨转化为金刚石要吸收能量。在该条件下,下列结论正确的是( )。
A.金刚石比石墨稳定
B.等质量的金刚石和石墨完全燃烧释放的热量相同
C.金刚石转化为石墨是吸热反应
D.(金刚石)比(石墨)的总能量高
7.电池功率大,可用于海上导航,其结构如图所示。下列说法正确的是( )。
A.电池工作时,从交换膜左移向右 B.电子流动方向:铝电极→导线→碳纤维
C.铝电极的反应式为: D.铝电极表面有大量产生
8.常温下,在指定的分散系中下列各组微粒能大量共存的是( )。
A.空气:、、、
B.水玻璃:、、、
C.氨水:、、、
D.加几滴石蕊试液,溶液变红:、、、
9.下列有关化学反应速率说法正确的是( )。
A.与稀盐酸反应制,加入溶液,不会改变反应速率
B.与78%浓硫酸反应制取,若改用98%的浓硫酸,能加快的生成速率
C.锌与稀硫酸反应制备,加入少量硫酸铜固体,不影响反应速率
D.钠与乙醇反应的实验中,加入少量水可以加快产生氢气的速率
10.从山道年蒿这种植物中可以提取出一种具有抗癌活性的有机化合物,其结构简式为,下列有关叙述不正确的是( )。
A.该物质的分子式为
B.该物质具有一定的氧化性
C.该物质可以发生取代、加成、氧化反应,不能发生还原反应
D.该物质和青蒿素(如图)、具有相同的结构基团,稳定性较差
11.宏观辩识与微观探析要求学生能掌握验证说明物质结构性质的变化规律,下列有关表达不正确是( )。
A.气态氢化物的稳定性:
B.简单离子半径大小:
C.可用如图实验证明元素的非金属性:S>C>Si
D.碱金属熔点:Li>Na>K>Rb
12.由实验操作及现象,能得出相应结论的是( )。
选项 实验操作和现象 结论
A 将打磨过的镁条和铝条用导线连接后插入氢氧化钠溶液中,镁条上有气泡产生 金属性:Al>Mg
B 向溶液中滴加溶液,有气泡产生 能催化分解
C 向盛有和的试管中分别滴加浓盐酸,盛的试管中产生黄绿色气体 氧化性:
D 向淀粉溶液中加入稀硫酸,煮沸、冷却后,加入银氨溶液,水浴加热,没有银镜产生 淀粉尚未水解
13.已知:2-丙醇的沸点为84.6℃、丙酮的沸点为56.5℃。利用2-丙醇催化氧化制备丙酮,并利用如图装置提纯丙酮。下列叙述错误的是( )。
A.毛细玻璃管有平衡气压兼防止爆沸的作用
B.用热水浴加热,有利于控制温度且受热均匀
C.接真空泵是为了更好地完成减压蒸馏操作
D.温度计指示温度为84.6℃
14.某温度下,在恒容密闭容器中投入一定量的A、B发生反应:,时生成C的物质的量为(过程如图所示),下列说法中正确的是( )。
A.时,用A表示反应的速率为
B.
C.时容器内的压强为起始压强的
D.图中m点达到了反应进行的限度
15.水合肼是一种重要的化工原料,其沸点约为118℃,具有强还原性,实验室将稀溶液缓慢滴加到和的混合溶液中制备水合肼,其流程如图所示,下列说法正确的是( )。
A.“氧化”步骤中药品的滴加顺序不能颠倒
B.“蒸馏”操作需要用到的冷凝管的进出水顺序为上口进,下口出
C.“制备”过程中每消耗标准状况下,转移电子
D.“氧化”步骤中发生反应的离子方程式为:
二、非选择题:本题共4小题,共55分,除标注外,其余每空2分。
16.(12分)A、B、C、D、E、F为短周期主族元素,其中C的原子序数最小,它们的最高正价与原子半径关系如图所示。
回答下列问题:
(1)F简单离子结构示意图为__________(1分)。
(2)属于易燃易爆液体,严禁旅客携带,的结构式为__________(1分),写出在足量中燃烧的化学方程式__________。
(3)常用于安全气囊,该化合物含有的化学键类型有__________(填“离子键”、“极性键”或“非极性键”)。
(4)在硝酸工业中,D的氢化物能发生催化氧化反应,该反应的化学方程式为__________。
(5)与E处于同一主族且位于上一周期的元素G,可以与E形成如图离子,则该离子与稀硫酸反应的离子方程式为__________。
(6)化合物在工业上可用于处理废水中的重金属离子。向溶液中滴加酸性溶液,观察到溶液紫色褪去,并有无色无味气体产生,该反应的离子方程式为__________。
17.(13分)丙烯酸乙酯天然存在于菠萝等水果中,是一种食品用合成香料,可以利用有机物A、丙烯等石油化工产品为原料进行合成。
已知:有机物A属气态烃,在标准状况下的密度为。
请回答:
(1)用电子式表示无机物M的形成过程__________。
(2)写出有机物B的同分异构体的结构简式__________。
(3)下列说法正确的是__________(填序号)。
A.有机物B在加热条件下可以使黑色的氧化铜变红
B.有机物A分子中的所有原子在同一平面上
C.有机物B在人体内代谢最终被还原为和
D.有机物B、C均能与溶液反应
(4)有机物C中含有的官能团名称是__________。
(5)写出B与C反应生成丙烯酸乙酯的化学方程式__________,该反应的类型是__________(1分)。
(6)久置的丙烯酸乙酯自身会发生聚合反应,所得聚合物具有较好的弹性,可用于生产织物和皮革处理剂。请写出上述聚合过程的化学方程式__________。
18.(16分)
(1)以反应为原理设计成燃料电池,其能量转化率高,装置如图所示。
①A处加入的是__________,a处的电极反应式是__________。
②当消耗标准状况下时,导线上转移电子的物质的量是__________。
(2)将一定量纯净的氨基甲酸铵置于恒容密闭真空容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:。则以下情况不能说明该反应一定达到化学平衡状态的是__________(填序号)。
① ②密闭容器中总压强不变
③密闭容器中混合气体的密度不变 ④密闭容器中的体积分数不变
⑤密闭容器中混合气体的平均相对分子质量不变
(3)一定条件下,在密闭容器内,发生反应,的物质的量随时间变化如表:
时间/s 0 1 2 3 4 5
0.040 0.020 0.010 0.005 0.005 0.005
用表示内该反应的平均速率为__________;到第末,的转化率为__________。
(4)已知:,不同温度(T)下,分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度消耗一半时所需的相应时间),则__________(填“>”、“=”或“<”)。当温度为、起始压强为,反应至时,此时体系压强__________(用表示)。
19.(14分)次磷酸钠在食品工业中用作防腐剂、抗氧化剂,也是一种很好的化学镀剂。
(1)中P的化合价为__________价(1分)。
(2)将待镀零件浸泡在和的混合溶液中,可达到化学镀镍(在待镀零件表面形成一层金属镍)的目的,该过程中被氧化为二元弱酸,写出该反应的离子方程式__________。
(3)次磷酸钠的制备
将黄磷和过量烧碱溶液混合加热,生成和(气体),与溶液反应可生成次磷酸,实验装置如图:
①装置A中盛放烧碱溶液的仪器名称为__________(1分)。
②由装置A中发生化学反应可知,次磷酸属于__________元弱酸。
③装置C中发生反应的化学方程式为__________。
④反应结束后,向装置内通入的目的是__________。
⑤已知相关物质的溶解度如表:
25℃ 100℃
充分反应后,将A、C中溶液混合,再将混合液(含极少量)加热浓缩,有大量杂质晶体析出,然后__________(填操作名称),得到含的溶液,进一步处理得到粗产品。
(4)次磷酸钠的纯度测定
先取粗产品配成溶液,再取所配溶液于锥形瓶中,酸化后加入过量的碘水。充分反应后,剩余碘水恰好可消耗溶液(相关反应方程式为:,),则产品纯度为__________。
(已知:相对分子质量为88;纯度=×100%)。
咸宁市2023~2024学年度下学期高中期末考试
高一化学参考答案
一、选择题:本题共15小题,每小题3分,共45分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 B C D A B D B C D C B C D C A
二、非选择题:本题共4小题,共55分,除标注外,其余每空2分。
16.(12分)
(1)(1分)
(2)(1分)
(3)离子键和非极性键
(4)
(5)
(6)
17.(13分)
(1)
(2)
(3)AB
(4)碳碳双键、羧基
(5)
酯化反应(或取代反应)(1分)
(6)
18.(16分)
(1)①
②
(2)④⑤
(3)0.0015 87.5%
(4)>
19.(14分)
(1)(1分)
(2)
(3)①分液漏斗(1分)
②一
③
④将生成的全部排入C中充分吸收,增大次磷酸钠产率
⑤趁热过滤
(4)63.36%
同课章节目录
