2025届高三化学一轮专题复习讲义(28)-专题七第二讲 化学反应原理综合题
文档属性
| 名称 | 2025届高三化学一轮专题复习讲义(28)-专题七第二讲 化学反应原理综合题 |  | |
| 格式 | doc | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-30 08:01:10 | ||
图片预览



文档简介
2025届高三化学一轮专题复习讲义(28)
专题七 化学热点
7-2 化学反应原理综合题(1课时)
【复习目标】
理解最核心、最基础的概念和原理的内涵,能从模型的角度认识这些概念和原理,并说出它们建立的过程和关键证据,反思它们建立的思路与方法,深化对化学基本原理、基本观念的理解与认识,促进对科学本质的理解。
【重点突破】
通过对研究案例的研究过程的分析和研讨,帮助学生发展提出问题的意识和能力,扩展分析问题和解决问题的角度和思路。
【真题再现】
例1.(2023·江苏高考)空气中CO2含量的控制和CO2资源利用具有重要意义。
(1)燃煤烟气中CO2的捕集可通过如下所示的物质转化实现。
“吸收”后所得的KHCO3溶液与石灰乳反应的化学方程式为_______;载人航天器内,常用LiOH固体而很少用KOH固体吸收空气中的CO2,其原因是______。
(2)合成尿素[CO(NH2)2]是利用CO2的途径之一。尿素合成主要通过下列反应实现
反应Ⅰ:2NH3(g)+CO2(g)===NH2COONH4(l)
反应Ⅱ:NH2COONH4(l) === CO(NH2)2(l)+H2O (l)
①密闭体系中反应Ⅰ的平衡常数(K)与温度的关系如图甲所示,反应Ⅰ的△H___0(填“=”或“>”或“<”)。
②反应体系中除发生反应Ⅰ、反应Ⅱ外,还发生尿素水解、尿素缩合生成缩二脲[(NH2CO)2NH]和尿素转化为氰酸铵(NH4OCN)等副反应。尿素生产中实际投入NH3和CO2的物质的量之比为n(NH3)∶n(CO2)=4∶1,其实际投料比值远大于理论值的原因是__________。
(3)催化电解吸收CO2的KOH溶液可将CO2转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图乙所示。
FE%=×100%
其中,QX=nF,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
①当电解电压为U3V时,电解过程中含碳还原产物的(FE%)为0,阴极主要还原产物为_____(填化学式)。
②当电解电压为U2V时,阴极由HCO生成CH4的电极反应式为________。
③当电解电压为U3V时,电解生成的C2H4和HCOO-的物质的量之比为_____(写出计算过程)。
解析:(1)由图可知“吸收”后所得的KHCO3溶液与石灰乳反应生成碳酸钙用于煅烧产生二氧化碳,产物KOH可回收利用,故方程式为KHCO3+Ca(OH)2===CaCO3+KOH+H2O。载人航天器内,常用LiOH固体而很少用KOH固体吸收空气中的CO2的原因为相同质量的LiOH固体可吸收更多二氧化碳。(2)由图可知升高温度反应Ⅰ的lgK减小,说明温度升高平衡逆向移动,故正反应为放热反应,其△H <0。实际投料比值远大于理论值的原因是适当抑制副反应的发生,尿素中氮碳比小于副产物中缩二脲的氮碳比,氨气与二氧化碳的投料比越大,二氧化碳转化率越高。(3)当电解电压为U1V时,电解过程中含碳还原产物的FE%为0,说明二氧化碳为得电子,为氢离子得电子变成氢气。当电解电压为U2V时,根据得失电子守恒、原子守恒和电荷守恒可知碱性条件下阴极由HCO生成CH4的电极反应式为HCO+8e-+6H2O===CH4↑+9OH-或 10HCO+8e-===CH4↑+9CO+3H2O。当电解电压为U3V时,电解过程中还原产物C2H4的FE%为24%,还原产物HCOO-的FE%为8%,每生成1molC2H4转移12mole-,每生成1molHCOO-转移2mole-,故电解生成的C2H4和HCOO-的物质的量之比为∶=1∶2。
答案:(1)KHCO3+Ca(OH)2===CaCO3+KOH+H2O 相同质量的LiOH固体可吸收更多二氧化碳
(2)<0 适当抑制副反应的发生,尿素中氮碳比小于副产物中缩二脲的氮碳比,氨气与二氧化碳的投料比越大,二氧化碳转化率越高
(3)H2 HCO+8e-+6H2O===CH4↑+9OH-或 10HCO+8e-===CH4↑+9CO+3H2O。 每生成1molC2H4转移12mole-,每生成1molHCOO-转移2mole-,故电解生成的C2H4和HCOO-的物质的量之比为∶=1∶2
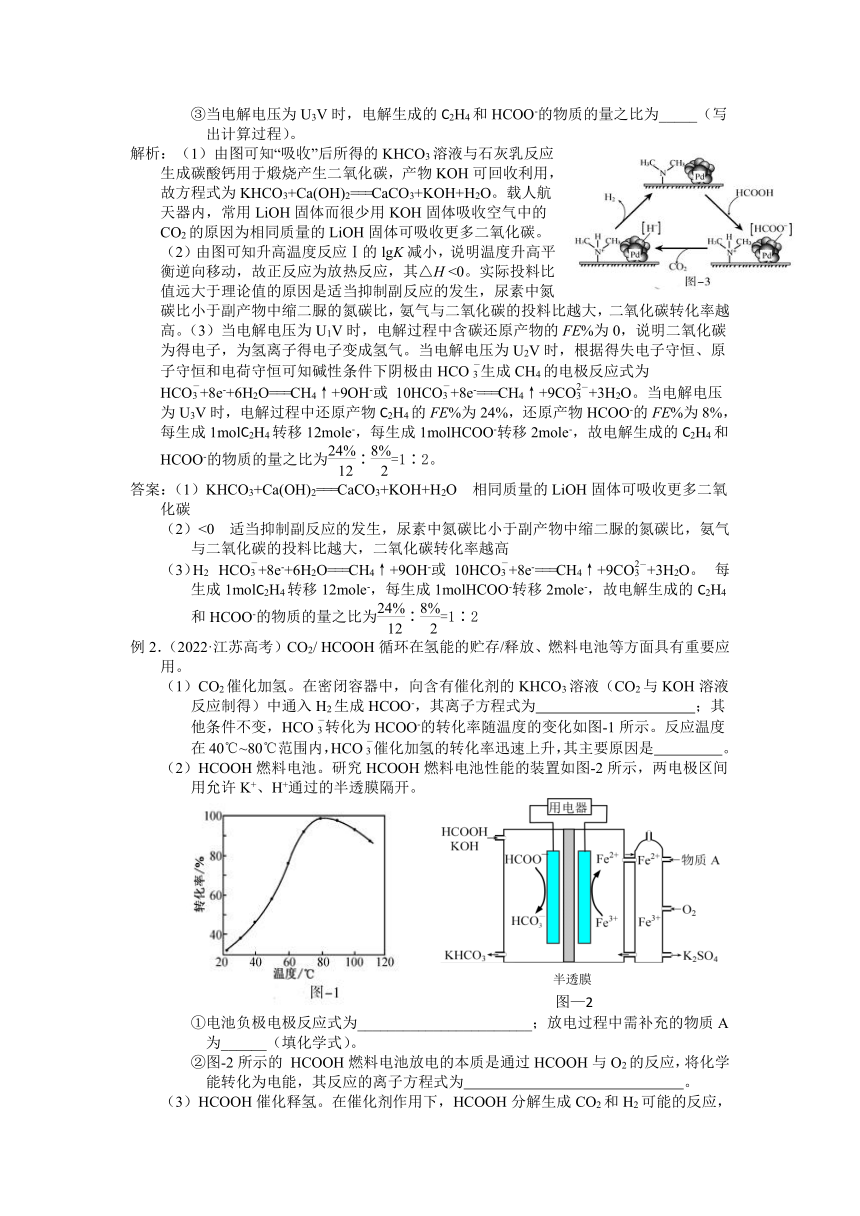
例2.(2022·江苏高考)CO2/ HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO-,其离子方程式为 ;其他条件不变,HCO转化为HCOO-的转化率随温度的变化如图-1所示。反应温度在40℃~80℃范围内,HCO催化加氢的转化率迅速上升,其主要原因是 。
(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图-2所示,两电极区间用允许K+、H+通过的半透膜隔开。
①电池负极电极反应式为_______________________;放电过程中需补充的物质A为______(填化学式)。
②图-2所示的 HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为 。
(3)HCOOH催化释氢。在催化剂作用下,HCOOH分解生成CO2和H2可能的反应,机理如图-3所示。
①HCOOD催化释氢反应除生成CO2外,还生成__________(填化学式)。
②研究发现:其他条件不变时,以 HCOOK溶液代替 HCOOH催化释氢的效果更佳,其具体优点是 。
答案:(1)HCO+H2HCOOˉ+H2O
温度升高反应速率增大,温度升高催化剂的活性增强
(2)HCOOˉ+2OHˉ-2eˉ=== HCO+H2O H2SO4
2HCOOH+O2+2OHˉ === 2 HCO+2H2O或2HCOOˉ+O2=== 2 HCO;
(3)①HD ②提高释放氢气的速率,提高释放出氢气的纯度
例3.(2021·江苏高考)甲烷是重要的资源,通过下列过程可实现由甲烷到氢气的转化。
(1)500℃时,CH4与H2O重整主要发生下列反应:
CH4(g)+H2O(g)CO(g)+3H2(g) CO(g)+H2O(g)H2(g)+CO2(g)
已知CaO(s)+CO2(g)===CaCO3(s) ΔH=-178.8kJ·mol-1。向重整反应体系中加入适量多孔CaO,其优点 。
(2)CH4与CO2重整的主要反应的热化学方程式为
反应I:CH4(g)+CO2(g) ===2CO(g)+2H2(g) ΔH=246.5kJ·mol-1
反应II:H2(g)+CO2(g) ===CO(g)+H2O(g) ΔH=41.2kJ·mol-1
反应III:2CO(g) ===CO2(g)+C(s) ΔH=-172.5kJ·mol-1
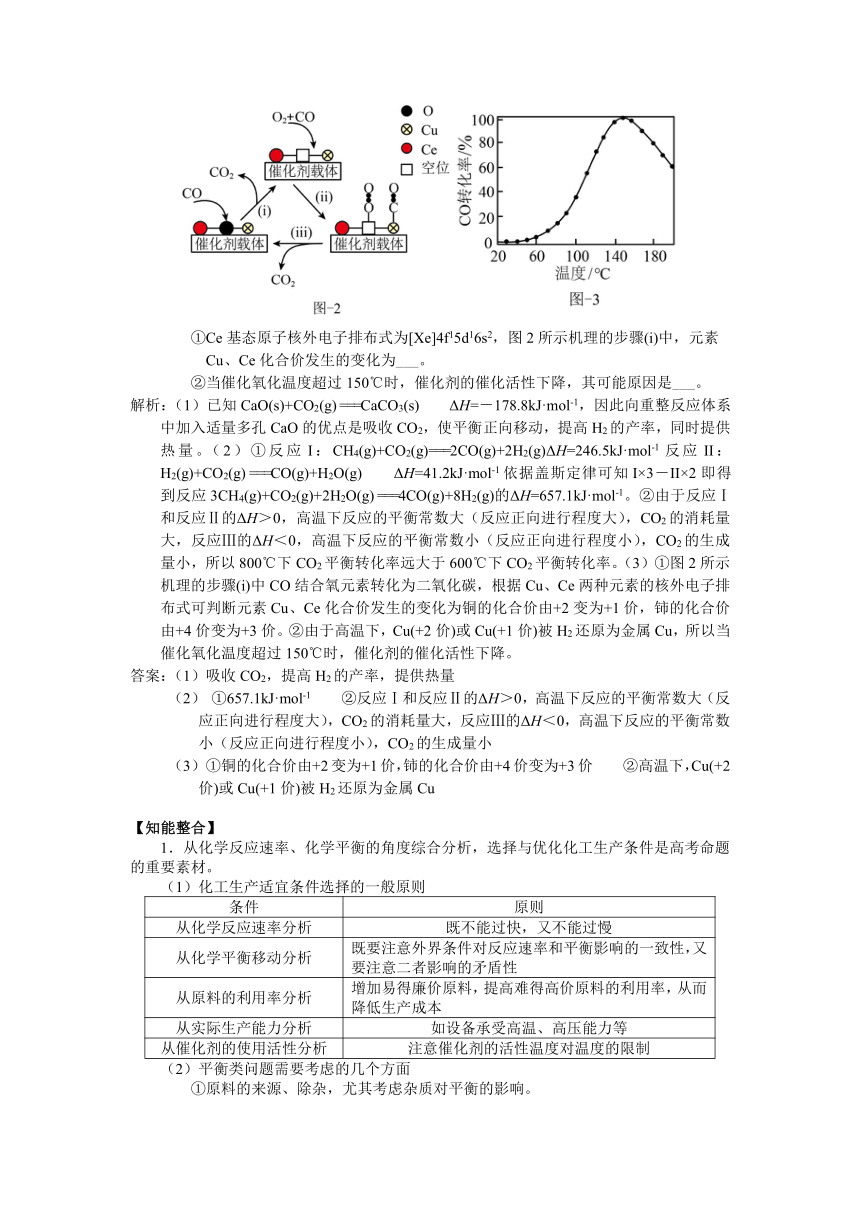
①在CH4与CO2重整体系中通入适量H2O(g),可减少C(s)的生成,反应3CH4(g)+CO2(g)+2H2O(g) ===4CO(g)+8H2(g)的ΔH=___。
②1.01×105Pa下,将n起始(CO2)︰n起始(CH4)=1︰1的混合气体置于密闭容器中,不同温度下重整体系中CH4和CO2的平衡转化率如图1所示。800℃下CO2平衡转化率远大于600℃下CO2平衡转化率,其原因是 。
(3)利用铜—铈氧化物(xCuO·yCeO2,Ce是活泼金属)催化氧化可除去H2中少量CO,催化氧化过程中Cu、Ce的化合价均发生变化,可能机理如图2所示。将n(CO)︰n(O2)︰n(H2)︰n(N2)=1︰1︰49︰49的混合气体以一定流速通过装有xCuO·yCeO2催化剂的反应器,CO的转化率随温度变化的曲线如图3所示。
①Ce基态原子核外电子排布式为[Xe]4f15d16s2,图2所示机理的步骤(i)中,元素Cu、Ce化合价发生的变化为___。
②当催化氧化温度超过150℃时,催化剂的催化活性下降,其可能原因是___。
解析:(1)已知CaO(s)+CO2(g) ===CaCO3(s) ΔH=-178.8kJ·mol-1,因此向重整反应体系中加入适量多孔CaO的优点是吸收CO2,使平衡正向移动,提高H2的产率,同时提供热量。(2)①反应I:CH4(g)+CO2(g)===2CO(g)+2H2(g)ΔH=246.5kJ·mol-1反应II:H2(g)+CO2(g) ===CO(g)+H2O(g) ΔH=41.2kJ·mol-1依据盖斯定律可知I×3-II×2即得到反应3CH4(g)+CO2(g)+2H2O(g) ===4CO(g)+8H2(g)的ΔH=657.1kJ·mol-1。②由于反应Ⅰ和反应Ⅱ的ΔH>0,高温下反应的平衡常数大(反应正向进行程度大),CO2的消耗量大,反应Ⅲ的ΔH<0,高温下反应的平衡常数小(反应正向进行程度小),CO2的生成量小,所以800℃下CO2平衡转化率远大于600℃下CO2平衡转化率。(3)①图2所示机理的步骤(i)中CO结合氧元素转化为二氧化碳,根据Cu、Ce两种元素的核外电子排布式可判断元素Cu、Ce化合价发生的变化为铜的化合价由+2变为+1价,铈的化合价由+4价变为+3价。②由于高温下,Cu(+2价)或Cu(+1价)被H2还原为金属Cu,所以当催化氧化温度超过150℃时,催化剂的催化活性下降。
答案:(1)吸收CO2,提高H2的产率,提供热量
(2) ①657.1kJ·mol-1 ②反应Ⅰ和反应Ⅱ的ΔH>0,高温下反应的平衡常数大(反应正向进行程度大),CO2的消耗量大,反应Ⅲ的ΔH<0,高温下反应的平衡常数小(反应正向进行程度小),CO2的生成量小
(3) ①铜的化合价由+2变为+1价,铈的化合价由+4价变为+3价 ②高温下,Cu(+2价)或Cu(+1价)被H2还原为金属Cu
【知能整合】
1.从化学反应速率、化学平衡的角度综合分析,选择与优化化工生产条件是高考命题的重要素材。
(1)化工生产适宜条件选择的一般原则
条件 原则
从化学反应速率分析 既不能过快,又不能过慢
从化学平衡移动分析 既要注意外界条件对反应速率和平衡影响的一致性,又要注意二者影响的矛盾性
从原料的利用率分析 增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本
从实际生产能力分析 如设备承受高温、高压能力等
从催化剂的使用活性分析 注意催化剂的活性温度对温度的限制
(2)平衡类问题需要考虑的几个方面
①原料的来源、除杂,尤其考虑杂质对平衡的影响。
②原料的循环利用。
③产物的污染处理。
④产物的酸碱性对反应的影响。
⑤气体产物的压强对平衡造成的影响。
⑥改变外界条件对多平衡体系的影响。
2.新情境下陌生电极反应式的书写方法:
(1)先区分原电池还是电解池再定电极;
(2)书写电极反应式,要考虑介质与放电生成的离子能否大量;
(3)也可以根据题目所给的总方程式,与其中一电极式相减即得另一电极反应式。
【体系再构】
【巩固练习】
基础训练
1.(2023·盐城三模)碳酸二甲酯()简称为DMC,是一种环保性能优异、用途广泛的化工原料。工业上用CO2与H2催化合成甲醇,由甲醇制备DMC。
(1)合成甲醇相关的热化学方程式如下:
反应Ⅰ:CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-49.2 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)===CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
①反应CO(g)+2H2(g)===CH3OH(g) ΔH=________ kJ·mol-1。
②将物质的量之比为1∶3的CO2与H2通入恒容密闭容器中进行反应,随着压强的增大,CO的选择性________(填“增大”或“减小”)
从平衡移动的角度分析,其可能的原因是__________________________ 。
③向合成甲醇的体系中加入少量Al2O3,单位时间内甲醇的选择性提高,其原因是__________________________。
(2)工业上以CH3OH作反应物和溶剂,电解碳酸1,2 丙二酯()、四乙基碘化铵(TEAI,提供I)和CH3OH混合液制备DMC。为探究反应机理,设计如下三个对比实验:
实验I:10 mL CH3OH+0.117 mol·L-1碳酸1,2 丙二酯,蒸馏,没有DMC生成。
实验II:10 mL CH3OH+0.117 mol·L-1碳酸1,2 丙二酯+0.1 mol·L-1TEAI,蒸馏,DMC产率7.5%。
实验III:10 mL CH3OH+0.117 mol·L-1碳酸1,2 丙二酯+0.1 mol·L-1TEAI,Cu为阴极、石墨为阳极,通电,DMC产率82.3%。
电催化酯交换法合成碳酸二甲酯的机理如图:
注:代表微粒带负电荷。
①阴极电极反应式为__________________________________________。
②I在反应过程中的机理可描述为_____________________________________。
【巩固练习】答案
1.(1)①-90.4
②减小 反应Ⅰ的正反应方向是气体分子数减小的反应,增大压强,平衡正向移动,CO2的平衡转化率增大,CH3OH的选择性提高,CO的选择性降低;反应Ⅱ是反应前后气体分子数不变的反应,受反应Ⅰ的影响,平衡逆向移动,CH3OH的选择性提高,CO的选择性降低
③Al2O3能降低反应Ⅰ的活化能,进而提高甲醇的选择性
(2)①2CH3OH+2e-===2CH3O-+H2↑
②O的电负性大于C,在碳酸1,2 丙二酯的分子中,酯基碳原子带有部分正电荷,受到体系中I进攻,碳氧双键断裂,酯基氧所带的负电荷离去,恢复碳氧双键;CH3O进攻酯基中的碳原子,I离去,恢复碳氧双键
拓展训练
2.CH4与CO2重整生成H2和CO的过程中主要发生下列反应
CH4(g)+CO2(g)===2H2(g)+2CO(g) ΔH=+247.1 kJ·mol-1
H2(g)+CO2(g)===H2O(g)+CO(g) ΔH=+41.2 kJ·mol-1
在恒压、反应物起始物质的量比n(CH4)∶n(CO2)=1∶1条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。
下列有关说法正确的是
A.升高温度、增大压强均有利于提高CH4的平衡转化率
B.曲线A表示CH4的平衡转化率随温度的变化
C.相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D.恒压、800 K、n(CH4)∶n(CO2)=1∶1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
3.(2023·扬州考前调研)烟气中的NOx是大气的主要污染物之一,NOx的吸收处理是当前研究的热点。
(1)还原吸收法
方法1:直接使用尿素[CO(NH2)2]溶液吸收烟气中的NOx。
方法2:先用合适的氧化剂将NOx中的NO氧化为NO2,再用CO(NH2)2溶液去还原吸收。
还原吸收等量的NOx,消耗尿素较多的是________(填“方法1”或“方法2”)。工业上选择方法2处理NOx的原因是_____________________________________。
(2)水吸收法
NO2和N2O4均能被水吸收,不同初始压强下,NO2和N2O4的混合气体被水吸收前和吸收达到平衡后,气体中NO2和N2O4的体积分数如图所示。混合气体中与水反应的主要成分是________。达到平衡后,气体中的NO2和N2O4的体积分数之和远小于100%,原因是____________________________________。
(3)配合物吸收法
钴氨配合物吸收NO的主要原理如下。
已知:[Co(NH3)6]2+对NO的配合能力很强,而[Co(NH3)6]3+对NO的配合能力极低。
①与NO反应的[Co(NH3)6]2+和与O2反应的[Co(NH3)6]2+的物质的量之比为________。
②钴氨溶液经过多次循环吸收NO后,其吸收NO的能力会降低,为了恢复钴氨溶液吸收NO的能力,需采取的方法是_________________________。
(4)NO与O2在某催化剂表面反应生成NO2的过程中,O2在催化剂表面能形成被吸附的O(用O-Site表示),接下来的机理可能有两种:
机理1:NO(g)+O SiteNO2-Site
机理2:NO-Site+O-SiteSite+NO2-Site
上述两个反应均为基元反应。保持温度和NO的浓度不变,测得NO与O2在该催化剂作用下反应的初始速率与O2浓度的关系如图所示。能合理解释图中曲线变化的机理为______________________(填“机理1”或“机理2”);判断的依据是__________________________________________________。
【拓展训练】答案:
2.D
3.(1)方法2 NO2在水中溶解度好,与尿素溶液反应速率快;NO2的氧化性强于NO
(2)N2O4 NO2和N2O4与水反应后生成了NO
(3)①1∶2 ②将[Co(NH3)6]3+还原为[Co(NH3)6]2+
(4)机理2 机理2认为反应速率与O吸附量和NO吸附量有关;O2浓度较小时,增加c(O2),O吸附量增大,反应速率加快;O
【课后作业】
1.肼(N2H4)在不同条件下分解产物不同,200 ℃时在Cu表面分解的机理如图1。
已知200 ℃时:
反应Ⅰ:3N2H4(g)===N2(g)+4NH3(g) ΔHl=-32.9 kJ·mol-1
反应Ⅱ: N2H4(g)+H2(g)===2NH3(g) ΔH2=-41.8 kJ·mol-1,下列说法不正确的是
A.图1所示过程①、②都是放热反应
B.反应Ⅱ的能量过程示意图如图2所示
C.断开3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为:
N2H4(g)===N2(g)+2H2 (g) ΔH=50.7 kJ·mol-1
2.我国科研人员提出了以Ni/Al2O3为催化剂,由CO2和H2转化为产品CH4的反应历程,其示意图如下:
下列说法不正确的是
A.总反应方程式为:CO2+4H2===CH4+2H2O
B.催化剂可有效提高反应物的平衡转化率
C.反应历程中,H—H键与C==O键断裂吸收能量
D.反应过程中,催化剂参与反应,改变反应路径,降低反应的活化能
3.在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
A.反应2NO(g)+O2(g) ===2NO2(g)的ΔH>0
B.图中X点所示条件下,延长反应时间不能提高NO转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D.380℃下,c起始(O2)=5.0×10 4 mol·L 1,NO平衡转化率为50%,则平衡常数K >2000
4.N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为 。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH =2NO+H2O 2NO2+2OH =NO+NO+H2O
①下列措施能提高尾气中NO和NO2去除率的有 (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中含有的主要杂质是 (填化学式);吸收后排放的尾气中含量较高的氮氧化物是 (填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl 和NO,其离子方程式为 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是 。
5.煤的燃烧排放的SO2、CO严重影响人们的生活质量。减少污染物的排放、研究SO2、CO等大气污染气体的综合利用具有重要意义。
Ⅰ. 燃煤脱硫技术是减少CO和SO2排放的常用方法之一。燃煤脱硫时常发生如下两个反应:
①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-l
②CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g) ΔH2=-394.0 kJ·mol-l
(1)某温度下在一体积恒定的密闭容器中若只发生反应①,下列不能说明该反应达到平衡状态的是 (填字母)。
A.容器内气体总压强不再变化
B.单位时间内生成1 mol SO2的同时消耗1 mol CO
C.混合气体的密度不再变化
D.混合气体的平均摩尔质量不再变化
(2)某科研小组研究起始一氧化碳物质的量、温度(T)对反应②的影响,实验结果如左图所示。
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是 。
②图像中T2 (填“>”、“<”、“=”或“无法确定”)T1,判断的理由是 。
Ⅱ. 氧化锌吸收法也能减少SO2的排放。配制ZnO悬浊液(含少量MgO、CaO),在吸收塔中封闭循环脱硫,发生的主要反应为ZnO+SO2ZnSO3(s),测得pH、吸收效率η随时间t的变化如右图所示。为提高SO2的吸收效率η, 可采取的措施为 (填字母)。
A.增大悬浊液中ZnO的量
B.适当提高单位时间内烟气的循环次数
C.调节溶液的pH至6.0以下
6.脱硫脱氮技术是环境科学研究的热点。
(1)某实验小组模拟O3氧化并结合(NH4)2SO3溶液吸收法,同时脱除SO2和NO的过程示意图如图。
已知气体反应器中主要发生如下反应(K为25 ℃下平衡常数、E为活化能):
Ⅰ. 2O3(g)===3O2(g) ΔH1=-286.6 kJ·mol-1、K1=1.6×1057、E1=24.6 kJ·mol-1
Ⅱ. NO(g)+O3(g)===NO2(g)+O2(g) ΔH2=-200.9 kJ·mol-1、K2=6.2×1034、E2=3.17 kJ·mol-1
III. SO2(g)+O3(g)===SO3(g)+O2(g) ΔH3=-241.6 kJ·mol-1、K3=1.1×1041、E3=58.17 kJ·mol-1
①其他条件不变时,温度高于150 ℃,在相同时间内SO2和NO的转化率均随温度升高而降低,原因是 。
②其他条件不变,SO2和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内SO2和NO的转化率随O3的浓度的变化关系如图1所示。NO的转化率始终高于SO2的原因是______________________________。
③从检测装置1中排出的气体经如图2所示的(NH4)2SO3溶液吸收器吸收,NO2被还原成NO。该喷淋吸收塔装置的优点是____________________________ 。
④其他条件不变,SO2和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,O3与NO的物质的量之比对SO2和NO脱除率的影响如图3所示。O3的浓度很低时,SO2的脱除率超过97%,其原因是__________________________。
(2)科研人员研究发现厌氧氨氧化生物酶体系可以促进H+和电子的转移(如a、b和c),能将废水中的NO转化为N2进入大气层,其反应过程如图4所示。
①请结合反应方程式,描述上述转化的具体过程: 。
②若废水中存在一定浓度的O2时,则上述转化无法发生,其可能原因是______。
【课后作业】答案
1.A 2.B 3.D
4.(1)2NH3+2O2N2O+3H2O
(2)①BC ②NaNO3 NO
(3)①3HClO+2NO+H2O===3Cl +2NO+5H+
②溶液pH越小,溶液中HClO的浓度越大,氧化NO的能力越强
5.I(1)B
(2)①c
②> 该反应为放热反应,升高温度平衡向逆反应方向移动,CO2体积分数降低,故T2>T1
II AB
6.(1)
①高于150℃,温度升高,反应Ⅰ的速率增大,c(O2)减小,反应Ⅱ、Ⅲ的速率减小,导致SO2和NO的转化率均降低
②反应Ⅱ的活化能小于反应Ⅲ,反应Ⅱ的速率大于反应Ⅲ,因此NO的转化率高于SO2
③增大气液接触面积,提高吸收效率
④(NH4)2SO3溶液直接与SO2反应是脱除SO2的主要原因
(2)
①反应Ⅲ:N2H4-4e-===N2↑+4H+,此反应产生4个H+和4个电子,通过生物酶转移,参与反应Ⅰ和反应Ⅱ,反应Ⅰ:NO+2H++e-===H2O+NO↑,反应消耗2个H+和1个电子,反应Ⅱ:NO+NH+2H++3e-===N2H4+H2O,消耗2个H+和3个电子(总反应为NO+NH===N2↑+2H2O)
②O2氧化NO(或NO)使反应终止,厌氧氨氧化酶在有氧条件下失去活性
半透膜
图—2
专题七 化学热点
7-2 化学反应原理综合题(1课时)
【复习目标】
理解最核心、最基础的概念和原理的内涵,能从模型的角度认识这些概念和原理,并说出它们建立的过程和关键证据,反思它们建立的思路与方法,深化对化学基本原理、基本观念的理解与认识,促进对科学本质的理解。
【重点突破】
通过对研究案例的研究过程的分析和研讨,帮助学生发展提出问题的意识和能力,扩展分析问题和解决问题的角度和思路。
【真题再现】
例1.(2023·江苏高考)空气中CO2含量的控制和CO2资源利用具有重要意义。
(1)燃煤烟气中CO2的捕集可通过如下所示的物质转化实现。
“吸收”后所得的KHCO3溶液与石灰乳反应的化学方程式为_______;载人航天器内,常用LiOH固体而很少用KOH固体吸收空气中的CO2,其原因是______。
(2)合成尿素[CO(NH2)2]是利用CO2的途径之一。尿素合成主要通过下列反应实现
反应Ⅰ:2NH3(g)+CO2(g)===NH2COONH4(l)
反应Ⅱ:NH2COONH4(l) === CO(NH2)2(l)+H2O (l)
①密闭体系中反应Ⅰ的平衡常数(K)与温度的关系如图甲所示,反应Ⅰ的△H___0(填“=”或“>”或“<”)。
②反应体系中除发生反应Ⅰ、反应Ⅱ外,还发生尿素水解、尿素缩合生成缩二脲[(NH2CO)2NH]和尿素转化为氰酸铵(NH4OCN)等副反应。尿素生产中实际投入NH3和CO2的物质的量之比为n(NH3)∶n(CO2)=4∶1,其实际投料比值远大于理论值的原因是__________。
(3)催化电解吸收CO2的KOH溶液可将CO2转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图乙所示。
FE%=×100%
其中,QX=nF,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
①当电解电压为U3V时,电解过程中含碳还原产物的(FE%)为0,阴极主要还原产物为_____(填化学式)。
②当电解电压为U2V时,阴极由HCO生成CH4的电极反应式为________。
③当电解电压为U3V时,电解生成的C2H4和HCOO-的物质的量之比为_____(写出计算过程)。
解析:(1)由图可知“吸收”后所得的KHCO3溶液与石灰乳反应生成碳酸钙用于煅烧产生二氧化碳,产物KOH可回收利用,故方程式为KHCO3+Ca(OH)2===CaCO3+KOH+H2O。载人航天器内,常用LiOH固体而很少用KOH固体吸收空气中的CO2的原因为相同质量的LiOH固体可吸收更多二氧化碳。(2)由图可知升高温度反应Ⅰ的lgK减小,说明温度升高平衡逆向移动,故正反应为放热反应,其△H <0。实际投料比值远大于理论值的原因是适当抑制副反应的发生,尿素中氮碳比小于副产物中缩二脲的氮碳比,氨气与二氧化碳的投料比越大,二氧化碳转化率越高。(3)当电解电压为U1V时,电解过程中含碳还原产物的FE%为0,说明二氧化碳为得电子,为氢离子得电子变成氢气。当电解电压为U2V时,根据得失电子守恒、原子守恒和电荷守恒可知碱性条件下阴极由HCO生成CH4的电极反应式为HCO+8e-+6H2O===CH4↑+9OH-或 10HCO+8e-===CH4↑+9CO+3H2O。当电解电压为U3V时,电解过程中还原产物C2H4的FE%为24%,还原产物HCOO-的FE%为8%,每生成1molC2H4转移12mole-,每生成1molHCOO-转移2mole-,故电解生成的C2H4和HCOO-的物质的量之比为∶=1∶2。
答案:(1)KHCO3+Ca(OH)2===CaCO3+KOH+H2O 相同质量的LiOH固体可吸收更多二氧化碳
(2)<0 适当抑制副反应的发生,尿素中氮碳比小于副产物中缩二脲的氮碳比,氨气与二氧化碳的投料比越大,二氧化碳转化率越高
(3)H2 HCO+8e-+6H2O===CH4↑+9OH-或 10HCO+8e-===CH4↑+9CO+3H2O。 每生成1molC2H4转移12mole-,每生成1molHCOO-转移2mole-,故电解生成的C2H4和HCOO-的物质的量之比为∶=1∶2
例2.(2022·江苏高考)CO2/ HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO-,其离子方程式为 ;其他条件不变,HCO转化为HCOO-的转化率随温度的变化如图-1所示。反应温度在40℃~80℃范围内,HCO催化加氢的转化率迅速上升,其主要原因是 。
(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图-2所示,两电极区间用允许K+、H+通过的半透膜隔开。
①电池负极电极反应式为_______________________;放电过程中需补充的物质A为______(填化学式)。
②图-2所示的 HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为 。
(3)HCOOH催化释氢。在催化剂作用下,HCOOH分解生成CO2和H2可能的反应,机理如图-3所示。
①HCOOD催化释氢反应除生成CO2外,还生成__________(填化学式)。
②研究发现:其他条件不变时,以 HCOOK溶液代替 HCOOH催化释氢的效果更佳,其具体优点是 。
答案:(1)HCO+H2HCOOˉ+H2O
温度升高反应速率增大,温度升高催化剂的活性增强
(2)HCOOˉ+2OHˉ-2eˉ=== HCO+H2O H2SO4
2HCOOH+O2+2OHˉ === 2 HCO+2H2O或2HCOOˉ+O2=== 2 HCO;
(3)①HD ②提高释放氢气的速率,提高释放出氢气的纯度
例3.(2021·江苏高考)甲烷是重要的资源,通过下列过程可实现由甲烷到氢气的转化。
(1)500℃时,CH4与H2O重整主要发生下列反应:
CH4(g)+H2O(g)CO(g)+3H2(g) CO(g)+H2O(g)H2(g)+CO2(g)
已知CaO(s)+CO2(g)===CaCO3(s) ΔH=-178.8kJ·mol-1。向重整反应体系中加入适量多孔CaO,其优点 。
(2)CH4与CO2重整的主要反应的热化学方程式为
反应I:CH4(g)+CO2(g) ===2CO(g)+2H2(g) ΔH=246.5kJ·mol-1
反应II:H2(g)+CO2(g) ===CO(g)+H2O(g) ΔH=41.2kJ·mol-1
反应III:2CO(g) ===CO2(g)+C(s) ΔH=-172.5kJ·mol-1
①在CH4与CO2重整体系中通入适量H2O(g),可减少C(s)的生成,反应3CH4(g)+CO2(g)+2H2O(g) ===4CO(g)+8H2(g)的ΔH=___。
②1.01×105Pa下,将n起始(CO2)︰n起始(CH4)=1︰1的混合气体置于密闭容器中,不同温度下重整体系中CH4和CO2的平衡转化率如图1所示。800℃下CO2平衡转化率远大于600℃下CO2平衡转化率,其原因是 。
(3)利用铜—铈氧化物(xCuO·yCeO2,Ce是活泼金属)催化氧化可除去H2中少量CO,催化氧化过程中Cu、Ce的化合价均发生变化,可能机理如图2所示。将n(CO)︰n(O2)︰n(H2)︰n(N2)=1︰1︰49︰49的混合气体以一定流速通过装有xCuO·yCeO2催化剂的反应器,CO的转化率随温度变化的曲线如图3所示。
①Ce基态原子核外电子排布式为[Xe]4f15d16s2,图2所示机理的步骤(i)中,元素Cu、Ce化合价发生的变化为___。
②当催化氧化温度超过150℃时,催化剂的催化活性下降,其可能原因是___。
解析:(1)已知CaO(s)+CO2(g) ===CaCO3(s) ΔH=-178.8kJ·mol-1,因此向重整反应体系中加入适量多孔CaO的优点是吸收CO2,使平衡正向移动,提高H2的产率,同时提供热量。(2)①反应I:CH4(g)+CO2(g)===2CO(g)+2H2(g)ΔH=246.5kJ·mol-1反应II:H2(g)+CO2(g) ===CO(g)+H2O(g) ΔH=41.2kJ·mol-1依据盖斯定律可知I×3-II×2即得到反应3CH4(g)+CO2(g)+2H2O(g) ===4CO(g)+8H2(g)的ΔH=657.1kJ·mol-1。②由于反应Ⅰ和反应Ⅱ的ΔH>0,高温下反应的平衡常数大(反应正向进行程度大),CO2的消耗量大,反应Ⅲ的ΔH<0,高温下反应的平衡常数小(反应正向进行程度小),CO2的生成量小,所以800℃下CO2平衡转化率远大于600℃下CO2平衡转化率。(3)①图2所示机理的步骤(i)中CO结合氧元素转化为二氧化碳,根据Cu、Ce两种元素的核外电子排布式可判断元素Cu、Ce化合价发生的变化为铜的化合价由+2变为+1价,铈的化合价由+4价变为+3价。②由于高温下,Cu(+2价)或Cu(+1价)被H2还原为金属Cu,所以当催化氧化温度超过150℃时,催化剂的催化活性下降。
答案:(1)吸收CO2,提高H2的产率,提供热量
(2) ①657.1kJ·mol-1 ②反应Ⅰ和反应Ⅱ的ΔH>0,高温下反应的平衡常数大(反应正向进行程度大),CO2的消耗量大,反应Ⅲ的ΔH<0,高温下反应的平衡常数小(反应正向进行程度小),CO2的生成量小
(3) ①铜的化合价由+2变为+1价,铈的化合价由+4价变为+3价 ②高温下,Cu(+2价)或Cu(+1价)被H2还原为金属Cu
【知能整合】
1.从化学反应速率、化学平衡的角度综合分析,选择与优化化工生产条件是高考命题的重要素材。
(1)化工生产适宜条件选择的一般原则
条件 原则
从化学反应速率分析 既不能过快,又不能过慢
从化学平衡移动分析 既要注意外界条件对反应速率和平衡影响的一致性,又要注意二者影响的矛盾性
从原料的利用率分析 增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本
从实际生产能力分析 如设备承受高温、高压能力等
从催化剂的使用活性分析 注意催化剂的活性温度对温度的限制
(2)平衡类问题需要考虑的几个方面
①原料的来源、除杂,尤其考虑杂质对平衡的影响。
②原料的循环利用。
③产物的污染处理。
④产物的酸碱性对反应的影响。
⑤气体产物的压强对平衡造成的影响。
⑥改变外界条件对多平衡体系的影响。
2.新情境下陌生电极反应式的书写方法:
(1)先区分原电池还是电解池再定电极;
(2)书写电极反应式,要考虑介质与放电生成的离子能否大量;
(3)也可以根据题目所给的总方程式,与其中一电极式相减即得另一电极反应式。
【体系再构】
【巩固练习】
基础训练
1.(2023·盐城三模)碳酸二甲酯()简称为DMC,是一种环保性能优异、用途广泛的化工原料。工业上用CO2与H2催化合成甲醇,由甲醇制备DMC。
(1)合成甲醇相关的热化学方程式如下:
反应Ⅰ:CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-49.2 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)===CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
①反应CO(g)+2H2(g)===CH3OH(g) ΔH=________ kJ·mol-1。
②将物质的量之比为1∶3的CO2与H2通入恒容密闭容器中进行反应,随着压强的增大,CO的选择性________(填“增大”或“减小”)
从平衡移动的角度分析,其可能的原因是__________________________ 。
③向合成甲醇的体系中加入少量Al2O3,单位时间内甲醇的选择性提高,其原因是__________________________。
(2)工业上以CH3OH作反应物和溶剂,电解碳酸1,2 丙二酯()、四乙基碘化铵(TEAI,提供I)和CH3OH混合液制备DMC。为探究反应机理,设计如下三个对比实验:
实验I:10 mL CH3OH+0.117 mol·L-1碳酸1,2 丙二酯,蒸馏,没有DMC生成。
实验II:10 mL CH3OH+0.117 mol·L-1碳酸1,2 丙二酯+0.1 mol·L-1TEAI,蒸馏,DMC产率7.5%。
实验III:10 mL CH3OH+0.117 mol·L-1碳酸1,2 丙二酯+0.1 mol·L-1TEAI,Cu为阴极、石墨为阳极,通电,DMC产率82.3%。
电催化酯交换法合成碳酸二甲酯的机理如图:
注:代表微粒带负电荷。
①阴极电极反应式为__________________________________________。
②I在反应过程中的机理可描述为_____________________________________。
【巩固练习】答案
1.(1)①-90.4
②减小 反应Ⅰ的正反应方向是气体分子数减小的反应,增大压强,平衡正向移动,CO2的平衡转化率增大,CH3OH的选择性提高,CO的选择性降低;反应Ⅱ是反应前后气体分子数不变的反应,受反应Ⅰ的影响,平衡逆向移动,CH3OH的选择性提高,CO的选择性降低
③Al2O3能降低反应Ⅰ的活化能,进而提高甲醇的选择性
(2)①2CH3OH+2e-===2CH3O-+H2↑
②O的电负性大于C,在碳酸1,2 丙二酯的分子中,酯基碳原子带有部分正电荷,受到体系中I进攻,碳氧双键断裂,酯基氧所带的负电荷离去,恢复碳氧双键;CH3O进攻酯基中的碳原子,I离去,恢复碳氧双键
拓展训练
2.CH4与CO2重整生成H2和CO的过程中主要发生下列反应
CH4(g)+CO2(g)===2H2(g)+2CO(g) ΔH=+247.1 kJ·mol-1
H2(g)+CO2(g)===H2O(g)+CO(g) ΔH=+41.2 kJ·mol-1
在恒压、反应物起始物质的量比n(CH4)∶n(CO2)=1∶1条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。
下列有关说法正确的是
A.升高温度、增大压强均有利于提高CH4的平衡转化率
B.曲线A表示CH4的平衡转化率随温度的变化
C.相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D.恒压、800 K、n(CH4)∶n(CO2)=1∶1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
3.(2023·扬州考前调研)烟气中的NOx是大气的主要污染物之一,NOx的吸收处理是当前研究的热点。
(1)还原吸收法
方法1:直接使用尿素[CO(NH2)2]溶液吸收烟气中的NOx。
方法2:先用合适的氧化剂将NOx中的NO氧化为NO2,再用CO(NH2)2溶液去还原吸收。
还原吸收等量的NOx,消耗尿素较多的是________(填“方法1”或“方法2”)。工业上选择方法2处理NOx的原因是_____________________________________。
(2)水吸收法
NO2和N2O4均能被水吸收,不同初始压强下,NO2和N2O4的混合气体被水吸收前和吸收达到平衡后,气体中NO2和N2O4的体积分数如图所示。混合气体中与水反应的主要成分是________。达到平衡后,气体中的NO2和N2O4的体积分数之和远小于100%,原因是____________________________________。
(3)配合物吸收法
钴氨配合物吸收NO的主要原理如下。
已知:[Co(NH3)6]2+对NO的配合能力很强,而[Co(NH3)6]3+对NO的配合能力极低。
①与NO反应的[Co(NH3)6]2+和与O2反应的[Co(NH3)6]2+的物质的量之比为________。
②钴氨溶液经过多次循环吸收NO后,其吸收NO的能力会降低,为了恢复钴氨溶液吸收NO的能力,需采取的方法是_________________________。
(4)NO与O2在某催化剂表面反应生成NO2的过程中,O2在催化剂表面能形成被吸附的O(用O-Site表示),接下来的机理可能有两种:
机理1:NO(g)+O SiteNO2-Site
机理2:NO-Site+O-SiteSite+NO2-Site
上述两个反应均为基元反应。保持温度和NO的浓度不变,测得NO与O2在该催化剂作用下反应的初始速率与O2浓度的关系如图所示。能合理解释图中曲线变化的机理为______________________(填“机理1”或“机理2”);判断的依据是__________________________________________________。
【拓展训练】答案:
2.D
3.(1)方法2 NO2在水中溶解度好,与尿素溶液反应速率快;NO2的氧化性强于NO
(2)N2O4 NO2和N2O4与水反应后生成了NO
(3)①1∶2 ②将[Co(NH3)6]3+还原为[Co(NH3)6]2+
(4)机理2 机理2认为反应速率与O吸附量和NO吸附量有关;O2浓度较小时,增加c(O2),O吸附量增大,反应速率加快;O
【课后作业】
1.肼(N2H4)在不同条件下分解产物不同,200 ℃时在Cu表面分解的机理如图1。
已知200 ℃时:
反应Ⅰ:3N2H4(g)===N2(g)+4NH3(g) ΔHl=-32.9 kJ·mol-1
反应Ⅱ: N2H4(g)+H2(g)===2NH3(g) ΔH2=-41.8 kJ·mol-1,下列说法不正确的是
A.图1所示过程①、②都是放热反应
B.反应Ⅱ的能量过程示意图如图2所示
C.断开3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为:
N2H4(g)===N2(g)+2H2 (g) ΔH=50.7 kJ·mol-1
2.我国科研人员提出了以Ni/Al2O3为催化剂,由CO2和H2转化为产品CH4的反应历程,其示意图如下:
下列说法不正确的是
A.总反应方程式为:CO2+4H2===CH4+2H2O
B.催化剂可有效提高反应物的平衡转化率
C.反应历程中,H—H键与C==O键断裂吸收能量
D.反应过程中,催化剂参与反应,改变反应路径,降低反应的活化能
3.在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
A.反应2NO(g)+O2(g) ===2NO2(g)的ΔH>0
B.图中X点所示条件下,延长反应时间不能提高NO转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D.380℃下,c起始(O2)=5.0×10 4 mol·L 1,NO平衡转化率为50%,则平衡常数K >2000
4.N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为 。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH =2NO+H2O 2NO2+2OH =NO+NO+H2O
①下列措施能提高尾气中NO和NO2去除率的有 (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中含有的主要杂质是 (填化学式);吸收后排放的尾气中含量较高的氮氧化物是 (填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl 和NO,其离子方程式为 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是 。
5.煤的燃烧排放的SO2、CO严重影响人们的生活质量。减少污染物的排放、研究SO2、CO等大气污染气体的综合利用具有重要意义。
Ⅰ. 燃煤脱硫技术是减少CO和SO2排放的常用方法之一。燃煤脱硫时常发生如下两个反应:
①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-l
②CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g) ΔH2=-394.0 kJ·mol-l
(1)某温度下在一体积恒定的密闭容器中若只发生反应①,下列不能说明该反应达到平衡状态的是 (填字母)。
A.容器内气体总压强不再变化
B.单位时间内生成1 mol SO2的同时消耗1 mol CO
C.混合气体的密度不再变化
D.混合气体的平均摩尔质量不再变化
(2)某科研小组研究起始一氧化碳物质的量、温度(T)对反应②的影响,实验结果如左图所示。
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是 。
②图像中T2 (填“>”、“<”、“=”或“无法确定”)T1,判断的理由是 。
Ⅱ. 氧化锌吸收法也能减少SO2的排放。配制ZnO悬浊液(含少量MgO、CaO),在吸收塔中封闭循环脱硫,发生的主要反应为ZnO+SO2ZnSO3(s),测得pH、吸收效率η随时间t的变化如右图所示。为提高SO2的吸收效率η, 可采取的措施为 (填字母)。
A.增大悬浊液中ZnO的量
B.适当提高单位时间内烟气的循环次数
C.调节溶液的pH至6.0以下
6.脱硫脱氮技术是环境科学研究的热点。
(1)某实验小组模拟O3氧化并结合(NH4)2SO3溶液吸收法,同时脱除SO2和NO的过程示意图如图。
已知气体反应器中主要发生如下反应(K为25 ℃下平衡常数、E为活化能):
Ⅰ. 2O3(g)===3O2(g) ΔH1=-286.6 kJ·mol-1、K1=1.6×1057、E1=24.6 kJ·mol-1
Ⅱ. NO(g)+O3(g)===NO2(g)+O2(g) ΔH2=-200.9 kJ·mol-1、K2=6.2×1034、E2=3.17 kJ·mol-1
III. SO2(g)+O3(g)===SO3(g)+O2(g) ΔH3=-241.6 kJ·mol-1、K3=1.1×1041、E3=58.17 kJ·mol-1
①其他条件不变时,温度高于150 ℃,在相同时间内SO2和NO的转化率均随温度升高而降低,原因是 。
②其他条件不变,SO2和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内SO2和NO的转化率随O3的浓度的变化关系如图1所示。NO的转化率始终高于SO2的原因是______________________________。
③从检测装置1中排出的气体经如图2所示的(NH4)2SO3溶液吸收器吸收,NO2被还原成NO。该喷淋吸收塔装置的优点是____________________________ 。
④其他条件不变,SO2和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,O3与NO的物质的量之比对SO2和NO脱除率的影响如图3所示。O3的浓度很低时,SO2的脱除率超过97%,其原因是__________________________。
(2)科研人员研究发现厌氧氨氧化生物酶体系可以促进H+和电子的转移(如a、b和c),能将废水中的NO转化为N2进入大气层,其反应过程如图4所示。
①请结合反应方程式,描述上述转化的具体过程: 。
②若废水中存在一定浓度的O2时,则上述转化无法发生,其可能原因是______。
【课后作业】答案
1.A 2.B 3.D
4.(1)2NH3+2O2N2O+3H2O
(2)①BC ②NaNO3 NO
(3)①3HClO+2NO+H2O===3Cl +2NO+5H+
②溶液pH越小,溶液中HClO的浓度越大,氧化NO的能力越强
5.I(1)B
(2)①c
②> 该反应为放热反应,升高温度平衡向逆反应方向移动,CO2体积分数降低,故T2>T1
II AB
6.(1)
①高于150℃,温度升高,反应Ⅰ的速率增大,c(O2)减小,反应Ⅱ、Ⅲ的速率减小,导致SO2和NO的转化率均降低
②反应Ⅱ的活化能小于反应Ⅲ,反应Ⅱ的速率大于反应Ⅲ,因此NO的转化率高于SO2
③增大气液接触面积,提高吸收效率
④(NH4)2SO3溶液直接与SO2反应是脱除SO2的主要原因
(2)
①反应Ⅲ:N2H4-4e-===N2↑+4H+,此反应产生4个H+和4个电子,通过生物酶转移,参与反应Ⅰ和反应Ⅱ,反应Ⅰ:NO+2H++e-===H2O+NO↑,反应消耗2个H+和1个电子,反应Ⅱ:NO+NH+2H++3e-===N2H4+H2O,消耗2个H+和3个电子(总反应为NO+NH===N2↑+2H2O)
②O2氧化NO(或NO)使反应终止,厌氧氨氧化酶在有氧条件下失去活性
半透膜
图—2
同课章节目录
