安徽省六安第二中学河西校区2023-2024学年高一下学期6月期末考试化学试题(无答案)
文档属性
| 名称 | 安徽省六安第二中学河西校区2023-2024学年高一下学期6月期末考试化学试题(无答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-30 08:08:09 | ||
图片预览


文档简介
六安第二中学河西校区2023-2024学年高一下学期6月期末考试
化学试卷
时间:75分钟 分值:100分
注意事项:
1、考生务必将自己的姓名、考生号、考试科目涂写在答题卡上。
2、每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号、不能答在试题卷上。
3.请按照题号在各题的答题区域(黑色线框)内作答,超出答题区域书写的答案无效。
4.保持答题卡卷面清洁,不折叠,不破损。
可能用到的相对原子质量:H-1 C-12 O-16 Fe-56 Cu-64 Ag-108
一、单项选择题:本大题共14小题,每题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的,请将正确的选项填涂在答题卡上。
1.下列有关化学用语的表述正确的是( )
A.乙烯的结构简式: B.乙醇的分子式:
C.的电子式: D.乙酸的分子结构球棍模型:
2.不属于氮的固定的是( )
A.根瘤菌把氮气转化为氨 B.氮气和氢气在适宜条件下合成氨
C.镁在氮气中燃烧 D.工业上用氨和二氧化碳合成尿素
3.下列有关有机化合物的组成、性质的说法,正确的是( )
A.水煤气、液化石油气的成分相同
B.葡萄糖、淀粉和乙酸乙酯在一定条件下都能发生水解反应
C.淀粉、蛋白质均属于高分子化合物,而油脂不属于高分子化合物
D.石油的裂解是化学变化,而石油的分馏和煤的干馏都是物理变化
4.下列实验操作对应的现象和根据现象得出的结论均正确的是( )
实验操作 现象 结论
A 在酸性高酸钾溶液中通入过量 溶液褪色 具有还原性
B 碳和浓硫酸加热所得气体产物依次通过品红溶液和澄清石灰水 溶液褪色 气体产物中含有和
C 向溶液X中加入少量稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 试纸未变蓝色 溶液X不含
D 足量的铜和浓硝酸反应,反应停止后,往溶液中加入稀硫酸 溶液继续有气泡产生 铜和稀硫酸反应生成
5.电子表所用的组扣电池的两极材料为锌和氧化银,电解质溶液为溶液,电池反应为,下列判断正确的是( )
A.锌为负极,被还原
B.为正极,发生氧化反应
C.纽扣电池工作时,电子从极经电路流向锌极
D.纽扣电池工作时,负极附近溶液的pH减小
6.研究表明,在一定条件下,与发生互变反应的能量变化如图所示,下列说法正确的是( )
注:表示或
A.表示
B.该条件下,比更稳定
C.转化为放出59.3kJ的能量
D.断开中所有的化学键需要吸收的能量为127.2kJ
7.乙醇分子结构中各种化学键如图所示,下列对乙醇的有关说法不正确的是( )
A.与金属钠反应时断裂①键 B.乙醇燃烧时所有的键都断
C.乙醇在铜催化下和氧气反应时键①和③断裂 D.乙醇和乙酸、浓硫酸共热时键②断裂
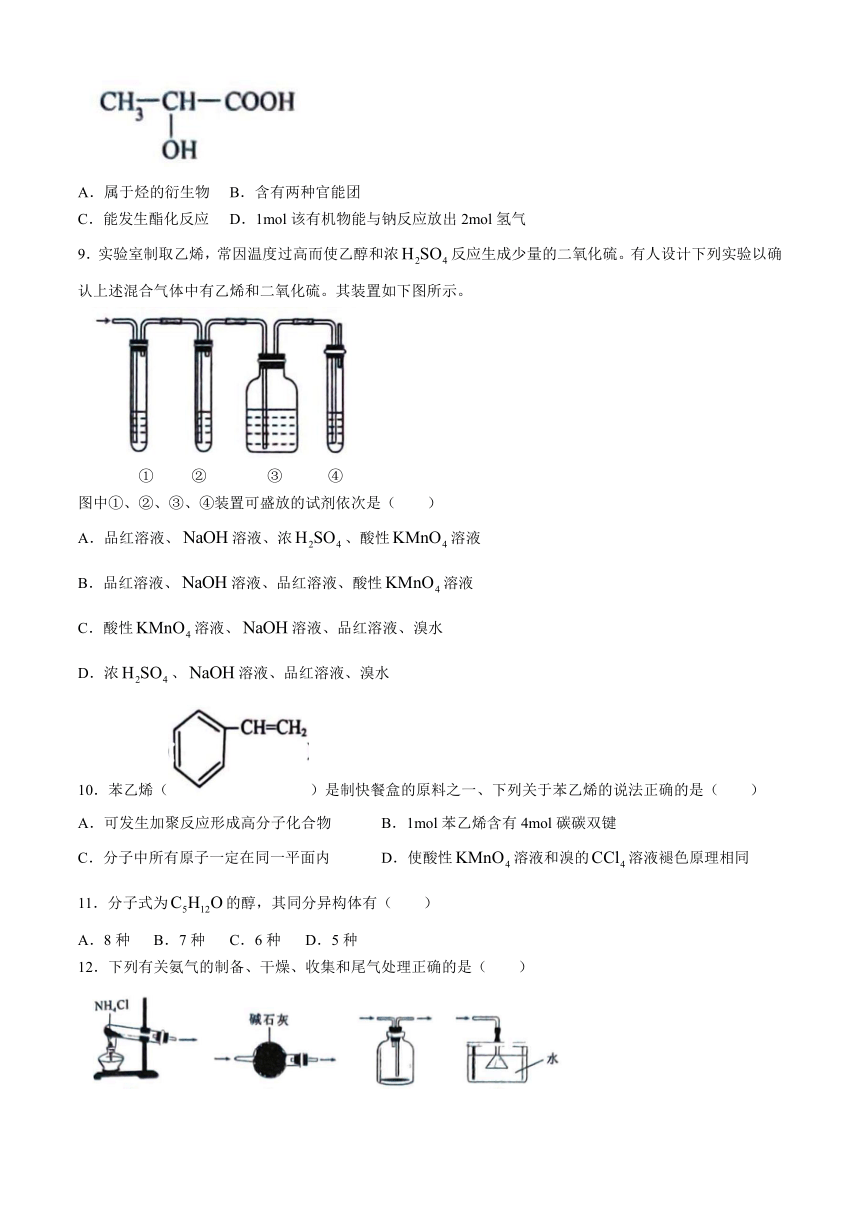
8.高强度运动会导致肌肉乳酸堆积,产生酸痛感。已知乳酸的结构简式如图所示,关于该有机物的说法错误的是( )
A.属于烃的衍生物 B.含有两种官能团
C.能发生酯化反应 D.1mol该有机物能与钠反应放出2mol氢气
9.实验室制取乙烯,常因温度过高而使乙醇和浓反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。其装置如下图所示。
① ② ③ ④
图中①、②、③、④装置可盛放的试剂依次是( )
A.品红溶液、溶液、浓、酸性溶液
B.品红溶液、溶液、品红溶液、酸性溶液
C.酸性溶液、溶液、品红溶液、溴水
D.浓、溶液、品红溶液、溴水
10.苯乙烯()是制快餐盒的原料之一、下列关于苯乙烯的说法正确的是( )
A.可发生加聚反应形成高分子化合物 B.1mol苯乙烯含有4mol碳碳双键
C.分子中所有原子一定在同一平面内 D.使酸性溶液和溴的溶液褪色原理相同
11.分子式为的醇,其同分异构体有( )
A.8种 B.7种 C.6种 D.5种
12.下列有关氨气的制备、干燥、收集和尾气处理正确的是( )
甲 乙 丙 丁
A.图甲:实验室制氨气 B.图乙:干燥氨气
C.图丙:收集氨气 D.图丁:尾气处理
13.下列说法正确的是( )
A.与一定互为同系物
B.与互为同分异构体
C.有2种不同的结构
D.和为不同种物质
14.足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和(忽略向的转化)、的混合气体3.36L(已折算成标准状况),这些气体与一定体积的氧气混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入2mol/L氢氧化钠溶液至铜离子恰好完全沉淀时消耗氢氧化钠溶液的体积是150mL。下列说法不正确的是( )
A.混合气体中含和的体积之比为1:1 B.标况下消耗氧气的体积为1.58L
C.此反应过程中转移的电子为0.3mol D.原浓硝酸含溶质的物质的量为0.45mol
二、填空题:本大题共4小题,每空2分,共58分。
15.S、N及其化合物在生产、生活中有重要应用。回答下列问题:
(1)某实验小组设计的制取并验证部分性质的实验装置(夹持装置已省略)如图所示。
①写出装置A中发生反应的化学方程式:________。若生成标准状况下,被还原的的物质的量为________mol。
②装置C、D中溶液均褪色,体现的性质依次是________、________。
(2)以为原料生产部分化工产品的流程如图所示:
①反应Ⅰ中若足量,反应的离子方程式为________。
②物质B的化学式为________。以为原料制取B(假定其中N元素完全转化至B中),理论上反应Ⅱ、Ⅲ需要消耗的物质的量共________mol。
③反应Ⅳ中需要先向饱和食盐水中通入________(填化学式),若D的焰色试验呈黄色,写出反应Ⅴ的化学方程式:________。
16.完成下列填空。
(1)温度一定,在一个2L的恒容密闭容器中,A、B、C三种气体物质的浓度随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
①该反应的化学方程式为________。从开始到平衡时C的反应速率为________,A的转化率为________。
②下列叙述能说明该反应已达到化学平衡状态的是________(填序号)。
A.A与C的浓度相等
B.相同时间内消耗,同时生成
C.混合气体的总质量不随时间的变化而变化
D.混合气体的密度不再发生变化
E.混合气体的压强不再发生变化
(2)“乙醇燃料电池”的工作原理为,装置如图所示。
①在该电池中的移动方向为由________(填“A到B”或“B到A”)。写出A电极的电极反应式:________。
②若标况下有参与反应,理论上通过质子交换膜的数目为________。
17.目前世界上60%的镁是从海水中提取的,下面是提取镁的流程图:
其中,的熔点为2800℃,的熔点为712℃
(1)从海水中获取淡水最常用的方法是________。
(2)操作A是________,试剂a为________(填化学式)。
(3)由无水制取金属镁的化学方程式为________。
(4)下列试剂中,能用于检验氯化镁中是否含水的是:________(填选项)。
A. B.无水硫酸铜 C.浓硫酸
18.A是一种重要的有机化工原料,其产量通常用来衡量一个国家的石油化学工业发展水平,通过一系列化学反应,可以制得成千上万种有用的物质。结合下图物质间转化关系回答问题。
(1)A结构简式为________。
(2)①的反应类型为________,E中的官能团名称是________。
(3)高分子化合物G是一种常见的合成纤维——丙纶,其结构简式为________。
(4)B→X的化学方程式为________。
(5)写出步骤②的化学方程式:________。
(6)与足量的金属完全反应,生成标准状况下氢气的体积为________L。
(7)写出E与发生加成反应所有产物的结构简式:________。
化学试卷
时间:75分钟 分值:100分
注意事项:
1、考生务必将自己的姓名、考生号、考试科目涂写在答题卡上。
2、每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号、不能答在试题卷上。
3.请按照题号在各题的答题区域(黑色线框)内作答,超出答题区域书写的答案无效。
4.保持答题卡卷面清洁,不折叠,不破损。
可能用到的相对原子质量:H-1 C-12 O-16 Fe-56 Cu-64 Ag-108
一、单项选择题:本大题共14小题,每题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的,请将正确的选项填涂在答题卡上。
1.下列有关化学用语的表述正确的是( )
A.乙烯的结构简式: B.乙醇的分子式:
C.的电子式: D.乙酸的分子结构球棍模型:
2.不属于氮的固定的是( )
A.根瘤菌把氮气转化为氨 B.氮气和氢气在适宜条件下合成氨
C.镁在氮气中燃烧 D.工业上用氨和二氧化碳合成尿素
3.下列有关有机化合物的组成、性质的说法,正确的是( )
A.水煤气、液化石油气的成分相同
B.葡萄糖、淀粉和乙酸乙酯在一定条件下都能发生水解反应
C.淀粉、蛋白质均属于高分子化合物,而油脂不属于高分子化合物
D.石油的裂解是化学变化,而石油的分馏和煤的干馏都是物理变化
4.下列实验操作对应的现象和根据现象得出的结论均正确的是( )
实验操作 现象 结论
A 在酸性高酸钾溶液中通入过量 溶液褪色 具有还原性
B 碳和浓硫酸加热所得气体产物依次通过品红溶液和澄清石灰水 溶液褪色 气体产物中含有和
C 向溶液X中加入少量稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 试纸未变蓝色 溶液X不含
D 足量的铜和浓硝酸反应,反应停止后,往溶液中加入稀硫酸 溶液继续有气泡产生 铜和稀硫酸反应生成
5.电子表所用的组扣电池的两极材料为锌和氧化银,电解质溶液为溶液,电池反应为,下列判断正确的是( )
A.锌为负极,被还原
B.为正极,发生氧化反应
C.纽扣电池工作时,电子从极经电路流向锌极
D.纽扣电池工作时,负极附近溶液的pH减小
6.研究表明,在一定条件下,与发生互变反应的能量变化如图所示,下列说法正确的是( )
注:表示或
A.表示
B.该条件下,比更稳定
C.转化为放出59.3kJ的能量
D.断开中所有的化学键需要吸收的能量为127.2kJ
7.乙醇分子结构中各种化学键如图所示,下列对乙醇的有关说法不正确的是( )
A.与金属钠反应时断裂①键 B.乙醇燃烧时所有的键都断
C.乙醇在铜催化下和氧气反应时键①和③断裂 D.乙醇和乙酸、浓硫酸共热时键②断裂
8.高强度运动会导致肌肉乳酸堆积,产生酸痛感。已知乳酸的结构简式如图所示,关于该有机物的说法错误的是( )
A.属于烃的衍生物 B.含有两种官能团
C.能发生酯化反应 D.1mol该有机物能与钠反应放出2mol氢气
9.实验室制取乙烯,常因温度过高而使乙醇和浓反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。其装置如下图所示。
① ② ③ ④
图中①、②、③、④装置可盛放的试剂依次是( )
A.品红溶液、溶液、浓、酸性溶液
B.品红溶液、溶液、品红溶液、酸性溶液
C.酸性溶液、溶液、品红溶液、溴水
D.浓、溶液、品红溶液、溴水
10.苯乙烯()是制快餐盒的原料之一、下列关于苯乙烯的说法正确的是( )
A.可发生加聚反应形成高分子化合物 B.1mol苯乙烯含有4mol碳碳双键
C.分子中所有原子一定在同一平面内 D.使酸性溶液和溴的溶液褪色原理相同
11.分子式为的醇,其同分异构体有( )
A.8种 B.7种 C.6种 D.5种
12.下列有关氨气的制备、干燥、收集和尾气处理正确的是( )
甲 乙 丙 丁
A.图甲:实验室制氨气 B.图乙:干燥氨气
C.图丙:收集氨气 D.图丁:尾气处理
13.下列说法正确的是( )
A.与一定互为同系物
B.与互为同分异构体
C.有2种不同的结构
D.和为不同种物质
14.足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和(忽略向的转化)、的混合气体3.36L(已折算成标准状况),这些气体与一定体积的氧气混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入2mol/L氢氧化钠溶液至铜离子恰好完全沉淀时消耗氢氧化钠溶液的体积是150mL。下列说法不正确的是( )
A.混合气体中含和的体积之比为1:1 B.标况下消耗氧气的体积为1.58L
C.此反应过程中转移的电子为0.3mol D.原浓硝酸含溶质的物质的量为0.45mol
二、填空题:本大题共4小题,每空2分,共58分。
15.S、N及其化合物在生产、生活中有重要应用。回答下列问题:
(1)某实验小组设计的制取并验证部分性质的实验装置(夹持装置已省略)如图所示。
①写出装置A中发生反应的化学方程式:________。若生成标准状况下,被还原的的物质的量为________mol。
②装置C、D中溶液均褪色,体现的性质依次是________、________。
(2)以为原料生产部分化工产品的流程如图所示:
①反应Ⅰ中若足量,反应的离子方程式为________。
②物质B的化学式为________。以为原料制取B(假定其中N元素完全转化至B中),理论上反应Ⅱ、Ⅲ需要消耗的物质的量共________mol。
③反应Ⅳ中需要先向饱和食盐水中通入________(填化学式),若D的焰色试验呈黄色,写出反应Ⅴ的化学方程式:________。
16.完成下列填空。
(1)温度一定,在一个2L的恒容密闭容器中,A、B、C三种气体物质的浓度随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
①该反应的化学方程式为________。从开始到平衡时C的反应速率为________,A的转化率为________。
②下列叙述能说明该反应已达到化学平衡状态的是________(填序号)。
A.A与C的浓度相等
B.相同时间内消耗,同时生成
C.混合气体的总质量不随时间的变化而变化
D.混合气体的密度不再发生变化
E.混合气体的压强不再发生变化
(2)“乙醇燃料电池”的工作原理为,装置如图所示。
①在该电池中的移动方向为由________(填“A到B”或“B到A”)。写出A电极的电极反应式:________。
②若标况下有参与反应,理论上通过质子交换膜的数目为________。
17.目前世界上60%的镁是从海水中提取的,下面是提取镁的流程图:
其中,的熔点为2800℃,的熔点为712℃
(1)从海水中获取淡水最常用的方法是________。
(2)操作A是________,试剂a为________(填化学式)。
(3)由无水制取金属镁的化学方程式为________。
(4)下列试剂中,能用于检验氯化镁中是否含水的是:________(填选项)。
A. B.无水硫酸铜 C.浓硫酸
18.A是一种重要的有机化工原料,其产量通常用来衡量一个国家的石油化学工业发展水平,通过一系列化学反应,可以制得成千上万种有用的物质。结合下图物质间转化关系回答问题。
(1)A结构简式为________。
(2)①的反应类型为________,E中的官能团名称是________。
(3)高分子化合物G是一种常见的合成纤维——丙纶,其结构简式为________。
(4)B→X的化学方程式为________。
(5)写出步骤②的化学方程式:________。
(6)与足量的金属完全反应,生成标准状况下氢气的体积为________L。
(7)写出E与发生加成反应所有产物的结构简式:________。
同课章节目录
