2025届高三化学一轮专题复习讲义(15)-专题三第八讲 沉淀溶解平衡
文档属性
| 名称 | 2025届高三化学一轮专题复习讲义(15)-专题三第八讲 沉淀溶解平衡 |  | |
| 格式 | doc | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-30 08:35:06 | ||
图片预览



文档简介
2025届高三化学一轮专题复习讲义(15)
专题三 基本理论
3-8 沉淀溶解平衡(1课时)
【复习目标】
1.认识难溶电解质的沉淀溶解平衡的概念、特征和影响因素。
2.理解难溶电解质的沉淀溶解平衡在沉淀的生成、溶解、转化中的应用。
3.溶度积常数的概念、表达式及在计算中的应用。
【重点突破】
难溶电解质的沉淀溶解平衡在沉淀的生成、溶解、转化中的应用。
【真题再现】
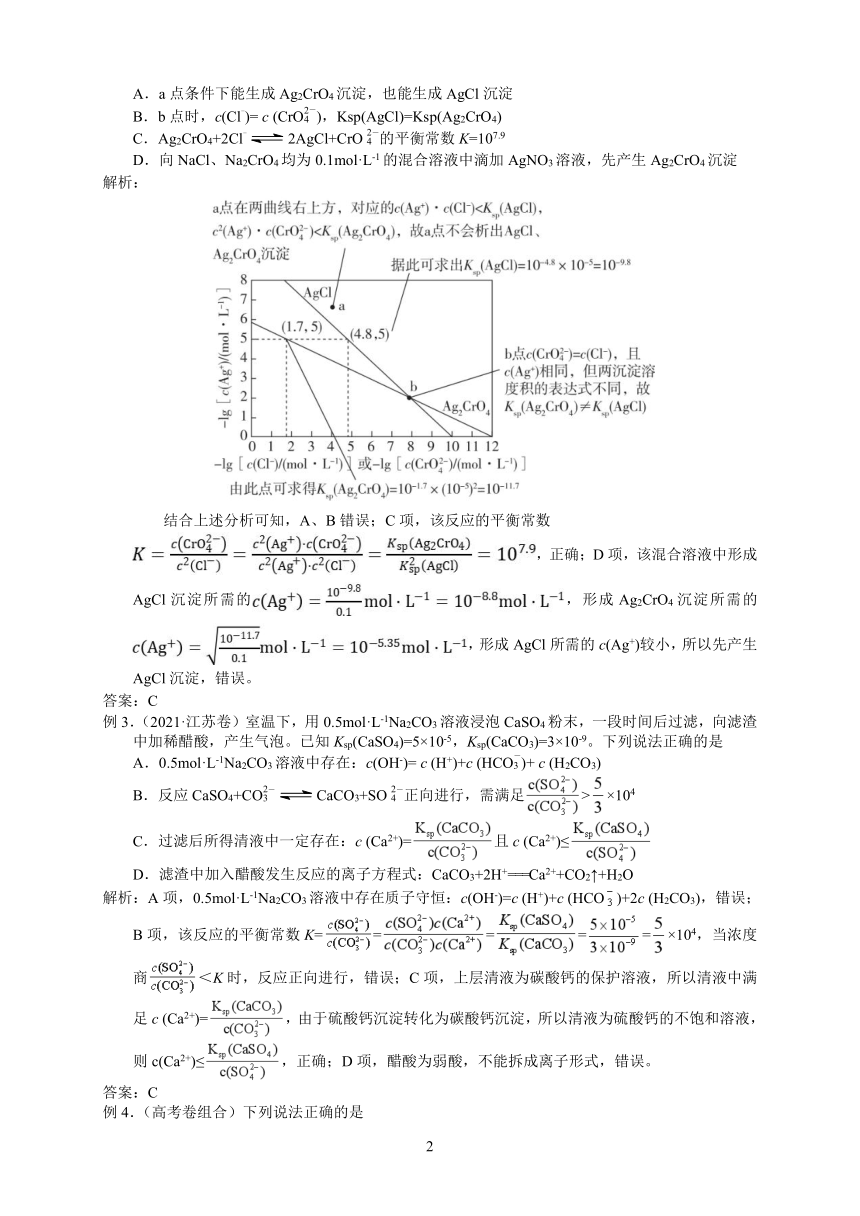
例1.(2023·全国甲卷)下图为Fe(OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的pM-pH
关系图(pM= -lg[c(M)/ ( mol·L-1);c(M) ≤10-5 mol·L-1 可认为M离子沉淀完全)。
下列叙述正确的是
A.由a 点可求得Ksp(Fe(OH)3)=10-8.5
B.pH=4时Al(OH)3的溶解度为mol·L-1
C.浓度均为0.01mol·L-1的Al3+和Fe3+可通过分步沉淀进行分离
D.Al3+、Cu2+混合溶液中c(Cu2+)=0.2mol·L-1时二者不会同时沉淀
解析:A项,a点pH=2、pM=2.5,则Ksp[Fe(OH)3]=c(Fe3+)·c3 (OH-)=10-2.5×(10-12)3=10-38.5, 错误;B项,pH=4时Al3+对应的pM=3,即c(Al3+)=10-3mol·L-1,故Al(OH)3的溶解度为10-3mol·L-1,错误;C项,由图可知,c(Fe3+)=10-5mol·L-1时的pH小于c(Al3+)=0.01mol·L-1 时的pH,则可通过调pH分步沉淀浓度均为0.01mol·L-1的Al3+和Fe3+,正确;D项,由题图可知,Al3+沉淀完全时,c(Al3+)≤10-5mol·L-1,pM≥5,此时pH≈4.7,此时Cu2+刚开始沉淀,浓度约为0.1mol·L-1,而题中c(Cu2+)=0.2mol·L-1>0.1mol·L-1,则Al3+、Cu2+会同时沉淀,错误。
答案:C
例2.(2023·全国乙卷)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是
A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B.b点时,c(Cl-)= c (CrO),Ksp(AgCl)=Ksp(Ag2CrO4)
C.Ag2CrO4+2Cl-2AgCl+CrO的平衡常数K=107.9
D.向NaCl、Na2CrO4均为0.1mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
解析:
结合上述分析可知,A、B错误;C项,该反应的平衡常数
,正确;D项,该混合溶液中形成AgCl沉淀所需的,形成Ag2CrO4沉淀所需的,形成AgCl所需的c(Ag+)较小,所以先产生AgCl沉淀,错误。
答案:C
例3.(2021·江苏卷)室温下,用0.5mol·L-1Na2CO3溶液浸泡CaSO4粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。已知Ksp(CaSO4)=5×10-5,Ksp(CaCO3)=3×10-9。下列说法正确的是
A.0.5mol·L-1Na2CO3溶液中存在:c(OH-)= c (H+)+c (HCO)+ c (H2CO3)
B.反应CaSO4+COCaCO3+SO正向进行,需满足>×104
C.过滤后所得清液中一定存在:c (Ca2+)=且c (Ca2+)≤
D.滤渣中加入醋酸发生反应的离子方程式:CaCO3+2H+===Ca2++CO2↑+H2O
解析:A项,0.5mol·L-1Na2CO3溶液中存在质子守恒:c(OH-)=c (H+)+c (HCO)+2c (H2CO3),错误;B项,该反应的平衡常数K=====×104,当浓度商<K时,反应正向进行,错误;C项,上层清液为碳酸钙的保护溶液,所以清液中满足c (Ca2+)=,由于硫酸钙沉淀转化为碳酸钙沉淀,所以清液为硫酸钙的不饱和溶液,则c(Ca2+)≤,正确;D项,醋酸为弱酸,不能拆成离子形式,错误。
答案:C
例4.(高考卷组合)下列说法正确的是
选项 实验 现象 结论
A 向2支盛有2mL相同浓度硝酸银溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 一支试管中产生黄色沉淀,另一支中无明显现象 Ksp(AgI)B 室温下,向浓度均为0.1mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液 出现白色沉淀 Ksp(BaSO4 )C 将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1 CuSO4溶液 先有白色沉淀生成,后变为浅蓝色沉淀 Cu(OH)2的溶度积比Mg(OH)2的大
D 将稀硫酸与Na2S反应产生的气体不断通入AgNO3与AgCl的浊液中 白色沉淀逐渐变为黑色沉淀 Ksp(AgCl)>Ksp(Ag2S)
解析:A项,根据题中描述可知黄色沉淀为AgI,另一支试管中无明显现象,说明没有AgCl析出,证明Ksp(AgI)答案:A
小结:在难溶电解质的饱和溶液中,溶解度小的沉淀会转化成溶解度更小的沉淀,但溶解度相差不大时,要注意浓度对平衡移动的影响。
【知能整合】
1.沉淀的生成
当溶液中离子积(Qc)大于溶度积(Ksp)时有沉淀生成。
(1)调节pH法:如除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至4左右,离子方程式为Fe3++3NH3·H2O===Fe(OH)3↓+3NH。
(2)沉淀剂法:如用H2S沉淀Cu2+,离子方程式为Cu2++H2S===CuS↓+2H+。
2.沉淀的溶解
当溶液中离子积(Qc)小于溶度积(Ksp)时,沉淀溶解。
(1)酸溶解:
用离子方程式表示CaCO3溶于盐酸:CaCO3+2H+===Ca2++CO2↑+H2O。
(2)盐溶解:
用离子方程式表示Mg(OH)2溶于NH4Cl溶液:Mg(OH)2+2NH===Mg2++2NH3·H2O。
(3)配位溶解:
用离子方程式表示AgCl溶于氨水:AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O。
(4)氧化还原溶解:如不溶于盐酸的硫化物Ag2S溶于稀HNO3。
3.沉淀的转化
在难溶电解质的饱和溶液中,溶解度小的沉淀会转化成溶解度更小的沉淀。
(1)实质:沉淀溶解平衡的移动。
(2)实例:AgNO3溶液AgClAgBr,则Ksp(AgCl)>Ksp(AgBr)。
(3)应用:
锅炉除垢:将CaSO4转化为CaCO3,离子方程式为CaSO4+CO===CaCO3+。
矿物转化:CuSO4溶液遇ZnS转化为CuS,离子方程式为ZnS+Cu2+===CuS+Zn2+。
【体系再构】
【随堂反馈】
基础训练
1.下列化学原理的应用,主要用沉淀溶解平衡原理解释的是
①热纯碱溶液的洗涤油污能力强
②误将钡盐[BaCl2、Ba(NO3)2]当作食盐混用后,常用0.5%的Na2SO4溶液解毒
③溶洞、珊瑚的形成
④碳酸钡不能作“钡餐”而硫酸钡则能
⑤泡沫灭火器灭火的原理
A.①②③ B.②③④ C.③④⑤ D.①②③④⑤
2.下列有关化学实验操作,现象和结论均为正确的是
选项 操作 现象 结论
A Mg2+和Cu2+共存的溶液中滴入适量NaOH溶液 产生白色沉淀 相同温度下,溶度积常数: Ksp[Mg(OH)2]B 向1mL2mol·L-1 NaOH溶液中先滴加2滴0.1mol·L-1 MgCl2溶液,再滴加2滴0.1 mol·L-1 FeCl3溶液,振荡 先生成白色沉淀,后生成红褐色沉淀 Ksp[Mg(OH)2]<Ksp[Fe(OH)3]
C 向浓度均为0.1mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 先出现蓝色沉淀 Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
D 分别向相同浓度的ZnSO4溶液和CuSO4溶液中通入H2S 前者无现象,后者有黑色沉淀生成 Ksp(CuS) > Ksp(ZnS)
3.某兴趣小组进行下列实验:
①将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1 NaOH溶液等体积混合得到浊液
②取少量①中浊液,滴加0.1 mol·L-1 FeCl3溶液,出现红褐色沉淀
③将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L-1 FeCl3溶液,白色沉淀变为红褐色沉淀
④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解
下列说法中不正确的是
A.将①中所得浊液过滤,所得滤液中含少量Mg2+
B.①中浊液中存在沉淀溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D.NH4Cl溶液中的NH可能是④中沉淀溶解的原因
4.25 ℃时,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,下列说法正确的是
A.在AgCl和Ag2CrO4共存的悬浊液中,
B.向Ag2CrO4悬浊液中加入NaCl浓溶液,Ag2CrO4不可能转化为AgCl
C.向AgCl饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Cl-)=c(Ag+)
D.向同浓度的Na2CrO4和NaCl混合溶液中滴加AgNO3溶液,AgCl先析出
5.在一混合溶液中含有KCl、KBr、K2CrO4,其浓度均为0.01 mol·L-1,向溶液中逐滴加入0.01 mol·L-1 AgNO3溶液时,最先和最后沉淀的物质分别是(已知:AgCl、AgBr、Ag2CrO4的Ksp分别为1.77×10-10、5.35×10-13、1.12×10-12)
A.AgBr、AgCl B.Ag2CrO4、AgCl C.AgBr、Ag2CrO4 D.同时沉淀
6.自然界中原生铜的硫化物经氧化、淋滤后变成CuSO4溶液,遇到闪锌矿(ZnS)可慢慢转变为铜蓝(CuS)。已知:Ksp(ZnS)=2×10-22,Ksp(CuS)=6×10-36。下列说法不正确的是
A.基态Cu+转化基态Cu2+,失去3d轨道上的电子
B.1个ZnS晶胞(如图)中含4个S2-
C.反应ZnS(s)+Cu2+(aq)CuS(s)+Zn2+(aq)正向进行,
需满足
D.生成铜蓝后的溶液中一定存在:c=且c<
拓展训练
7.为研究沉淀的生成及其转化,某小组进行如图实验。①中现象:产生红色沉淀,②中现象:溶液先浑浊,后来澄清,③中现象:产生白色沉淀。关于该实验的分析不正确的是
A.①浊液中存在平衡:Ag2CrO4(s)2Ag+(aq)+CrO(aq)
B.②中溶液变澄清的原因:AgOH+2NH3·H2O===[Ag(NH3)2]OH+2H2O
C.③中颜色变化说明有AgCl生成
D.该实验可以证明AgCl比Ag2CrO4更难溶
8.室温下,用饱和Na2CO3溶液浸泡BaSO4粉末,一段时间后过滤,向滤渣中加入盐酸,产生气泡。已知Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9。下列说法正确的是
A.Na2CO3饱和溶液中存在:c(OH-)=c(H+)+c(HCO)+c(H2CO3)
B.反应BaSO4(s)+CO(aq)BaCO3(s)+SO(aq)正向进行,需满足
C.过滤后所得的滤液中一定存在:c(Ba2+)=,且c(SO)>c(CO)
D.滤渣中加入盐酸发生反应的离子方程式:CO+2H+===CO2↑+H2O
9.已知:Ksp(FeS)=6×10-18,Ksp(CuS)=1×10-36。室温下,向CuSO4溶液中加入FeS粉末,一段时间后过滤,向滤渣中加入足量稀硫酸,固体部分溶解。下列说法正确的是
A.室温下,CuS的溶解度大于FeS
B.反应FeS(s)+Cu2+(aq)CuS(s)+Fe2+(aq)正向进行,需满足<6×1018
C.生成CuS后的溶液中一定存在:c(S2-)=,且c(S2-)>
D.滤渣中加入稀硫酸发生反应的离子方程式为CuS+2H+===Cu2++H2S↑
【随堂反馈】答案
1.B 2.C 3.C 4.D 5.C 6.D 7.D 8.B 9.B
【课后作业】
1.下列依据实验操作及现象所得出的结论正确的是
选项 实验操作 现象 结论
A 向浓度均为0.1mol·L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液 出现黄色沉淀 Ksp(AgCl)<Ksp(AgI)
B 向2mL0.01mol·L-1的AgNO3溶液中滴加几滴同浓度的NaCl溶液后,滴加 KI 溶液 先产生白色沉淀,后出现黄色沉淀 证明 Ksp(AgI)<Ksp(AgCl)
C 向10 mL 0.2 mol·L-1 ZnSO4溶液中加入10 mL 0.4 mol·L-1 Na2S溶液,再滴加CuSO4溶液 先产生白色沉淀,然后沉淀变黑 相同温度下,溶度积常数:Ksp(CuS)<Ksp(ZnS)
D 向盛有2mLNa2S的溶液加入过量ZnSO4溶液,再逐滴加入同浓度的CuSO4溶液 白色沉淀逐渐变为黑色固体 Ksp(CuS)E 向BaSO4固体中加入饱和Na2CO3溶液,过滤,沉淀洗净后加入足量稀盐酸 沉淀 部分溶解,且产生气泡 Ksp(BaSO4)>Ksp(BaCO3)
2.实验:①0.1 mol·L-1AgNO3溶液和 0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl转化为AgI
D.实验可以证明AgI比AgCl更难溶
3.硫酸锌是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,医药上用作催吐剂。已知25 ℃时,Ksp[Zn(OH)2]=1.0×10-17,Ksp(Ag2SO4)=1.2×10-5,下列说法正确的是
A.在水中加入少量ZnSO4固体时,水的电离平衡向正反应方向移动,Kw减小
B.ZnSO4溶液中:c(Zn2+)+ c (H+)= c (OH-)+ c (SO42-)
C.向0.5 L 0.02 mol·L-1 ZnSO4溶液中加入等体积等浓度的AgNO3溶液即可生成Ag2SO4沉淀
D.溶液中某离子的浓度低于1.0×10-5 mol·L-1时即可认为该离子被除尽,常温下要除去
0.2 mol·L-1 ZnSO4溶液中的Zn2+,至少要调节溶液的pH≥8
4.已知:①AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体;②室温下,Ksp(AgCl)=2.0×10-10,Ksp(Ag2S)=2.0×10-48。向AgCl的悬浊液中加入一定量的Na2S溶液并振荡,白色固体向黑色固体转化。下列说法正确的是
A.Na2S溶液中存在:
c(OH-)=c(H+)+c(HS-)+2c(S2-)
B.向AgCl悬浊液加入足量氨水,溶液变澄清。反应的离子方程式为
AgCl+4NH3·H2O===[Ag(NH3)4]++Cl-+4H2O
C.反应2AgCl+S2-Ag2S+2Cl-要正向进行,需满足<2×1028
D.将转化后的体系静置,上层清液中离子浓度存在关系:c(Ag+)=且
c(Ag+)=
5.常温下,向10 mL 0.1 mol·L-1 NaCl溶液和10 mL 0.1 mol·L-1K2CrO4溶液中分别滴加等物质的量浓度的AgNO3溶液,滴加过程中有关物理量的变化关系如图所示。下列说法正确的是
A.常温下Ksp(AgCl)的数量级为10-10
B.向c(Cl-)=c(CrO)=0.01 mol/L 的溶液中滴加AgNO3溶液,先得到Ag2CrO4沉淀
C.c点所示溶液中c(Ag+)≈1.3×10-6 mol/L
D.a、b两点存在沉淀的溶解平衡,而c点不存在此平衡
6.牙齿表面的矿物质Ca5(PO4)3OH可被CH3COOH溶解。向牙膏中添加NaHCO3、NaF均可增强护齿效果。已知:
CH3COOH H3PO4 Ca5(PO4)3OH Ca5(PO4)3F
Ka或Ksp 1.76×10-5 Ka1 7.52×10-3Ka3 2.2×10-13 8.0×10-30 4.0×10-60
下列说法正确的是
A.CH3COOH溶解Ca5(PO4)3OH的离子方程式为
Ca5(PO4)3OH+10CH3COOH===5Ca2++10CH3COO-+3H3PO4+H2O
B.比较0.1 mol·L-1 NaHCO3溶液和0.1 mol·L-1 NaF溶液中粒子浓度,存在
c(HCO3-)+2c(H2CO3)<c(HF)+c(F-)
C.当<5.0×10-31时,Ca5(PO4)3OH可与F-反应转化为Ca5(PO4)3F
D.0.001 mol·L-1 Na3PO4溶液中:c(Na+)>c(PO)>c(OH-)>c(H+)
7.室温下,已知Ksp(CuS)=8.8×10-36,饱和Cu(OH)2溶液中x=-lg与pH的关系如图所示。向0.1 mol·L-1 的Na2S溶液(pH=12.4)中加入一定量的CuSO4晶体。下列说法正确的是
A.室温下Ksp[Cu(OH)2]=2.2×10-18
B.加入CuSO4晶体时,先生成Cu(OH)2沉淀
C.室温下,CuS在等浓度的Na2S和H2S溶液中的Ksp相等
D.反应后的溶液中存在离子浓度关系:
c(Na+)+c(H+)+c(Cu2+)=c(S2-)+c(HS-)+c(OH-)+c(SO)
8.(1)沉淀除杂。向上述酸浸液中加入pH调节剂,再通入CO2得到MnCO3。酸浸液中Mn2+、Ca2+、Mg2+的浓度分别为0.9mol·L-1、2×10-5 mol·L-1、3×10-2 mol·L-1,若使酸浸液中Mn2+完全沉淀(离子浓度小于10-5 mol·L-1)与Ca2+、Mg2+分离,需控制溶液中c(CO)的范围为____
[Ksp(MnCO3)=2×10-11,Ksp(CaCO3)=3×10-9,Ksp(MgCO3)=6×10-6]。
(2)工业上经常利用硫酸亚铁处理含铬废水,向含有Cr2O的废水加入硫酸亚铁并调节pH使其转化为Cr(OH)3和Fe(OH)3除去,若处理后的废水中残留的c(Fe3+)=2.0×10 13 mol·L-1,则残留的Cr3+的浓度为________。(已知:Ksp[Fe(OH)3]=4.0×10 38,Ksp[Cr(OH)3]=6.0×10 31)
(3)调pH:向酸浸、还原所得滤液中加入MnCO3固体,调节溶液的pH,过滤。若要使Fe3+和Al3+沉淀完全,则需调节溶液的pH最小值为_____________(已知溶液中金属离子的物质的量浓度≤10-5 mol·L-1时可以看成沉淀完全,Ksp[Fe(OH)3]=1×10-37.4,Ksp[Al(OH)3]=1×10-33)。
(4)充分沉淀后测得废水中F-的含量为9.5 mg·L-1,此时SO的浓度为__________ mol·L-1 [已知:Ksp(CaSO4)=5.0×10-5、Ksp(CaF2)=5.0×10-9]。
(5)除镁、钙时,通常向溶液中加入一定量NaF溶液,充分反应后过滤。
①已知常温下:Ksp(CaF2)=2.7×10-11,Ksp(MgF2)=6.4×10-9。
则反应CaF2(s)+Mg2+(aq)MgF2(s)+Ca2+(aq)的平衡常数为K=________。
②除镁、钙时,溶液的pH过低会导致Ca2+、Mg2+沉淀不完全,原因是______________。
9.废旧铅蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和 Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表:
难溶电解质 PbSO4 PbCO3 BaSO4 BaCO3
Ksp 2.5×10-8 7.4×10-14 1.1×10-10 2.6×10-9
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
金属氢氧化物 Fe(OH)3 Fe(OH)2 Al(OH)3 Pb(OH)2
开始沉淀的pH 2.3 6.8 3.5 7.2
完全沉淀的pH 3.2 8.3 4.6 9.1
回答下列问题:
(1)在“脱硫”中PbSO4转化反应的离子方程式为 ,用沉淀溶解平衡原理解释选择NaCO3的原因 。
(2)在“脱硫”中,加入NaCO3不能使铅膏中BaSO4完全转化,原因是 。
(3)在“酸浸”中,除加入醋酸(HAc),还要加入H2O2。
ⅰ.能被H2O2氧化的离子是 ;
ⅱ.H2O2促进了金属Pb在醋酸中转化为Pb(Ac)2,其化学方程式为 ;
ⅲ.H2O2也能使PbO2转化为Pb(Ac)2,H2O2的作用是 。
(4)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是 。
(5)“沉铅”的滤液中,金属离子有 。
【课后作业】答案
1.D 2.B 3.D 4.C 5.A 6.D 7.C
8.(1)2×10-6~1.5×10-4 mol·L-1
(2)3.0×10-6 mol·L-1
(3)4.7
(4)0.0025
(5)①4.2×10-3
②pH过低时,H+浓度较大,会与F-反应生成HF,导致Ca2+、Mg2+沉淀不完全
9.
(1)PbSO4(s)+CO(aq)=== PbCO3(s)+SO(aq) 反应PbSO4(s)+CO(aq)=== PbCO3(s)+SO(aq)的平衡常数K=eq \f(c SO , c CO )q \f(c SO , c CO )=3.4105>105,PbSO4可以比较彻底的转化为PbCO3
(2)反应BaSO4(s)+CO(aq)= BaCO3(s)+SO(aq)的平衡常数K=eq \f(c SO , c CO )=0.04<<105,反应正向进行的程度有限
(3)Fe2+ Pb+H2O2+2HAc===Pb(Ac)2+2H2O 作还原剂
(4)Fe(OH)3、Al(OH)3
(5)Ba2+、Na+
8
专题三 基本理论
3-8 沉淀溶解平衡(1课时)
【复习目标】
1.认识难溶电解质的沉淀溶解平衡的概念、特征和影响因素。
2.理解难溶电解质的沉淀溶解平衡在沉淀的生成、溶解、转化中的应用。
3.溶度积常数的概念、表达式及在计算中的应用。
【重点突破】
难溶电解质的沉淀溶解平衡在沉淀的生成、溶解、转化中的应用。
【真题再现】
例1.(2023·全国甲卷)下图为Fe(OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的pM-pH
关系图(pM= -lg[c(M)/ ( mol·L-1);c(M) ≤10-5 mol·L-1 可认为M离子沉淀完全)。
下列叙述正确的是
A.由a 点可求得Ksp(Fe(OH)3)=10-8.5
B.pH=4时Al(OH)3的溶解度为mol·L-1
C.浓度均为0.01mol·L-1的Al3+和Fe3+可通过分步沉淀进行分离
D.Al3+、Cu2+混合溶液中c(Cu2+)=0.2mol·L-1时二者不会同时沉淀
解析:A项,a点pH=2、pM=2.5,则Ksp[Fe(OH)3]=c(Fe3+)·c3 (OH-)=10-2.5×(10-12)3=10-38.5, 错误;B项,pH=4时Al3+对应的pM=3,即c(Al3+)=10-3mol·L-1,故Al(OH)3的溶解度为10-3mol·L-1,错误;C项,由图可知,c(Fe3+)=10-5mol·L-1时的pH小于c(Al3+)=0.01mol·L-1 时的pH,则可通过调pH分步沉淀浓度均为0.01mol·L-1的Al3+和Fe3+,正确;D项,由题图可知,Al3+沉淀完全时,c(Al3+)≤10-5mol·L-1,pM≥5,此时pH≈4.7,此时Cu2+刚开始沉淀,浓度约为0.1mol·L-1,而题中c(Cu2+)=0.2mol·L-1>0.1mol·L-1,则Al3+、Cu2+会同时沉淀,错误。
答案:C
例2.(2023·全国乙卷)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是
A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B.b点时,c(Cl-)= c (CrO),Ksp(AgCl)=Ksp(Ag2CrO4)
C.Ag2CrO4+2Cl-2AgCl+CrO的平衡常数K=107.9
D.向NaCl、Na2CrO4均为0.1mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
解析:
结合上述分析可知,A、B错误;C项,该反应的平衡常数
,正确;D项,该混合溶液中形成AgCl沉淀所需的,形成Ag2CrO4沉淀所需的,形成AgCl所需的c(Ag+)较小,所以先产生AgCl沉淀,错误。
答案:C
例3.(2021·江苏卷)室温下,用0.5mol·L-1Na2CO3溶液浸泡CaSO4粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。已知Ksp(CaSO4)=5×10-5,Ksp(CaCO3)=3×10-9。下列说法正确的是
A.0.5mol·L-1Na2CO3溶液中存在:c(OH-)= c (H+)+c (HCO)+ c (H2CO3)
B.反应CaSO4+COCaCO3+SO正向进行,需满足>×104
C.过滤后所得清液中一定存在:c (Ca2+)=且c (Ca2+)≤
D.滤渣中加入醋酸发生反应的离子方程式:CaCO3+2H+===Ca2++CO2↑+H2O
解析:A项,0.5mol·L-1Na2CO3溶液中存在质子守恒:c(OH-)=c (H+)+c (HCO)+2c (H2CO3),错误;B项,该反应的平衡常数K=====×104,当浓度商<K时,反应正向进行,错误;C项,上层清液为碳酸钙的保护溶液,所以清液中满足c (Ca2+)=,由于硫酸钙沉淀转化为碳酸钙沉淀,所以清液为硫酸钙的不饱和溶液,则c(Ca2+)≤,正确;D项,醋酸为弱酸,不能拆成离子形式,错误。
答案:C
例4.(高考卷组合)下列说法正确的是
选项 实验 现象 结论
A 向2支盛有2mL相同浓度硝酸银溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 一支试管中产生黄色沉淀,另一支中无明显现象 Ksp(AgI)
D 将稀硫酸与Na2S反应产生的气体不断通入AgNO3与AgCl的浊液中 白色沉淀逐渐变为黑色沉淀 Ksp(AgCl)>Ksp(Ag2S)
解析:A项,根据题中描述可知黄色沉淀为AgI,另一支试管中无明显现象,说明没有AgCl析出,证明Ksp(AgI)
小结:在难溶电解质的饱和溶液中,溶解度小的沉淀会转化成溶解度更小的沉淀,但溶解度相差不大时,要注意浓度对平衡移动的影响。
【知能整合】
1.沉淀的生成
当溶液中离子积(Qc)大于溶度积(Ksp)时有沉淀生成。
(1)调节pH法:如除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至4左右,离子方程式为Fe3++3NH3·H2O===Fe(OH)3↓+3NH。
(2)沉淀剂法:如用H2S沉淀Cu2+,离子方程式为Cu2++H2S===CuS↓+2H+。
2.沉淀的溶解
当溶液中离子积(Qc)小于溶度积(Ksp)时,沉淀溶解。
(1)酸溶解:
用离子方程式表示CaCO3溶于盐酸:CaCO3+2H+===Ca2++CO2↑+H2O。
(2)盐溶解:
用离子方程式表示Mg(OH)2溶于NH4Cl溶液:Mg(OH)2+2NH===Mg2++2NH3·H2O。
(3)配位溶解:
用离子方程式表示AgCl溶于氨水:AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O。
(4)氧化还原溶解:如不溶于盐酸的硫化物Ag2S溶于稀HNO3。
3.沉淀的转化
在难溶电解质的饱和溶液中,溶解度小的沉淀会转化成溶解度更小的沉淀。
(1)实质:沉淀溶解平衡的移动。
(2)实例:AgNO3溶液AgClAgBr,则Ksp(AgCl)>Ksp(AgBr)。
(3)应用:
锅炉除垢:将CaSO4转化为CaCO3,离子方程式为CaSO4+CO===CaCO3+。
矿物转化:CuSO4溶液遇ZnS转化为CuS,离子方程式为ZnS+Cu2+===CuS+Zn2+。
【体系再构】
【随堂反馈】
基础训练
1.下列化学原理的应用,主要用沉淀溶解平衡原理解释的是
①热纯碱溶液的洗涤油污能力强
②误将钡盐[BaCl2、Ba(NO3)2]当作食盐混用后,常用0.5%的Na2SO4溶液解毒
③溶洞、珊瑚的形成
④碳酸钡不能作“钡餐”而硫酸钡则能
⑤泡沫灭火器灭火的原理
A.①②③ B.②③④ C.③④⑤ D.①②③④⑤
2.下列有关化学实验操作,现象和结论均为正确的是
选项 操作 现象 结论
A Mg2+和Cu2+共存的溶液中滴入适量NaOH溶液 产生白色沉淀 相同温度下,溶度积常数: Ksp[Mg(OH)2]
C 向浓度均为0.1mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 先出现蓝色沉淀 Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
D 分别向相同浓度的ZnSO4溶液和CuSO4溶液中通入H2S 前者无现象,后者有黑色沉淀生成 Ksp(CuS) > Ksp(ZnS)
3.某兴趣小组进行下列实验:
①将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1 NaOH溶液等体积混合得到浊液
②取少量①中浊液,滴加0.1 mol·L-1 FeCl3溶液,出现红褐色沉淀
③将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L-1 FeCl3溶液,白色沉淀变为红褐色沉淀
④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解
下列说法中不正确的是
A.将①中所得浊液过滤,所得滤液中含少量Mg2+
B.①中浊液中存在沉淀溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D.NH4Cl溶液中的NH可能是④中沉淀溶解的原因
4.25 ℃时,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,下列说法正确的是
A.在AgCl和Ag2CrO4共存的悬浊液中,
B.向Ag2CrO4悬浊液中加入NaCl浓溶液,Ag2CrO4不可能转化为AgCl
C.向AgCl饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Cl-)=c(Ag+)
D.向同浓度的Na2CrO4和NaCl混合溶液中滴加AgNO3溶液,AgCl先析出
5.在一混合溶液中含有KCl、KBr、K2CrO4,其浓度均为0.01 mol·L-1,向溶液中逐滴加入0.01 mol·L-1 AgNO3溶液时,最先和最后沉淀的物质分别是(已知:AgCl、AgBr、Ag2CrO4的Ksp分别为1.77×10-10、5.35×10-13、1.12×10-12)
A.AgBr、AgCl B.Ag2CrO4、AgCl C.AgBr、Ag2CrO4 D.同时沉淀
6.自然界中原生铜的硫化物经氧化、淋滤后变成CuSO4溶液,遇到闪锌矿(ZnS)可慢慢转变为铜蓝(CuS)。已知:Ksp(ZnS)=2×10-22,Ksp(CuS)=6×10-36。下列说法不正确的是
A.基态Cu+转化基态Cu2+,失去3d轨道上的电子
B.1个ZnS晶胞(如图)中含4个S2-
C.反应ZnS(s)+Cu2+(aq)CuS(s)+Zn2+(aq)正向进行,
需满足
D.生成铜蓝后的溶液中一定存在:c=且c<
拓展训练
7.为研究沉淀的生成及其转化,某小组进行如图实验。①中现象:产生红色沉淀,②中现象:溶液先浑浊,后来澄清,③中现象:产生白色沉淀。关于该实验的分析不正确的是
A.①浊液中存在平衡:Ag2CrO4(s)2Ag+(aq)+CrO(aq)
B.②中溶液变澄清的原因:AgOH+2NH3·H2O===[Ag(NH3)2]OH+2H2O
C.③中颜色变化说明有AgCl生成
D.该实验可以证明AgCl比Ag2CrO4更难溶
8.室温下,用饱和Na2CO3溶液浸泡BaSO4粉末,一段时间后过滤,向滤渣中加入盐酸,产生气泡。已知Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9。下列说法正确的是
A.Na2CO3饱和溶液中存在:c(OH-)=c(H+)+c(HCO)+c(H2CO3)
B.反应BaSO4(s)+CO(aq)BaCO3(s)+SO(aq)正向进行,需满足
C.过滤后所得的滤液中一定存在:c(Ba2+)=,且c(SO)>c(CO)
D.滤渣中加入盐酸发生反应的离子方程式:CO+2H+===CO2↑+H2O
9.已知:Ksp(FeS)=6×10-18,Ksp(CuS)=1×10-36。室温下,向CuSO4溶液中加入FeS粉末,一段时间后过滤,向滤渣中加入足量稀硫酸,固体部分溶解。下列说法正确的是
A.室温下,CuS的溶解度大于FeS
B.反应FeS(s)+Cu2+(aq)CuS(s)+Fe2+(aq)正向进行,需满足<6×1018
C.生成CuS后的溶液中一定存在:c(S2-)=,且c(S2-)>
D.滤渣中加入稀硫酸发生反应的离子方程式为CuS+2H+===Cu2++H2S↑
【随堂反馈】答案
1.B 2.C 3.C 4.D 5.C 6.D 7.D 8.B 9.B
【课后作业】
1.下列依据实验操作及现象所得出的结论正确的是
选项 实验操作 现象 结论
A 向浓度均为0.1mol·L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液 出现黄色沉淀 Ksp(AgCl)<Ksp(AgI)
B 向2mL0.01mol·L-1的AgNO3溶液中滴加几滴同浓度的NaCl溶液后,滴加 KI 溶液 先产生白色沉淀,后出现黄色沉淀 证明 Ksp(AgI)<Ksp(AgCl)
C 向10 mL 0.2 mol·L-1 ZnSO4溶液中加入10 mL 0.4 mol·L-1 Na2S溶液,再滴加CuSO4溶液 先产生白色沉淀,然后沉淀变黑 相同温度下,溶度积常数:Ksp(CuS)<Ksp(ZnS)
D 向盛有2mLNa2S的溶液加入过量ZnSO4溶液,再逐滴加入同浓度的CuSO4溶液 白色沉淀逐渐变为黑色固体 Ksp(CuS)
2.实验:①0.1 mol·L-1AgNO3溶液和 0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl转化为AgI
D.实验可以证明AgI比AgCl更难溶
3.硫酸锌是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,医药上用作催吐剂。已知25 ℃时,Ksp[Zn(OH)2]=1.0×10-17,Ksp(Ag2SO4)=1.2×10-5,下列说法正确的是
A.在水中加入少量ZnSO4固体时,水的电离平衡向正反应方向移动,Kw减小
B.ZnSO4溶液中:c(Zn2+)+ c (H+)= c (OH-)+ c (SO42-)
C.向0.5 L 0.02 mol·L-1 ZnSO4溶液中加入等体积等浓度的AgNO3溶液即可生成Ag2SO4沉淀
D.溶液中某离子的浓度低于1.0×10-5 mol·L-1时即可认为该离子被除尽,常温下要除去
0.2 mol·L-1 ZnSO4溶液中的Zn2+,至少要调节溶液的pH≥8
4.已知:①AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体;②室温下,Ksp(AgCl)=2.0×10-10,Ksp(Ag2S)=2.0×10-48。向AgCl的悬浊液中加入一定量的Na2S溶液并振荡,白色固体向黑色固体转化。下列说法正确的是
A.Na2S溶液中存在:
c(OH-)=c(H+)+c(HS-)+2c(S2-)
B.向AgCl悬浊液加入足量氨水,溶液变澄清。反应的离子方程式为
AgCl+4NH3·H2O===[Ag(NH3)4]++Cl-+4H2O
C.反应2AgCl+S2-Ag2S+2Cl-要正向进行,需满足<2×1028
D.将转化后的体系静置,上层清液中离子浓度存在关系:c(Ag+)=且
c(Ag+)=
5.常温下,向10 mL 0.1 mol·L-1 NaCl溶液和10 mL 0.1 mol·L-1K2CrO4溶液中分别滴加等物质的量浓度的AgNO3溶液,滴加过程中有关物理量的变化关系如图所示。下列说法正确的是
A.常温下Ksp(AgCl)的数量级为10-10
B.向c(Cl-)=c(CrO)=0.01 mol/L 的溶液中滴加AgNO3溶液,先得到Ag2CrO4沉淀
C.c点所示溶液中c(Ag+)≈1.3×10-6 mol/L
D.a、b两点存在沉淀的溶解平衡,而c点不存在此平衡
6.牙齿表面的矿物质Ca5(PO4)3OH可被CH3COOH溶解。向牙膏中添加NaHCO3、NaF均可增强护齿效果。已知:
CH3COOH H3PO4 Ca5(PO4)3OH Ca5(PO4)3F
Ka或Ksp 1.76×10-5 Ka1 7.52×10-3Ka3 2.2×10-13 8.0×10-30 4.0×10-60
下列说法正确的是
A.CH3COOH溶解Ca5(PO4)3OH的离子方程式为
Ca5(PO4)3OH+10CH3COOH===5Ca2++10CH3COO-+3H3PO4+H2O
B.比较0.1 mol·L-1 NaHCO3溶液和0.1 mol·L-1 NaF溶液中粒子浓度,存在
c(HCO3-)+2c(H2CO3)<c(HF)+c(F-)
C.当<5.0×10-31时,Ca5(PO4)3OH可与F-反应转化为Ca5(PO4)3F
D.0.001 mol·L-1 Na3PO4溶液中:c(Na+)>c(PO)>c(OH-)>c(H+)
7.室温下,已知Ksp(CuS)=8.8×10-36,饱和Cu(OH)2溶液中x=-lg与pH的关系如图所示。向0.1 mol·L-1 的Na2S溶液(pH=12.4)中加入一定量的CuSO4晶体。下列说法正确的是
A.室温下Ksp[Cu(OH)2]=2.2×10-18
B.加入CuSO4晶体时,先生成Cu(OH)2沉淀
C.室温下,CuS在等浓度的Na2S和H2S溶液中的Ksp相等
D.反应后的溶液中存在离子浓度关系:
c(Na+)+c(H+)+c(Cu2+)=c(S2-)+c(HS-)+c(OH-)+c(SO)
8.(1)沉淀除杂。向上述酸浸液中加入pH调节剂,再通入CO2得到MnCO3。酸浸液中Mn2+、Ca2+、Mg2+的浓度分别为0.9mol·L-1、2×10-5 mol·L-1、3×10-2 mol·L-1,若使酸浸液中Mn2+完全沉淀(离子浓度小于10-5 mol·L-1)与Ca2+、Mg2+分离,需控制溶液中c(CO)的范围为____
[Ksp(MnCO3)=2×10-11,Ksp(CaCO3)=3×10-9,Ksp(MgCO3)=6×10-6]。
(2)工业上经常利用硫酸亚铁处理含铬废水,向含有Cr2O的废水加入硫酸亚铁并调节pH使其转化为Cr(OH)3和Fe(OH)3除去,若处理后的废水中残留的c(Fe3+)=2.0×10 13 mol·L-1,则残留的Cr3+的浓度为________。(已知:Ksp[Fe(OH)3]=4.0×10 38,Ksp[Cr(OH)3]=6.0×10 31)
(3)调pH:向酸浸、还原所得滤液中加入MnCO3固体,调节溶液的pH,过滤。若要使Fe3+和Al3+沉淀完全,则需调节溶液的pH最小值为_____________(已知溶液中金属离子的物质的量浓度≤10-5 mol·L-1时可以看成沉淀完全,Ksp[Fe(OH)3]=1×10-37.4,Ksp[Al(OH)3]=1×10-33)。
(4)充分沉淀后测得废水中F-的含量为9.5 mg·L-1,此时SO的浓度为__________ mol·L-1 [已知:Ksp(CaSO4)=5.0×10-5、Ksp(CaF2)=5.0×10-9]。
(5)除镁、钙时,通常向溶液中加入一定量NaF溶液,充分反应后过滤。
①已知常温下:Ksp(CaF2)=2.7×10-11,Ksp(MgF2)=6.4×10-9。
则反应CaF2(s)+Mg2+(aq)MgF2(s)+Ca2+(aq)的平衡常数为K=________。
②除镁、钙时,溶液的pH过低会导致Ca2+、Mg2+沉淀不完全,原因是______________。
9.废旧铅蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和 Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表:
难溶电解质 PbSO4 PbCO3 BaSO4 BaCO3
Ksp 2.5×10-8 7.4×10-14 1.1×10-10 2.6×10-9
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
金属氢氧化物 Fe(OH)3 Fe(OH)2 Al(OH)3 Pb(OH)2
开始沉淀的pH 2.3 6.8 3.5 7.2
完全沉淀的pH 3.2 8.3 4.6 9.1
回答下列问题:
(1)在“脱硫”中PbSO4转化反应的离子方程式为 ,用沉淀溶解平衡原理解释选择NaCO3的原因 。
(2)在“脱硫”中,加入NaCO3不能使铅膏中BaSO4完全转化,原因是 。
(3)在“酸浸”中,除加入醋酸(HAc),还要加入H2O2。
ⅰ.能被H2O2氧化的离子是 ;
ⅱ.H2O2促进了金属Pb在醋酸中转化为Pb(Ac)2,其化学方程式为 ;
ⅲ.H2O2也能使PbO2转化为Pb(Ac)2,H2O2的作用是 。
(4)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是 。
(5)“沉铅”的滤液中,金属离子有 。
【课后作业】答案
1.D 2.B 3.D 4.C 5.A 6.D 7.C
8.(1)2×10-6~1.5×10-4 mol·L-1
(2)3.0×10-6 mol·L-1
(3)4.7
(4)0.0025
(5)①4.2×10-3
②pH过低时,H+浓度较大,会与F-反应生成HF,导致Ca2+、Mg2+沉淀不完全
9.
(1)PbSO4(s)+CO(aq)=== PbCO3(s)+SO(aq) 反应PbSO4(s)+CO(aq)=== PbCO3(s)+SO(aq)的平衡常数K=eq \f(c SO , c CO )q \f(c SO , c CO )=3.4105>105,PbSO4可以比较彻底的转化为PbCO3
(2)反应BaSO4(s)+CO(aq)= BaCO3(s)+SO(aq)的平衡常数K=eq \f(c SO , c CO )=0.04<<105,反应正向进行的程度有限
(3)Fe2+ Pb+H2O2+2HAc===Pb(Ac)2+2H2O 作还原剂
(4)Fe(OH)3、Al(OH)3
(5)Ba2+、Na+
8
同课章节目录
