第2章 分子结构与性质 综合测试 (含解析)2023-2024学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 第2章 分子结构与性质 综合测试 (含解析)2023-2024学年高二下学期化学人教版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-01 00:00:00 | ||
图片预览



文档简介
第2章 分子结构与性质 综合测试
2023-2024学年高二下学期化学人教版(2019)选择性必修2
一、单选题
1.在下列物质中,含有非极性共价键的是( )
A.CO2 B.CH4 C.Na2O2 D.MgCl2
2.某有机物的结构简式为HC≡CCH2CH=CH2,则该有机物分子中含有的 键和 键的数目分别为( )
A.11、3 B.10、3 C.11、4 D.10、4
3.航天员王亚平在太空授课时,用一根粘有结晶核的棉棒触碰失重的过饱和醋酸钠溶液小球,使其迅速结晶为发热的结晶球。下列说法错误的是( )
A.形成结晶球是一个放热过程
B.过饱和醋酸钠溶液属于电解质
C.醋酸与碳酸钠反应可生成醋酸钠
D.醋酸钠晶体中存在离子键、共价键
4.黑火药是我国古代的四大发明之一,主要由硫磺、硝石和木炭组成。黑火药爆炸时,其反应原理:。下列说法正确的是( )
A.该反应的氧化剂为C
B.与的化学键类型完全相同
C.该反应的反应物总能量小于生成物总能量
D.该反应具有速率快、放热多、产生气体多等特点
5.离子键、共价键、和分子间作用力是微粒之间的不同作用力。下列物质中只含有上述一种作用力的是( )
A.冰 B.碘单质 C.氢氧化钠 D.氯化钠
6.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
C.在1 L的容器中发生反应,10 min内 N2减少了1 mol,因此10 min内的平均反应速率为v(NO)=0.1 mol·
D.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
7.下列各组物质,原子间的化学键类型不同的是( )
A.HCl、HNO3 B.H2O、NH3 C.MgCl2、NaF D.CCl4、KOH
8.解痉药物奥昔布宁的结构简式如图所示。下列关于奥昔布宁的说法正确的是( )
A.组成元素均位于元素周期表的p区
B.基态原子第一电离能:N>O>H>C
C.分子中碳原子杂化轨道类型有2种
D.分子中两个六元环的成环原子均各自共面
9.下列说法错误的是( )
A.用电子式表示K2S的形成过程为:
B.MgCl2和NaOH中的化学键类型完全相同,都属于离子化合物
C.CO2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D.反应2H2O+2F2=O2+4HF,同时有极性键和非极性键的断裂和形成
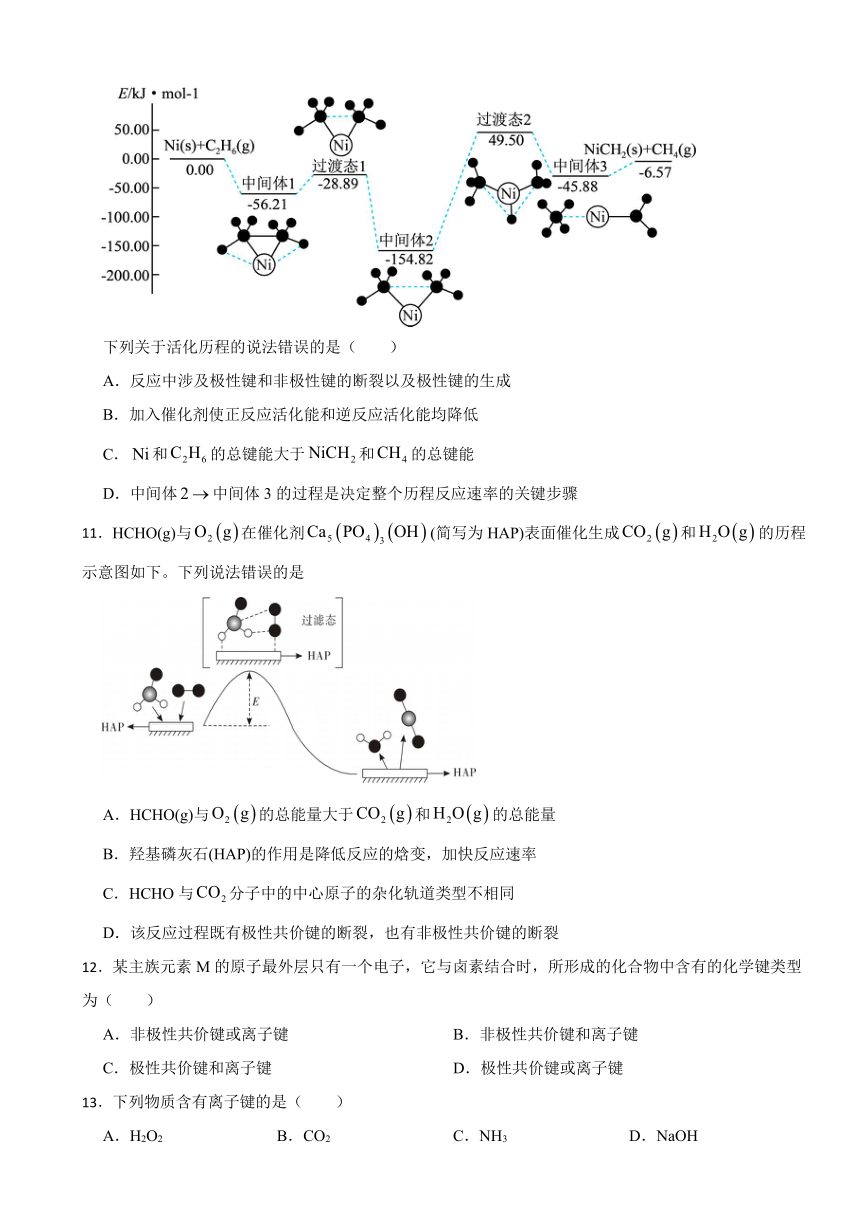
10.金属可活化放出,其反应历程如图所示:
下列关于活化历程的说法错误的是( )
A.反应中涉及极性键和非极性键的断裂以及极性键的生成
B.加入催化剂使正反应活化能和逆反应活化能均降低
C.和的总键能大于和的总键能
D.中间体中间体3的过程是决定整个历程反应速率的关键步骤
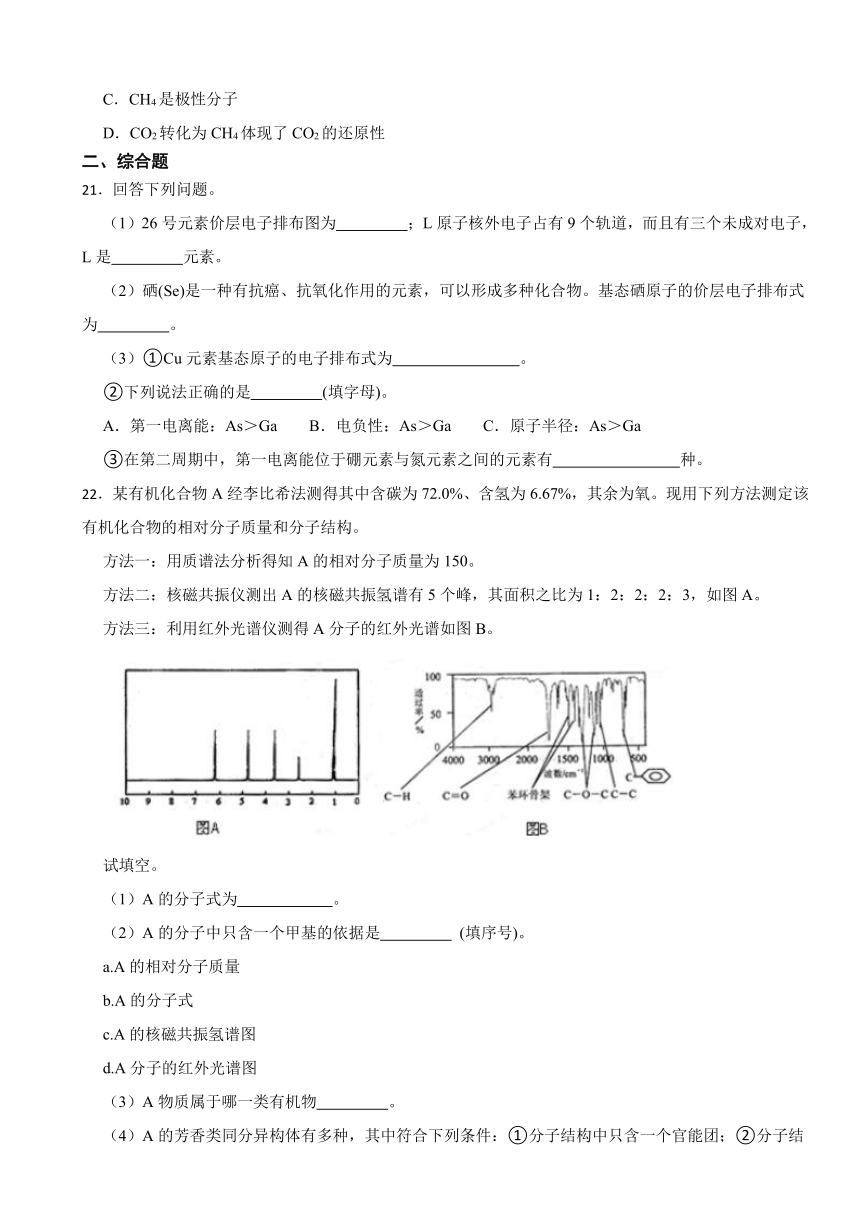
11.HCHO(g)与在催化剂(简写为HAP)表面催化生成和的历程示意图如下。下列说法错误的是
A.HCHO(g)与的总能量大于和的总能量
B.羟基磷灰石(HAP)的作用是降低反应的焓变,加快反应速率
C.HCHO与分子中的中心原子的杂化轨道类型不相同
D.该反应过程既有极性共价键的断裂,也有非极性共价键的断裂
12.某主族元素M的原子最外层只有一个电子,它与卤素结合时,所形成的化合物中含有的化学键类型为( )
A.非极性共价键或离子键 B.非极性共价键和离子键
C.极性共价键和离子键 D.极性共价键或离子键
13.下列物质含有离子键的是( )
A.H2O2 B.CO2 C.NH3 D.NaOH
14.有机物Y的分子式为C4H8O2,其红外光谱如图所示,则该有机物可能的结构简式为( )
A.CH3COOCH2CH3 B.OHCCH2CH2OCH3
C.HCOOCH2CH2CH3 D.(CH3)2CHCOOH
15.向下列配合物的水溶液中加入AgNO3溶液,不能生成AgCl沉淀的是( )
A.[ Co(NH3)4Cl2]Cl B.[Co(NH3)3Cl3]
C.[Co(NH3)6]Cl3 D.[Co(NH3)5Cl]Cl2
16.下列叙述正确的是( )
A.一个HClO分子中含有一个H-Cl键和一个Cl-O键
B.共价化合物中一定没有离子键
C.离子化合物中一定没有共价键
D.非金属组成的化合物不可能是离子化合物
17.下列物质中,只存在有非极性共价键的是( )
A.N2 B.NaCl C.KOH D.H2O
18.向盛有硫酸铜水溶液的试管里逐滴加入氨水,首先形成蓝色絮状沉淀,继续滴加氨水,沉淀溶解得到深蓝色的透明溶液。下列对此现象说法正确的是( )
A.向反应后的溶液加入乙醇,溶液不会有变化,因为[Cu(NH3)4]2+不会与乙醇发生反应
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+
C.用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象
D.在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道
19.共价键、离子键和范德华力都是微粒之间的不同作用力,下列含有上述两种结合力的是 ( )
①Na2O2②SiO2③石墨 ④金刚石 ⑤NaCl ⑥白磷
A.①②④ B.①③⑥ C.②④⑥ D.③④⑤
20.资源化利用CO2是实现“碳中和”的重要途径,CO2在光催化转化为CH4的原理为:
CO2+4H2CH4+2H2O。下列有关CO2、CH4的说法正确的是( )
A.CO2的空间构型是V形
B.电负性:O>C>H
C.CH4是极性分子
D.CO2转化为CH4体现了CO2的还原性
二、综合题
21.回答下列问题。
(1)26号元素价层电子排布图为 ;L原子核外电子占有9个轨道,而且有三个未成对电子,L是 元素。
(2)硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。基态硒原子的价层电子排布式为 。
(3)①Cu元素基态原子的电子排布式为 。
②下列说法正确的是 (填字母)。
A.第一电离能:As>Ga B.电负性:As>Ga C.原子半径:As>Ga
③在第二周期中,第一电离能位于硼元素与氮元素之间的元素有 种。
22.某有机化合物A经李比希法测得其中含碳为72.0%、含氢为6.67%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3,如图A。
方法三:利用红外光谱仪测得A分子的红外光谱如图B。
试填空。
(1)A的分子式为 。
(2)A的分子中只含一个甲基的依据是 (填序号)。
a.A的相对分子质量
b.A的分子式
c.A的核磁共振氢谱图
d.A分子的红外光谱图
(3)A物质属于哪一类有机物 。
(4)A的芳香类同分异构体有多种,其中符合下列条件:①分子结构中只含一个官能团;②分子结构中含有一个甲基;③苯环上只有一个取代基;写出符合条件的任意一种 。
23.研究压电材料对于自动化技术具有重要意义。一种有机—无机复合压电材料的单斜晶体结构沿晶轴方向投影如图所示(H原子未画出),晶胞内总共含有84个原子。晶胞参数为,,。回答下列问题:
(1)基态Mn原子的价电子轨道表示式为 。在元素周期表中位置为 。
(2)1 mol 晶胞中含有Cl原子 mol,含有杂化的中心原子 mol;该晶体中提供电子对形成配位键的原子是 。
(3)TMCM性质活泼,一定条件下可分解生成三甲胺[],中N原子的价层电子对构型为 ;的沸点高于,主要原因是 。
24.锌是人体必需的微量元素,[Zn(NH3)4]CO3在生物活性等方面发挥重要的作用。
(1)Zn2+基态核外电子排布式为 。
(2)[Zn(NH3)4]CO3中C、H、O、N四种元素的第一电离能由大到小的顺序为 ; 的空间构型为 (用文字描述);1mol[Zn(NH3)4]CO3中内界所含有的σ键数目为 。
(3)某含锌配合物可用于模拟碳酸酐酶的催化活性,该配合物中含有DMF分子。DMF分子的结构如图l所示。DMF分子中碳原子轨道的杂化类型是 。
(4)闪锌矿可看作由Zn2+和S2-各自形成的面心立方结构相互穿插而成。其晶胞结构示意图如图2所示,则其中S2-的配位数是 个。
25.锌是人体必需的微量元素之一,常被人们誉为生命之花和智力之源。乳酸锌是常见的补锌剂,制取原理为(C3H5O3)2Ca+ZnSO4=(C3H5O3)2Zn+CaSO4↓。回答下列问题:
(1)基态Zn原子的价电子排布式为 。
(2)氧元素的原子核外有 种不同运动状态的电子,有 种不同能量的电子,下列不同状态的氧原子其能量最低的是 (填字母)。
A. B.
C. D.
(3)乳酸(CH3CHOHCOOH)分子中碳原子的轨道杂化类型为 ,分子中第一电离能最大的原子是 。
(4)SO3分子的空间构型为 ;与为等电子体的分子为 (写一种)。
答案解析部分
1.【答案】C
【解析】【解答】A.CO2中C原子和O原子之间存在极性共价键,A不符合题意;
B.CH4中C原子和H原子之间存在极性共价键,B不符合题意;
C.Na2O2中钠离子和过氧根离子之间存在离子键,O与O之间存在非极性共价键,C符合题意;
D.MgCl2中镁离子和氯离子之间存在离子键,D不符合题意;
故答案为:C。
【分析】一般的活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,同种非金属元素之间形成非极性键,不同非金属元素之间形成极性键。
2.【答案】B
【解析】【解答】单键全部为σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键,故该有机物分子中的碳氢σ键6个,碳碳σ键4个,因此σ键总数为10个,π键总数为3个,故B符合题意。
故答案为B。
【分析】单键均为σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键,据此解答。
3.【答案】B
【解析】【解答】A.醋酸钠溶液结晶过程释放能量,所以醋酸钠溶液结晶是一个放热过程,A不符合题意;
B.电解质为化合物,而过饱和醋酸钠溶液为混合物,故其不是电解质,B符合题意;
C.醋酸和碳酸钠反应生成醋酸钠和二氧化碳以及水,C不符合题意;
D.醋酸钠为离子晶体,其中存在离子键,醋酸根离子中存在共价键,D不符合题意;
故答案为:B。
【分析】A.醋酸钠结晶释放热量;
B.电解质是指在水溶液中或熔融状态下能导电的化合物;
C.醋酸和碳酸钠反应生成醋酸钠、二氧化碳和水;
D.醋酸钠由醋酸根离子和钠离子构成,醋酸根离子中含有共价键。
4.【答案】D
【解析】【解答】A.反应中硫元素化合价降低,氮元素化合价降低,碳元素化合价升高,所以氧化剂为硝酸钾和硫,A不符合题意;
B.硝酸钾中含有离子键和共价键,硫化钾只含有离子键,B不符合题意;
C.该反应为放热反应,该反应的反应物总能量大于生成物的总能量,C不符合题意;
D.该反应为爆炸反应,具有速率快,放热多,产生气体多等特点,D符合题意;
故答案为:D。
【分析】A、氧化还原反应中,化合价升高作为还原剂,化合价降低作为氧化剂;
B、极性键为不同非金属原子的结合,非极性键为相同非金属原子得到结合,离子键为金属或铵根离子与非金属离子的结合,共价键为非金属和非金属原子的结合;
C、反应物的总能量大于生成物的总能量,为放热反应,反之吸热反应;
D、爆炸的特点是瞬间发生,速率快,放出热量多。
5.【答案】D
【解析】【解答】A.冰中含共价键、范德华力、氢键三种作用力,故A不选;
B.碘中含共价键、范德华力两种作用力,故B不选;
C.NaOH中含离子键、共价键两种作用力,故C不选;
D.氯化钠中只含离子键一种作用力,故D选;
故答案为:D。
【分析】A.冰中H与O形成共价键,分子间形成范德华力,且O的非金属性强,可形成氢键;
B.碘中含共价键、范德华力;
C.NaOH中含离子键、共价键;
D.氯化钠中只含离子键。
6.【答案】D
【解析】【解答】A.焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2(g)+O2(g)=2NO(g)ΔH2=946+498-2×632=+180 kJ·mol–1,故该反应是吸热反应,故A不符合题意;
B.一氧化氮与氢氧化钠溶液不反应,是不成盐氧化物,故B不符合题意;
C.在1L的容器中发生反应, 10 min内 N2减少了1 mol,因此10 min内的平均反应速率:v(N2)=1/(1×10)=0.1 mol·L-1 min-1;根据反应N2(g)+O2(g)=2NO(g)可以知道,v(NO)=2v(N2)=0.2 mol·L-1 min-1;故C不符合题意;
D.根据A计算可以知道反应是吸热反应,故1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,故D符合题意;
故答案为:D。
【分析】含有氮元素的非金属氧化物有的是酸性氧化物,如N2O5 、N2O3;而NO既不与酸反应,又不与碱反应,为不成盐氧化物;NO2虽然能够与碱反应生成盐和水,但是该反应为氧化还原反应,NO2不是酸性氧化物。
7.【答案】D
【解析】【解答】A.HCl中的H和Cl之间以共价键结合,HNO3中的H、O、N之间也以共价键结合,故A不选;
B. H2O和NH3均是原子间通过共价键结合而成,故B不选;
C. MgCl2是镁离子和氯离子通过离子键结合而成的,NaF是钠离子和氟离子通过离子键结合而成的。故C不选;
D. CCl4是碳原子和氯原子通过共价键结合而成,而KOH是钾离子和氢氧根离子通过离子键结合而成,故D选。
故答案为:D。
【分析】离子化合物是离子间通过离子键结合而成的,通常活泼金属氧化物和金属离子或铵根离子和酸根离子组成的盐以及强碱都是离子化合物。而酸、非金属氧化物和大多数的有机物都是共价化合物。
8.【答案】B
【解析】【解答】A.氢元素位于元素周期表的s区,A不符合题意;
B.同一主族元素从上向下第一电离能逐渐减小,同一周期主族元素从左向右第一电离能呈增大趋势,但第IIA族和第VA族最外层电子处于全满和半满状态,较稳定,其第一电离能比同周期相邻元素第一电离能大,因此基态原子第一电离能:N>O>H>C,B符合题意;
C.分子中含三键碳、双键碳和饱和碳,碳原子的杂化类型有sp、sp2、sp3共3种杂化类型,C不符合题意;
D.分子中苯环的成环原子共面,但另一个六元环中的碳全为饱和碳,其成环原子不共面,D不符合题意;
故答案为:B。
【分析】A.H是s区元素;
C.三键碳为sp杂化,苯环和双键碳为sp2杂化,饱和碳原子为sp3杂化;
D.除苯环外的另一个六元环成环原子不共面。
9.【答案】B
【解析】【解答】A.K2S的形成过程中,S原子得到两个电子,形成阴离子,K原子失去电子形成阳离子,阴阳离子通过离子键结合,用电子式表示为: ,故A不符合题意;
B.MgCl2中只含离子键,属于离子化合物,NaOH中既含离子键又含共价键,也属于离子化合物,化学键类型不完全相同,故B符合题意;
C.CO2分子中C原子和两个O原子分别共用两对共用电子对,每个原子都满足8电子稳定结构;Cl2分子中,两个Cl原子间共用1对共用电子对都达到8电子稳定结构,故C不符合题意;
D.反应2H2O+2F2=O2+4HF,反应物水中含有极性键,F2中含有非极性键,产物O2中含有非极性键,HF中含有极性键,则反应过程中同时有极性键和非极性键的断裂和形成,故D不符合题意;
故答案为:B。
【分析】A、K失去电子,S得电子;
B、MgCl2中只含离子键,NaOH中既含离子键又含共价键;
C、根据共用电子对来确定元素是否达到8电子稳定结构;
D、水和HF含有极性键,F2和O2含有非极性键。
10.【答案】C
【解析】【解答】A、金属可活化放出的过程中,结合图示,存在C-Ni键、Ni-H键、C-H键的生成,以及C-C键、Ni-H键的断裂,涉及极性键和非极性键的断裂以及极性键的生成,故A选项正确;
B、催化剂的作用是降低反应过渡态的能垒,即降低反应活化能,且正逆反应降低的活化能相同,因此加入催化剂使正反应活化能和逆反应活化能均降低,故B选项正确;
C、和的相对总能量为0,和的相对总能量为-6.57,正反应放热,和总键能小于和的总键能,故C选项错误;
D、慢反应决定总反应速率,中间体中间体3的过程正反应活化能最大,反应速率最慢,所以中间体中间体3的过程是决定整个历程反应速率的关键步骤,故D选项正确;
故答案为:C
【分析】A、结合图示,存在C-Ni键、Ni-H键、C-H键的生成,以及C-C键、Ni-H键的断裂,涉及极性键和非极性键的断裂以及极性键的生成;
B、催化剂的作用是降低反应过渡态的能垒,即降低反应活化能,且正逆反应降低的活化能相同;
C、通过比较相对总能量,判断出反应是吸热反应还是放热反应,进而判断总键能的大小;
D、慢反应决定总反应速率。
11.【答案】B
【解析】【解答】A.根据图中信息得到,反应物总能量大于生成物总能量,A项正确;
B.催化剂可以加快反应速率,但是不能够改变反应的焓变,B项错误;
C.根据价层电子互斥理论可得,HCHO分子中的中心原子价层电子对数为3,杂化类型为sp2,二氧化碳分子中的中心原子价层电子对数为2,杂化类型为sp,两者中心原子的杂化轨道类型不相同,C项正确;
D.断开的极性共价键为C-H键,非极性共价键键为O=O键,D项正确;
故答案为:B。
【分析】易错分析:B.催化剂是通过改变反应活化能,加快反应速率,但是反应物和生成物的能量不变,反应焓变不变。
12.【答案】D
【解析】【解答】最外层电子数为1的原子有氢原子、碱金属元素原子和部分过渡区金属元素原子,氢元素与卤素结合时,所形成的化合物中含有极性共价键,金属元素与卤素结合时,所形成的化合物中含有离子键,则所形成的化合物中含有的化学键类型为极性共价键或离子键,
故答案为:D。
【分析】根据题干信息可知M位于第ⅠA族,除H为非金属元素外,其他均为金属元素。若M为氢元素,则卤化氢中只含极性共价键;若M为金属元素,所得化合物为离子化合物,含有离子键。
13.【答案】D
【解析】【解答】A.H2O2的结构式为H-O-O-H,则分子中只存在共价键,故A不符合题意;
B.二氧化碳中碳原子和氧原子之间只存在共价键,故B不符合题意;
C.氨气中氮原子和氢原子之间只存在共价键,故C不符合题意;
D.氢氧化钠中钠离子和氢氧根离子之间存在离子键,氢原子和氧原子之间存在共价键,故D符合题意;
故答案为D。
【分析】离子键是阴阳离子之间强烈的相互作用,一般形成于金属和非金属之间。
14.【答案】A
【解析】【解答】由红外光谱图可看出该分子中有不对称CH3,因此该分子中有2个CH3,由图也可以看出含有C=O双键、C-O-C单键,则A的结构简式为CH3COOCH2CH3或CH3CH2COOCH3,
故答案为:A。
【分析】本题考查有机物结构式的确定,侧重分析与应用能力的考查,把握图中信息及官能团的确定为解答的关键。
15.【答案】B
【解析】【解答】配合物中由配位键结合的几乎不电离的稳定部分为配合物的内界,通过离子键与内界结合的部分为配合物的外界,只要外界存在Cl-,加入AgNO3溶液即有AgCl沉淀生成。配合物[Co( NH3)3Cl3]中,Co3+、NH3、Cl-全部处于内界,在溶液中很难电离出Cl-,加入AgNO3溶液不生成AgCl沉淀,B项符合题意。
【分析】水溶液中加入AgNO3溶液有AgCl沉淀生成,说明该物质的溶液中有自由移动的氯离子,内界中的配离子不能电离出来。
16.【答案】B
【解析】【解答】A.HClO分子O原子为中心原子,含有一个H-O键和一个O-Cl键,A不符合题意;
B.只含有共价键的化合物为共价化合物,所以共价化合物中没有离子键,B符合题意;
C.离子化合物中可以含有共价键,如NaOH中含有O-H键,C不符合题意;
D.非金属元素可以组成离子化合物,如NH4Cl,D不符合题意;
故答案为:B。
【分析】A.次氯酸是氢原子和氯原子与氧原子形成共价键
B.共价化合物中只有共价键
C.离子化合物中可能有共价键一定有离子键
D.离子化合物一般由金属元素和非金属元素形成,非金属元素也可以形成离子化合物
17.【答案】A
【解析】【解答】A.N2是单质,N2分子中2个N原子通过非极性共价键N≡N结合,A符合题意;
B.NaCl是离子化合物,Na+与Cl-之间通过离子键结合,无共价键,B不符合题意;
C.KOH是离子化合物,K+与OH-通过离子键结合,在OH-中H与O 原子之间通极性共价键结合,C不符合题意;
D.H2O是由分子构成,在H2O分子中 O原子与2个H原子通过极性共价键H-O结合,无非极性共价键,D不符合题意;
故答案为:A。
【分析】非极性共价键一般存在于同种原子构成的单质中
18.【答案】B
【解析】【解答】A. 在乙醇中的溶解度小于在水中的溶解度,向溶液中加入乙醇后会析出蓝色晶体 ,A不符合题意;
B. 氢氧化铜和氨水继续反应生成生成深蓝色的配合离子[Cu(NH3)4]2+,B符合题意;
C. 用硝酸铜溶液代替硫酸铜溶液进行实验,硝酸铜中的铜离子和氨水反应现象与硫酸铜中铜离子和氨水反应现象相同,能观察到同样的现象,C不符合题意;
D. 在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3给出孤对电子,D不符合题意;
故答案为:B。
【分析】A.从[Cu (NH3) 4]SO4在乙醇中的溶解度入手考虑;
B.沉淀Cu (OH) 2与NH3反应生成深蓝色的配离子[Cu (NH3) 4]2+;
C.实质还是Cu2+的反应,NO3-不参与反应;
D. Cu2+ 提供空轨道,NH3提供孤对电子。
19.【答案】B
【解析】【解答】①过氧化钠中含有离子键和非极性键;②二氧化硅中只含有极性键;③石墨中含有非极性键,同时还含有分子间作用力;④金刚石中只存在非极性键;⑤氯化钠只含有离子键;⑥白磷含有非极性键,同时还含有分子间作用力。
故答案为:B。
【分析】注意共价化合物中一定不含有离子键,但离子化合物中不一定不含有共价键,如氯化铵中既有离子键也有共价键。
20.【答案】B
【解析】【解答】A.CO2的结构为O=C=O,其空间构型为直线型,A不符合题意;
B.C、O位于同周期,由分析可知,C、O、H元素的电负性是:O>C>H,B符合题意;
C.CH4的空间构型是正四面体,正负电荷中心重合,属于非极性分子,C不符合题意;
D.CO2转化为CH4的过程中,碳元素的化合价由+4降为-4,说明CO2作氧化剂,体现了CO2的氧化性,D不符合题意;
故答案为:B。
【分析】A.根据CO2的结构进行分析。
B.电负性表示吸电子能力的强弱,同周期元素(惰性原子除外)的电负性从左到右依次增强。
C.极性分子和非极性分子的区别是正负电荷中心是否重合,若重合为非极性分子,若不重合为极性分子。
D.氧化剂具有氧化性,还原剂具有还原性。
21.【答案】(1);P
(2)4s24p4
(3)[Ar]3d104s1;AB;3
【解析】【解答】 (1) 26号元素的价电子排布式为3d64s2,价层电子排布图为 ;L原子核外电子占有9个轨道,而且有三个未成对电子,电子排布式为1s22s22p63s23p3,L是P;
(2)硒(Se)为34号,基态硒原子的价层电子排布式为4s24p4;
(3)①Cu为29号,基态原子的电子排布式为[Ar]3d104s1;
②A.Ga、As为第四周期元素,价电子排布式分别为4s24p1和4s24p3,As的4p轨道半充满,原子的能量低,第一电离能大,第一电离能:As>Ga,A符合题意;
B.As和Ga为同周期元素,As在Ga的右边,非金属性As比Ga强,电负性:As>Ga,B符合题意;
C.同周期元素从左到右,原子半径依次减小,As与Ga同周期,在Ga的右边,原子半径:As<Ga,C不符合题意;
③在第二周期中,Be的2s轨道全充满、N的2p轨道半充满,第一电离能反常,第一电离能由低到高的顺序为B、Be、C、O、N,位于硼元素与氮元素之间的元素有Be、C、O 有3种;
【分析】 (1) 26号元素的价电子排布式为3d64s2;P的电子排布式为1s22s22p63s23p3;
(2)硒(Se)为34号,基态硒原子的价层电子排布式为4s24p4;
(3)①Cu为29号,基态原子的电子排布式为[Ar]3d104s1;
②A.Ga、As为第四周期元素,价电子排布式分别为4s24p1和4s24p3,As的4p轨道半充满,原子的能量低,第一电离能大;
B.非金属性As比Ga强;
C.同周期元素从左到右,原子半径依次减小;
③在第二周期中,Be的2s轨道全充满、N的2p轨道半充满,第一电离能反常。
22.【答案】(1)C9H10O2
(2)bc
(3)酯类
(4)C6H5COOCH2CH3、 、 、 任意一种
【解析】【解答】(1)有机物A中C原子个数N(C)═ =9,有机物A中H原子个数N(H)═ =10,有机物A中O原子个数N(O)═ =2,所以有机物A的分子式为C9H10O2;(2)A的核磁共振氢谱有5个峰,说明分子中有5种H原子,其面积之比为对应的各种H原子个数之比,由分子式可知分子中H原子总数,进而确定甲基数目,所以需要知道A的分子式及A的核磁共振氢谱图,故答案为bc;(3)由A分子的红外光谱知,含有C6H5C-基团,由苯环上只有一个取代基可知,苯环上的氢有三种,H原子个数分别为1个、2个、2个,由A的核磁共振氢谱可知,除苯环外,还有两种氢,且两种氢的个数分别为2个、3个,由A分子的红外光谱可知,A分子结构有碳碳单键及C-H、C=O、C-O等基团,所以符合条件的有机物A结构简式为 ,由此可知有机物的结构中含有酯基,故属于酯类;(4)A为 ,A的芳香类同分异构体有多种,①分子结构中只含一个官能团;②分子结构中含有一个甲基;③苯环上只有一个取代基,满足条件的取代基(组成为-C3H5O2)有:-OOCCH2CH3、-CH2OOCCH3、-CH2COOCH3、-CH(CH3)OOCH、-CH(CH3)COOH,则符合要求的同分异构体的结构简式可为C6H5COOCH2CH3、 、 、 任意一种 。
【分析】(1)根据各元素的含量,结合相对分子质量确定有机物A中C、H、O原子个数,进而确定有机物A的分子式;(2)A的核磁共振氢谱有5个峰,说明分子中有5种H原子,其面积之比为对应的各种H原子个数之比,根据分子式可知分子中H原子总数,进而确定甲基数目;(3)根据A分子的红外光谱,核磁共振氢谱确定确定A的结构简式;(4)先确定取代基的组成,再书写符合条件的取代基的异构体,据此解答。
23.【答案】(1);第4周期第ⅦB族
(2)16;32;Cl、N
(3)(正)四面体(形);二者均为分子晶体,相对分子质量更大
【解析】【解答】(1)基态Mn原子的电子排布式为:,价电子轨道表示式为 ,在周期表中的未知为:第4周期第ⅦB族;
(2)根据晶胞结构图,原子棱上有24个,面心有8个,里面有6个,总个数为:个,含有杂化的中心原子为32,Cl、N含有孤电子对,提供提供电子对形成配位键;
(3)中N价层电子对为4,构型为正四面体结构;相对分子质量较大,所以沸点较高。
【分析】(1)依据原子构造原理和洪特规则分析;
(2)利用均摊法确定原子数;根据晶胞结构图,依据配合物的结构确定配位键的数目;
(3)依据价层电子对数=σ键数+孤电子对数,由价层电子对数确定VSEPR模型,再确定空间立体构型;分子晶体的相对分子质量越大,沸点越高。
24.【答案】(1)[Ar]3d10或1s22s22p63s23p63d10
(2)N>O>H>C;平面正三角形;16NA或16×6.02×1023
(3)sp2、sp3
(4)4
【解析】【解答】(1)Zn是30号元素,其原子核外有30个电子,失去最外层两个电子生成锌离子,根据构造原理书写其核外电子排布式为[Ar]3d10或1s22s22p63s23p63d10 ;
(2)同周期元素从左到右元素的第一电离能呈逐渐增大趋势,N原子最外层核外电子排布处于半充满状态,结构稳定,其第一电离能比相邻元素都要大,则有第一电离能N>O>C,又因为H原子比碳原子的核外电子距离原子核近,受到原子核的引力大,电离需要消耗的能量更多,所以H的第一电离能比C的大,故有:N>O>H>C; 中心原子的价层电子对数=3+ × (4+2 3×2)=3,C原子的杂化方式为sp2,没有孤电子对,分子的立体构型为平面正三角形; [Zn(NH3)4]CO3中内界为[Zn(NH3)4]2+,每个NH3含有3个σ键,Zn2+与N原子形成4个配位键,则一个[Zn(NH3)4]2+中σ键数目为3×4+4=16个,则1mol[Zn(NH3)4]CO3中内界所含有的σ键数目为16NA或16×6.02×1023;
(3)DMF分子中有碳氧双键和甲基,C均无孤对电子,C=O为平面结构,则羰基上C为sp2杂化,甲基为四面体结构,甲基上C为sp3杂化;
(4)根据晶胞结构示意图如图2所示,则其中S2-的配位数是4个。
【分析】(1)Zn是30号元素,其原子核外有30个电子,失去两个电子生成锌离子,Zn2+基态核外有28个电子,根据构造原理书写其核外电子排布式;
(2)价层电子对数=σ键电子对数+中心原子上的孤电子对数,根据价层电子对数判断微粒构型;根据元素周期表第一电离能的递变规律比较第一电离能大小;配位键和共价单键都为σ键;
(3)C=O为平面结构,甲基为四面体结构,由此分析解答;
(4)根据图示观察判断S2-的配位数。
25.【答案】(1)3d104s2
(2)8;3;A
(3)sp2、sp3;O
(4)平面三角形;SiF4或(CF4、CCl4)
【解析】【解答】(1)Zn是30号元素,基态Zn原子的价电子排布式为3d104s2;答案为:3d104s2;
(2)氧元素是8号元素,电子排布式为:1s22s22p4,原子核外有8种不同运动状态的电子,同一能级的电子其能量相同,故有3种不同能量的电子;
分析A、B、C、D选项中四种氧原子的电子排布图可知,C、D是激发态,能量较高,B中的原子排布不符合洪特规则,A项中符合泡利不相容原理和洪特规则。其能量最低;
答案为:8;3;A;
(3)乳酸(CH3CHOHCOOH)分子中羧基中的碳原子形成2个单键和1个双键,碳原子采用sp2杂化,剩余2个碳原子形成4个单键,碳原子采用sp3杂化;分子中C、H、O三种原子相比较,同周期从左至右。第一电离能总体上呈增大趋势。故第一电离能最大的是O;答案为:sp2、sp3;O;
(4)SO3分子的中心原子价电子对数为3,通过价层电子对互斥模型进行判断,其孤电子对为0,则SO3分子的空间构型为平面正三角形;含有5个原子,价电子个数为32个,则与互为等电子体的分子可以为SiF4、CF4、CCl4等;答案为:平面三角形;SiF4或(CF4、CCl4)。
【分析】(1)Zn是30号元素,基态Zn原子的价电子排布式为3d104s2;
(2)氧元素是8号元素,电子排布式为:1s22s22p4,原子核外有8种不同运动状态的电子,有3种不同能量的电子,A、B、C、D四种氧原子中C、D是激发态,能量较高,A、B中B的原子排布不符合洪特规则,则能量最低的是A;
(3)乳酸(CH3CHOHCOOH)分子中羧基中的碳原子形成2个单键个1个双键,碳原子采用sp2杂化,剩余2个碳原子形成4个单键,碳原子采用sp2杂化;分子中C、H、O三种原子相比较,第一电离能最大的是O;
(4)NO3-分子的中心原子价电子对数为3,孤电子对为0,NO3-分子的空间构型为平面正三角形;含有5个原子,价电子个数为32个,则与互为等电子体的分子可以为 SiF4或CF4、CCl4 等。
2023-2024学年高二下学期化学人教版(2019)选择性必修2
一、单选题
1.在下列物质中,含有非极性共价键的是( )
A.CO2 B.CH4 C.Na2O2 D.MgCl2
2.某有机物的结构简式为HC≡CCH2CH=CH2,则该有机物分子中含有的 键和 键的数目分别为( )
A.11、3 B.10、3 C.11、4 D.10、4
3.航天员王亚平在太空授课时,用一根粘有结晶核的棉棒触碰失重的过饱和醋酸钠溶液小球,使其迅速结晶为发热的结晶球。下列说法错误的是( )
A.形成结晶球是一个放热过程
B.过饱和醋酸钠溶液属于电解质
C.醋酸与碳酸钠反应可生成醋酸钠
D.醋酸钠晶体中存在离子键、共价键
4.黑火药是我国古代的四大发明之一,主要由硫磺、硝石和木炭组成。黑火药爆炸时,其反应原理:。下列说法正确的是( )
A.该反应的氧化剂为C
B.与的化学键类型完全相同
C.该反应的反应物总能量小于生成物总能量
D.该反应具有速率快、放热多、产生气体多等特点
5.离子键、共价键、和分子间作用力是微粒之间的不同作用力。下列物质中只含有上述一种作用力的是( )
A.冰 B.碘单质 C.氢氧化钠 D.氯化钠
6.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
C.在1 L的容器中发生反应,10 min内 N2减少了1 mol,因此10 min内的平均反应速率为v(NO)=0.1 mol·
D.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
7.下列各组物质,原子间的化学键类型不同的是( )
A.HCl、HNO3 B.H2O、NH3 C.MgCl2、NaF D.CCl4、KOH
8.解痉药物奥昔布宁的结构简式如图所示。下列关于奥昔布宁的说法正确的是( )
A.组成元素均位于元素周期表的p区
B.基态原子第一电离能:N>O>H>C
C.分子中碳原子杂化轨道类型有2种
D.分子中两个六元环的成环原子均各自共面
9.下列说法错误的是( )
A.用电子式表示K2S的形成过程为:
B.MgCl2和NaOH中的化学键类型完全相同,都属于离子化合物
C.CO2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D.反应2H2O+2F2=O2+4HF,同时有极性键和非极性键的断裂和形成
10.金属可活化放出,其反应历程如图所示:
下列关于活化历程的说法错误的是( )
A.反应中涉及极性键和非极性键的断裂以及极性键的生成
B.加入催化剂使正反应活化能和逆反应活化能均降低
C.和的总键能大于和的总键能
D.中间体中间体3的过程是决定整个历程反应速率的关键步骤
11.HCHO(g)与在催化剂(简写为HAP)表面催化生成和的历程示意图如下。下列说法错误的是
A.HCHO(g)与的总能量大于和的总能量
B.羟基磷灰石(HAP)的作用是降低反应的焓变,加快反应速率
C.HCHO与分子中的中心原子的杂化轨道类型不相同
D.该反应过程既有极性共价键的断裂,也有非极性共价键的断裂
12.某主族元素M的原子最外层只有一个电子,它与卤素结合时,所形成的化合物中含有的化学键类型为( )
A.非极性共价键或离子键 B.非极性共价键和离子键
C.极性共价键和离子键 D.极性共价键或离子键
13.下列物质含有离子键的是( )
A.H2O2 B.CO2 C.NH3 D.NaOH
14.有机物Y的分子式为C4H8O2,其红外光谱如图所示,则该有机物可能的结构简式为( )
A.CH3COOCH2CH3 B.OHCCH2CH2OCH3
C.HCOOCH2CH2CH3 D.(CH3)2CHCOOH
15.向下列配合物的水溶液中加入AgNO3溶液,不能生成AgCl沉淀的是( )
A.[ Co(NH3)4Cl2]Cl B.[Co(NH3)3Cl3]
C.[Co(NH3)6]Cl3 D.[Co(NH3)5Cl]Cl2
16.下列叙述正确的是( )
A.一个HClO分子中含有一个H-Cl键和一个Cl-O键
B.共价化合物中一定没有离子键
C.离子化合物中一定没有共价键
D.非金属组成的化合物不可能是离子化合物
17.下列物质中,只存在有非极性共价键的是( )
A.N2 B.NaCl C.KOH D.H2O
18.向盛有硫酸铜水溶液的试管里逐滴加入氨水,首先形成蓝色絮状沉淀,继续滴加氨水,沉淀溶解得到深蓝色的透明溶液。下列对此现象说法正确的是( )
A.向反应后的溶液加入乙醇,溶液不会有变化,因为[Cu(NH3)4]2+不会与乙醇发生反应
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+
C.用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象
D.在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道
19.共价键、离子键和范德华力都是微粒之间的不同作用力,下列含有上述两种结合力的是 ( )
①Na2O2②SiO2③石墨 ④金刚石 ⑤NaCl ⑥白磷
A.①②④ B.①③⑥ C.②④⑥ D.③④⑤
20.资源化利用CO2是实现“碳中和”的重要途径,CO2在光催化转化为CH4的原理为:
CO2+4H2CH4+2H2O。下列有关CO2、CH4的说法正确的是( )
A.CO2的空间构型是V形
B.电负性:O>C>H
C.CH4是极性分子
D.CO2转化为CH4体现了CO2的还原性
二、综合题
21.回答下列问题。
(1)26号元素价层电子排布图为 ;L原子核外电子占有9个轨道,而且有三个未成对电子,L是 元素。
(2)硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。基态硒原子的价层电子排布式为 。
(3)①Cu元素基态原子的电子排布式为 。
②下列说法正确的是 (填字母)。
A.第一电离能:As>Ga B.电负性:As>Ga C.原子半径:As>Ga
③在第二周期中,第一电离能位于硼元素与氮元素之间的元素有 种。
22.某有机化合物A经李比希法测得其中含碳为72.0%、含氢为6.67%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3,如图A。
方法三:利用红外光谱仪测得A分子的红外光谱如图B。
试填空。
(1)A的分子式为 。
(2)A的分子中只含一个甲基的依据是 (填序号)。
a.A的相对分子质量
b.A的分子式
c.A的核磁共振氢谱图
d.A分子的红外光谱图
(3)A物质属于哪一类有机物 。
(4)A的芳香类同分异构体有多种,其中符合下列条件:①分子结构中只含一个官能团;②分子结构中含有一个甲基;③苯环上只有一个取代基;写出符合条件的任意一种 。
23.研究压电材料对于自动化技术具有重要意义。一种有机—无机复合压电材料的单斜晶体结构沿晶轴方向投影如图所示(H原子未画出),晶胞内总共含有84个原子。晶胞参数为,,。回答下列问题:
(1)基态Mn原子的价电子轨道表示式为 。在元素周期表中位置为 。
(2)1 mol 晶胞中含有Cl原子 mol,含有杂化的中心原子 mol;该晶体中提供电子对形成配位键的原子是 。
(3)TMCM性质活泼,一定条件下可分解生成三甲胺[],中N原子的价层电子对构型为 ;的沸点高于,主要原因是 。
24.锌是人体必需的微量元素,[Zn(NH3)4]CO3在生物活性等方面发挥重要的作用。
(1)Zn2+基态核外电子排布式为 。
(2)[Zn(NH3)4]CO3中C、H、O、N四种元素的第一电离能由大到小的顺序为 ; 的空间构型为 (用文字描述);1mol[Zn(NH3)4]CO3中内界所含有的σ键数目为 。
(3)某含锌配合物可用于模拟碳酸酐酶的催化活性,该配合物中含有DMF分子。DMF分子的结构如图l所示。DMF分子中碳原子轨道的杂化类型是 。
(4)闪锌矿可看作由Zn2+和S2-各自形成的面心立方结构相互穿插而成。其晶胞结构示意图如图2所示,则其中S2-的配位数是 个。
25.锌是人体必需的微量元素之一,常被人们誉为生命之花和智力之源。乳酸锌是常见的补锌剂,制取原理为(C3H5O3)2Ca+ZnSO4=(C3H5O3)2Zn+CaSO4↓。回答下列问题:
(1)基态Zn原子的价电子排布式为 。
(2)氧元素的原子核外有 种不同运动状态的电子,有 种不同能量的电子,下列不同状态的氧原子其能量最低的是 (填字母)。
A. B.
C. D.
(3)乳酸(CH3CHOHCOOH)分子中碳原子的轨道杂化类型为 ,分子中第一电离能最大的原子是 。
(4)SO3分子的空间构型为 ;与为等电子体的分子为 (写一种)。
答案解析部分
1.【答案】C
【解析】【解答】A.CO2中C原子和O原子之间存在极性共价键,A不符合题意;
B.CH4中C原子和H原子之间存在极性共价键,B不符合题意;
C.Na2O2中钠离子和过氧根离子之间存在离子键,O与O之间存在非极性共价键,C符合题意;
D.MgCl2中镁离子和氯离子之间存在离子键,D不符合题意;
故答案为:C。
【分析】一般的活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,同种非金属元素之间形成非极性键,不同非金属元素之间形成极性键。
2.【答案】B
【解析】【解答】单键全部为σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键,故该有机物分子中的碳氢σ键6个,碳碳σ键4个,因此σ键总数为10个,π键总数为3个,故B符合题意。
故答案为B。
【分析】单键均为σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键,据此解答。
3.【答案】B
【解析】【解答】A.醋酸钠溶液结晶过程释放能量,所以醋酸钠溶液结晶是一个放热过程,A不符合题意;
B.电解质为化合物,而过饱和醋酸钠溶液为混合物,故其不是电解质,B符合题意;
C.醋酸和碳酸钠反应生成醋酸钠和二氧化碳以及水,C不符合题意;
D.醋酸钠为离子晶体,其中存在离子键,醋酸根离子中存在共价键,D不符合题意;
故答案为:B。
【分析】A.醋酸钠结晶释放热量;
B.电解质是指在水溶液中或熔融状态下能导电的化合物;
C.醋酸和碳酸钠反应生成醋酸钠、二氧化碳和水;
D.醋酸钠由醋酸根离子和钠离子构成,醋酸根离子中含有共价键。
4.【答案】D
【解析】【解答】A.反应中硫元素化合价降低,氮元素化合价降低,碳元素化合价升高,所以氧化剂为硝酸钾和硫,A不符合题意;
B.硝酸钾中含有离子键和共价键,硫化钾只含有离子键,B不符合题意;
C.该反应为放热反应,该反应的反应物总能量大于生成物的总能量,C不符合题意;
D.该反应为爆炸反应,具有速率快,放热多,产生气体多等特点,D符合题意;
故答案为:D。
【分析】A、氧化还原反应中,化合价升高作为还原剂,化合价降低作为氧化剂;
B、极性键为不同非金属原子的结合,非极性键为相同非金属原子得到结合,离子键为金属或铵根离子与非金属离子的结合,共价键为非金属和非金属原子的结合;
C、反应物的总能量大于生成物的总能量,为放热反应,反之吸热反应;
D、爆炸的特点是瞬间发生,速率快,放出热量多。
5.【答案】D
【解析】【解答】A.冰中含共价键、范德华力、氢键三种作用力,故A不选;
B.碘中含共价键、范德华力两种作用力,故B不选;
C.NaOH中含离子键、共价键两种作用力,故C不选;
D.氯化钠中只含离子键一种作用力,故D选;
故答案为:D。
【分析】A.冰中H与O形成共价键,分子间形成范德华力,且O的非金属性强,可形成氢键;
B.碘中含共价键、范德华力;
C.NaOH中含离子键、共价键;
D.氯化钠中只含离子键。
6.【答案】D
【解析】【解答】A.焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2(g)+O2(g)=2NO(g)ΔH2=946+498-2×632=+180 kJ·mol–1,故该反应是吸热反应,故A不符合题意;
B.一氧化氮与氢氧化钠溶液不反应,是不成盐氧化物,故B不符合题意;
C.在1L的容器中发生反应, 10 min内 N2减少了1 mol,因此10 min内的平均反应速率:v(N2)=1/(1×10)=0.1 mol·L-1 min-1;根据反应N2(g)+O2(g)=2NO(g)可以知道,v(NO)=2v(N2)=0.2 mol·L-1 min-1;故C不符合题意;
D.根据A计算可以知道反应是吸热反应,故1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,故D符合题意;
故答案为:D。
【分析】含有氮元素的非金属氧化物有的是酸性氧化物,如N2O5 、N2O3;而NO既不与酸反应,又不与碱反应,为不成盐氧化物;NO2虽然能够与碱反应生成盐和水,但是该反应为氧化还原反应,NO2不是酸性氧化物。
7.【答案】D
【解析】【解答】A.HCl中的H和Cl之间以共价键结合,HNO3中的H、O、N之间也以共价键结合,故A不选;
B. H2O和NH3均是原子间通过共价键结合而成,故B不选;
C. MgCl2是镁离子和氯离子通过离子键结合而成的,NaF是钠离子和氟离子通过离子键结合而成的。故C不选;
D. CCl4是碳原子和氯原子通过共价键结合而成,而KOH是钾离子和氢氧根离子通过离子键结合而成,故D选。
故答案为:D。
【分析】离子化合物是离子间通过离子键结合而成的,通常活泼金属氧化物和金属离子或铵根离子和酸根离子组成的盐以及强碱都是离子化合物。而酸、非金属氧化物和大多数的有机物都是共价化合物。
8.【答案】B
【解析】【解答】A.氢元素位于元素周期表的s区,A不符合题意;
B.同一主族元素从上向下第一电离能逐渐减小,同一周期主族元素从左向右第一电离能呈增大趋势,但第IIA族和第VA族最外层电子处于全满和半满状态,较稳定,其第一电离能比同周期相邻元素第一电离能大,因此基态原子第一电离能:N>O>H>C,B符合题意;
C.分子中含三键碳、双键碳和饱和碳,碳原子的杂化类型有sp、sp2、sp3共3种杂化类型,C不符合题意;
D.分子中苯环的成环原子共面,但另一个六元环中的碳全为饱和碳,其成环原子不共面,D不符合题意;
故答案为:B。
【分析】A.H是s区元素;
C.三键碳为sp杂化,苯环和双键碳为sp2杂化,饱和碳原子为sp3杂化;
D.除苯环外的另一个六元环成环原子不共面。
9.【答案】B
【解析】【解答】A.K2S的形成过程中,S原子得到两个电子,形成阴离子,K原子失去电子形成阳离子,阴阳离子通过离子键结合,用电子式表示为: ,故A不符合题意;
B.MgCl2中只含离子键,属于离子化合物,NaOH中既含离子键又含共价键,也属于离子化合物,化学键类型不完全相同,故B符合题意;
C.CO2分子中C原子和两个O原子分别共用两对共用电子对,每个原子都满足8电子稳定结构;Cl2分子中,两个Cl原子间共用1对共用电子对都达到8电子稳定结构,故C不符合题意;
D.反应2H2O+2F2=O2+4HF,反应物水中含有极性键,F2中含有非极性键,产物O2中含有非极性键,HF中含有极性键,则反应过程中同时有极性键和非极性键的断裂和形成,故D不符合题意;
故答案为:B。
【分析】A、K失去电子,S得电子;
B、MgCl2中只含离子键,NaOH中既含离子键又含共价键;
C、根据共用电子对来确定元素是否达到8电子稳定结构;
D、水和HF含有极性键,F2和O2含有非极性键。
10.【答案】C
【解析】【解答】A、金属可活化放出的过程中,结合图示,存在C-Ni键、Ni-H键、C-H键的生成,以及C-C键、Ni-H键的断裂,涉及极性键和非极性键的断裂以及极性键的生成,故A选项正确;
B、催化剂的作用是降低反应过渡态的能垒,即降低反应活化能,且正逆反应降低的活化能相同,因此加入催化剂使正反应活化能和逆反应活化能均降低,故B选项正确;
C、和的相对总能量为0,和的相对总能量为-6.57,正反应放热,和总键能小于和的总键能,故C选项错误;
D、慢反应决定总反应速率,中间体中间体3的过程正反应活化能最大,反应速率最慢,所以中间体中间体3的过程是决定整个历程反应速率的关键步骤,故D选项正确;
故答案为:C
【分析】A、结合图示,存在C-Ni键、Ni-H键、C-H键的生成,以及C-C键、Ni-H键的断裂,涉及极性键和非极性键的断裂以及极性键的生成;
B、催化剂的作用是降低反应过渡态的能垒,即降低反应活化能,且正逆反应降低的活化能相同;
C、通过比较相对总能量,判断出反应是吸热反应还是放热反应,进而判断总键能的大小;
D、慢反应决定总反应速率。
11.【答案】B
【解析】【解答】A.根据图中信息得到,反应物总能量大于生成物总能量,A项正确;
B.催化剂可以加快反应速率,但是不能够改变反应的焓变,B项错误;
C.根据价层电子互斥理论可得,HCHO分子中的中心原子价层电子对数为3,杂化类型为sp2,二氧化碳分子中的中心原子价层电子对数为2,杂化类型为sp,两者中心原子的杂化轨道类型不相同,C项正确;
D.断开的极性共价键为C-H键,非极性共价键键为O=O键,D项正确;
故答案为:B。
【分析】易错分析:B.催化剂是通过改变反应活化能,加快反应速率,但是反应物和生成物的能量不变,反应焓变不变。
12.【答案】D
【解析】【解答】最外层电子数为1的原子有氢原子、碱金属元素原子和部分过渡区金属元素原子,氢元素与卤素结合时,所形成的化合物中含有极性共价键,金属元素与卤素结合时,所形成的化合物中含有离子键,则所形成的化合物中含有的化学键类型为极性共价键或离子键,
故答案为:D。
【分析】根据题干信息可知M位于第ⅠA族,除H为非金属元素外,其他均为金属元素。若M为氢元素,则卤化氢中只含极性共价键;若M为金属元素,所得化合物为离子化合物,含有离子键。
13.【答案】D
【解析】【解答】A.H2O2的结构式为H-O-O-H,则分子中只存在共价键,故A不符合题意;
B.二氧化碳中碳原子和氧原子之间只存在共价键,故B不符合题意;
C.氨气中氮原子和氢原子之间只存在共价键,故C不符合题意;
D.氢氧化钠中钠离子和氢氧根离子之间存在离子键,氢原子和氧原子之间存在共价键,故D符合题意;
故答案为D。
【分析】离子键是阴阳离子之间强烈的相互作用,一般形成于金属和非金属之间。
14.【答案】A
【解析】【解答】由红外光谱图可看出该分子中有不对称CH3,因此该分子中有2个CH3,由图也可以看出含有C=O双键、C-O-C单键,则A的结构简式为CH3COOCH2CH3或CH3CH2COOCH3,
故答案为:A。
【分析】本题考查有机物结构式的确定,侧重分析与应用能力的考查,把握图中信息及官能团的确定为解答的关键。
15.【答案】B
【解析】【解答】配合物中由配位键结合的几乎不电离的稳定部分为配合物的内界,通过离子键与内界结合的部分为配合物的外界,只要外界存在Cl-,加入AgNO3溶液即有AgCl沉淀生成。配合物[Co( NH3)3Cl3]中,Co3+、NH3、Cl-全部处于内界,在溶液中很难电离出Cl-,加入AgNO3溶液不生成AgCl沉淀,B项符合题意。
【分析】水溶液中加入AgNO3溶液有AgCl沉淀生成,说明该物质的溶液中有自由移动的氯离子,内界中的配离子不能电离出来。
16.【答案】B
【解析】【解答】A.HClO分子O原子为中心原子,含有一个H-O键和一个O-Cl键,A不符合题意;
B.只含有共价键的化合物为共价化合物,所以共价化合物中没有离子键,B符合题意;
C.离子化合物中可以含有共价键,如NaOH中含有O-H键,C不符合题意;
D.非金属元素可以组成离子化合物,如NH4Cl,D不符合题意;
故答案为:B。
【分析】A.次氯酸是氢原子和氯原子与氧原子形成共价键
B.共价化合物中只有共价键
C.离子化合物中可能有共价键一定有离子键
D.离子化合物一般由金属元素和非金属元素形成,非金属元素也可以形成离子化合物
17.【答案】A
【解析】【解答】A.N2是单质,N2分子中2个N原子通过非极性共价键N≡N结合,A符合题意;
B.NaCl是离子化合物,Na+与Cl-之间通过离子键结合,无共价键,B不符合题意;
C.KOH是离子化合物,K+与OH-通过离子键结合,在OH-中H与O 原子之间通极性共价键结合,C不符合题意;
D.H2O是由分子构成,在H2O分子中 O原子与2个H原子通过极性共价键H-O结合,无非极性共价键,D不符合题意;
故答案为:A。
【分析】非极性共价键一般存在于同种原子构成的单质中
18.【答案】B
【解析】【解答】A. 在乙醇中的溶解度小于在水中的溶解度,向溶液中加入乙醇后会析出蓝色晶体 ,A不符合题意;
B. 氢氧化铜和氨水继续反应生成生成深蓝色的配合离子[Cu(NH3)4]2+,B符合题意;
C. 用硝酸铜溶液代替硫酸铜溶液进行实验,硝酸铜中的铜离子和氨水反应现象与硫酸铜中铜离子和氨水反应现象相同,能观察到同样的现象,C不符合题意;
D. 在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3给出孤对电子,D不符合题意;
故答案为:B。
【分析】A.从[Cu (NH3) 4]SO4在乙醇中的溶解度入手考虑;
B.沉淀Cu (OH) 2与NH3反应生成深蓝色的配离子[Cu (NH3) 4]2+;
C.实质还是Cu2+的反应,NO3-不参与反应;
D. Cu2+ 提供空轨道,NH3提供孤对电子。
19.【答案】B
【解析】【解答】①过氧化钠中含有离子键和非极性键;②二氧化硅中只含有极性键;③石墨中含有非极性键,同时还含有分子间作用力;④金刚石中只存在非极性键;⑤氯化钠只含有离子键;⑥白磷含有非极性键,同时还含有分子间作用力。
故答案为:B。
【分析】注意共价化合物中一定不含有离子键,但离子化合物中不一定不含有共价键,如氯化铵中既有离子键也有共价键。
20.【答案】B
【解析】【解答】A.CO2的结构为O=C=O,其空间构型为直线型,A不符合题意;
B.C、O位于同周期,由分析可知,C、O、H元素的电负性是:O>C>H,B符合题意;
C.CH4的空间构型是正四面体,正负电荷中心重合,属于非极性分子,C不符合题意;
D.CO2转化为CH4的过程中,碳元素的化合价由+4降为-4,说明CO2作氧化剂,体现了CO2的氧化性,D不符合题意;
故答案为:B。
【分析】A.根据CO2的结构进行分析。
B.电负性表示吸电子能力的强弱,同周期元素(惰性原子除外)的电负性从左到右依次增强。
C.极性分子和非极性分子的区别是正负电荷中心是否重合,若重合为非极性分子,若不重合为极性分子。
D.氧化剂具有氧化性,还原剂具有还原性。
21.【答案】(1);P
(2)4s24p4
(3)[Ar]3d104s1;AB;3
【解析】【解答】 (1) 26号元素的价电子排布式为3d64s2,价层电子排布图为 ;L原子核外电子占有9个轨道,而且有三个未成对电子,电子排布式为1s22s22p63s23p3,L是P;
(2)硒(Se)为34号,基态硒原子的价层电子排布式为4s24p4;
(3)①Cu为29号,基态原子的电子排布式为[Ar]3d104s1;
②A.Ga、As为第四周期元素,价电子排布式分别为4s24p1和4s24p3,As的4p轨道半充满,原子的能量低,第一电离能大,第一电离能:As>Ga,A符合题意;
B.As和Ga为同周期元素,As在Ga的右边,非金属性As比Ga强,电负性:As>Ga,B符合题意;
C.同周期元素从左到右,原子半径依次减小,As与Ga同周期,在Ga的右边,原子半径:As<Ga,C不符合题意;
③在第二周期中,Be的2s轨道全充满、N的2p轨道半充满,第一电离能反常,第一电离能由低到高的顺序为B、Be、C、O、N,位于硼元素与氮元素之间的元素有Be、C、O 有3种;
【分析】 (1) 26号元素的价电子排布式为3d64s2;P的电子排布式为1s22s22p63s23p3;
(2)硒(Se)为34号,基态硒原子的价层电子排布式为4s24p4;
(3)①Cu为29号,基态原子的电子排布式为[Ar]3d104s1;
②A.Ga、As为第四周期元素,价电子排布式分别为4s24p1和4s24p3,As的4p轨道半充满,原子的能量低,第一电离能大;
B.非金属性As比Ga强;
C.同周期元素从左到右,原子半径依次减小;
③在第二周期中,Be的2s轨道全充满、N的2p轨道半充满,第一电离能反常。
22.【答案】(1)C9H10O2
(2)bc
(3)酯类
(4)C6H5COOCH2CH3、 、 、 任意一种
【解析】【解答】(1)有机物A中C原子个数N(C)═ =9,有机物A中H原子个数N(H)═ =10,有机物A中O原子个数N(O)═ =2,所以有机物A的分子式为C9H10O2;(2)A的核磁共振氢谱有5个峰,说明分子中有5种H原子,其面积之比为对应的各种H原子个数之比,由分子式可知分子中H原子总数,进而确定甲基数目,所以需要知道A的分子式及A的核磁共振氢谱图,故答案为bc;(3)由A分子的红外光谱知,含有C6H5C-基团,由苯环上只有一个取代基可知,苯环上的氢有三种,H原子个数分别为1个、2个、2个,由A的核磁共振氢谱可知,除苯环外,还有两种氢,且两种氢的个数分别为2个、3个,由A分子的红外光谱可知,A分子结构有碳碳单键及C-H、C=O、C-O等基团,所以符合条件的有机物A结构简式为 ,由此可知有机物的结构中含有酯基,故属于酯类;(4)A为 ,A的芳香类同分异构体有多种,①分子结构中只含一个官能团;②分子结构中含有一个甲基;③苯环上只有一个取代基,满足条件的取代基(组成为-C3H5O2)有:-OOCCH2CH3、-CH2OOCCH3、-CH2COOCH3、-CH(CH3)OOCH、-CH(CH3)COOH,则符合要求的同分异构体的结构简式可为C6H5COOCH2CH3、 、 、 任意一种 。
【分析】(1)根据各元素的含量,结合相对分子质量确定有机物A中C、H、O原子个数,进而确定有机物A的分子式;(2)A的核磁共振氢谱有5个峰,说明分子中有5种H原子,其面积之比为对应的各种H原子个数之比,根据分子式可知分子中H原子总数,进而确定甲基数目;(3)根据A分子的红外光谱,核磁共振氢谱确定确定A的结构简式;(4)先确定取代基的组成,再书写符合条件的取代基的异构体,据此解答。
23.【答案】(1);第4周期第ⅦB族
(2)16;32;Cl、N
(3)(正)四面体(形);二者均为分子晶体,相对分子质量更大
【解析】【解答】(1)基态Mn原子的电子排布式为:,价电子轨道表示式为 ,在周期表中的未知为:第4周期第ⅦB族;
(2)根据晶胞结构图,原子棱上有24个,面心有8个,里面有6个,总个数为:个,含有杂化的中心原子为32,Cl、N含有孤电子对,提供提供电子对形成配位键;
(3)中N价层电子对为4,构型为正四面体结构;相对分子质量较大,所以沸点较高。
【分析】(1)依据原子构造原理和洪特规则分析;
(2)利用均摊法确定原子数;根据晶胞结构图,依据配合物的结构确定配位键的数目;
(3)依据价层电子对数=σ键数+孤电子对数,由价层电子对数确定VSEPR模型,再确定空间立体构型;分子晶体的相对分子质量越大,沸点越高。
24.【答案】(1)[Ar]3d10或1s22s22p63s23p63d10
(2)N>O>H>C;平面正三角形;16NA或16×6.02×1023
(3)sp2、sp3
(4)4
【解析】【解答】(1)Zn是30号元素,其原子核外有30个电子,失去最外层两个电子生成锌离子,根据构造原理书写其核外电子排布式为[Ar]3d10或1s22s22p63s23p63d10 ;
(2)同周期元素从左到右元素的第一电离能呈逐渐增大趋势,N原子最外层核外电子排布处于半充满状态,结构稳定,其第一电离能比相邻元素都要大,则有第一电离能N>O>C,又因为H原子比碳原子的核外电子距离原子核近,受到原子核的引力大,电离需要消耗的能量更多,所以H的第一电离能比C的大,故有:N>O>H>C; 中心原子的价层电子对数=3+ × (4+2 3×2)=3,C原子的杂化方式为sp2,没有孤电子对,分子的立体构型为平面正三角形; [Zn(NH3)4]CO3中内界为[Zn(NH3)4]2+,每个NH3含有3个σ键,Zn2+与N原子形成4个配位键,则一个[Zn(NH3)4]2+中σ键数目为3×4+4=16个,则1mol[Zn(NH3)4]CO3中内界所含有的σ键数目为16NA或16×6.02×1023;
(3)DMF分子中有碳氧双键和甲基,C均无孤对电子,C=O为平面结构,则羰基上C为sp2杂化,甲基为四面体结构,甲基上C为sp3杂化;
(4)根据晶胞结构示意图如图2所示,则其中S2-的配位数是4个。
【分析】(1)Zn是30号元素,其原子核外有30个电子,失去两个电子生成锌离子,Zn2+基态核外有28个电子,根据构造原理书写其核外电子排布式;
(2)价层电子对数=σ键电子对数+中心原子上的孤电子对数,根据价层电子对数判断微粒构型;根据元素周期表第一电离能的递变规律比较第一电离能大小;配位键和共价单键都为σ键;
(3)C=O为平面结构,甲基为四面体结构,由此分析解答;
(4)根据图示观察判断S2-的配位数。
25.【答案】(1)3d104s2
(2)8;3;A
(3)sp2、sp3;O
(4)平面三角形;SiF4或(CF4、CCl4)
【解析】【解答】(1)Zn是30号元素,基态Zn原子的价电子排布式为3d104s2;答案为:3d104s2;
(2)氧元素是8号元素,电子排布式为:1s22s22p4,原子核外有8种不同运动状态的电子,同一能级的电子其能量相同,故有3种不同能量的电子;
分析A、B、C、D选项中四种氧原子的电子排布图可知,C、D是激发态,能量较高,B中的原子排布不符合洪特规则,A项中符合泡利不相容原理和洪特规则。其能量最低;
答案为:8;3;A;
(3)乳酸(CH3CHOHCOOH)分子中羧基中的碳原子形成2个单键和1个双键,碳原子采用sp2杂化,剩余2个碳原子形成4个单键,碳原子采用sp3杂化;分子中C、H、O三种原子相比较,同周期从左至右。第一电离能总体上呈增大趋势。故第一电离能最大的是O;答案为:sp2、sp3;O;
(4)SO3分子的中心原子价电子对数为3,通过价层电子对互斥模型进行判断,其孤电子对为0,则SO3分子的空间构型为平面正三角形;含有5个原子,价电子个数为32个,则与互为等电子体的分子可以为SiF4、CF4、CCl4等;答案为:平面三角形;SiF4或(CF4、CCl4)。
【分析】(1)Zn是30号元素,基态Zn原子的价电子排布式为3d104s2;
(2)氧元素是8号元素,电子排布式为:1s22s22p4,原子核外有8种不同运动状态的电子,有3种不同能量的电子,A、B、C、D四种氧原子中C、D是激发态,能量较高,A、B中B的原子排布不符合洪特规则,则能量最低的是A;
(3)乳酸(CH3CHOHCOOH)分子中羧基中的碳原子形成2个单键个1个双键,碳原子采用sp2杂化,剩余2个碳原子形成4个单键,碳原子采用sp2杂化;分子中C、H、O三种原子相比较,第一电离能最大的是O;
(4)NO3-分子的中心原子价电子对数为3,孤电子对为0,NO3-分子的空间构型为平面正三角形;含有5个原子,价电子个数为32个,则与互为等电子体的分子可以为 SiF4或CF4、CCl4 等。
