浙江省宁波市慈溪市2023-2024学年高一下学期6月期末考试化学试题(含答案)
文档属性
| 名称 | 浙江省宁波市慈溪市2023-2024学年高一下学期6月期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 893.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-01 14:40:51 | ||
图片预览

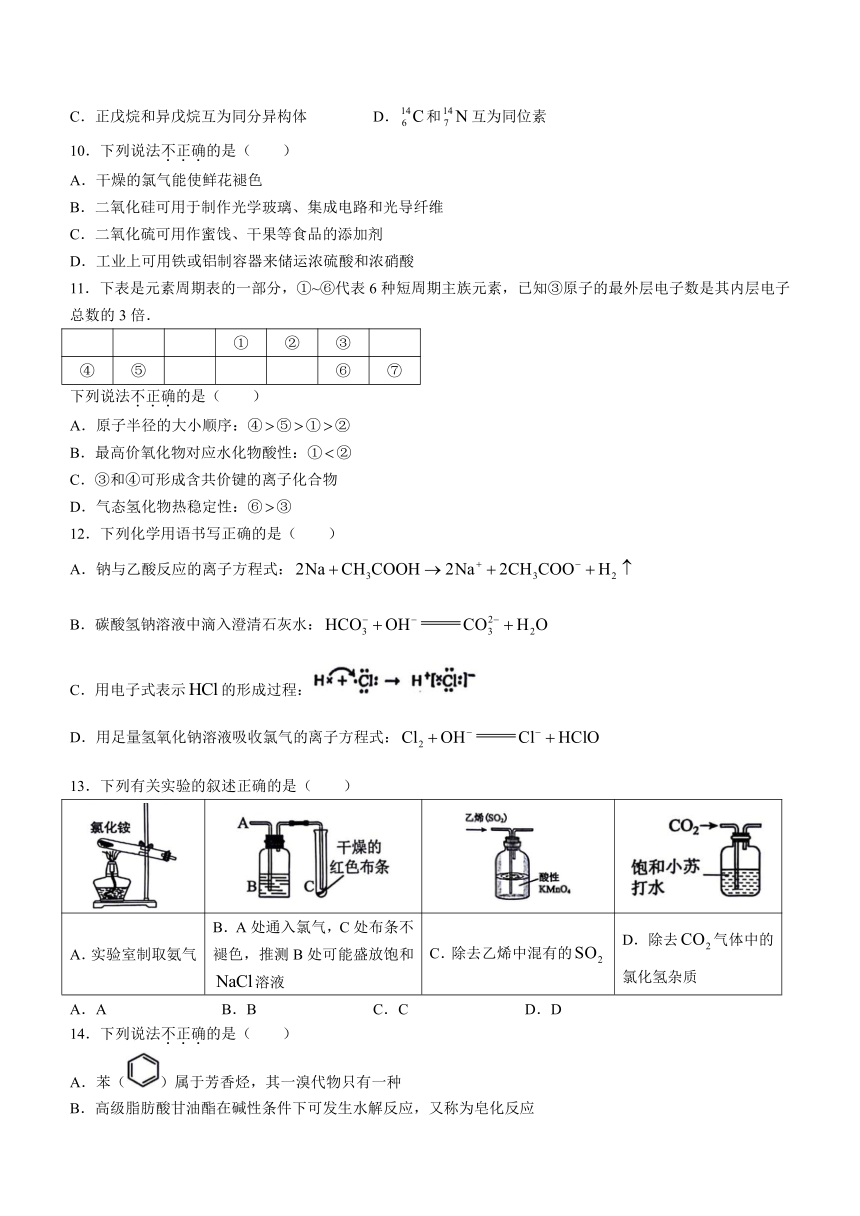
文档简介
慈溪市2023-2024学年高一下学期6月期末考试
化学试题
本试题满分100分,考试时间60分钟.
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32
Cl 35.5 Fe 56 Cu 64 Ba 137
一、选择题Ⅰ(本大题共15小题,每小题2分,共30分.每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.纯碱的化学式是( )
A. B. C. D.
2.按物质的组成进行分类,属于( )
A.酸 B.氧化物 C.盐 D.有机物
3.用浓硫酸稀释配制硫酸溶液,不需要用到的实验仪器是( )
A. B. C. D.
4.下列物质属于非电解质的是( )
A. B.盐酸 C.Si D.
5.反应中,氧化剂是( )
A. B. C. D.
6.下列物质所含分子数与所含分子数相同的是( )
A. B. C. D.
7.下列属于物理变化的是( )
A.葡萄糖在体内氧化 B.油脂的水解 C.煤的干馏 D.石油的分馏
8.下列物质对应的化学式不正确的是( )
A.石英: B.重晶石: C.黄铁矿: D.熟石膏:
9.下列说法不正确的是( )
A.和互为同系物 B.石墨和石墨烯互为同素异形体
C.正戊烷和异戊烷互为同分异构体 D.和互为同位素
10.下列说法不正确的是( )
A.干燥的氯气能使鲜花褪色
B.二氧化硅可用于制作光学玻璃、集成电路和光导纤维
C.二氧化硫可用作蜜饯、干果等食品的添加剂
D.工业上可用铁或铝制容器来储运浓硫酸和浓硝酸
11.下表是元素周期表的一部分,①~⑥代表6种短周期主族元素,已知③原子的最外层电子数是其内层电子总数的3倍.
① ② ③
④ ⑤ ⑥ ⑦
下列说法不正确的是( )
A.原子半径的大小顺序:④⑤①②
B.最高价氧化物对应水化物酸性:①②
C.③和④可形成含共价键的离子化合物
D.气态氢化物热稳定性:⑥③
12.下列化学用语书写正确的是( )
A.钠与乙酸反应的离子方程式:
B.碳酸氢钠溶液中滴入澄清石灰水:
C.用电子式表示的形成过程:
D.用足量氢氧化钠溶液吸收氯气的离子方程式:
13.下列有关实验的叙述正确的是( )
A.实验室制取氨气 B.A处通入氯气,C处布条不褪色,推测B处可能盛放饱和溶液 C.除去乙烯中混有的 D.除去气体中的氯化氢杂质
A.A B.B C.C D.D
14.下列说法不正确的是( )
A.苯()属于芳香烃,其一溴代物只有一种
B.高级脂肪酸甘油酯在碱性条件下可发生水解反应,又称为皂化反应
C.乙醇分子中含有,能和盐酸发生中和反应
D.食醋可清除水壶中的少量水垢,说明乙酸的酸性强于碳酸
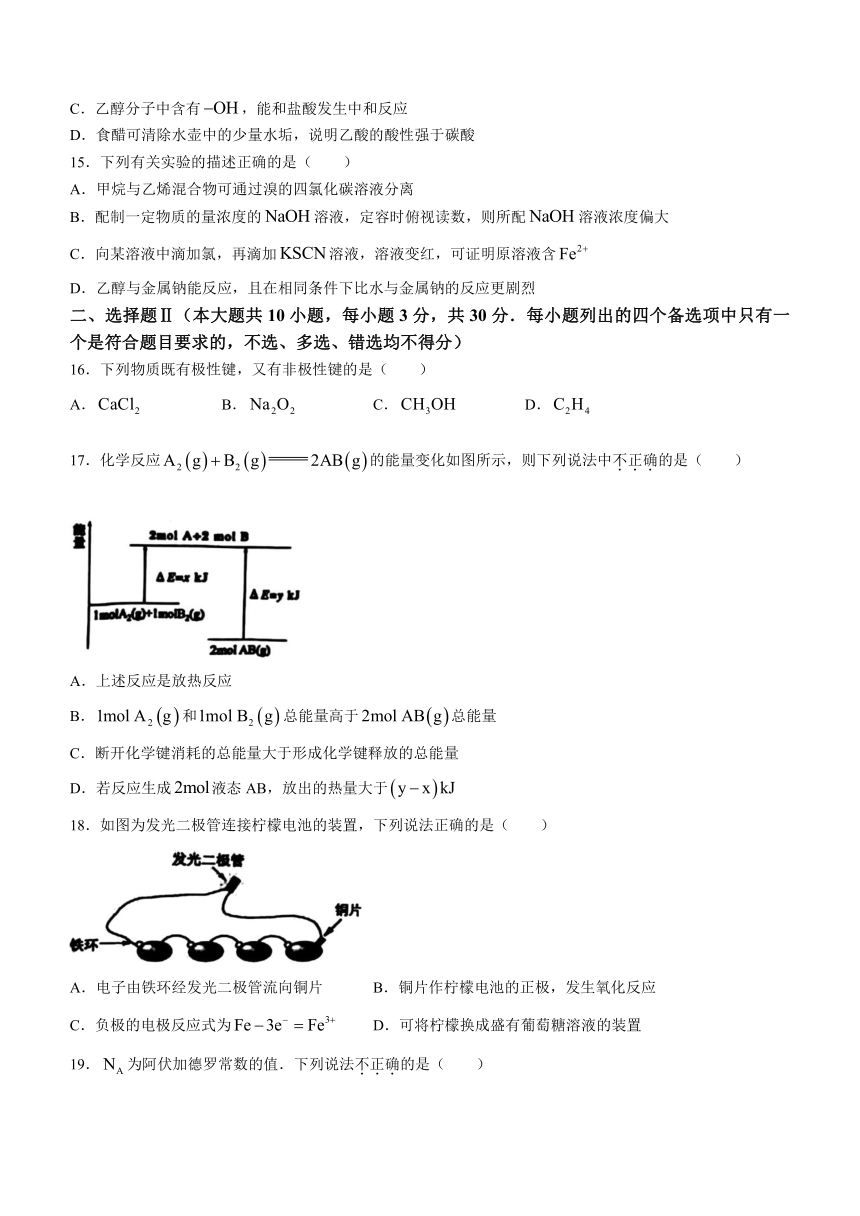
15.下列有关实验的描述正确的是( )
A.甲烷与乙烯混合物可通过溴的四氯化碳溶液分离
B.配制一定物质的量浓度的溶液,定容时俯视读数,则所配溶液浓度偏大
C.向某溶液中滴加氯,再滴加溶液,溶液变红,可证明原溶液含
D.乙醇与金属钠能反应,且在相同条件下比水与金属钠的反应更剧烈
二、选择题Ⅱ(本大题共10小题,每小题3分,共30分.每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
16.下列物质既有极性键,又有非极性键的是( )
A. B. C. D.
17.化学反应的能量变化如图所示,则下列说法中不正确的是( )
A.上述反应是放热反应
B.和总能量高于总能量
C.断开化学键消耗的总能量大于形成化学键释放的总能量
D.若反应生成液态AB,放出的热量大于
18.如图为发光二极管连接柠檬电池的装置,下列说法正确的是( )
A.电子由铁环经发光二极管流向铜片 B.铜片作柠檬电池的正极,发生氧化反应
C.负极的电极反应式为 D.可将柠檬换成盛有葡萄糖溶液的装置
19.为阿伏加德罗常数的值.下列说法不正确的是( )
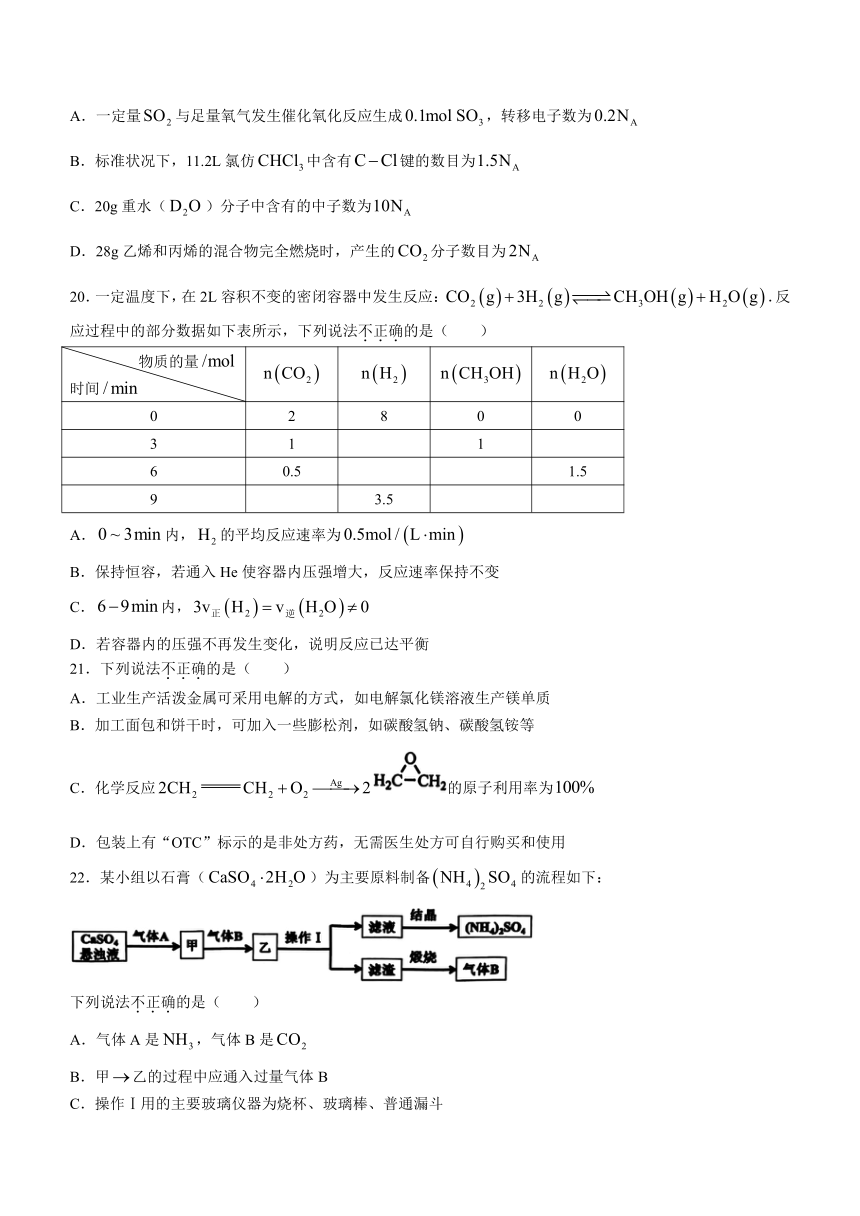
A.一定量与足量氧气发生催化氧化反应生成,转移电子数为
B.标准状况下,11.2L氯仿中含有键的数目为
C.20g重水()分子中含有的中子数为
D.28g乙烯和丙烯的混合物完全燃烧时,产生的分子数目为
20.一定温度下,在2L容积不变的密闭容器中发生反应:.反应过程中的部分数据如下表所示,下列说法不正确的是( )
物质的量 时间
0 2 8 0 0
3 1 1
6 0.5 1.5
9 3.5
A.内,的平均反应速率为
B.保持恒容,若通入He使容器内压强增大,反应速率保持不变
C.内,
D.若容器内的压强不再发生变化,说明反应已达平衡
21.下列说法不正确的是( )
A.工业生产活泼金属可采用电解的方式,如电解氯化镁溶液生产镁单质
B.加工面包和饼干时,可加入一些膨松剂,如碳酸氢钠、碳酸氢铵等
C.化学反应的原子利用率为
D.包装上有“OTC”标示的是非处方药,无需医生处方可自行购买和使用
22.某小组以石膏()为主要原料制备的流程如下:
下列说法不正确的是( )
A.气体A是,气体B是
B.甲乙的过程中应通入过量气体B
C.操作Ⅰ用的主要玻璃仪器为烧杯、玻璃棒、普通漏斗
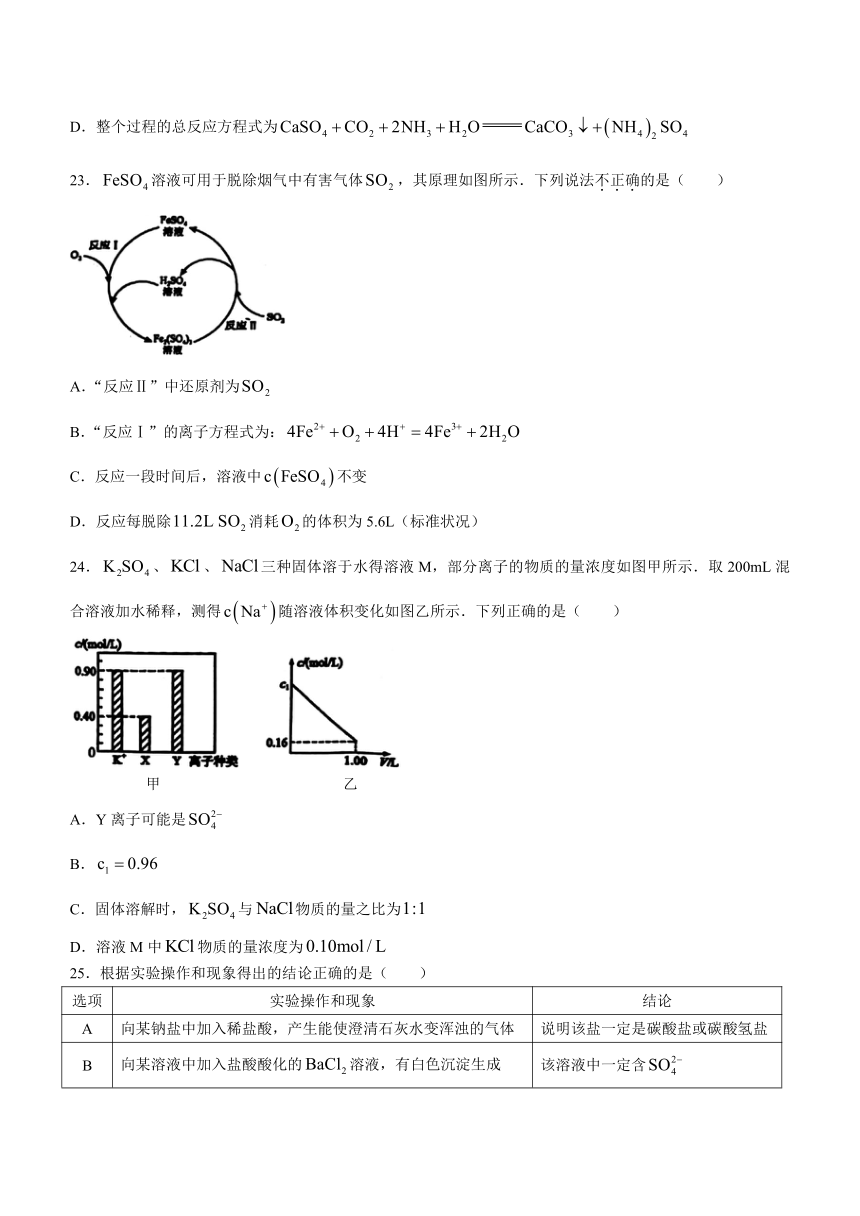
D.整个过程的总反应方程式为
23.溶液可用于脱除烟气中有害气体,其原理如图所示.下列说法不正确的是( )
A.“反应Ⅱ”中还原剂为
B.“反应Ⅰ”的离子方程式为:
C.反应一段时间后,溶液中不变
D.反应每脱除消耗的体积为5.6L(标准状况)
24.、、三种固体溶于水得溶液M,部分离子的物质的量浓度如图甲所示.取200mL混合溶液加水稀释,测得随溶液体积变化如图乙所示.下列正确的是( )
甲 乙
A.Y离子可能是
B.
C.固体溶解时,与物质的量之比为
D.溶液M中物质的量浓度为
25.根据实验操作和现象得出的结论正确的是( )
选项 实验操作和现象 结论
A 向某钠盐中加入稀盐酸,产生能使澄清石灰水变浑浊的气体 说明该盐一定是碳酸盐或碳酸氢盐
B 向某溶液中加入盐酸酸化的溶液,有白色沉淀生成 该溶液中一定含
C 向某溶液中滴加少量溶液,没有产生能使湿润红色石蕊试纸变蓝的刺激性气体 该溶液中不含
D 向沉淀中滴加溶液,沉淀溶解 铝有一定的非金属性
A.A B.B C.C D.D
非选择题部分
三、非选择题(本大题共5小题,共40分)
26.(8分)请回答:
(1)蔗糖的分子式是________;的电子式是________.
(2)向溶液中滴加溶液,可观察到________,最终变成红褐色沉淀.
(3)浓硫酸与木炭加热时的化学反应方程式是________.
27.(8分)土豆丝放入水中浸泡,水变浑浊并产生白色沉淀,其主要成分是有机物A,A遇碘会变蓝.以A为原料获得有机物E的转化关系如下图,已知E是有香味的无色油状液体.F含有甲基,且与乙酸、乙醇均能发生酯化反应.
请回答:
(1)B所含官能团的名称为________.
(2)写出F的结构简式________.
(3)下列说法正确的是________.
A.检验反应是否进行完全,可取样加入溶液碱化后,再加入新制氢氧化铜悬浊液并加热,看是否产生砖红色沉淀
B.用碳酸钠溶液可以鉴别C、D和E
C.有机物C、D、F都能与金属钠反应
D,两分子F可发生酯化反应生成环状的酯
(4)G是F的同分异构体,与乙酸、乙醇也均能发生酯化反应.写出G与乙酸发生酯化反应的方程式________.
28.(8分)硫酸渣是黄铁矿制备硫酸过程中得到的焙烧渣,主要含、等,工业上可用硫酸渣生产四氧化三铁.
已知:“还原”时,发生反应;与不反应.
请回答:
(1)滤渣的主要成分是________.
(2)溶于足量盐酸的离子方程式为________.
(3)下列有关说法不正确的是________.
A.“酸溶”时适当提高硫酸浓度可加快反应速率
B.滤液经结晶过滤可得副产品芒硝
C.可由或铁粉替代
D.“还原”时氧化产物与还原产物的物质的量之比为
(4)“氧化”的条件为高温,写出该反应的化学方程式________.
29.(10分)氨的催化氧化:是工业生产硝酸的重要步骤.某化学活动小组设计了如下装置模拟该实验过程,并检验产物性质(部分固定装置略去).
请回答:
(1)装置A发生的反应有浓氨水的分解,还有________(用化学方程式表示).
(2)装置B的名称为________,B中的药品X为________(填选项).
A.浓硫酸 B.胆矾 C.碱石灰 D.碳酸钙
(3)反应后,装置E中除存在较多的、外,还可能存在的一种阳离子是________,试设计实验证明这种离子的存在________.
(4)E中产生的离子反应方程式是________.
30.(6分)有一份含镁、铝的合金粉末样品,将其分为两等份,向第一份样品中加入过量的氢氧化钠溶液,得到(标准状况),向第二份样品中加入的盐酸,完全反应后,得到(标准状况).
请计算:
(1)原样品中铝的物质的量为________.
(2)该合金中镁、铝的物质的量之比为________.
(3)为将第二份样品反应后的溶液中的镁、铝元素完全分开,至少需加入的溶液________mL.
参考答案
一、选择题Ⅰ(本大题共15小题,每小题2分,共30分)
题号 1 2 3 4 5 6 7 8 9 10
答案 C C A A B C D B D B
题号 11 12 13 14 15
答案 D A D C B
二、选择题Ⅱ(本大题共10小题,每小题3分,共30分)
题号 16 17 18 19 20 21 22 23 24 25
答案 D C A B C A B C D D
三、非选择题(本大题共5小题,共40分)
26.(共8分,每空2分)
(1)
(2)先产生白色沉淀,迅速变为灰绿色
(3)(浓)
27.(共8分,每空2分)
(1)羟基、醛基 (2) (3)BCD
(4)
28.(共8分,每空2分)
(1) (2)
(3)D (4)
29.(共10分)(1)
(2)U型管 C
(3) 取少许E中溶液于试管,加入足量的氢氧化钠浓溶液,加热,若产生能使湿润的红色石蕊试纸变蓝的气体,证明E溶液中含有
(4)
30.(共6分,每空2分)(1) (2) (3)110
化学试题
本试题满分100分,考试时间60分钟.
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32
Cl 35.5 Fe 56 Cu 64 Ba 137
一、选择题Ⅰ(本大题共15小题,每小题2分,共30分.每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.纯碱的化学式是( )
A. B. C. D.
2.按物质的组成进行分类,属于( )
A.酸 B.氧化物 C.盐 D.有机物
3.用浓硫酸稀释配制硫酸溶液,不需要用到的实验仪器是( )
A. B. C. D.
4.下列物质属于非电解质的是( )
A. B.盐酸 C.Si D.
5.反应中,氧化剂是( )
A. B. C. D.
6.下列物质所含分子数与所含分子数相同的是( )
A. B. C. D.
7.下列属于物理变化的是( )
A.葡萄糖在体内氧化 B.油脂的水解 C.煤的干馏 D.石油的分馏
8.下列物质对应的化学式不正确的是( )
A.石英: B.重晶石: C.黄铁矿: D.熟石膏:
9.下列说法不正确的是( )
A.和互为同系物 B.石墨和石墨烯互为同素异形体
C.正戊烷和异戊烷互为同分异构体 D.和互为同位素
10.下列说法不正确的是( )
A.干燥的氯气能使鲜花褪色
B.二氧化硅可用于制作光学玻璃、集成电路和光导纤维
C.二氧化硫可用作蜜饯、干果等食品的添加剂
D.工业上可用铁或铝制容器来储运浓硫酸和浓硝酸
11.下表是元素周期表的一部分,①~⑥代表6种短周期主族元素,已知③原子的最外层电子数是其内层电子总数的3倍.
① ② ③
④ ⑤ ⑥ ⑦
下列说法不正确的是( )
A.原子半径的大小顺序:④⑤①②
B.最高价氧化物对应水化物酸性:①②
C.③和④可形成含共价键的离子化合物
D.气态氢化物热稳定性:⑥③
12.下列化学用语书写正确的是( )
A.钠与乙酸反应的离子方程式:
B.碳酸氢钠溶液中滴入澄清石灰水:
C.用电子式表示的形成过程:
D.用足量氢氧化钠溶液吸收氯气的离子方程式:
13.下列有关实验的叙述正确的是( )
A.实验室制取氨气 B.A处通入氯气,C处布条不褪色,推测B处可能盛放饱和溶液 C.除去乙烯中混有的 D.除去气体中的氯化氢杂质
A.A B.B C.C D.D
14.下列说法不正确的是( )
A.苯()属于芳香烃,其一溴代物只有一种
B.高级脂肪酸甘油酯在碱性条件下可发生水解反应,又称为皂化反应
C.乙醇分子中含有,能和盐酸发生中和反应
D.食醋可清除水壶中的少量水垢,说明乙酸的酸性强于碳酸
15.下列有关实验的描述正确的是( )
A.甲烷与乙烯混合物可通过溴的四氯化碳溶液分离
B.配制一定物质的量浓度的溶液,定容时俯视读数,则所配溶液浓度偏大
C.向某溶液中滴加氯,再滴加溶液,溶液变红,可证明原溶液含
D.乙醇与金属钠能反应,且在相同条件下比水与金属钠的反应更剧烈
二、选择题Ⅱ(本大题共10小题,每小题3分,共30分.每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
16.下列物质既有极性键,又有非极性键的是( )
A. B. C. D.
17.化学反应的能量变化如图所示,则下列说法中不正确的是( )
A.上述反应是放热反应
B.和总能量高于总能量
C.断开化学键消耗的总能量大于形成化学键释放的总能量
D.若反应生成液态AB,放出的热量大于
18.如图为发光二极管连接柠檬电池的装置,下列说法正确的是( )
A.电子由铁环经发光二极管流向铜片 B.铜片作柠檬电池的正极,发生氧化反应
C.负极的电极反应式为 D.可将柠檬换成盛有葡萄糖溶液的装置
19.为阿伏加德罗常数的值.下列说法不正确的是( )
A.一定量与足量氧气发生催化氧化反应生成,转移电子数为
B.标准状况下,11.2L氯仿中含有键的数目为
C.20g重水()分子中含有的中子数为
D.28g乙烯和丙烯的混合物完全燃烧时,产生的分子数目为
20.一定温度下,在2L容积不变的密闭容器中发生反应:.反应过程中的部分数据如下表所示,下列说法不正确的是( )
物质的量 时间
0 2 8 0 0
3 1 1
6 0.5 1.5
9 3.5
A.内,的平均反应速率为
B.保持恒容,若通入He使容器内压强增大,反应速率保持不变
C.内,
D.若容器内的压强不再发生变化,说明反应已达平衡
21.下列说法不正确的是( )
A.工业生产活泼金属可采用电解的方式,如电解氯化镁溶液生产镁单质
B.加工面包和饼干时,可加入一些膨松剂,如碳酸氢钠、碳酸氢铵等
C.化学反应的原子利用率为
D.包装上有“OTC”标示的是非处方药,无需医生处方可自行购买和使用
22.某小组以石膏()为主要原料制备的流程如下:
下列说法不正确的是( )
A.气体A是,气体B是
B.甲乙的过程中应通入过量气体B
C.操作Ⅰ用的主要玻璃仪器为烧杯、玻璃棒、普通漏斗
D.整个过程的总反应方程式为
23.溶液可用于脱除烟气中有害气体,其原理如图所示.下列说法不正确的是( )
A.“反应Ⅱ”中还原剂为
B.“反应Ⅰ”的离子方程式为:
C.反应一段时间后,溶液中不变
D.反应每脱除消耗的体积为5.6L(标准状况)
24.、、三种固体溶于水得溶液M,部分离子的物质的量浓度如图甲所示.取200mL混合溶液加水稀释,测得随溶液体积变化如图乙所示.下列正确的是( )
甲 乙
A.Y离子可能是
B.
C.固体溶解时,与物质的量之比为
D.溶液M中物质的量浓度为
25.根据实验操作和现象得出的结论正确的是( )
选项 实验操作和现象 结论
A 向某钠盐中加入稀盐酸,产生能使澄清石灰水变浑浊的气体 说明该盐一定是碳酸盐或碳酸氢盐
B 向某溶液中加入盐酸酸化的溶液,有白色沉淀生成 该溶液中一定含
C 向某溶液中滴加少量溶液,没有产生能使湿润红色石蕊试纸变蓝的刺激性气体 该溶液中不含
D 向沉淀中滴加溶液,沉淀溶解 铝有一定的非金属性
A.A B.B C.C D.D
非选择题部分
三、非选择题(本大题共5小题,共40分)
26.(8分)请回答:
(1)蔗糖的分子式是________;的电子式是________.
(2)向溶液中滴加溶液,可观察到________,最终变成红褐色沉淀.
(3)浓硫酸与木炭加热时的化学反应方程式是________.
27.(8分)土豆丝放入水中浸泡,水变浑浊并产生白色沉淀,其主要成分是有机物A,A遇碘会变蓝.以A为原料获得有机物E的转化关系如下图,已知E是有香味的无色油状液体.F含有甲基,且与乙酸、乙醇均能发生酯化反应.
请回答:
(1)B所含官能团的名称为________.
(2)写出F的结构简式________.
(3)下列说法正确的是________.
A.检验反应是否进行完全,可取样加入溶液碱化后,再加入新制氢氧化铜悬浊液并加热,看是否产生砖红色沉淀
B.用碳酸钠溶液可以鉴别C、D和E
C.有机物C、D、F都能与金属钠反应
D,两分子F可发生酯化反应生成环状的酯
(4)G是F的同分异构体,与乙酸、乙醇也均能发生酯化反应.写出G与乙酸发生酯化反应的方程式________.
28.(8分)硫酸渣是黄铁矿制备硫酸过程中得到的焙烧渣,主要含、等,工业上可用硫酸渣生产四氧化三铁.
已知:“还原”时,发生反应;与不反应.
请回答:
(1)滤渣的主要成分是________.
(2)溶于足量盐酸的离子方程式为________.
(3)下列有关说法不正确的是________.
A.“酸溶”时适当提高硫酸浓度可加快反应速率
B.滤液经结晶过滤可得副产品芒硝
C.可由或铁粉替代
D.“还原”时氧化产物与还原产物的物质的量之比为
(4)“氧化”的条件为高温,写出该反应的化学方程式________.
29.(10分)氨的催化氧化:是工业生产硝酸的重要步骤.某化学活动小组设计了如下装置模拟该实验过程,并检验产物性质(部分固定装置略去).
请回答:
(1)装置A发生的反应有浓氨水的分解,还有________(用化学方程式表示).
(2)装置B的名称为________,B中的药品X为________(填选项).
A.浓硫酸 B.胆矾 C.碱石灰 D.碳酸钙
(3)反应后,装置E中除存在较多的、外,还可能存在的一种阳离子是________,试设计实验证明这种离子的存在________.
(4)E中产生的离子反应方程式是________.
30.(6分)有一份含镁、铝的合金粉末样品,将其分为两等份,向第一份样品中加入过量的氢氧化钠溶液,得到(标准状况),向第二份样品中加入的盐酸,完全反应后,得到(标准状况).
请计算:
(1)原样品中铝的物质的量为________.
(2)该合金中镁、铝的物质的量之比为________.
(3)为将第二份样品反应后的溶液中的镁、铝元素完全分开,至少需加入的溶液________mL.
参考答案
一、选择题Ⅰ(本大题共15小题,每小题2分,共30分)
题号 1 2 3 4 5 6 7 8 9 10
答案 C C A A B C D B D B
题号 11 12 13 14 15
答案 D A D C B
二、选择题Ⅱ(本大题共10小题,每小题3分,共30分)
题号 16 17 18 19 20 21 22 23 24 25
答案 D C A B C A B C D D
三、非选择题(本大题共5小题,共40分)
26.(共8分,每空2分)
(1)
(2)先产生白色沉淀,迅速变为灰绿色
(3)(浓)
27.(共8分,每空2分)
(1)羟基、醛基 (2) (3)BCD
(4)
28.(共8分,每空2分)
(1) (2)
(3)D (4)
29.(共10分)(1)
(2)U型管 C
(3) 取少许E中溶液于试管,加入足量的氢氧化钠浓溶液,加热,若产生能使湿润的红色石蕊试纸变蓝的气体,证明E溶液中含有
(4)
30.(共6分,每空2分)(1) (2) (3)110
同课章节目录
