2.3.1 共价键的极性 课件 (共22张ppt) 2023-2024学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3.1 共价键的极性 课件 (共22张ppt) 2023-2024学年高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-01 15:22:00 | ||
图片预览







文档简介
(共22张PPT)
第二章 分子结构与性质
分子结构与物质的性质
1.认识键的极性与分子极性的联系。
2.掌握判断键的极性以及分子极性的方法,熟悉常见分子的极性 。
1.共价键的分类
共价键
极性共价键
非极性共价键
由不同原子形成的共价键,电子对会发生偏移
由相同原子形成的共价键,电子对不发生偏移
极性键中的两个键合电子,一个呈正电性(δ+),另一个呈负电性(δ-)。
一、共价键的极性
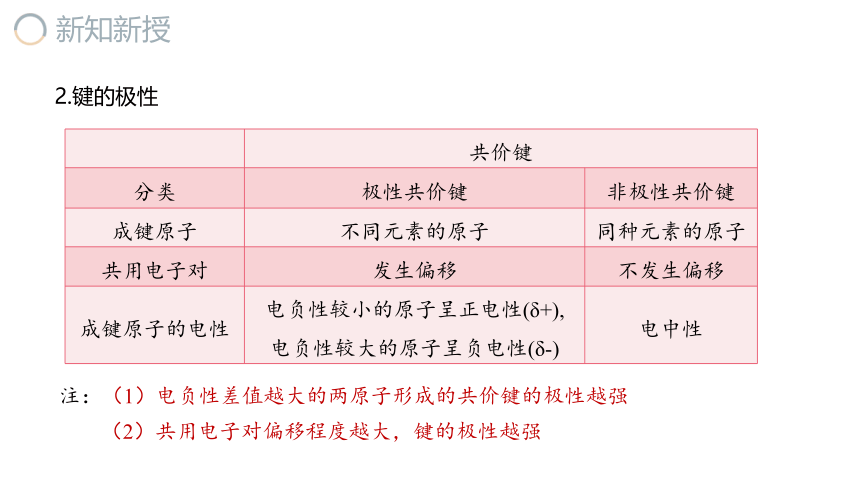
2.键的极性
共价键 分类 极性共价键 非极性共价键
成键原子 不同元素的原子 同种元素的原子
共用电子对 发生偏移 不发生偏移
成键原子的电性 电负性较小的原子呈正电性(δ+), 电负性较大的原子呈负电性(δ-) 电中性
注:(1)电负性差值越大的两原子形成的共价键的极性越强
(2)共用电子对偏移程度越大,键的极性越强
3.键的极性判断方法
(1)根据组成元素:
同种元素:A-A型为非极性键
不同种元素:A-B型为极性键
(2)根据共用电子对是否偏移:
共用电子对有偏移:极性键
共用电子对没有偏移:非极性键
(3)根据元素的电负性:
成键原子电负性相同:非极性键
成键原子电负性不同:极性键
3.键的极性判断方法
注意:键的极性只取决于成键原子的元素种类或电负性的差异,与其他因素无关。
同种非金属元素原子间形成的共价键是非极性键
不同种非金属元素原子间形成的共价键是极性键
根据共用电子对是否偏移,共价键有极性键、非极性键之分。
分子的极性又是根据什么来判定呢?
以共价键结合的分子是否也有极性分子、非极性分子之分呢?
极性的表示方法——极性向量
极性向量可形象地描述极性键的电荷分布情况,极性向量指向的一端,说明该处负电荷更为集中。
δ+
δ-
方向由正电中心指向负电中心
非极性键无极性向量,说明在非极性键里,正负电荷的中心是重合的。
1.非极性分子
电荷分布均匀、对称的分子或者:正电荷中心与负电荷中心重合,
即键的极性的向量和为0
2.极性分子
电荷分布不均匀、不对称的分子
或者:正电荷中心与负电荷中心不重合,即键的极性的向量和不为0
要对分子极性进行判断,也可用极性向量。
极性向量的矢量和指向的一端,说明该处负电荷更为集中,为极性分子。
若矢量和为零,为非极性分子。
二、分子的极性
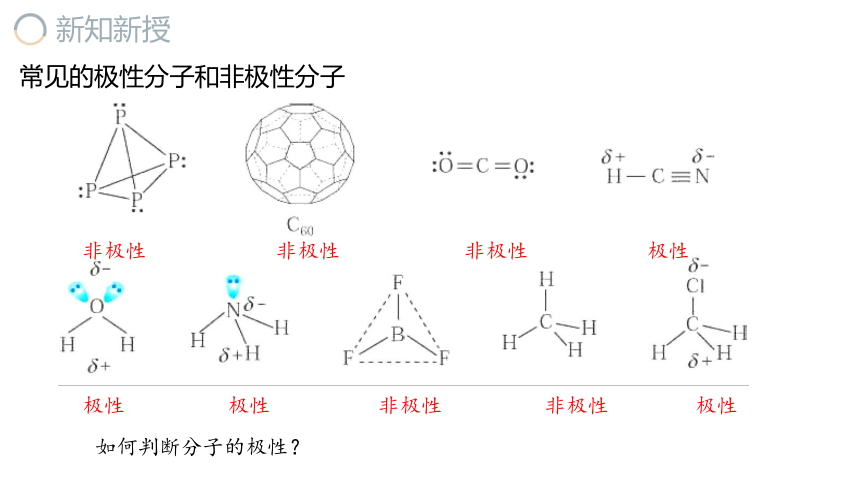
常见的极性分子和非极性分子
如何判断分子的极性?
非极性 非极性 非极性 极性
极性 极性 非极性 非极性 极性
【思考与讨论】
(1)以下双原子分子中,哪些是极性分子,哪些是非极性分子
H2 O2 Cl2 HCl
双原子分子中,单质是非极性分子;化合物是极性分子。
H2 O2、 Cl2 是非极性分子;HCl是极性分子
(2)P4和C60是极性分子还是非极性分子
只含非极性键的分子一定是非极性分子。
都是非极性分子
化合物分子中,分子空间结构对称的是非极性分子,如对称的直线形,平面正三角形,正四面体形;分子空间结构不对称的是极性分子 ,如不对称的直线形,V形,三角锥形。
(3)以下化合物分子中,哪些是极性分子,哪些是非极性分子
CO2 HCN H2O NH3 BF3 CH4 CH3Cl
CO2、BF3、CH4都是非极性分子,HCN、H2O、NH3、CH3Cl都是极性分子
判断分子的极性可依据分子中化学键的极性的向量和。
只含非极性键的分子一定是非极性分子;含极性键的分子有没有极性,必修依据分子中极性键的极性的向量和是否等于零而定。当分子中各个键的极性的向量和等于零时,是非极性分子,否则是极性分子。或者,我们可根据分子的正电中心和负电中心是否重合来判断它是否是极性分子。
3.分子的极性的判断方法
(1)单原子分子(稀有气体)
(2)双原子分子
单质
化合物
非极性分子
极性分子
注意:取决于原子间的共价键是否有极性。
是一种重要物质。大气高空的臭氧层;
保护了地球生物的生存;空气质量预报中臭氧含量是空气质量的重要指标;它还是有机合成的氧化剂、替代氯气的净水剂……
臭氧分子的空间结构与水分子的相似,臭氧分子中的共价键是极性键,臭氧分子有极性,但很微弱。仅是水分子的极性的28%。其中心氧原子是呈正电性的,而端位的两个氧原子是呈电负性的。
臭氧是极性分子
键的极性对物质的化学性质有重要影响。例如,羧酸是一大类含羧基的有机酸。羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。
pKa=-lgKa
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
三、键的极性对化学性质的影响
三氟乙酸的酸性大于三氯乙酸
F的电负性
Cl的电负性
>
F-C的极性
Cl-C的极性
>
F3-C的极性
Cl3-C的极性
>
三氟乙酸的羧基中的羟基的极性更大
三氟乙酸更容易电离出氢离子
三氟乙酸的酸性强于三氯乙酸,这是由于氟的电负性大于氯的电负性,C—F键的极性大于C—Cl键,导致羧基中的O—H键的极性更大,更易电离出氢离子。
据此,酸性关系:
CCl3COOH>CHCl2COOH
>CH2ClCOOH
甲酸的酸性大于乙酸
烃基(符号R-)是推电子基团
烃基越长推电子效应越大
使羧基中的羟基的极性越小
羧酸的酸性越弱
随着烃基加长,酸性的差异越来越小
烃基(符号R—)是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。所以酸性:甲酸>乙酸>丙酸
1、键的极性对羧酸酸性大小的影响实质是通过改变羧基中羟基的极性而实现的,羧基中羟基的极性越大,越容易电离出H+,则羧酸的酸性越大。
2、与羧基相邻的共价键的极性越大,过传导作用使羧基中羟基的极性越大,则羧酸的酸性越大。
3、烃基是推电子基团,即将电子推向羟基,从而减小羟基的极性,导致羧酸的酸性减小。一般地,烃基越长,推电子效应越大,羧酸的酸性越小。
(1)根据元素周期律判断。
①同一主族元素的非金属氢化物的酸性从上到下逐渐增强,如HF②同一周期元素的非金属氢化物的酸性从左向右逐渐增强,如H2S③同一主族元素最高价氧化物对应水化物的酸性从上到下逐渐减弱,如HClO4>HBrO4>HIO4;HNO3>H3PO4;H2CO3>H2SiO3。
④同一周期元素最高价氧化物对应水化物的酸性从左向右逐渐增强,如H3PO4判断物质酸性强弱的方法
①.极性分子中不可能含有非极性键。 ( )
②.离子化合物中不可能含有非极性键。( )
③.非极性分子中不可能含有极性键。( )
④.极性分子中一定含有极性键。( )
⑤.H2O、CO2、CH4都是非极性分子。( )
1.判断正误(正确的打“√”,错误的打“×”)
√
×
×
×
×
D
2.在下列物质中,分子中电荷空间分布对称的是( )
①CO2 ②CCl4 ③NH3 ④H2O ⑤HBr
A.①②④ B.②④⑤ C.③⑤ D.①②
A
3.下列物质中,由极性键形成的非极性分子是( )
A. CO2 B. Br2 C. CaCl2 D. SO2
4.无机含氧酸酸性的强弱规律之一为:成酸元素的化合价越高,酸性越强。下列说法正确的是( )
A.根据这一规律高氯酸是强酸
B.H3PO4的酸性比盐酸的酸性强
C.碳酸比亚硫酸的酸性强
D.硝酸与磷酸的酸性强度一样
A
5.下列关于粒子结构的描述不正确的是( )
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含1个极性键的18电子粒子
C.CH2Cl2和CCl4均是空间结构为四面体形的非极性分子
D.SO2和SO3中心原子的杂化轨道类型均为sp2,空间构型分别为V形、平面三角形
C
6.下列物质:①BeCl2 ②Ar ③白磷 ④BF3 ⑤NH3 ⑥H2O2,其中含极性键的非极性分子是( )
A.①④⑥ B.②③⑥ C.①④ D.①③④⑤
C
第二章 分子结构与性质
分子结构与物质的性质
1.认识键的极性与分子极性的联系。
2.掌握判断键的极性以及分子极性的方法,熟悉常见分子的极性 。
1.共价键的分类
共价键
极性共价键
非极性共价键
由不同原子形成的共价键,电子对会发生偏移
由相同原子形成的共价键,电子对不发生偏移
极性键中的两个键合电子,一个呈正电性(δ+),另一个呈负电性(δ-)。
一、共价键的极性
2.键的极性
共价键 分类 极性共价键 非极性共价键
成键原子 不同元素的原子 同种元素的原子
共用电子对 发生偏移 不发生偏移
成键原子的电性 电负性较小的原子呈正电性(δ+), 电负性较大的原子呈负电性(δ-) 电中性
注:(1)电负性差值越大的两原子形成的共价键的极性越强
(2)共用电子对偏移程度越大,键的极性越强
3.键的极性判断方法
(1)根据组成元素:
同种元素:A-A型为非极性键
不同种元素:A-B型为极性键
(2)根据共用电子对是否偏移:
共用电子对有偏移:极性键
共用电子对没有偏移:非极性键
(3)根据元素的电负性:
成键原子电负性相同:非极性键
成键原子电负性不同:极性键
3.键的极性判断方法
注意:键的极性只取决于成键原子的元素种类或电负性的差异,与其他因素无关。
同种非金属元素原子间形成的共价键是非极性键
不同种非金属元素原子间形成的共价键是极性键
根据共用电子对是否偏移,共价键有极性键、非极性键之分。
分子的极性又是根据什么来判定呢?
以共价键结合的分子是否也有极性分子、非极性分子之分呢?
极性的表示方法——极性向量
极性向量可形象地描述极性键的电荷分布情况,极性向量指向的一端,说明该处负电荷更为集中。
δ+
δ-
方向由正电中心指向负电中心
非极性键无极性向量,说明在非极性键里,正负电荷的中心是重合的。
1.非极性分子
电荷分布均匀、对称的分子或者:正电荷中心与负电荷中心重合,
即键的极性的向量和为0
2.极性分子
电荷分布不均匀、不对称的分子
或者:正电荷中心与负电荷中心不重合,即键的极性的向量和不为0
要对分子极性进行判断,也可用极性向量。
极性向量的矢量和指向的一端,说明该处负电荷更为集中,为极性分子。
若矢量和为零,为非极性分子。
二、分子的极性
常见的极性分子和非极性分子
如何判断分子的极性?
非极性 非极性 非极性 极性
极性 极性 非极性 非极性 极性
【思考与讨论】
(1)以下双原子分子中,哪些是极性分子,哪些是非极性分子
H2 O2 Cl2 HCl
双原子分子中,单质是非极性分子;化合物是极性分子。
H2 O2、 Cl2 是非极性分子;HCl是极性分子
(2)P4和C60是极性分子还是非极性分子
只含非极性键的分子一定是非极性分子。
都是非极性分子
化合物分子中,分子空间结构对称的是非极性分子,如对称的直线形,平面正三角形,正四面体形;分子空间结构不对称的是极性分子 ,如不对称的直线形,V形,三角锥形。
(3)以下化合物分子中,哪些是极性分子,哪些是非极性分子
CO2 HCN H2O NH3 BF3 CH4 CH3Cl
CO2、BF3、CH4都是非极性分子,HCN、H2O、NH3、CH3Cl都是极性分子
判断分子的极性可依据分子中化学键的极性的向量和。
只含非极性键的分子一定是非极性分子;含极性键的分子有没有极性,必修依据分子中极性键的极性的向量和是否等于零而定。当分子中各个键的极性的向量和等于零时,是非极性分子,否则是极性分子。或者,我们可根据分子的正电中心和负电中心是否重合来判断它是否是极性分子。
3.分子的极性的判断方法
(1)单原子分子(稀有气体)
(2)双原子分子
单质
化合物
非极性分子
极性分子
注意:取决于原子间的共价键是否有极性。
是一种重要物质。大气高空的臭氧层;
保护了地球生物的生存;空气质量预报中臭氧含量是空气质量的重要指标;它还是有机合成的氧化剂、替代氯气的净水剂……
臭氧分子的空间结构与水分子的相似,臭氧分子中的共价键是极性键,臭氧分子有极性,但很微弱。仅是水分子的极性的28%。其中心氧原子是呈正电性的,而端位的两个氧原子是呈电负性的。
臭氧是极性分子
键的极性对物质的化学性质有重要影响。例如,羧酸是一大类含羧基的有机酸。羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。
pKa=-lgKa
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
三、键的极性对化学性质的影响
三氟乙酸的酸性大于三氯乙酸
F的电负性
Cl的电负性
>
F-C的极性
Cl-C的极性
>
F3-C的极性
Cl3-C的极性
>
三氟乙酸的羧基中的羟基的极性更大
三氟乙酸更容易电离出氢离子
三氟乙酸的酸性强于三氯乙酸,这是由于氟的电负性大于氯的电负性,C—F键的极性大于C—Cl键,导致羧基中的O—H键的极性更大,更易电离出氢离子。
据此,酸性关系:
CCl3COOH>CHCl2COOH
>CH2ClCOOH
甲酸的酸性大于乙酸
烃基(符号R-)是推电子基团
烃基越长推电子效应越大
使羧基中的羟基的极性越小
羧酸的酸性越弱
随着烃基加长,酸性的差异越来越小
烃基(符号R—)是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。所以酸性:甲酸>乙酸>丙酸
1、键的极性对羧酸酸性大小的影响实质是通过改变羧基中羟基的极性而实现的,羧基中羟基的极性越大,越容易电离出H+,则羧酸的酸性越大。
2、与羧基相邻的共价键的极性越大,过传导作用使羧基中羟基的极性越大,则羧酸的酸性越大。
3、烃基是推电子基团,即将电子推向羟基,从而减小羟基的极性,导致羧酸的酸性减小。一般地,烃基越长,推电子效应越大,羧酸的酸性越小。
(1)根据元素周期律判断。
①同一主族元素的非金属氢化物的酸性从上到下逐渐增强,如HF
④同一周期元素最高价氧化物对应水化物的酸性从左向右逐渐增强,如H3PO4
①.极性分子中不可能含有非极性键。 ( )
②.离子化合物中不可能含有非极性键。( )
③.非极性分子中不可能含有极性键。( )
④.极性分子中一定含有极性键。( )
⑤.H2O、CO2、CH4都是非极性分子。( )
1.判断正误(正确的打“√”,错误的打“×”)
√
×
×
×
×
D
2.在下列物质中,分子中电荷空间分布对称的是( )
①CO2 ②CCl4 ③NH3 ④H2O ⑤HBr
A.①②④ B.②④⑤ C.③⑤ D.①②
A
3.下列物质中,由极性键形成的非极性分子是( )
A. CO2 B. Br2 C. CaCl2 D. SO2
4.无机含氧酸酸性的强弱规律之一为:成酸元素的化合价越高,酸性越强。下列说法正确的是( )
A.根据这一规律高氯酸是强酸
B.H3PO4的酸性比盐酸的酸性强
C.碳酸比亚硫酸的酸性强
D.硝酸与磷酸的酸性强度一样
A
5.下列关于粒子结构的描述不正确的是( )
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含1个极性键的18电子粒子
C.CH2Cl2和CCl4均是空间结构为四面体形的非极性分子
D.SO2和SO3中心原子的杂化轨道类型均为sp2,空间构型分别为V形、平面三角形
C
6.下列物质:①BeCl2 ②Ar ③白磷 ④BF3 ⑤NH3 ⑥H2O2,其中含极性键的非极性分子是( )
A.①④⑥ B.②③⑥ C.①④ D.①③④⑤
C
