河南省周口市太康县第一高级中学2023-2024学年高一下学期期末考试化学试题(含解析)
文档属性
| 名称 | 河南省周口市太康县第一高级中学2023-2024学年高一下学期期末考试化学试题(含解析) |  | |
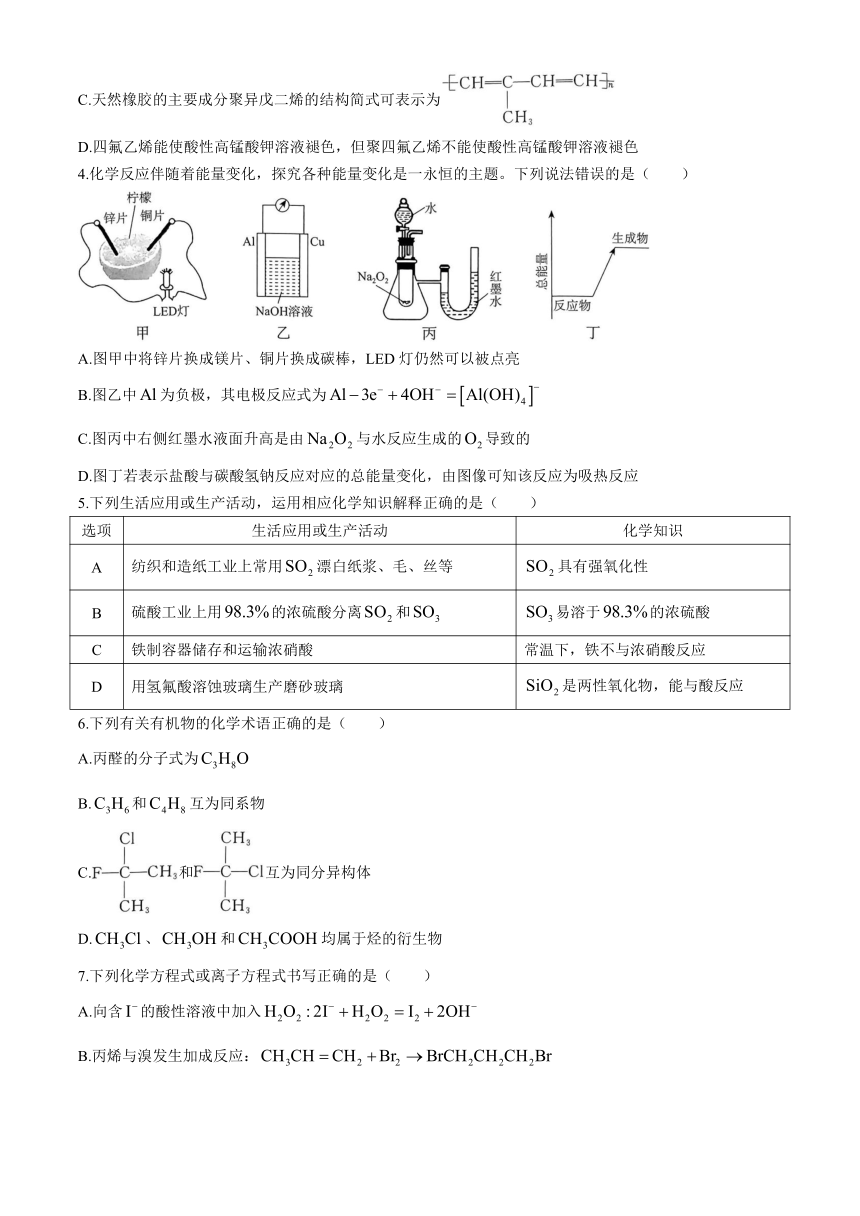
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-02 08:10:37 | ||
图片预览



文档简介
太康县第一高级中学2023-2024学年高一下学期期末考试
化学
全卷满分100分,考试时间75分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、班级、考场号、座位号、考生号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Zn-65 Pb-207
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.花鼓灯是国家级非物质文化遗产之一。铿锵的锣鼓,翻飞的巾、扇、伞,是花鼓灯表演的必备器具。下列说法错误的是( )
A.“花鼓灯”中使用的锣采用黄铜作原料,黄铜的硬度低于纯铜
B.“花鼓灯”中使用的鼓上的鼓皮由羊皮制作而成,羊皮的主要成分为蛋白质
C.“花鼓灯”中使用的巾是由棉花纺织而成,棉花的主要成分为纤维素
D.“花鼓灯”中使用的扇和伞均由丝绸和竹子制作,可用灼烧的方法区分丝织品和棉织品
2.下列化学用语错误的是( )
A.异戊烷的结构简式:
B.甲基的电子式:
C.乙醇的分子结构模型:
D.油脂的结构通式:(、、代表高级脂肪酸的烃基)
3.下列有关有机物的结构、性质和检验的说法正确的是( )
A.油脂属于酯类有机物,所有油脂均不能使溴水褪色
B.向蔗糖水解液中直接加入新制检验其水解产物中是否有葡萄糖
C.天然橡胶的主要成分聚异戊二烯的结构简式可表示为
D.四氟乙烯能使酸性高锰酸钾溶液褪色,但聚四氟乙烯不能使酸性高锰酸钾溶液褪色
4.化学反应伴随着能量变化,探究各种能量变化是一永恒的主题。下列说法错误的是( )
A.图甲中将锌片换成镁片、铜片换成碳棒,LED灯仍然可以被点亮
B.图乙中为负极,其电极反应式为
C.图丙中右侧红墨水液面升高是由与水反应生成的导致的
D.图丁若表示盐酸与碳酸氢钠反应对应的总能量变化,由图像可知该反应为吸热反应
5.下列生活应用或生产活动,运用相应化学知识解释正确的是( )
选项 生活应用或生产活动 化学知识
A 纺织和造纸工业上常用漂白纸浆、毛、丝等 具有强氧化性
B 硫酸工业上用的浓硫酸分离和 易溶于的浓硫酸
C 铁制容器储存和运输浓硝酸 常温下,铁不与浓硝酸反应
D 用氢氟酸溶蚀玻璃生产磨砂玻璃 是两性氧化物,能与酸反应
6.下列有关有机物的化学术语正确的是( )
A.丙醛的分子式为
B.和互为同系物
C.和互为同分异构体
D.、和均属于烃的衍生物
7.下列化学方程式或离子方程式书写正确的是( )
A.向含的酸性溶液中加入
B.丙烯与溴发生加成反应:
C.足量的铁粉与稀硝酸混合:
D.正丙醇与氧气经催化生成丙醛:
8.1,2-二溴乙烷是无色油状液体,工业上可用海水晒盐后得到的苦卤制备1,2-二溴乙烷,其部分工艺流程如图所示:
下列说法错误的是( )
A.向“吹出塔”中通入热空气,利用溴的易挥发性,将溴吹出
B.“吸收塔”中发生氧化还原反应,其中作氧化剂
C.“分离”时的操作为分液
D.“制备”时发生的反应为加成反应
9.下列实验操作不能达到实验目的的是( )
选项 实验操作 实验目的
A 将浓硫酸滴入蔗糖中并不断搅拌,观察现象 验证浓硫酸具有脱水性和强氧化性
B 向烯丙醇中加入少量酸性高锰酸钾溶液,观察现象 验证烯丙醇含有碳碳双键
C 用两支试管分别取等浓度的鸡蛋清溶液和淀粉溶液,分别滴加几滴浓硝酸,加热后观察现象 鉴别鸡蛋清溶液和淀粉溶液
D 用两支试管分别取等浓度的蔗糖溶液和葡萄糖溶液,分别滴加银氨溶液,水浴加热后,观察现象 鉴别蔗糖和葡萄糖
10.利用和王水可分离提纯金银铜合金材质的马拉松纪念奖牌,其工艺流程如图所示,下列说法错误的是( )
已知:①王水是浓硝酸和浓盐酸以体积比为混合得到的混合物;
②“溶金”时会有气体逸出,溶液中金元素主要以形式存在。
A.浓硝酸应放置于棕色细口玻璃瓶中避光保存
B.“溶金”时发生反应的离子方程式为
C.“还原”制金的过程中若有生成,则理论上至少需要
D.“沉银”后所得的滤液主要是硝酸铜和硝酸钠的混合溶液
11.以乙烯为原料生产环氧乙烷()的反应过程中存在以下两步反应:
①
②
下列说法错误的是( )
A.反应①属于加成反应
B.可用溴的溶液鉴别乙烯和
C.氯气与水反应的离子方程式为
D.等物质的量的乙烯与环氧乙烷完全燃烧,消耗氧气的物质的量之比为
12.有机物4-羟基-1-环己烯-1-羧酸被广泛应用于化妆品中,其结构简式如图所示。下列关于该有机物的说法错误的是( )
A.分子式为
B.一定条件下既能与乙醇反应也能与乙酸反应
C.该有机物与足量的反应最多能生成
D.在铜的催化作用下与反应生成的产物中含有醛基
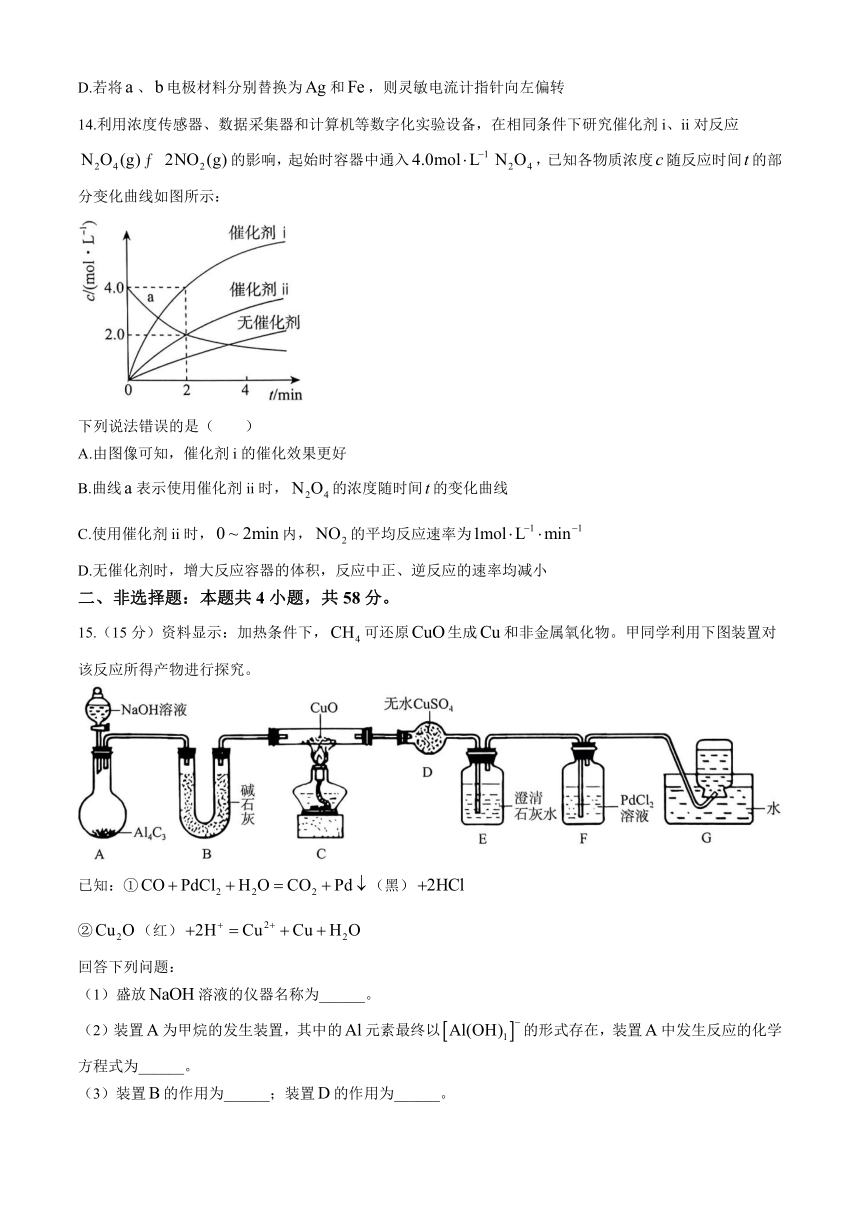
13.铅酸蓄电池中总反应的离子方程式为。电池的简易装置如图所示,已知放电时灵敏电流计指针向右偏转。下列说法错误的是( )
A.电池中电极为负极,发生氧化反应
B.放电时,溶液中的向电极移动
C.放电时,电极的质量减小,电极的质量增大
D.若将、电极材料分别替换为和,则灵敏电流计指针向左偏转
14.利用浓度传感器、数据采集器和计算机等数字化实验设备,在相同条件下研究催化剂i、ii对反应的影响,起始时容器中通入,已知各物质浓度随反应时间的部分变化曲线如图所示:
下列说法错误的是( )
A.由图像可知,催化剂i的催化效果更好
B.曲线表示使用催化剂ii时,的浓度随时间的变化曲线
C.使用催化剂ii时,内,的平均反应速率为
D.无催化剂时,增大反应容器的体积,反应中正、逆反应的速率均减小
二、非选择题:本题共4小题,共58分。
15.(15分)资料显示:加热条件下,可还原生成和非金属氧化物。甲同学利用下图装置对该反应所得产物进行探究。
已知:①(黑)
②(红)
回答下列问题:
(1)盛放溶液的仪器名称为______。
(2)装置为甲烷的发生装置,其中的元素最终以的形式存在,装置中发生反应的化学方程式为______。
(3)装置的作用为______;装置的作用为______。
(4)连接好实验装置并检验气密性后,应先______后______(填选项字母)。
a.打开分液漏斗的活塞 b.点燃酒精灯
(5)确认气体产物中有和的现象分别为______。
(6)乙同学认为固体产物中还可能含有。取少许固体产物,加入适量______,观察到______,证明固体产物中没有。
16.(14分)利用硅酸锂制备碳酸锂和高纯硅的工艺流程如图所示。
回答下列问题:
(1)“沉硅”过程发生反应的离子方程式为______。
(2)“过滤”所需的玻璃仪器有______。
(3)“浓缩”的目的为______。
(4)根据流程分析物质的溶解度:______(填“>”或“<”)。
(5)“制备”过程发生反应的化学方程式为______。
(6)“还原”过程中两种反应物的物质的量之比为______。
(7)写出两种高纯硅的用途:______。
17.(15分)丙烯酸仲丁酯是一种重要的有机物,被广泛应用于涂料和塑料制备中。结合下图中物质间的转化关系回答问题:
(1)丙烯酸仲丁酯的分子式为______。
(2)反应④的反应类型为______。
(3)有机物中的含氧官能团名称为______;有机物的官能团名称为______。
(4)聚合物的结构简式为______。
(5)反应②的化学方程式为______。
(6)反应⑤的化学方程式为______。
(7)与2-丁烯具有相同官能团的同分异构体有______种(不考虑立体异构)。
(8)下列关于丙烯酸仲丁酯的说法正确的是______(填选项字母)。
A.与乙酸乙酯属于同系物
B.常温下为液体,密度比水小
C.能使溴水和酸性高锰酸钾溶液褪色
D.能发生水解反应生成羧酸和醇
18.(14分)选择适当的催化剂在高温条件下可将汽车尾气中的、转化为无毒气体。已知反应原理为:。
回答下列问题:
(1)已知断开中的化学键要吸收的能量,断开中的化学键要吸收的能量,形成中的化学键要释放出的能量,形成中的化学键要释放出的能量,则该反应属于______反应(填“放热”或“吸热”)。
(2)已知在一定温度下,向密闭容器中充入、、、发生上述反应,反应过程中各物质的物质的量随时间变化的曲线如图甲所示:
甲
①表示的物质的量随时间变化的曲线为______(填曲线字母)。
②反应开始至,的平均反应速率为______。
③反应速率的大小:点正反应的速率______点逆反应的速率(填“”“”或“”)。
④关于上述反应,下列叙述错误的是______(填选项字母)。( )
A.通过调控反应条件,可以提高该反应进行的程度
B.升高温度可增大正反应的速率,降低逆反应的速率
C.平衡时充入使反应容器的压强增大,生成的反应速率不变
D.与的物质的量之比为,说明反应达到化学平衡
(3)可将上述反应设计成燃料电池,该电池的工作原理如图乙所示,电极、均为多孔性电极。
乙
①该装置中的能量转化形式为______。
②该电池中电子的流动方向为______。
A.由电极经导线流向电极
B.由电极经溶液流向电极
C.由电极经导线流向电极
D.由电极经溶液流向电极
③该电池中电极上发生______反应(填“氧化”或“还原”)。
2023-2024学年下学期高一年级期末考试
化学参考答案
1.A 解析:“花鼓灯”中使用的锣采用黄铜作原料,黄铜的硬度高于纯铜,A项错误;羊皮的主要成分为蛋白质,B项正确;棉花的主要成分为纤维素,C项正确;可用灼烧的方法区分丝织品和棉织品,D项正确。故选A。
2.B 解析:甲基的电子式为,B项错误。故选B。
3.D 解析:油脂属于酯类有机物,有的油脂中含有碳碳双键,能使溴水褪色,A项错误;蔗糖水解液呈酸性,应先用溶液中和,不能直接加入新制检验其水解产物中是否有葡萄糖,B项错误;天然橡胶的主要成分聚异戊二烯的结构简式可表示为,C 项错误;四氟乙烯能使酸性高锰酸钾溶液褪色,但聚四氟乙烯不能使酸性高锰酸钾溶液褪色,D项正确。故选D。
4.C 解析:图甲中将锌片换成镁片、铜片换成碳棒,LED灯仍然可以被点亮,A项正确;图乙中为负极,其电极反应式为,B项正确;图丙中右侧红墨水液面升高是由与水反应放热导致具支管的锥形瓶中气体膨胀从而使U型管中形成液面差,C项错误;图丁若表示盐酸与碳酸氢钠反应对应的总能量变化,由图像可知该反应为吸热反应,D项正确。故选C。
5.B 解析:纺织和造纸工业上常用漂白纸浆、毛、丝等,不是由于具有强氧化性,A项错误;工业上用的浓硫酸吸收混合气体中的,说明易溶于的浓硫酸,B项正确;常温下,铁在浓硝酸中反应生成致密氧化膜,导致钝化,C项错误;是酸性氧化物,D项错误。故选B。
6.D 解析:丙醛的分子式为,A项错误;和的结构未知,无法确定二者是否为同系物,B项错误;和是同一种物质,C项错误;、和均属于烃的衍生物,D项正确。故选D。
7.C 解析:向含的酸性溶液中加入:,A项错误;丙烯与溴发生加成反应:,B项错误;足量的铁粉与稀硝酸混合:,C项正确;正丙醇与氧气经催化生成丙醛:,D项错误。故选C。
8.B 解析:向“吹出塔”中通入热空气,利用溴的易挥发性,将溴吹出,A项正确;“吸收塔”中发生氧化还原反应,其中作还原剂,B项错误;“分离”时的操作为分液,C项正确;“制备”时发生的反应为加成反应,D项正确。故选B。
9.B 解析:将浓硫酸滴入蔗糖中并不断搅拌,观察到有疏松多孔的焦炭与刺激性气味气体产生,可证明浓硫酸具有脱水性和强氧化性,A项正确;烯丙醇中含有的碳碳双键和羟基均能使酸性高锰酸钾溶液褪色,故向烯丙醇中加入少量酸性高锰酸钾溶液无法验证烯丙醇中含有碳碳双键,B项错误;鸡蛋清溶液的主要成分是蛋白质,遇浓硝酸加热后会发生显色反应,可通过滴加浓硝酸鉴别鸡蛋清溶液和淀粉溶液,C项正确;蔗糖中不含有醛基,葡萄糖中含有醛基,用两支试管分别取题述溶液,分别滴加银氨溶液,水浴加热后,观察是否有银镜产生可鉴别蔗糖和葡萄糖,D项正确。故选B。
10.C 解析:浓硝酸应放置于棕色细口玻璃瓶中避光保存,A项正确;“溶金”时发生反应的离子方程式为,B项正确;根据得失电子守恒,还原制金的过程中若有生成,则理论上至少需要,C项错误;“沉银”后所得的滤液主要是硝酸铜和硝酸钠的混合溶液,D项正确。故选C。
11.C 解析:根据反应①的方程式可知,反应①属于加成反应,A项正确;乙烯中含有碳碳双键,可使溴的溶液褪色,不能使溴的溶液褪色,故可用溴的溶液鉴别乙烯和,B项正确;氯气与水反应的离子方程式为,C项错误;等物质的量的乙烯与环氧乙烷完全燃烧,消耗氧气的物质的量之比为,D项正确。故选C。
12.D 解析:4-羟基-1-环己烯-1-羧酸的分子式为,A项正确;该有机物含有羟基和羧基,因此一定条件下既能与乙醇反应也能与乙酸反应,B项正确;该有机物中的羟基和羧基均能与反应,该有机物与足量的反应最多能生成,C项正确;该有机物在铜的催化作用下与反应生成的产物中不含醛基,D项错误。故选D。
13.C 解析:根据铅酸蓄电池总反应的离子方程式可知,电极为负极,电极为正极,故电极为负极,发生氧化反应,A项正确;放电时,阳离子向正极移动,故溶液中的向电极移动,B项正确;放电时,、电极的质量均增大,C项错误;若将、电极材料分别替换为和,则电极为负极,灵敏电流计指针向左偏转,D项正确。故选C。
14.B 解析:由图可知,使用催化剂i时,反应速率最大,催化效果更好,A项正确;曲线表示使用催化剂i时,的浓度随时间的变化曲线,此时和的物质的量浓度变化量之比与化学计量数之比相同,B项错误;使用催化剂ii时,内,的平均反应速率为,C项正确;无催化剂时,增大反应容器的体积,反应中正、逆反应的速率均减小,D项正确。故选B。
15.(15分)
(1)分液漏斗(1分)
(2)(2分)
(3)除去甲烷中的水蒸气(2分,合理即可) 验证甲烷还原的产物中含有水(2分,合理即可)
(4)(1分) (1分)
(5)装置中澄清石灰水变浑浊、装置中产生黑色沉淀(2分,合理即可)
(6)稀硫酸(或稀盐酸)(2分,合理即可) 溶液未变蓝(2分,合理即可)
解析:(1)盛放溶液的仪器名称为分液漏斗。
(2)装置中发生反应的化学方程式为。
(3)装置的作用为除去甲烷中的水蒸气;装置的作用为验证甲烷还原的产物中含有水。
(4)为避免在不纯时点燃引发危险,连接好装置后,应先打开分液漏斗的活塞,后点燃酒精灯。
(5)确认气体产物中有和的现象分别为装置中澄清石灰水变浑浊、装置中产生黑色沉淀。
(6)取少许固体产物,加入适量稀硫酸(或稀盐酸),观察到溶液未变蓝,证明固体产物中没有。
16.(14分)
(1)(2分)
(2)烧杯、漏斗、玻璃棒(2分)
(3)增大溶液中的浓度(2分,合理即可)
(4)(2分)
(5)(2分)
(6)(2分)
(7)制作芯片和太阳能电池(2分,合理即可)
解析:(1)“沉硅”过程发生反应的离子方程式为。
(2)“过滤”所需的玻璃仪器有烧杯、漏斗、玻璃棒。
(3)“浓缩”的目的为增大溶液中的浓度。
(4)根据流程分析可知的溶解度大于。
(5)“制备”过程发生反应的化学方程式为。
(6)“还原”过程发生反应的化学方程式为。故“还原”过程中两种反应物的物质的量之比为。
(7)高纯硅可用于制作芯片和太阳能电池等。
17.(15分)
(1)(1分)
(2)氧化反应(1分)
(3)羧基(1分) 醛基(1分)
(4)(2分)
(5)(2分)
(6) (2分)
(7)2(2分)
(8)BCD(3分)
解析:(1)丙烯酸仲丁酯的分子式为。
(2)反应④的反应类型为氧化反应。
(3)有机物为,因此其含氧官能团为羧基;有机物的官能团为醛基。
(4)聚合物的结构简式为。
(5)反应②的化学方程式为。
(6)反应⑤的化学方程式为。
(7)与2-丁烯具有相同官能团的同分异构体分别为和,共2种。
(8)丙烯酸仲丁酯与乙酸乙酯不属于同系物,A项错误;低级酯常温下为液体,密度比水小,B项正确;丙烯酸仲丁酯中含有碳碳双键,能使溴水和酸性高锰酸钾溶液褪色,C项正确;丙烯酸仲丁酯中含有酯基,能发生水解反应生成羧酸和醇,D项正确。故选BCD。
18.(14分)
(1)放热(1分)
(2)①a(1分)②(2分)③>(2分)④BD(2分)
(3)①化学能转化为电能(2分)②(2分)③还原(2分)
解析:(1)断开中的化学键要吸收的能量,断开中的化学键要吸收的能量,形成中的化学键要释放出的能量,形成中的化学键要释放出的能量,则该反应吸收的总能量为,放出的总能量为,因此该反应为放热反应。
(2)①化学方程式中只有的化学计量数不同于其他物质,因此曲线表示的物质的量随时间的变化,推测出曲线表示的物质的量随时间的变化。
②反应开始至,减少了,因此平均反应速率为。
③点正反应的速率大于平衡时的正反应速率,平衡时正、逆反应速率相等,因此点正反应的速率大于点逆反应的速率。
④通过调控反应条件,可以提高该反应进行的程度,A项正确;升高温度可同时增大正、逆反应的速率,B项错误;平衡时冲入使反应容器的压强增大,但反应物和生成物的浓度不变,因此生成的反应速率不变,C项正确;与开始时冲入的物质的量之比为,反应生成的物质的量之比也为,因此与的物质的量之比为不能说明反应达到化学平衡,D项错误。故选BD。
(3)①该装置中的能量转化形式为化学能转化为电能。
②该电池中电子的流动方向为由电极经导线流向电极。
③该电池中电极上发生还原反应。
化学
全卷满分100分,考试时间75分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、班级、考场号、座位号、考生号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Zn-65 Pb-207
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.花鼓灯是国家级非物质文化遗产之一。铿锵的锣鼓,翻飞的巾、扇、伞,是花鼓灯表演的必备器具。下列说法错误的是( )
A.“花鼓灯”中使用的锣采用黄铜作原料,黄铜的硬度低于纯铜
B.“花鼓灯”中使用的鼓上的鼓皮由羊皮制作而成,羊皮的主要成分为蛋白质
C.“花鼓灯”中使用的巾是由棉花纺织而成,棉花的主要成分为纤维素
D.“花鼓灯”中使用的扇和伞均由丝绸和竹子制作,可用灼烧的方法区分丝织品和棉织品
2.下列化学用语错误的是( )
A.异戊烷的结构简式:
B.甲基的电子式:
C.乙醇的分子结构模型:
D.油脂的结构通式:(、、代表高级脂肪酸的烃基)
3.下列有关有机物的结构、性质和检验的说法正确的是( )
A.油脂属于酯类有机物,所有油脂均不能使溴水褪色
B.向蔗糖水解液中直接加入新制检验其水解产物中是否有葡萄糖
C.天然橡胶的主要成分聚异戊二烯的结构简式可表示为
D.四氟乙烯能使酸性高锰酸钾溶液褪色,但聚四氟乙烯不能使酸性高锰酸钾溶液褪色
4.化学反应伴随着能量变化,探究各种能量变化是一永恒的主题。下列说法错误的是( )
A.图甲中将锌片换成镁片、铜片换成碳棒,LED灯仍然可以被点亮
B.图乙中为负极,其电极反应式为
C.图丙中右侧红墨水液面升高是由与水反应生成的导致的
D.图丁若表示盐酸与碳酸氢钠反应对应的总能量变化,由图像可知该反应为吸热反应
5.下列生活应用或生产活动,运用相应化学知识解释正确的是( )
选项 生活应用或生产活动 化学知识
A 纺织和造纸工业上常用漂白纸浆、毛、丝等 具有强氧化性
B 硫酸工业上用的浓硫酸分离和 易溶于的浓硫酸
C 铁制容器储存和运输浓硝酸 常温下,铁不与浓硝酸反应
D 用氢氟酸溶蚀玻璃生产磨砂玻璃 是两性氧化物,能与酸反应
6.下列有关有机物的化学术语正确的是( )
A.丙醛的分子式为
B.和互为同系物
C.和互为同分异构体
D.、和均属于烃的衍生物
7.下列化学方程式或离子方程式书写正确的是( )
A.向含的酸性溶液中加入
B.丙烯与溴发生加成反应:
C.足量的铁粉与稀硝酸混合:
D.正丙醇与氧气经催化生成丙醛:
8.1,2-二溴乙烷是无色油状液体,工业上可用海水晒盐后得到的苦卤制备1,2-二溴乙烷,其部分工艺流程如图所示:
下列说法错误的是( )
A.向“吹出塔”中通入热空气,利用溴的易挥发性,将溴吹出
B.“吸收塔”中发生氧化还原反应,其中作氧化剂
C.“分离”时的操作为分液
D.“制备”时发生的反应为加成反应
9.下列实验操作不能达到实验目的的是( )
选项 实验操作 实验目的
A 将浓硫酸滴入蔗糖中并不断搅拌,观察现象 验证浓硫酸具有脱水性和强氧化性
B 向烯丙醇中加入少量酸性高锰酸钾溶液,观察现象 验证烯丙醇含有碳碳双键
C 用两支试管分别取等浓度的鸡蛋清溶液和淀粉溶液,分别滴加几滴浓硝酸,加热后观察现象 鉴别鸡蛋清溶液和淀粉溶液
D 用两支试管分别取等浓度的蔗糖溶液和葡萄糖溶液,分别滴加银氨溶液,水浴加热后,观察现象 鉴别蔗糖和葡萄糖
10.利用和王水可分离提纯金银铜合金材质的马拉松纪念奖牌,其工艺流程如图所示,下列说法错误的是( )
已知:①王水是浓硝酸和浓盐酸以体积比为混合得到的混合物;
②“溶金”时会有气体逸出,溶液中金元素主要以形式存在。
A.浓硝酸应放置于棕色细口玻璃瓶中避光保存
B.“溶金”时发生反应的离子方程式为
C.“还原”制金的过程中若有生成,则理论上至少需要
D.“沉银”后所得的滤液主要是硝酸铜和硝酸钠的混合溶液
11.以乙烯为原料生产环氧乙烷()的反应过程中存在以下两步反应:
①
②
下列说法错误的是( )
A.反应①属于加成反应
B.可用溴的溶液鉴别乙烯和
C.氯气与水反应的离子方程式为
D.等物质的量的乙烯与环氧乙烷完全燃烧,消耗氧气的物质的量之比为
12.有机物4-羟基-1-环己烯-1-羧酸被广泛应用于化妆品中,其结构简式如图所示。下列关于该有机物的说法错误的是( )
A.分子式为
B.一定条件下既能与乙醇反应也能与乙酸反应
C.该有机物与足量的反应最多能生成
D.在铜的催化作用下与反应生成的产物中含有醛基
13.铅酸蓄电池中总反应的离子方程式为。电池的简易装置如图所示,已知放电时灵敏电流计指针向右偏转。下列说法错误的是( )
A.电池中电极为负极,发生氧化反应
B.放电时,溶液中的向电极移动
C.放电时,电极的质量减小,电极的质量增大
D.若将、电极材料分别替换为和,则灵敏电流计指针向左偏转
14.利用浓度传感器、数据采集器和计算机等数字化实验设备,在相同条件下研究催化剂i、ii对反应的影响,起始时容器中通入,已知各物质浓度随反应时间的部分变化曲线如图所示:
下列说法错误的是( )
A.由图像可知,催化剂i的催化效果更好
B.曲线表示使用催化剂ii时,的浓度随时间的变化曲线
C.使用催化剂ii时,内,的平均反应速率为
D.无催化剂时,增大反应容器的体积,反应中正、逆反应的速率均减小
二、非选择题:本题共4小题,共58分。
15.(15分)资料显示:加热条件下,可还原生成和非金属氧化物。甲同学利用下图装置对该反应所得产物进行探究。
已知:①(黑)
②(红)
回答下列问题:
(1)盛放溶液的仪器名称为______。
(2)装置为甲烷的发生装置,其中的元素最终以的形式存在,装置中发生反应的化学方程式为______。
(3)装置的作用为______;装置的作用为______。
(4)连接好实验装置并检验气密性后,应先______后______(填选项字母)。
a.打开分液漏斗的活塞 b.点燃酒精灯
(5)确认气体产物中有和的现象分别为______。
(6)乙同学认为固体产物中还可能含有。取少许固体产物,加入适量______,观察到______,证明固体产物中没有。
16.(14分)利用硅酸锂制备碳酸锂和高纯硅的工艺流程如图所示。
回答下列问题:
(1)“沉硅”过程发生反应的离子方程式为______。
(2)“过滤”所需的玻璃仪器有______。
(3)“浓缩”的目的为______。
(4)根据流程分析物质的溶解度:______(填“>”或“<”)。
(5)“制备”过程发生反应的化学方程式为______。
(6)“还原”过程中两种反应物的物质的量之比为______。
(7)写出两种高纯硅的用途:______。
17.(15分)丙烯酸仲丁酯是一种重要的有机物,被广泛应用于涂料和塑料制备中。结合下图中物质间的转化关系回答问题:
(1)丙烯酸仲丁酯的分子式为______。
(2)反应④的反应类型为______。
(3)有机物中的含氧官能团名称为______;有机物的官能团名称为______。
(4)聚合物的结构简式为______。
(5)反应②的化学方程式为______。
(6)反应⑤的化学方程式为______。
(7)与2-丁烯具有相同官能团的同分异构体有______种(不考虑立体异构)。
(8)下列关于丙烯酸仲丁酯的说法正确的是______(填选项字母)。
A.与乙酸乙酯属于同系物
B.常温下为液体,密度比水小
C.能使溴水和酸性高锰酸钾溶液褪色
D.能发生水解反应生成羧酸和醇
18.(14分)选择适当的催化剂在高温条件下可将汽车尾气中的、转化为无毒气体。已知反应原理为:。
回答下列问题:
(1)已知断开中的化学键要吸收的能量,断开中的化学键要吸收的能量,形成中的化学键要释放出的能量,形成中的化学键要释放出的能量,则该反应属于______反应(填“放热”或“吸热”)。
(2)已知在一定温度下,向密闭容器中充入、、、发生上述反应,反应过程中各物质的物质的量随时间变化的曲线如图甲所示:
甲
①表示的物质的量随时间变化的曲线为______(填曲线字母)。
②反应开始至,的平均反应速率为______。
③反应速率的大小:点正反应的速率______点逆反应的速率(填“”“”或“”)。
④关于上述反应,下列叙述错误的是______(填选项字母)。( )
A.通过调控反应条件,可以提高该反应进行的程度
B.升高温度可增大正反应的速率,降低逆反应的速率
C.平衡时充入使反应容器的压强增大,生成的反应速率不变
D.与的物质的量之比为,说明反应达到化学平衡
(3)可将上述反应设计成燃料电池,该电池的工作原理如图乙所示,电极、均为多孔性电极。
乙
①该装置中的能量转化形式为______。
②该电池中电子的流动方向为______。
A.由电极经导线流向电极
B.由电极经溶液流向电极
C.由电极经导线流向电极
D.由电极经溶液流向电极
③该电池中电极上发生______反应(填“氧化”或“还原”)。
2023-2024学年下学期高一年级期末考试
化学参考答案
1.A 解析:“花鼓灯”中使用的锣采用黄铜作原料,黄铜的硬度高于纯铜,A项错误;羊皮的主要成分为蛋白质,B项正确;棉花的主要成分为纤维素,C项正确;可用灼烧的方法区分丝织品和棉织品,D项正确。故选A。
2.B 解析:甲基的电子式为,B项错误。故选B。
3.D 解析:油脂属于酯类有机物,有的油脂中含有碳碳双键,能使溴水褪色,A项错误;蔗糖水解液呈酸性,应先用溶液中和,不能直接加入新制检验其水解产物中是否有葡萄糖,B项错误;天然橡胶的主要成分聚异戊二烯的结构简式可表示为,C 项错误;四氟乙烯能使酸性高锰酸钾溶液褪色,但聚四氟乙烯不能使酸性高锰酸钾溶液褪色,D项正确。故选D。
4.C 解析:图甲中将锌片换成镁片、铜片换成碳棒,LED灯仍然可以被点亮,A项正确;图乙中为负极,其电极反应式为,B项正确;图丙中右侧红墨水液面升高是由与水反应放热导致具支管的锥形瓶中气体膨胀从而使U型管中形成液面差,C项错误;图丁若表示盐酸与碳酸氢钠反应对应的总能量变化,由图像可知该反应为吸热反应,D项正确。故选C。
5.B 解析:纺织和造纸工业上常用漂白纸浆、毛、丝等,不是由于具有强氧化性,A项错误;工业上用的浓硫酸吸收混合气体中的,说明易溶于的浓硫酸,B项正确;常温下,铁在浓硝酸中反应生成致密氧化膜,导致钝化,C项错误;是酸性氧化物,D项错误。故选B。
6.D 解析:丙醛的分子式为,A项错误;和的结构未知,无法确定二者是否为同系物,B项错误;和是同一种物质,C项错误;、和均属于烃的衍生物,D项正确。故选D。
7.C 解析:向含的酸性溶液中加入:,A项错误;丙烯与溴发生加成反应:,B项错误;足量的铁粉与稀硝酸混合:,C项正确;正丙醇与氧气经催化生成丙醛:,D项错误。故选C。
8.B 解析:向“吹出塔”中通入热空气,利用溴的易挥发性,将溴吹出,A项正确;“吸收塔”中发生氧化还原反应,其中作还原剂,B项错误;“分离”时的操作为分液,C项正确;“制备”时发生的反应为加成反应,D项正确。故选B。
9.B 解析:将浓硫酸滴入蔗糖中并不断搅拌,观察到有疏松多孔的焦炭与刺激性气味气体产生,可证明浓硫酸具有脱水性和强氧化性,A项正确;烯丙醇中含有的碳碳双键和羟基均能使酸性高锰酸钾溶液褪色,故向烯丙醇中加入少量酸性高锰酸钾溶液无法验证烯丙醇中含有碳碳双键,B项错误;鸡蛋清溶液的主要成分是蛋白质,遇浓硝酸加热后会发生显色反应,可通过滴加浓硝酸鉴别鸡蛋清溶液和淀粉溶液,C项正确;蔗糖中不含有醛基,葡萄糖中含有醛基,用两支试管分别取题述溶液,分别滴加银氨溶液,水浴加热后,观察是否有银镜产生可鉴别蔗糖和葡萄糖,D项正确。故选B。
10.C 解析:浓硝酸应放置于棕色细口玻璃瓶中避光保存,A项正确;“溶金”时发生反应的离子方程式为,B项正确;根据得失电子守恒,还原制金的过程中若有生成,则理论上至少需要,C项错误;“沉银”后所得的滤液主要是硝酸铜和硝酸钠的混合溶液,D项正确。故选C。
11.C 解析:根据反应①的方程式可知,反应①属于加成反应,A项正确;乙烯中含有碳碳双键,可使溴的溶液褪色,不能使溴的溶液褪色,故可用溴的溶液鉴别乙烯和,B项正确;氯气与水反应的离子方程式为,C项错误;等物质的量的乙烯与环氧乙烷完全燃烧,消耗氧气的物质的量之比为,D项正确。故选C。
12.D 解析:4-羟基-1-环己烯-1-羧酸的分子式为,A项正确;该有机物含有羟基和羧基,因此一定条件下既能与乙醇反应也能与乙酸反应,B项正确;该有机物中的羟基和羧基均能与反应,该有机物与足量的反应最多能生成,C项正确;该有机物在铜的催化作用下与反应生成的产物中不含醛基,D项错误。故选D。
13.C 解析:根据铅酸蓄电池总反应的离子方程式可知,电极为负极,电极为正极,故电极为负极,发生氧化反应,A项正确;放电时,阳离子向正极移动,故溶液中的向电极移动,B项正确;放电时,、电极的质量均增大,C项错误;若将、电极材料分别替换为和,则电极为负极,灵敏电流计指针向左偏转,D项正确。故选C。
14.B 解析:由图可知,使用催化剂i时,反应速率最大,催化效果更好,A项正确;曲线表示使用催化剂i时,的浓度随时间的变化曲线,此时和的物质的量浓度变化量之比与化学计量数之比相同,B项错误;使用催化剂ii时,内,的平均反应速率为,C项正确;无催化剂时,增大反应容器的体积,反应中正、逆反应的速率均减小,D项正确。故选B。
15.(15分)
(1)分液漏斗(1分)
(2)(2分)
(3)除去甲烷中的水蒸气(2分,合理即可) 验证甲烷还原的产物中含有水(2分,合理即可)
(4)(1分) (1分)
(5)装置中澄清石灰水变浑浊、装置中产生黑色沉淀(2分,合理即可)
(6)稀硫酸(或稀盐酸)(2分,合理即可) 溶液未变蓝(2分,合理即可)
解析:(1)盛放溶液的仪器名称为分液漏斗。
(2)装置中发生反应的化学方程式为。
(3)装置的作用为除去甲烷中的水蒸气;装置的作用为验证甲烷还原的产物中含有水。
(4)为避免在不纯时点燃引发危险,连接好装置后,应先打开分液漏斗的活塞,后点燃酒精灯。
(5)确认气体产物中有和的现象分别为装置中澄清石灰水变浑浊、装置中产生黑色沉淀。
(6)取少许固体产物,加入适量稀硫酸(或稀盐酸),观察到溶液未变蓝,证明固体产物中没有。
16.(14分)
(1)(2分)
(2)烧杯、漏斗、玻璃棒(2分)
(3)增大溶液中的浓度(2分,合理即可)
(4)(2分)
(5)(2分)
(6)(2分)
(7)制作芯片和太阳能电池(2分,合理即可)
解析:(1)“沉硅”过程发生反应的离子方程式为。
(2)“过滤”所需的玻璃仪器有烧杯、漏斗、玻璃棒。
(3)“浓缩”的目的为增大溶液中的浓度。
(4)根据流程分析可知的溶解度大于。
(5)“制备”过程发生反应的化学方程式为。
(6)“还原”过程发生反应的化学方程式为。故“还原”过程中两种反应物的物质的量之比为。
(7)高纯硅可用于制作芯片和太阳能电池等。
17.(15分)
(1)(1分)
(2)氧化反应(1分)
(3)羧基(1分) 醛基(1分)
(4)(2分)
(5)(2分)
(6) (2分)
(7)2(2分)
(8)BCD(3分)
解析:(1)丙烯酸仲丁酯的分子式为。
(2)反应④的反应类型为氧化反应。
(3)有机物为,因此其含氧官能团为羧基;有机物的官能团为醛基。
(4)聚合物的结构简式为。
(5)反应②的化学方程式为。
(6)反应⑤的化学方程式为。
(7)与2-丁烯具有相同官能团的同分异构体分别为和,共2种。
(8)丙烯酸仲丁酯与乙酸乙酯不属于同系物,A项错误;低级酯常温下为液体,密度比水小,B项正确;丙烯酸仲丁酯中含有碳碳双键,能使溴水和酸性高锰酸钾溶液褪色,C项正确;丙烯酸仲丁酯中含有酯基,能发生水解反应生成羧酸和醇,D项正确。故选BCD。
18.(14分)
(1)放热(1分)
(2)①a(1分)②(2分)③>(2分)④BD(2分)
(3)①化学能转化为电能(2分)②(2分)③还原(2分)
解析:(1)断开中的化学键要吸收的能量,断开中的化学键要吸收的能量,形成中的化学键要释放出的能量,形成中的化学键要释放出的能量,则该反应吸收的总能量为,放出的总能量为,因此该反应为放热反应。
(2)①化学方程式中只有的化学计量数不同于其他物质,因此曲线表示的物质的量随时间的变化,推测出曲线表示的物质的量随时间的变化。
②反应开始至,减少了,因此平均反应速率为。
③点正反应的速率大于平衡时的正反应速率,平衡时正、逆反应速率相等,因此点正反应的速率大于点逆反应的速率。
④通过调控反应条件,可以提高该反应进行的程度,A项正确;升高温度可同时增大正、逆反应的速率,B项错误;平衡时冲入使反应容器的压强增大,但反应物和生成物的浓度不变,因此生成的反应速率不变,C项正确;与开始时冲入的物质的量之比为,反应生成的物质的量之比也为,因此与的物质的量之比为不能说明反应达到化学平衡,D项错误。故选BD。
(3)①该装置中的能量转化形式为化学能转化为电能。
②该电池中电子的流动方向为由电极经导线流向电极。
③该电池中电极上发生还原反应。
同课章节目录
