2023-2024学年高一化学下学期期末复习重难点02常见物质的制取与性质探究(含解析)
文档属性
| 名称 | 2023-2024学年高一化学下学期期末复习重难点02常见物质的制取与性质探究(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-03 10:48:50 | ||
图片预览

文档简介
重难点02 常见物质的制取与性质探究
(2022-2023高一下·湖南张家界·期末)
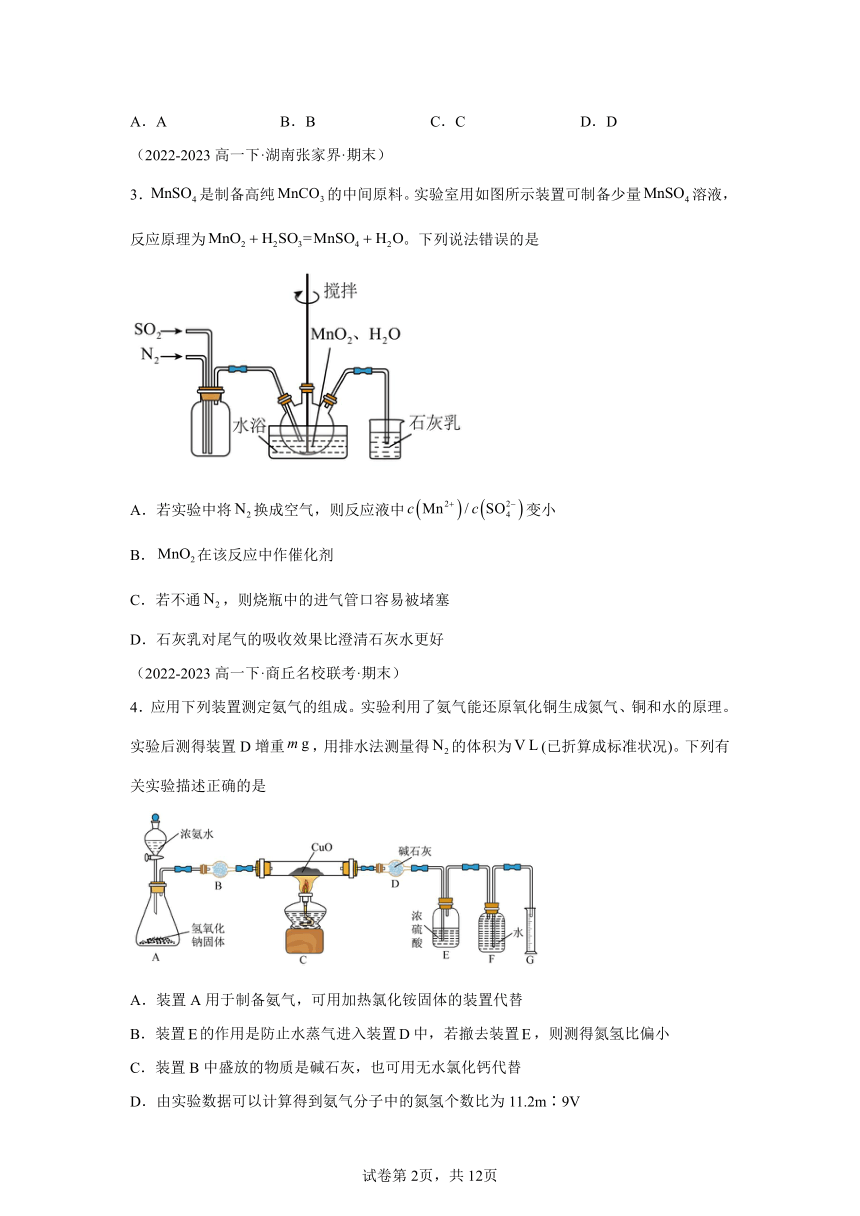
1.下列装置可以用于相应实验的是
A B C D
制备 分离乙醇和乙酸 验证酸性 测量体积
A.A B.B C.C D.D
(2022-2023高一下·湖南衡阳·期末)
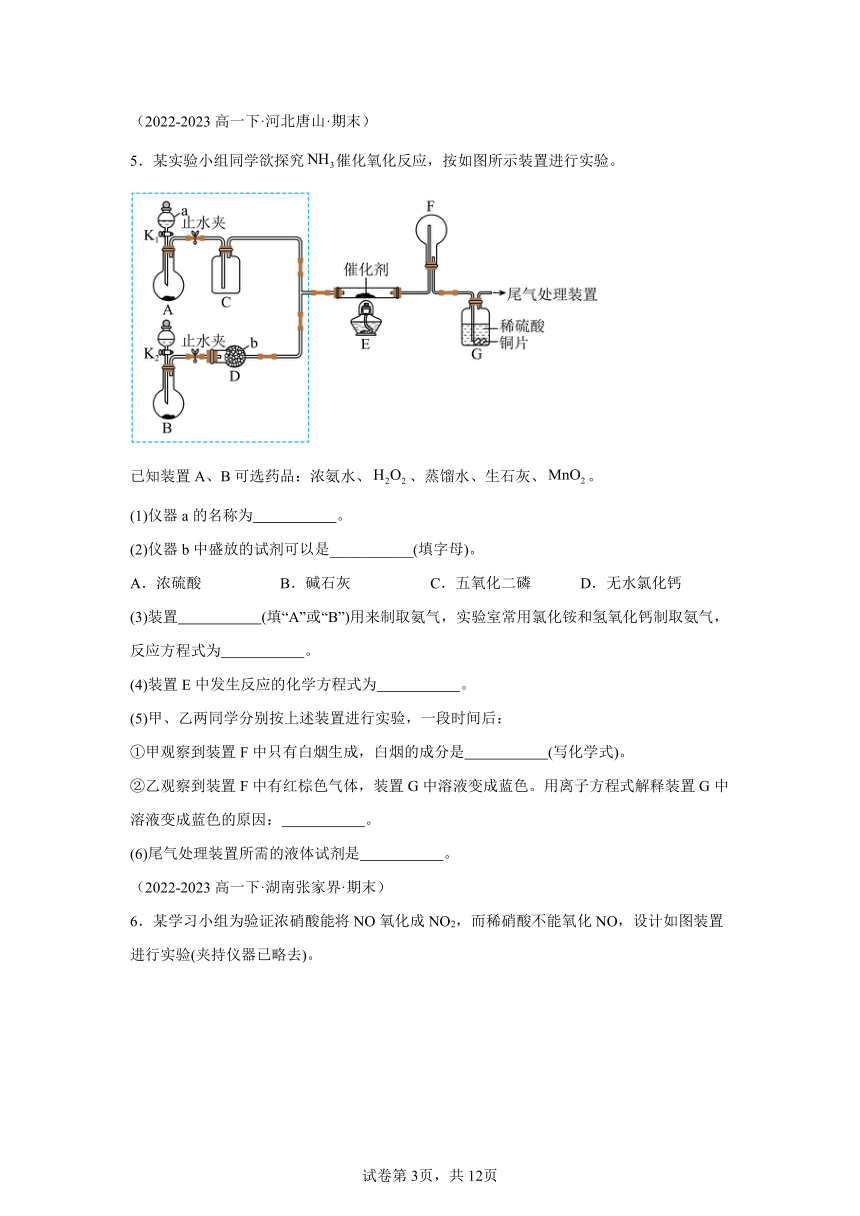
2.下列实验操作不能达到相应实验目的的是
选项 A B C D
实验操作
实验目的 实验室制 取Fe(OH)2 不能制备并收集 少量NO2气体 制备干燥NH3 验证浓硫酸的脱 水性、强氧化性
A.A B.B C.C D.D
(2022-2023高一下·湖南张家界·期末)
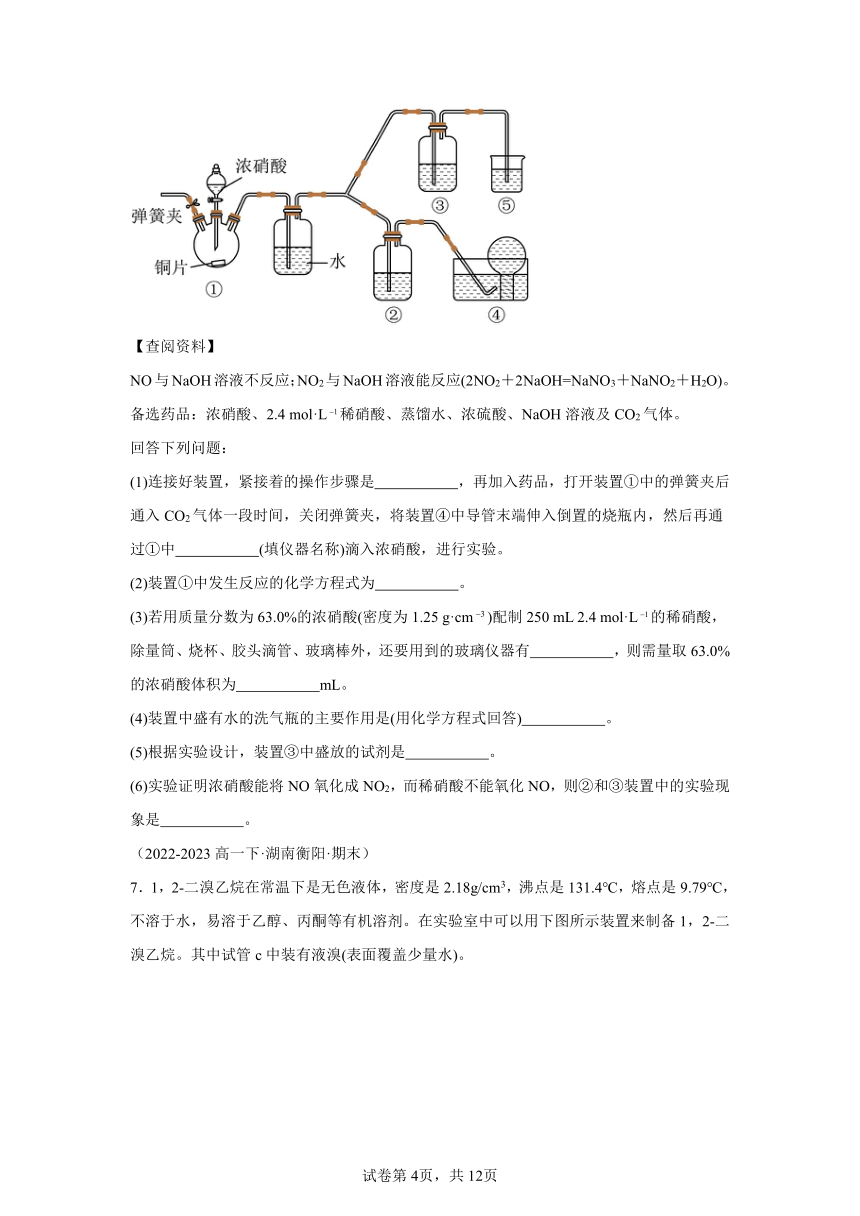
3.是制备高纯的中间原料。实验室用如图所示装置可制备少量溶液,反应原理为。下列说法错误的是
A.若实验中将换成空气,则反应液中变小
B.在该反应中作催化剂
C.若不通,则烧瓶中的进气管口容易被堵塞
D.石灰乳对尾气的吸收效果比澄清石灰水更好
(2022-2023高一下·商丘名校联考·期末)
4.应用下列装置测定氨气的组成。实验利用了氨气能还原氧化铜生成氮气、铜和水的原理。实验后测得装置D增重,用排水法测量得的体积为(已折算成标准状况)。下列有关实验描述正确的是
A.装置A用于制备氨气,可用加热氯化铵固体的装置代替
B.装置的作用是防止水蒸气进入装置中,若撤去装置,则测得氮氢比偏小
C.装置B中盛放的物质是碱石灰,也可用无水氯化钙代替
D.由实验数据可以计算得到氨气分子中的氮氢个数比为11.2m∶9V
(2022-2023高一下·河北唐山·期末)
5.某实验小组同学欲探究催化氧化反应,按如图所示装置进行实验。
已知装置A、B可选药品:浓氨水、、蒸馏水、生石灰、。
(1)仪器a的名称为 。
(2)仪器b中盛放的试剂可以是___________(填字母)。
A.浓硫酸 B.碱石灰 C.五氧化二磷 D.无水氯化钙
(3)装置 (填“A”或“B”)用来制取氨气,实验室常用氯化铵和氢氧化钙制取氨气,反应方程式为 。
(4)装置E中发生反应的化学方程式为 。
(5)甲、乙两同学分别按上述装置进行实验,一段时间后:
①甲观察到装置F中只有白烟生成,白烟的成分是 (写化学式)。
②乙观察到装置F中有红棕色气体,装置G中溶液变成蓝色。用离子方程式解释装置G中溶液变成蓝色的原因: 。
(6)尾气处理装置所需的液体试剂是 。
(2022-2023高一下·湖南张家界·期末)
6.某学习小组为验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,设计如图装置进行实验(夹持仪器已略去)。
【查阅资料】
NO与NaOH溶液不反应;NO2与NaOH溶液能反应(2NO2+2NaOH=NaNO3+NaNO2+H2O)。
备选药品:浓硝酸、2.4 mol·L稀硝酸、蒸馏水、浓硫酸、NaOH溶液及CO2气体。
回答下列问题:
(1)连接好装置,紧接着的操作步骤是 ,再加入药品,打开装置①中的弹簧夹后通入CO2气体一段时间,关闭弹簧夹,将装置④中导管末端伸入倒置的烧瓶内,然后再通过①中 (填仪器名称)滴入浓硝酸,进行实验。
(2)装置①中发生反应的化学方程式为 。
(3)若用质量分数为63.0%的浓硝酸(密度为1.25 g·cm)配制250 mL 2.4 mol·L的稀硝酸,除量筒、烧杯、胶头滴管、玻璃棒外,还要用到的玻璃仪器有 ,则需量取63.0%的浓硝酸体积为 mL。
(4)装置中盛有水的洗气瓶的主要作用是(用化学方程式回答) 。
(5)根据实验设计,装置③中盛放的试剂是 。
(6)实验证明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,则②和③装置中的实验现象是 。
(2022-2023高一下·湖南衡阳·期末)
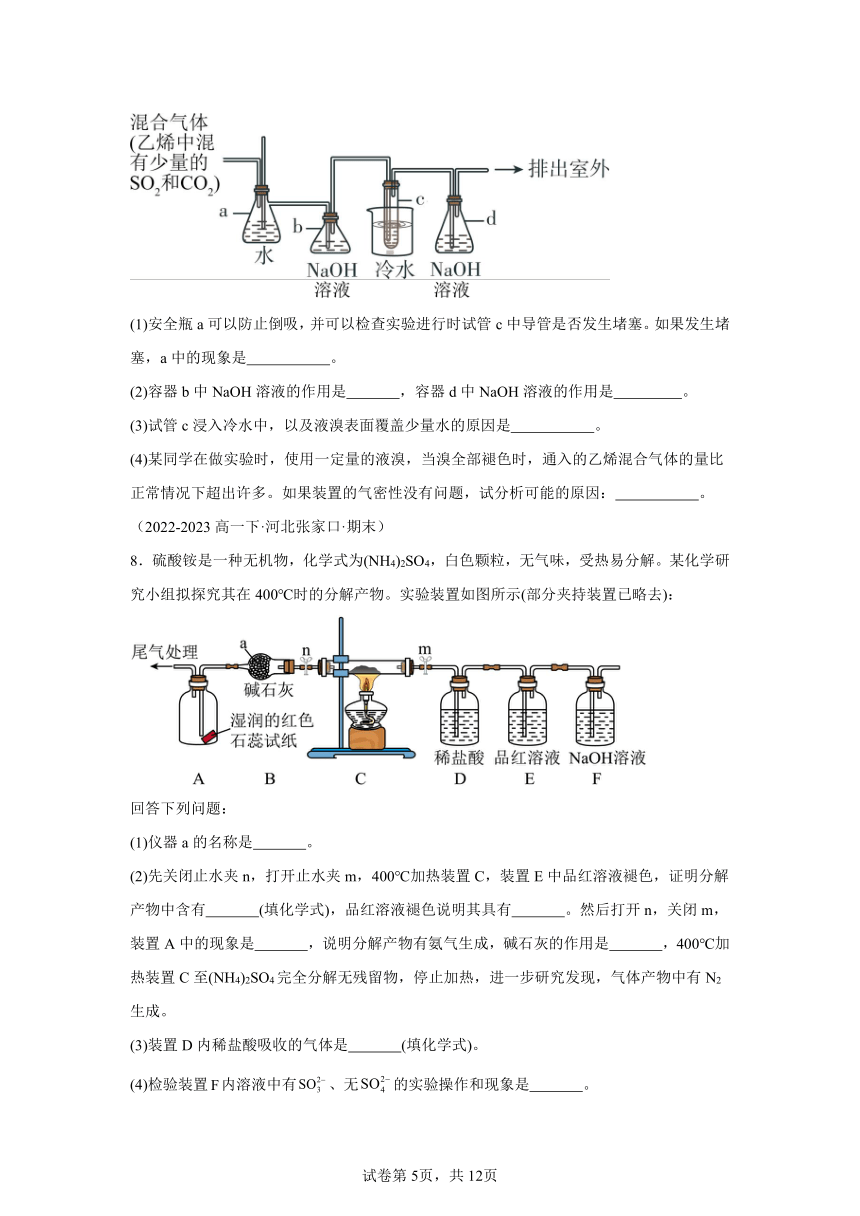
7.1,2 二溴乙烷在常温下是无色液体,密度是2.18g/cm3,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于乙醇、丙酮等有机溶剂。在实验室中可以用下图所示装置来制备1,2 二溴乙烷。其中试管c中装有液溴(表面覆盖少量水)。
(1)安全瓶a可以防止倒吸,并可以检查实验进行时试管c中导管是否发生堵塞。如果发生堵塞,a中的现象是 。
(2)容器b中NaOH溶液的作用是 ,容器d中NaOH溶液的作用是 。
(3)试管c浸入冷水中,以及液溴表面覆盖少量水的原因是 。
(4)某同学在做实验时,使用一定量的液溴,当溴全部褪色时,通入的乙烯混合气体的量比正常情况下超出许多。如果装置的气密性没有问题,试分析可能的原因: 。
(2022-2023高一下·河北张家口·期末)
8.硫酸铵是一种无机物,化学式为(NH4)2SO4,白色颗粒,无气味,受热易分解。某化学研究小组拟探究其在400℃时的分解产物。实验装置如图所示(部分夹持装置已略去):
回答下列问题:
(1)仪器a的名称是 。
(2)先关闭止水夹n,打开止水夹m,400℃加热装置C,装置E中品红溶液褪色,证明分解产物中含有 (填化学式),品红溶液褪色说明其具有 。然后打开n,关闭m,装置A中的现象是 ,说明分解产物有氨气生成,碱石灰的作用是 ,400℃加热装置C至(NH4)2SO4完全分解无残留物,停止加热,进一步研究发现,气体产物中有N2生成。
(3)装置D内稀盐酸吸收的气体是 (填化学式)。
(4)检验装置内溶液中有、无的实验操作和现象是 。
(5)(NH4)2SO4在400℃分解的化学方程式是 。
(2022-2023高一下·黑龙江实验中学·期末)
9.1,2-二氯乙烷是杀菌剂稻瘟灵和植物生长调节剂矮壮素的中间体,不溶于水,易溶于有机溶剂,沸点83.6℃,在光照下易分解。制备1,2-二氯乙烷相关原理和实验装置图如下:
已知:;甘油的沸点为290℃。
请回答以下问题:
(1)写出装置Ⅳ中发生的化学反应方程式 。
(2)仪器A的名称是 ,装置Ⅵ中水的作用是 。
(3)Ⅳ中反应前先加入少量1,2-二氯乙烷液体,其作用是 (填序号)。
a.作催化剂 b.溶解和乙烯 c.促进气体反应物间的接触
(4)已知液相直接氯化法可生成1,2-二氯乙烷的同系物,得到产物有 种不同结构,写出上述产物中一种含有两个甲基的同分异构体的结构简式 。
(2022-2023高一下·辽宁六校协作体·期末)
10.某化学兴趣小组为了制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。
(1)若氨气的发生装置选择a,则其化学反应方程式为 。
(2)若氨气的发生装置选择b,则所用的试剂为 和 。
(3)B装置中的干燥剂可选用 :实验中观察到C装置中的现象是 。
(4)当实验进行一段时间后,挤压D装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是 ,E中倒扣漏斗的作用是 。
(5)氨气(NH3)是一种重要的化工原料,其中约80%用来生产各种氮肥。其中利用NH3生产NH4NO3的主要转化途径如图(转化所需试剂及条件已略去):
NH3→NO→NO2→HNO3NH4NO3
①NH3→NO的化学方程为 。
②NO2→HNO3的化学方程式为 。
(2022-2023高一下·湖南师大附中博才实验中学·期末)
11.亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业中的用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-=2+H2O;
②气体液化的温度:NO2为21℃,NO为-152℃。
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、 、 、B。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是 。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是 ;
②装置E的作用是 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是 。
(2022-2023高一下·吉林“BEST合作体”联考·期末)
12.回答下列问题:
(1)如图包含气体发生装置和收集装置(部分装置的夹持仪器已省略),实验室以Cu与浓反应制备并收集,应选择的装置是 (填字母)。
(2)SCR脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达90%以上。反应机理如图所示,写出该反应的化学方程式: 。
(3)目前,NaClO溶液广泛地应用于脱硫脱硝。某课外小组同学设计了如图喷淋吸收塔装置(如图)。设计该装置的优点是 ,脱硝(NO)反应的离子方程式为 。
(4)某兴趣小组用溶液吸收含的尾气(其余气体均与溶液不反应),实验装置如图所示,装置A中发生反应的离子方程式为 。
若尾气的体积为V L,该实验条件下气体摩尔体积为Vm L/mol,尾气中全部被装置A吸收。反应后将装置A中溶液全部转移至烧杯中,向其中逐滴加入0.1000 溶液,发生反应,当反应恰好完全时,共消耗溶液18.00mL。请通过计算确定尾气中的体积分数为 。
(2022-2023高一下·辽宁部分学校·期末)
13.亚硝酸钠(NaNO2)常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。NaNO2是白色粉末,易溶于水。
回答下列问题:
(1)滴入浓硝酸前先通入一段时间的N2,目的是 。
(2)B中发生反应的化学方程式为 、 。
(3)C中试剂是 (填名称)。
(4)实验过程中,当D中 (填硬质玻璃管中实验现象)时表明D中反应已完成。
(5)探究 NaNO2的性质。取一定量产品溶于水,将得到的溶液分成三份并进行如下实验:
实验 操作 现象
Ⅰ 在第一份溶液中滴加酚酞溶液 溶液呈红色,不褪色
Ⅱ 在酸性高锰酸钾溶液中滴加第二份溶液 溶液褪色
Ⅲ 在淀粉—KI溶液中滴加第三份溶液 溶液变蓝
由此推知,NaNO2具有的性质依次为 、 、 。
(2022-2023高一下·辽宁葫芦岛·期末)
14.验证氧化性,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
实验过程:
Ⅰ.打开止水夹,通入一段时间,再将T型导管插入B中,继续通入,然后关闭,,。
Ⅱ.打开活塞a,滴加 定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开和活塞c,加入70%的硫酸溶液,一段时间后关闭。
Ⅵ.更换试管D,重复过程Ⅳ,检验B中溶液的离子。
(1)检验B中溶液中的现象为 ,发生反应的离子方程式 。
(2)过程Ⅰ的目的是 。
(3)若向过程ⅢB中的黄色溶液中通入气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式: 。
(4)若将C中制取的通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为 。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果 定能够证明氧化性的是 (填“甲”“乙”或“丙”)。
过程为Ⅳ,B溶液中含有的离子 过程Ⅵ,B溶液中含有的离子
甲 有无 有
乙 既有又有 有
丙 有无 有
(6)将B中的溶液换成溶液并向其中通入(标准状况下),若溶液中有的被氧化成单质,则原溶液中的物质的量浓度为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.Na2CO3固体比较稳定,受热不易分解,所以不能采用加热碳酸钠的方式制备二氧化碳,A错误;
B.乙醇和乙酸是互溶的,不能采用分液的方式分离,应采用蒸馏来分离,B错误;
C.二氧化硫通入品红溶液中,可以验证其漂白性,不能验证酸性,C错误;
D.测量氧气体积时,装置选择量气管,测量时要恢复到室温,量气管和水准管两边液面高度相等时,氧气排开水的体积与氧气的体积相等,即可用如图装置测量氧气的体积,D正确;
故选D。
2.C
【详解】A.铁与稀硫酸反应放出的氢气排出装置内的空气,再挤压胶头滴管内的氢氧化钠溶液与硫酸亚铁反应生成的Fe(OH)2,Fe(OH)2与空气隔绝,Fe(OH)2不易被氧化,故A正确;
B.二氧化氮和水反应,不能用排水法收集二氧化氮,故B正确;
C.加热氯化铵和氢氧化钙固体混合物制备氨气,故C错误;
D.浓硫酸滴入蔗糖中,蔗糖炭化变黑,证明浓硫酸具有脱水性;高锰酸钾溶液褪色、澄清石灰水变浑浊,说明碳和浓硫酸反应生成二氧化硫和二氧化碳,证明浓硫酸具有强氧化性,故D正确;
选C。
3.B
【详解】A.和反应生成,不稳定,易被氧化,空气中含有氧气可以将氧化为,导致溶液中增大,反应液中变小,故A正确;
B.在该反应中,是反应物,不是催化剂,故B错误;
C.若不通,易溶于水会发生倒吸,从而使部分进入烧瓶中的进气管堵塞管口,故C正确;
D.微溶于水,若用澄清石灰水吸收尾气,因的浓度较低,对的吸收效果差,导致尾气中大部分逸出,故D正确;
故选B。
4.B
【分析】装置A制备氨气,装置B干燥氨气,装置C中氨气还原氧化铜生成氮气、水和铜,装置D吸收产生的水蒸气,装置E防止水蒸气进入装置D中,吸收剩余的氨气,装置F排水法测量氮气的体积,据此解答。
【详解】A.加热氯化铵固体生成氨气和氯化氢,在管口二者又重新化合生成氯化铵,不能制备氨气,A错误;
B.装置E的作用是吸收剩余的氨气,同时防止水蒸气进入装置D中,若撤去装置E,会导致水蒸气的质量增加,则测得氮氢比偏小,B正确;
C.生成的氨气中含有水蒸气,装置B的作用是干燥氨气,NH3会和无水氯化钙反应,不能将碱石灰替换成无水氯化钙,C错误;
D.标准状况下,bL氮气的物质的量为:n(N2)=,含有的N的物质的量为: ,装置D增重的为水的质量,则水的物质的量为:,含有的H的物质的量为:,氨气中含有的N、H原子数之比为::=9V:11.2m,D错误;
故选B。
5.(1)分液漏斗
(2)B
(3) B
(4)
(5)
(6)NaOH溶液
【分析】该实验装置是探究NH3催化氧化反应,氨气和氧气在催化剂、加热的条件下生成一氧化氮和水,化学方程式为:4NH3+5O24NO+6H2O;氨气极易溶于水,BD装置中含有吸水装置,由此推测,装置B为制备氨气的装置,装置A为制备O2的装置,装置A烧瓶中为固体二氧化锰与过氧化氢反应制取氧气;装置B烧瓶中固体为氧化钙,氧化钙和浓氨水反应生成氨气,氨气是碱性气体,故干燥管D中装有碱性干燥剂;氨气和氧气在装置E中反应生成一氧化氮和水;F装置中,一氧化氮和氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸和一氧化氮,氨气和硝酸反应生成硝酸铵,产生白烟;装置G中,含有硝酸、硫酸和铜,铜和硝酸反应生成硝酸铜、一氧化氮和水,溶液变为蓝色;
【详解】(1)仪器a的名称为分液漏斗。
(2)由分析可知,仪器b中盛放的试剂可以是碱石灰。
(3)由分析可知,装置B用来制取氨气,实验室常用氯化铵和氢氧化钙制取氨气,同时生成氯化铵和水,反应方程式为;
(4)由分析可知,E中发生反应为氨气和氧气催化氧化生成NO和水,化学方程式为:4NH3+5O24NO+6H2O;
(5)①由分析可知,装置F中白烟的成分是:NH4NO3;
②装置G中溶液变成蓝色的原因是铜和硝酸生成硝酸铜和NO、水:。
(6)尾气中含有一氧化氮、二氧化氮有毒,可用氢氧化钠溶液吸收尾气。
6.(1) 检查装置的气密性 分液漏斗
(2)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(3) 250 mL容量瓶 48.0或48
(4)3NO2+H2O=2HNO3+NO
(5)浓硝酸或浓HNO3
(6)装置②中液面上方气体仍为无色,装置③中液面上方气体由无色变为红棕色
【分析】浓硝酸与铜反应生成二氧化氮气体,通过水转化为NO,NO通过盛有浓硝酸的试剂瓶③,观察浓硝酸能不能把NO氧化为NO2,NO通过盛有稀硝酸的试剂瓶②,观察有没有被氧化为NO2。
【详解】(1)连接好装置后先检查装置的气密性,再加入药品;盛浓硝酸的仪器是分液漏斗;
(2)装置①是铜与浓硝酸反应生成硝酸铜、二氧化氮和水,方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(3)配制250ml2.4mol/L的溶液需要250ml的容量瓶;250ml2.4mol/L的溶液需要0.25×2.4=0.6mol硝酸,(V×1.25×63.0%)÷63=0.6,得出V=48.0ml;
(4)生成的二氧化氮与水反应,把二氧化氮转化为NO,反应的化学方程式为3NO2+H2O=2HNO3+NO;
(5)③中盛放的是浓硝酸,能把NO氧化为NO2,最后被⑤中的氢氧化钠溶液吸收,②中盛放的是稀硝酸,不能氧化NO,最后用排水法收集尾气;
(6)②中稀硝酸不能氧化NO,②中气体仍为无色,③中浓硝酸能氧化NO生成NO2,气体有无色变为红棕色。
7.(1)a中直玻璃管内的水柱会上升,甚至水会溢出
(2) 除去乙烯中的CO2、SO2 吸收溴蒸气
(3)减少溴的挥发
(4)通入乙烯的速率过快
【详解】(1)当d堵塞时,气体不畅通则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管;
(2)b中盛氢氧化钠液其作用是洗涤乙烯,除去乙烯中的CO2、SO2;容器d中NaOH溶液的作用是处理尾气,吸收溴蒸气;
(3)溴单质易挥发,降低温度及水封有利于减少溴的挥发;
(4)装置的气密性没有问题,而通入的乙烯混合气体的量比正常情况下超出许多,可能是通入乙烯的速率过快。
8.(1)干燥管或球形干燥管
(2) SO2 漂白性 试纸变蓝 除去NH3中的SO2和H2O
(3)NH3
(4)取少量装置F内溶液于试管中,滴加足量的BaCl2溶液,生成白色沉淀;加入足量稀盐酸后沉淀完全溶解,并放出无色具有刺激性气味的气体
(5)
【分析】本题为实验探究题装置C为(NH4)2SO4受热分解装置,关闭止水夹n,打开止水夹m,则气体依次通过D、E、F装置,装置D为吸收NH3装置,E为检验SO2装置,F为尾气处理装置,打开n,关闭m,则气体通入装置A中,可检验产物中有无NH3生成,据此分析解题。
【详解】(1)由题干实验装置图可知,仪器a的名称是球形干燥管或干燥管,故答案为:干燥管或球形干燥管;
(2)先关闭止水夹n,打开止水夹m,400℃加热装置C, SO2具有漂白性,能够漂白品红等有色物质,装置E中品红溶液褪色,证明分解产物中含有SO2,品红溶液褪色说明其具有漂白性,NH3溶于水呈碱性,则NH3遇到湿润的红色石蕊试纸将变为蓝色,然后打开n,关闭m,装置A中的现象是试纸变蓝,说明分解产物有氨气生成,碱石灰的作用是除去NH3中的SO2和H2O,400℃加热装置C至(NH4)2SO4完全分解无残留物,停止加热,进一步研究发现,气体产物中有N2生成,故答案为:SO2;漂白性;试纸变蓝;除去NH3中的SO2和H2O;
(3)由(2)中分析可知,分解产物为SO2、N2、NH3和H2O,故装置D内稀盐酸吸收的气体是NH3,故答案为:NH3;
(4)利用BaSO3不溶于水而溶液稀盐酸,BaSO4既不溶于水也不溶于稀盐酸的特性可知,检验装置内溶液中有、无的实验操作和现象是取少量装置F内溶液于试管中,滴加足量的BaCl2溶液,生成白色沉淀;加入足量稀盐酸后沉淀完全溶解,并放出无色具有刺激性气味的气体,故答案为:取少量装置F内溶液于试管中,滴加足量的BaCl2溶液,生成白色沉淀;加入足量稀盐酸后沉淀完全溶解,并放出无色具有刺激性气味的气体;
(5)由(2)实验可知,分解产物为SO2、N2、NH3和H2O,则该分解反应方程式为:,故答案为:。
9.(1)
(2) 分液漏斗 除去乙烯中的乙醇杂质
(3)bc
(4) 3 (其它答案正确即可)
【分析】本实验分成三个部分,分别为制备氯气、制备乙烯、制备1,2-二氯乙烷,装置I为氯气的发生装置,装置II为除去氯气中的氯化氢,装置III为除去氯气中的水蒸气;装置VII为乙烯的发生装置,装置VI为除去乙烯中的乙醇,装置V为除去乙烯中的水,装置IV为乙烯与氯气加成制备1,2-二氯乙烷。
【详解】(1)IV为乙烯与氯气加成制备1,2-二氯乙烷,发生的化学反应方程式为:;
(2)仪器A的名称是分液漏斗,装置Ⅵ中水的作用是除去乙烯中的乙醇
(3)氯气和乙烯在水中的溶解度都很校,在Ⅳ中反应前先加入少量1,2-二氯乙烷液体,可增大氯气和乙烯的溶解度,促进气体反应物间的接触,故选bc;
(4)
液相直接氯化法,加成得到二氯取代物的结构有: ,故答案为3;有两个甲基的同分异构体的结构简式。
10.(1)
(2) 生石灰 浓氨水
(3) 碱石灰 试纸变蓝
(4) 产生白烟 防止倒吸
(5)
【分析】本实验的目的为制取氨气并探究其性质,A为氨气的制取装置,B为干燥装置,C可以检验氨气的碱性,D中氨气和浓盐酸反应生成氯化铵,E为尾气处理装置,结合实验室氨气的制取原理进行分析解答。
【详解】(1)装置a适用干固体(或固体混合物)加热制备气体。选择装置a制NH3,使用Ca(OH)2和NH4Cl的混合物共热制NH3,反应的化学方程式为,答案:;
(2)装置b适用干固体与液体常温下制气体。选择装置b制NH3,所用试剂为生石灰和浓氨水,生石灰和水反应放出大量的热,导致浓氨水中氨气逸出得到氨气,答案:生石灰;浓氨水;
(3)氨气呈碱性,干燥NH3选用碱石灰作干燥剂;NH3呈碱性,使红色石蕊试纸变蓝,C装置中的现象是湿润的红色石蕊试纸变蓝,答案:碱石灰;试纸变蓝;
(4)浓盐酸具有挥发性,NH3与HCl化合成白色固体NH4Cl,反应的化学方程式为NH3+HCl=NH4Cl,挤压D装詈中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是产生大量白烟。NH3水容易造成倒吸,因此E中倒扣漏斗的作用防止倒吸;答案:产生白烟;防止倒吸;
(5)①NH3→NO的化学方程式为,故答案为:;
②NO2→HNO3的化学方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO。
11.(1) E D
(2)排出装置中的空气
(3) 开始时装置D中无色,通入氧气后出现红棕色气体 降温冷凝,使NO2完全液化,除去气体中的NO2,避免干扰NO的检验
(4)4NO2+O2+4NaOH=4NaNO3+2H2O
(5)2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O
【分析】本实验是探究亚硝酸钠与硫酸反应及气体产物的成分。NaNO2中氮元素显+3价,在酸性条件下能发生岐化反应,氮由+3价升高到+4价可产生NO2气体,降到+2价可产生NO气体,可推测NaNO2和H2SO4反应产物中可能含有NO2和NO气体。NO2为红棕色易液化的气体,无色的NO气体极易被O2氧化为NO2。根据NO、NO2的液化温度和性质可知装置D用于检验NO,装置E用于检验并分离NO2,装置B为尾气处理装置,NO2会干扰NO的检验,由此分析解答。
【详解】(1)NaNO2中氮元素显+3价,在酸性条件下能发生岐化反应,氮由+3价升高到+4价可产生NO2气体,降到+2价可产生NO气体,可推测NaNO2与H2SO4反应产物中可能含NO和NO2。根据NO、NO2的液化温度和性质可知装置D用于检验NO,装置E用于检验并分离NO2,装置B为尾气处理装置,NO2会干扰NO的检验,所以为了检验装置A中的气体产物,应该将生成气体干燥后首先通过E分离出二氧化氮,故仪器的连接顺序是A、C、E、D、B;
(2)由于NO极易被空气中的氧气氧化为NO2,所以先通入一段时间氮气,排出装置中的空气,防止可能产生的NO被氧化成NO2,造成对A中反应产物检验的干扰;
(3)①利用装置D检验NO,根据2NO+O2=2NO2可知,开始时装置D中无色,通入氧气后出现红棕色气体即可证明NO的存在;
②装置E的作用是降温冷凝,使NO2完全液化,除去气体中的NO2,避免干扰NO的检验;
(4)因为NO2、O2和水共同作用可以产生HNO3,所以装置B中发生反应的化学方程式为4NO2+O2+4NaOH=4NaNO3+2H2O;
(5)根据上述实验探究可知,NaNO2和H2SO4反应产生NO2、NO,同时生成硫酸钠、水,装置A中发生反应的化学方程式是2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O。
12.(1)AD
(2)
(3) 增大了气体与NaClO溶液的接触面积,加快了脱硫脱硝速率,并使气体吸收更充分(合理即得分)
(4)
【详解】(1)实验室以Cu与浓HNO3反应制备并收集NO2,根据反应物的状态是固体和液体,反应不需要加热,确定发生装置为A,根据NO2能与水反应且密度大于空气,应用向上排空气法收集NO2气体,则收集装置是D,故选AD;
(2)根据反应原理可知,NO、NH3、O2为反应物,生成N2和H2O,配平化学方程式为:;
(3)喷淋吸收塔装置的优点:增大了气体与NaClO溶液的接触面积,加快了脱硫脱硝速率,由图可知,NaClO与NO反应生成硝酸根离子和氯离子,配平反应的离子方程式为;
(4)装置A中,Fe2(SO4)3溶液吸收SO2反应的离子方程式为:;FeSO4与Ce(SO4)2发生反应Fe2++Ce4+=Ce3++Fe3+,n(Fe2+)= n(Ce4+)=cV=0.1000 mol·L-1×0.018L=0.0018mol,由反应可知n(SO2)=0.5n(Fe2+)=0.5×0.0018mol=9×10-4mol,尾气的体积为V L,该实验条件下气体摩尔体积为Vm L/mol,则尾气的物质的量为n=,尾气中的体积分数为。
13.(1)除去装置中的,防止生成杂质
(2)
(3)浓硫酸
(4)淡黄色粉末全部变为白色粉末
(5) 溶于水,溶液显碱性 还原性 氧化性
【分析】铜与浓硝酸反应产生NO2,产生的NO2进入B中与水反应生成硝酸和NO,稀硝酸进一步和铜粉反应也产生NO,再经干燥进入D与过氧化钠反应制得NaNO2,因为NaNO2易溶于水,E装置的浓硫酸可以防止F中的水蒸气进入D中,F装置用来尾气吸收NO。
【详解】(1)反应开始之前通外来气体一般是排尽装置中的空气,防止空气中的某成分对后续实验有干扰,结合本题情景可知,滴入浓硝酸前先通入一段时间的N2,目的是:去装置中的,防止生成杂质。
(2)B中发生反应的化学方程式为:、。
(3)根据分析可知C装置是用来干燥NO气体的,应该盛放的是浓硫酸。
(4)D中发生的是NO和过氧化钠的反应,过氧化钠是淡黄色固体,NaNO2是白色粉末,所以当观察到淡黄色粉末全部变为白色粉末能说明反应结束。
(5)实验Ⅰ加酚酞变红可推断NaNO2溶液显碱性,实验Ⅰ溶液不褪色说明NaNO2溶液没有漂白性但实验Ⅱ能使酸性高锰酸钾溶液褪色说明该物质有还原性,实验Ⅲ加淀粉碘化钾溶液变蓝说明该物质有氧化性将I-氧化为了I2。
14.(1) 蓝色沉淀 3Fe2+ + 2[Fe(CN)6]3- = Fe3 [Fe(CN)6]2↓
(2)排出装置中的空气,防止其氧化Fe2+,干扰实验
(3)2Fe3+ + H2S = 2Fe2+ + S ↓+ 2H+
(4)
(5)甲、乙
(6)10mol/L
【分析】通入一段时间N2,排出装置中的氧气,利用装置A用二氧化锰和浓盐酸制备氯气,利用装置C用70%的浓硫酸和亚硫酸钠制备二氧化硫,利用装置A、B、D和活塞的开关验证氧化性,利用装置C、B、D和活塞的开关验证氧化性,据此分析。
【详解】(1)亚铁离子与[Fe(CN)6]3-反应生成蓝色沉淀Fe3 [Fe(CN)6]2,离子方程式为3Fe2+ + 2[Fe(CN)6]3- = Fe3 [Fe(CN)6]2↓;故答案为:蓝色沉淀;3Fe2+ + 2[Fe(CN)6]3- = Fe3 [Fe(CN)6]2↓;
(2)通入氮气的目的是排除空气的干扰,因为空气中的氧气也能氧化亚铁离子,故答案为:排出装置中的空气,防止其氧化Fe2+,干扰实验;
(3)B溶液变黄,说明亚铁离子被氧化为铁离子,通入H2S气体,会观察到有淡黄色沉淀生成,该黄色沉淀是S单质,说明铁离子与硫化氢发生氧化还原反应,生成S和亚铁离子,依据元素守恒,溶液中还有氢离子生成,离子方程式为2Fe3+ + H2S = 2Fe2+ + S ↓+ 2H+ ;故答案为:2Fe3+ + H2S = 2Fe2+ + S ↓+ 2H+;
(4)SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,是因为二氧化硫与酸性高锰酸钾发生氧化还原反应,生成硫酸根离子、锰离子、氢离子,化学方程式为2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4,故答案为:;
(5)乙中第一次既有Fe3+又有 Fe2+,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生SO2与Fe3+的反应,则氧化性:Fe3+> SO2;甲中第一次有Fe3+,无Fe2+,则氧化性:Cl2>Fe3+,第二次有Fe2+,说明发生SO2与Fe3+的反应,则氧化性:Fe3+> SO2;丙中第一次有Fe3+,无Fe2+,说明氯气足量,第二次有,可能是过量的氯气把SO2氧化为,不能说明氧化性Fe3+> SO2;故答案为:甲、乙;
(6)设原FeBr2溶液中FeBr2的物质的量为xmol,根据还原性Fe2+>Br-,得通入的氯气先与亚铁离子反应生成铁离子,Cl2+2Fe2+=2Fe3++2Cl-,消耗氯气的物质的量是0.5xmol,后与溴离子反应生成溴单质,Cl2+2Br-=Br2+2Cl-,溶液中有1/2的Br-被氧化成单质Br2,则消耗的氯气为0.5xmol,所以0.5x+0.5x=22.4/22.4,解得x=1,所以原FeBr2溶液中FeBr2的物质的量浓度为1mol/0.1L=10mol/L,故答案为:10mol/L。
答案第1页,共2页
答案第1页,共2页
(2022-2023高一下·湖南张家界·期末)
1.下列装置可以用于相应实验的是
A B C D
制备 分离乙醇和乙酸 验证酸性 测量体积
A.A B.B C.C D.D
(2022-2023高一下·湖南衡阳·期末)
2.下列实验操作不能达到相应实验目的的是
选项 A B C D
实验操作
实验目的 实验室制 取Fe(OH)2 不能制备并收集 少量NO2气体 制备干燥NH3 验证浓硫酸的脱 水性、强氧化性
A.A B.B C.C D.D
(2022-2023高一下·湖南张家界·期末)
3.是制备高纯的中间原料。实验室用如图所示装置可制备少量溶液,反应原理为。下列说法错误的是
A.若实验中将换成空气,则反应液中变小
B.在该反应中作催化剂
C.若不通,则烧瓶中的进气管口容易被堵塞
D.石灰乳对尾气的吸收效果比澄清石灰水更好
(2022-2023高一下·商丘名校联考·期末)
4.应用下列装置测定氨气的组成。实验利用了氨气能还原氧化铜生成氮气、铜和水的原理。实验后测得装置D增重,用排水法测量得的体积为(已折算成标准状况)。下列有关实验描述正确的是
A.装置A用于制备氨气,可用加热氯化铵固体的装置代替
B.装置的作用是防止水蒸气进入装置中,若撤去装置,则测得氮氢比偏小
C.装置B中盛放的物质是碱石灰,也可用无水氯化钙代替
D.由实验数据可以计算得到氨气分子中的氮氢个数比为11.2m∶9V
(2022-2023高一下·河北唐山·期末)
5.某实验小组同学欲探究催化氧化反应,按如图所示装置进行实验。
已知装置A、B可选药品:浓氨水、、蒸馏水、生石灰、。
(1)仪器a的名称为 。
(2)仪器b中盛放的试剂可以是___________(填字母)。
A.浓硫酸 B.碱石灰 C.五氧化二磷 D.无水氯化钙
(3)装置 (填“A”或“B”)用来制取氨气,实验室常用氯化铵和氢氧化钙制取氨气,反应方程式为 。
(4)装置E中发生反应的化学方程式为 。
(5)甲、乙两同学分别按上述装置进行实验,一段时间后:
①甲观察到装置F中只有白烟生成,白烟的成分是 (写化学式)。
②乙观察到装置F中有红棕色气体,装置G中溶液变成蓝色。用离子方程式解释装置G中溶液变成蓝色的原因: 。
(6)尾气处理装置所需的液体试剂是 。
(2022-2023高一下·湖南张家界·期末)
6.某学习小组为验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,设计如图装置进行实验(夹持仪器已略去)。
【查阅资料】
NO与NaOH溶液不反应;NO2与NaOH溶液能反应(2NO2+2NaOH=NaNO3+NaNO2+H2O)。
备选药品:浓硝酸、2.4 mol·L稀硝酸、蒸馏水、浓硫酸、NaOH溶液及CO2气体。
回答下列问题:
(1)连接好装置,紧接着的操作步骤是 ,再加入药品,打开装置①中的弹簧夹后通入CO2气体一段时间,关闭弹簧夹,将装置④中导管末端伸入倒置的烧瓶内,然后再通过①中 (填仪器名称)滴入浓硝酸,进行实验。
(2)装置①中发生反应的化学方程式为 。
(3)若用质量分数为63.0%的浓硝酸(密度为1.25 g·cm)配制250 mL 2.4 mol·L的稀硝酸,除量筒、烧杯、胶头滴管、玻璃棒外,还要用到的玻璃仪器有 ,则需量取63.0%的浓硝酸体积为 mL。
(4)装置中盛有水的洗气瓶的主要作用是(用化学方程式回答) 。
(5)根据实验设计,装置③中盛放的试剂是 。
(6)实验证明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,则②和③装置中的实验现象是 。
(2022-2023高一下·湖南衡阳·期末)
7.1,2 二溴乙烷在常温下是无色液体,密度是2.18g/cm3,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于乙醇、丙酮等有机溶剂。在实验室中可以用下图所示装置来制备1,2 二溴乙烷。其中试管c中装有液溴(表面覆盖少量水)。
(1)安全瓶a可以防止倒吸,并可以检查实验进行时试管c中导管是否发生堵塞。如果发生堵塞,a中的现象是 。
(2)容器b中NaOH溶液的作用是 ,容器d中NaOH溶液的作用是 。
(3)试管c浸入冷水中,以及液溴表面覆盖少量水的原因是 。
(4)某同学在做实验时,使用一定量的液溴,当溴全部褪色时,通入的乙烯混合气体的量比正常情况下超出许多。如果装置的气密性没有问题,试分析可能的原因: 。
(2022-2023高一下·河北张家口·期末)
8.硫酸铵是一种无机物,化学式为(NH4)2SO4,白色颗粒,无气味,受热易分解。某化学研究小组拟探究其在400℃时的分解产物。实验装置如图所示(部分夹持装置已略去):
回答下列问题:
(1)仪器a的名称是 。
(2)先关闭止水夹n,打开止水夹m,400℃加热装置C,装置E中品红溶液褪色,证明分解产物中含有 (填化学式),品红溶液褪色说明其具有 。然后打开n,关闭m,装置A中的现象是 ,说明分解产物有氨气生成,碱石灰的作用是 ,400℃加热装置C至(NH4)2SO4完全分解无残留物,停止加热,进一步研究发现,气体产物中有N2生成。
(3)装置D内稀盐酸吸收的气体是 (填化学式)。
(4)检验装置内溶液中有、无的实验操作和现象是 。
(5)(NH4)2SO4在400℃分解的化学方程式是 。
(2022-2023高一下·黑龙江实验中学·期末)
9.1,2-二氯乙烷是杀菌剂稻瘟灵和植物生长调节剂矮壮素的中间体,不溶于水,易溶于有机溶剂,沸点83.6℃,在光照下易分解。制备1,2-二氯乙烷相关原理和实验装置图如下:
已知:;甘油的沸点为290℃。
请回答以下问题:
(1)写出装置Ⅳ中发生的化学反应方程式 。
(2)仪器A的名称是 ,装置Ⅵ中水的作用是 。
(3)Ⅳ中反应前先加入少量1,2-二氯乙烷液体,其作用是 (填序号)。
a.作催化剂 b.溶解和乙烯 c.促进气体反应物间的接触
(4)已知液相直接氯化法可生成1,2-二氯乙烷的同系物,得到产物有 种不同结构,写出上述产物中一种含有两个甲基的同分异构体的结构简式 。
(2022-2023高一下·辽宁六校协作体·期末)
10.某化学兴趣小组为了制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。
(1)若氨气的发生装置选择a,则其化学反应方程式为 。
(2)若氨气的发生装置选择b,则所用的试剂为 和 。
(3)B装置中的干燥剂可选用 :实验中观察到C装置中的现象是 。
(4)当实验进行一段时间后,挤压D装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是 ,E中倒扣漏斗的作用是 。
(5)氨气(NH3)是一种重要的化工原料,其中约80%用来生产各种氮肥。其中利用NH3生产NH4NO3的主要转化途径如图(转化所需试剂及条件已略去):
NH3→NO→NO2→HNO3NH4NO3
①NH3→NO的化学方程为 。
②NO2→HNO3的化学方程式为 。
(2022-2023高一下·湖南师大附中博才实验中学·期末)
11.亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业中的用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-=2+H2O;
②气体液化的温度:NO2为21℃,NO为-152℃。
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、 、 、B。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是 。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是 ;
②装置E的作用是 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是 。
(2022-2023高一下·吉林“BEST合作体”联考·期末)
12.回答下列问题:
(1)如图包含气体发生装置和收集装置(部分装置的夹持仪器已省略),实验室以Cu与浓反应制备并收集,应选择的装置是 (填字母)。
(2)SCR脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达90%以上。反应机理如图所示,写出该反应的化学方程式: 。
(3)目前,NaClO溶液广泛地应用于脱硫脱硝。某课外小组同学设计了如图喷淋吸收塔装置(如图)。设计该装置的优点是 ,脱硝(NO)反应的离子方程式为 。
(4)某兴趣小组用溶液吸收含的尾气(其余气体均与溶液不反应),实验装置如图所示,装置A中发生反应的离子方程式为 。
若尾气的体积为V L,该实验条件下气体摩尔体积为Vm L/mol,尾气中全部被装置A吸收。反应后将装置A中溶液全部转移至烧杯中,向其中逐滴加入0.1000 溶液,发生反应,当反应恰好完全时,共消耗溶液18.00mL。请通过计算确定尾气中的体积分数为 。
(2022-2023高一下·辽宁部分学校·期末)
13.亚硝酸钠(NaNO2)常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。NaNO2是白色粉末,易溶于水。
回答下列问题:
(1)滴入浓硝酸前先通入一段时间的N2,目的是 。
(2)B中发生反应的化学方程式为 、 。
(3)C中试剂是 (填名称)。
(4)实验过程中,当D中 (填硬质玻璃管中实验现象)时表明D中反应已完成。
(5)探究 NaNO2的性质。取一定量产品溶于水,将得到的溶液分成三份并进行如下实验:
实验 操作 现象
Ⅰ 在第一份溶液中滴加酚酞溶液 溶液呈红色,不褪色
Ⅱ 在酸性高锰酸钾溶液中滴加第二份溶液 溶液褪色
Ⅲ 在淀粉—KI溶液中滴加第三份溶液 溶液变蓝
由此推知,NaNO2具有的性质依次为 、 、 。
(2022-2023高一下·辽宁葫芦岛·期末)
14.验证氧化性,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
实验过程:
Ⅰ.打开止水夹,通入一段时间,再将T型导管插入B中,继续通入,然后关闭,,。
Ⅱ.打开活塞a,滴加 定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开和活塞c,加入70%的硫酸溶液,一段时间后关闭。
Ⅵ.更换试管D,重复过程Ⅳ,检验B中溶液的离子。
(1)检验B中溶液中的现象为 ,发生反应的离子方程式 。
(2)过程Ⅰ的目的是 。
(3)若向过程ⅢB中的黄色溶液中通入气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式: 。
(4)若将C中制取的通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为 。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果 定能够证明氧化性的是 (填“甲”“乙”或“丙”)。
过程为Ⅳ,B溶液中含有的离子 过程Ⅵ,B溶液中含有的离子
甲 有无 有
乙 既有又有 有
丙 有无 有
(6)将B中的溶液换成溶液并向其中通入(标准状况下),若溶液中有的被氧化成单质,则原溶液中的物质的量浓度为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.Na2CO3固体比较稳定,受热不易分解,所以不能采用加热碳酸钠的方式制备二氧化碳,A错误;
B.乙醇和乙酸是互溶的,不能采用分液的方式分离,应采用蒸馏来分离,B错误;
C.二氧化硫通入品红溶液中,可以验证其漂白性,不能验证酸性,C错误;
D.测量氧气体积时,装置选择量气管,测量时要恢复到室温,量气管和水准管两边液面高度相等时,氧气排开水的体积与氧气的体积相等,即可用如图装置测量氧气的体积,D正确;
故选D。
2.C
【详解】A.铁与稀硫酸反应放出的氢气排出装置内的空气,再挤压胶头滴管内的氢氧化钠溶液与硫酸亚铁反应生成的Fe(OH)2,Fe(OH)2与空气隔绝,Fe(OH)2不易被氧化,故A正确;
B.二氧化氮和水反应,不能用排水法收集二氧化氮,故B正确;
C.加热氯化铵和氢氧化钙固体混合物制备氨气,故C错误;
D.浓硫酸滴入蔗糖中,蔗糖炭化变黑,证明浓硫酸具有脱水性;高锰酸钾溶液褪色、澄清石灰水变浑浊,说明碳和浓硫酸反应生成二氧化硫和二氧化碳,证明浓硫酸具有强氧化性,故D正确;
选C。
3.B
【详解】A.和反应生成,不稳定,易被氧化,空气中含有氧气可以将氧化为,导致溶液中增大,反应液中变小,故A正确;
B.在该反应中,是反应物,不是催化剂,故B错误;
C.若不通,易溶于水会发生倒吸,从而使部分进入烧瓶中的进气管堵塞管口,故C正确;
D.微溶于水,若用澄清石灰水吸收尾气,因的浓度较低,对的吸收效果差,导致尾气中大部分逸出,故D正确;
故选B。
4.B
【分析】装置A制备氨气,装置B干燥氨气,装置C中氨气还原氧化铜生成氮气、水和铜,装置D吸收产生的水蒸气,装置E防止水蒸气进入装置D中,吸收剩余的氨气,装置F排水法测量氮气的体积,据此解答。
【详解】A.加热氯化铵固体生成氨气和氯化氢,在管口二者又重新化合生成氯化铵,不能制备氨气,A错误;
B.装置E的作用是吸收剩余的氨气,同时防止水蒸气进入装置D中,若撤去装置E,会导致水蒸气的质量增加,则测得氮氢比偏小,B正确;
C.生成的氨气中含有水蒸气,装置B的作用是干燥氨气,NH3会和无水氯化钙反应,不能将碱石灰替换成无水氯化钙,C错误;
D.标准状况下,bL氮气的物质的量为:n(N2)=,含有的N的物质的量为: ,装置D增重的为水的质量,则水的物质的量为:,含有的H的物质的量为:,氨气中含有的N、H原子数之比为::=9V:11.2m,D错误;
故选B。
5.(1)分液漏斗
(2)B
(3) B
(4)
(5)
(6)NaOH溶液
【分析】该实验装置是探究NH3催化氧化反应,氨气和氧气在催化剂、加热的条件下生成一氧化氮和水,化学方程式为:4NH3+5O24NO+6H2O;氨气极易溶于水,BD装置中含有吸水装置,由此推测,装置B为制备氨气的装置,装置A为制备O2的装置,装置A烧瓶中为固体二氧化锰与过氧化氢反应制取氧气;装置B烧瓶中固体为氧化钙,氧化钙和浓氨水反应生成氨气,氨气是碱性气体,故干燥管D中装有碱性干燥剂;氨气和氧气在装置E中反应生成一氧化氮和水;F装置中,一氧化氮和氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸和一氧化氮,氨气和硝酸反应生成硝酸铵,产生白烟;装置G中,含有硝酸、硫酸和铜,铜和硝酸反应生成硝酸铜、一氧化氮和水,溶液变为蓝色;
【详解】(1)仪器a的名称为分液漏斗。
(2)由分析可知,仪器b中盛放的试剂可以是碱石灰。
(3)由分析可知,装置B用来制取氨气,实验室常用氯化铵和氢氧化钙制取氨气,同时生成氯化铵和水,反应方程式为;
(4)由分析可知,E中发生反应为氨气和氧气催化氧化生成NO和水,化学方程式为:4NH3+5O24NO+6H2O;
(5)①由分析可知,装置F中白烟的成分是:NH4NO3;
②装置G中溶液变成蓝色的原因是铜和硝酸生成硝酸铜和NO、水:。
(6)尾气中含有一氧化氮、二氧化氮有毒,可用氢氧化钠溶液吸收尾气。
6.(1) 检查装置的气密性 分液漏斗
(2)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(3) 250 mL容量瓶 48.0或48
(4)3NO2+H2O=2HNO3+NO
(5)浓硝酸或浓HNO3
(6)装置②中液面上方气体仍为无色,装置③中液面上方气体由无色变为红棕色
【分析】浓硝酸与铜反应生成二氧化氮气体,通过水转化为NO,NO通过盛有浓硝酸的试剂瓶③,观察浓硝酸能不能把NO氧化为NO2,NO通过盛有稀硝酸的试剂瓶②,观察有没有被氧化为NO2。
【详解】(1)连接好装置后先检查装置的气密性,再加入药品;盛浓硝酸的仪器是分液漏斗;
(2)装置①是铜与浓硝酸反应生成硝酸铜、二氧化氮和水,方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(3)配制250ml2.4mol/L的溶液需要250ml的容量瓶;250ml2.4mol/L的溶液需要0.25×2.4=0.6mol硝酸,(V×1.25×63.0%)÷63=0.6,得出V=48.0ml;
(4)生成的二氧化氮与水反应,把二氧化氮转化为NO,反应的化学方程式为3NO2+H2O=2HNO3+NO;
(5)③中盛放的是浓硝酸,能把NO氧化为NO2,最后被⑤中的氢氧化钠溶液吸收,②中盛放的是稀硝酸,不能氧化NO,最后用排水法收集尾气;
(6)②中稀硝酸不能氧化NO,②中气体仍为无色,③中浓硝酸能氧化NO生成NO2,气体有无色变为红棕色。
7.(1)a中直玻璃管内的水柱会上升,甚至水会溢出
(2) 除去乙烯中的CO2、SO2 吸收溴蒸气
(3)减少溴的挥发
(4)通入乙烯的速率过快
【详解】(1)当d堵塞时,气体不畅通则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管;
(2)b中盛氢氧化钠液其作用是洗涤乙烯,除去乙烯中的CO2、SO2;容器d中NaOH溶液的作用是处理尾气,吸收溴蒸气;
(3)溴单质易挥发,降低温度及水封有利于减少溴的挥发;
(4)装置的气密性没有问题,而通入的乙烯混合气体的量比正常情况下超出许多,可能是通入乙烯的速率过快。
8.(1)干燥管或球形干燥管
(2) SO2 漂白性 试纸变蓝 除去NH3中的SO2和H2O
(3)NH3
(4)取少量装置F内溶液于试管中,滴加足量的BaCl2溶液,生成白色沉淀;加入足量稀盐酸后沉淀完全溶解,并放出无色具有刺激性气味的气体
(5)
【分析】本题为实验探究题装置C为(NH4)2SO4受热分解装置,关闭止水夹n,打开止水夹m,则气体依次通过D、E、F装置,装置D为吸收NH3装置,E为检验SO2装置,F为尾气处理装置,打开n,关闭m,则气体通入装置A中,可检验产物中有无NH3生成,据此分析解题。
【详解】(1)由题干实验装置图可知,仪器a的名称是球形干燥管或干燥管,故答案为:干燥管或球形干燥管;
(2)先关闭止水夹n,打开止水夹m,400℃加热装置C, SO2具有漂白性,能够漂白品红等有色物质,装置E中品红溶液褪色,证明分解产物中含有SO2,品红溶液褪色说明其具有漂白性,NH3溶于水呈碱性,则NH3遇到湿润的红色石蕊试纸将变为蓝色,然后打开n,关闭m,装置A中的现象是试纸变蓝,说明分解产物有氨气生成,碱石灰的作用是除去NH3中的SO2和H2O,400℃加热装置C至(NH4)2SO4完全分解无残留物,停止加热,进一步研究发现,气体产物中有N2生成,故答案为:SO2;漂白性;试纸变蓝;除去NH3中的SO2和H2O;
(3)由(2)中分析可知,分解产物为SO2、N2、NH3和H2O,故装置D内稀盐酸吸收的气体是NH3,故答案为:NH3;
(4)利用BaSO3不溶于水而溶液稀盐酸,BaSO4既不溶于水也不溶于稀盐酸的特性可知,检验装置内溶液中有、无的实验操作和现象是取少量装置F内溶液于试管中,滴加足量的BaCl2溶液,生成白色沉淀;加入足量稀盐酸后沉淀完全溶解,并放出无色具有刺激性气味的气体,故答案为:取少量装置F内溶液于试管中,滴加足量的BaCl2溶液,生成白色沉淀;加入足量稀盐酸后沉淀完全溶解,并放出无色具有刺激性气味的气体;
(5)由(2)实验可知,分解产物为SO2、N2、NH3和H2O,则该分解反应方程式为:,故答案为:。
9.(1)
(2) 分液漏斗 除去乙烯中的乙醇杂质
(3)bc
(4) 3 (其它答案正确即可)
【分析】本实验分成三个部分,分别为制备氯气、制备乙烯、制备1,2-二氯乙烷,装置I为氯气的发生装置,装置II为除去氯气中的氯化氢,装置III为除去氯气中的水蒸气;装置VII为乙烯的发生装置,装置VI为除去乙烯中的乙醇,装置V为除去乙烯中的水,装置IV为乙烯与氯气加成制备1,2-二氯乙烷。
【详解】(1)IV为乙烯与氯气加成制备1,2-二氯乙烷,发生的化学反应方程式为:;
(2)仪器A的名称是分液漏斗,装置Ⅵ中水的作用是除去乙烯中的乙醇
(3)氯气和乙烯在水中的溶解度都很校,在Ⅳ中反应前先加入少量1,2-二氯乙烷液体,可增大氯气和乙烯的溶解度,促进气体反应物间的接触,故选bc;
(4)
液相直接氯化法,加成得到二氯取代物的结构有: ,故答案为3;有两个甲基的同分异构体的结构简式。
10.(1)
(2) 生石灰 浓氨水
(3) 碱石灰 试纸变蓝
(4) 产生白烟 防止倒吸
(5)
【分析】本实验的目的为制取氨气并探究其性质,A为氨气的制取装置,B为干燥装置,C可以检验氨气的碱性,D中氨气和浓盐酸反应生成氯化铵,E为尾气处理装置,结合实验室氨气的制取原理进行分析解答。
【详解】(1)装置a适用干固体(或固体混合物)加热制备气体。选择装置a制NH3,使用Ca(OH)2和NH4Cl的混合物共热制NH3,反应的化学方程式为,答案:;
(2)装置b适用干固体与液体常温下制气体。选择装置b制NH3,所用试剂为生石灰和浓氨水,生石灰和水反应放出大量的热,导致浓氨水中氨气逸出得到氨气,答案:生石灰;浓氨水;
(3)氨气呈碱性,干燥NH3选用碱石灰作干燥剂;NH3呈碱性,使红色石蕊试纸变蓝,C装置中的现象是湿润的红色石蕊试纸变蓝,答案:碱石灰;试纸变蓝;
(4)浓盐酸具有挥发性,NH3与HCl化合成白色固体NH4Cl,反应的化学方程式为NH3+HCl=NH4Cl,挤压D装詈中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是产生大量白烟。NH3水容易造成倒吸,因此E中倒扣漏斗的作用防止倒吸;答案:产生白烟;防止倒吸;
(5)①NH3→NO的化学方程式为,故答案为:;
②NO2→HNO3的化学方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO。
11.(1) E D
(2)排出装置中的空气
(3) 开始时装置D中无色,通入氧气后出现红棕色气体 降温冷凝,使NO2完全液化,除去气体中的NO2,避免干扰NO的检验
(4)4NO2+O2+4NaOH=4NaNO3+2H2O
(5)2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O
【分析】本实验是探究亚硝酸钠与硫酸反应及气体产物的成分。NaNO2中氮元素显+3价,在酸性条件下能发生岐化反应,氮由+3价升高到+4价可产生NO2气体,降到+2价可产生NO气体,可推测NaNO2和H2SO4反应产物中可能含有NO2和NO气体。NO2为红棕色易液化的气体,无色的NO气体极易被O2氧化为NO2。根据NO、NO2的液化温度和性质可知装置D用于检验NO,装置E用于检验并分离NO2,装置B为尾气处理装置,NO2会干扰NO的检验,由此分析解答。
【详解】(1)NaNO2中氮元素显+3价,在酸性条件下能发生岐化反应,氮由+3价升高到+4价可产生NO2气体,降到+2价可产生NO气体,可推测NaNO2与H2SO4反应产物中可能含NO和NO2。根据NO、NO2的液化温度和性质可知装置D用于检验NO,装置E用于检验并分离NO2,装置B为尾气处理装置,NO2会干扰NO的检验,所以为了检验装置A中的气体产物,应该将生成气体干燥后首先通过E分离出二氧化氮,故仪器的连接顺序是A、C、E、D、B;
(2)由于NO极易被空气中的氧气氧化为NO2,所以先通入一段时间氮气,排出装置中的空气,防止可能产生的NO被氧化成NO2,造成对A中反应产物检验的干扰;
(3)①利用装置D检验NO,根据2NO+O2=2NO2可知,开始时装置D中无色,通入氧气后出现红棕色气体即可证明NO的存在;
②装置E的作用是降温冷凝,使NO2完全液化,除去气体中的NO2,避免干扰NO的检验;
(4)因为NO2、O2和水共同作用可以产生HNO3,所以装置B中发生反应的化学方程式为4NO2+O2+4NaOH=4NaNO3+2H2O;
(5)根据上述实验探究可知,NaNO2和H2SO4反应产生NO2、NO,同时生成硫酸钠、水,装置A中发生反应的化学方程式是2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O。
12.(1)AD
(2)
(3) 增大了气体与NaClO溶液的接触面积,加快了脱硫脱硝速率,并使气体吸收更充分(合理即得分)
(4)
【详解】(1)实验室以Cu与浓HNO3反应制备并收集NO2,根据反应物的状态是固体和液体,反应不需要加热,确定发生装置为A,根据NO2能与水反应且密度大于空气,应用向上排空气法收集NO2气体,则收集装置是D,故选AD;
(2)根据反应原理可知,NO、NH3、O2为反应物,生成N2和H2O,配平化学方程式为:;
(3)喷淋吸收塔装置的优点:增大了气体与NaClO溶液的接触面积,加快了脱硫脱硝速率,由图可知,NaClO与NO反应生成硝酸根离子和氯离子,配平反应的离子方程式为;
(4)装置A中,Fe2(SO4)3溶液吸收SO2反应的离子方程式为:;FeSO4与Ce(SO4)2发生反应Fe2++Ce4+=Ce3++Fe3+,n(Fe2+)= n(Ce4+)=cV=0.1000 mol·L-1×0.018L=0.0018mol,由反应可知n(SO2)=0.5n(Fe2+)=0.5×0.0018mol=9×10-4mol,尾气的体积为V L,该实验条件下气体摩尔体积为Vm L/mol,则尾气的物质的量为n=,尾气中的体积分数为。
13.(1)除去装置中的,防止生成杂质
(2)
(3)浓硫酸
(4)淡黄色粉末全部变为白色粉末
(5) 溶于水,溶液显碱性 还原性 氧化性
【分析】铜与浓硝酸反应产生NO2,产生的NO2进入B中与水反应生成硝酸和NO,稀硝酸进一步和铜粉反应也产生NO,再经干燥进入D与过氧化钠反应制得NaNO2,因为NaNO2易溶于水,E装置的浓硫酸可以防止F中的水蒸气进入D中,F装置用来尾气吸收NO。
【详解】(1)反应开始之前通外来气体一般是排尽装置中的空气,防止空气中的某成分对后续实验有干扰,结合本题情景可知,滴入浓硝酸前先通入一段时间的N2,目的是:去装置中的,防止生成杂质。
(2)B中发生反应的化学方程式为:、。
(3)根据分析可知C装置是用来干燥NO气体的,应该盛放的是浓硫酸。
(4)D中发生的是NO和过氧化钠的反应,过氧化钠是淡黄色固体,NaNO2是白色粉末,所以当观察到淡黄色粉末全部变为白色粉末能说明反应结束。
(5)实验Ⅰ加酚酞变红可推断NaNO2溶液显碱性,实验Ⅰ溶液不褪色说明NaNO2溶液没有漂白性但实验Ⅱ能使酸性高锰酸钾溶液褪色说明该物质有还原性,实验Ⅲ加淀粉碘化钾溶液变蓝说明该物质有氧化性将I-氧化为了I2。
14.(1) 蓝色沉淀 3Fe2+ + 2[Fe(CN)6]3- = Fe3 [Fe(CN)6]2↓
(2)排出装置中的空气,防止其氧化Fe2+,干扰实验
(3)2Fe3+ + H2S = 2Fe2+ + S ↓+ 2H+
(4)
(5)甲、乙
(6)10mol/L
【分析】通入一段时间N2,排出装置中的氧气,利用装置A用二氧化锰和浓盐酸制备氯气,利用装置C用70%的浓硫酸和亚硫酸钠制备二氧化硫,利用装置A、B、D和活塞的开关验证氧化性,利用装置C、B、D和活塞的开关验证氧化性,据此分析。
【详解】(1)亚铁离子与[Fe(CN)6]3-反应生成蓝色沉淀Fe3 [Fe(CN)6]2,离子方程式为3Fe2+ + 2[Fe(CN)6]3- = Fe3 [Fe(CN)6]2↓;故答案为:蓝色沉淀;3Fe2+ + 2[Fe(CN)6]3- = Fe3 [Fe(CN)6]2↓;
(2)通入氮气的目的是排除空气的干扰,因为空气中的氧气也能氧化亚铁离子,故答案为:排出装置中的空气,防止其氧化Fe2+,干扰实验;
(3)B溶液变黄,说明亚铁离子被氧化为铁离子,通入H2S气体,会观察到有淡黄色沉淀生成,该黄色沉淀是S单质,说明铁离子与硫化氢发生氧化还原反应,生成S和亚铁离子,依据元素守恒,溶液中还有氢离子生成,离子方程式为2Fe3+ + H2S = 2Fe2+ + S ↓+ 2H+ ;故答案为:2Fe3+ + H2S = 2Fe2+ + S ↓+ 2H+;
(4)SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,是因为二氧化硫与酸性高锰酸钾发生氧化还原反应,生成硫酸根离子、锰离子、氢离子,化学方程式为2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4,故答案为:;
(5)乙中第一次既有Fe3+又有 Fe2+,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生SO2与Fe3+的反应,则氧化性:Fe3+> SO2;甲中第一次有Fe3+,无Fe2+,则氧化性:Cl2>Fe3+,第二次有Fe2+,说明发生SO2与Fe3+的反应,则氧化性:Fe3+> SO2;丙中第一次有Fe3+,无Fe2+,说明氯气足量,第二次有,可能是过量的氯气把SO2氧化为,不能说明氧化性Fe3+> SO2;故答案为:甲、乙;
(6)设原FeBr2溶液中FeBr2的物质的量为xmol,根据还原性Fe2+>Br-,得通入的氯气先与亚铁离子反应生成铁离子,Cl2+2Fe2+=2Fe3++2Cl-,消耗氯气的物质的量是0.5xmol,后与溴离子反应生成溴单质,Cl2+2Br-=Br2+2Cl-,溶液中有1/2的Br-被氧化成单质Br2,则消耗的氯气为0.5xmol,所以0.5x+0.5x=22.4/22.4,解得x=1,所以原FeBr2溶液中FeBr2的物质的量浓度为1mol/0.1L=10mol/L,故答案为:10mol/L。
答案第1页,共2页
答案第1页,共2页
同课章节目录
