广西南宁市第二中学2023-2024学年高一下学期7月期末考试化学试题(含答案)
文档属性
| 名称 | 广西南宁市第二中学2023-2024学年高一下学期7月期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-03 18:06:57 | ||
图片预览



文档简介
南宁市第二中学2023-2024学年高一下学期7月期末考试
化学
(时间75分钟,满分100分)
可能用到的原子量:H-1 C-12 O-16
一、单选题(含14小题,每小题3分共42分;每小题只有一个选项最符合题意)
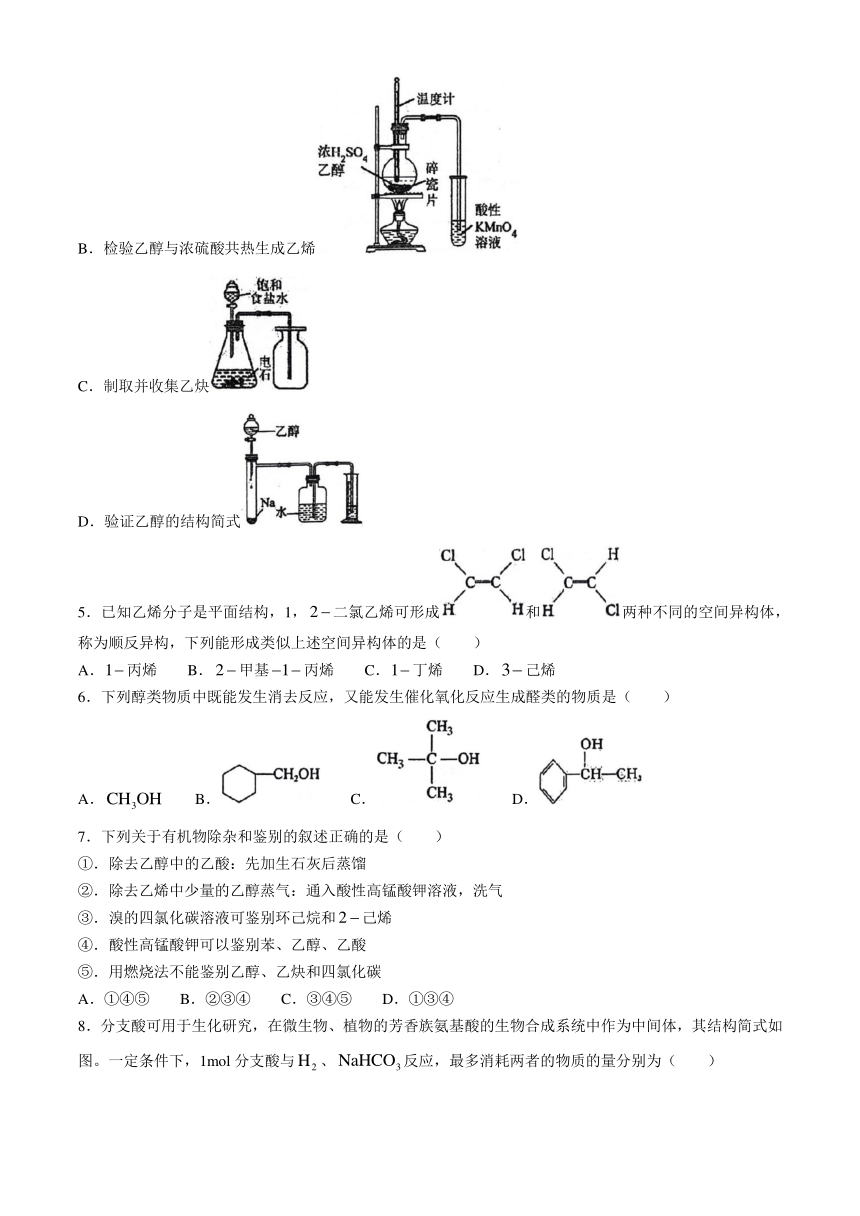
1.化学与生产、生活、科技息息相关,下列叙述正确的是( )
A.利用合成了硬脂酸():实现了无机小分子向有机高分子的转变
B.医用酒精可用于杀菌消毒,其成分主要是95%的乙醇溶液
C.用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯
D.医用防护口罩中层为超细聚丙烯纤维熔喷材料层,其中聚丙烯的链节为
2.下列化学用语表示正确的是( )
A.乙炔的电子式: B.乙醇的键线式:
C.丙烷的球棍模型: D.乙烯的结构简式:
3.为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,所含分子数目为
B.1.7g羟基(—OH)中含有的电子数为
C.分子中所含键的数目为
D.浓硫酸共热条件下,1mol乙醇与1mol冰醋酸充分反应后生成的乙酸乙酯分子总数为
4.下列实验装置的有关说法正确的是( )
A.实验室制备乙酸乙酯
B.检验乙醇与浓硫酸共热生成乙烯
C.制取并收集乙炔
D.验证乙醇的结构简式
5.已知乙烯分子是平面结构,1,二氯乙烯可形成和两种不同的空间异构体,称为顺反异构,下列能形成类似上述空间异构体的是( )
A.丙烯 B.甲基丙烯 C.丁烯 D.己烯
6.下列醇类物质中既能发生消去反应,又能发生催化氧化反应生成醛类的物质是( )
A. B. C. D.
7.下列关于有机物除杂和鉴别的叙述正确的是( )
①.除去乙醇中的乙酸:先加生石灰后蒸馏
②.除去乙烯中少量的乙醇蒸气:通入酸性高锰酸钾溶液,洗气
③.溴的四氯化碳溶液可鉴别环己烷和己烯
④.酸性高锰酸钾可以鉴别苯、乙醇、乙酸
⑤.用燃烧法不能鉴别乙醇、乙炔和四氯化碳
A.①④⑤ B.②③④ C.③④⑤ D.①③④
8.分支酸可用于生化研究,在微生物、植物的芳香族氨基酸的生物合成系统中作为中间体,其结构简式如图。一定条件下,1mol分支酸与、反应,最多消耗两者的物质的量分别为( )
A.3mol、2mol B.5mol、2mol C.3mol、3mol D.5mol、3mol
9.薄荷是常用中药之一,从薄荷中提取的薄荷醇可制成医药。薄荷醇的结构简式如图,下列说法正确的是( )
A.薄荷醇和环己醇互为同系物
B.薄荷醇的分子中至少有12个原子处于同一平面上
C.薄荷醇在Cu或Ag作催化剂、加热条件下能被氧化为醛
D.一定条件下,薄荷醇能发生取代反应、消去反应,不能发生氧化反应
10.工业上可通过甲醇羰基化法制取甲酸甲酯():,在容积固定的密闭容器中,投入等物质的量和CO,测得相同时间内CO的转化率随温度变化曲线如图所示。下列说法不正确的是( )
A.增大甲醇蒸气的浓度,CO的转化率增大 B.平衡常数
C.其他条件不变的情况下,反应速率 D.生产时反应温度控制在80~85℃为宜
11.乙醇与有机物A在浓硫酸催化下加热,得到有芳香气味的液体有机物B,经测定该有机物B的分子式为。则A的结构可能有(不考虑立体异构)( )
A.3种 B.4种 C.5种 D.6种
12.食品用合成香料—丙烯酸乙酯()天然存在于菠萝等水果中,可用乙烯、丙烯等石油化工产品为原料进行合成:
下列说法错误的是( )
A.生成丙烯酸乙酯的过程中,应按A→浓硫酸→B的顺序添加试剂
B.1molB与足量Na反应,最多生成11.2L气体(折算成标准状况)
C.仅用水无法鉴别A和丙烯酸乙酯
D.丙烯酸乙酯在NaOH溶液中反应:
13.已知C—C键可以绕键轴旋转,结构简式为的化合物中,处于同一平面内的原子最多有( )
A.20个 B.19个 C.18个 D.17个
14.某混合气体由两种气态烃组成。2.24L该混合气体完全燃烧后,得到4.48L二氧化碳(所有气体均已折算成标准状况)和3.6g水。则这两种气体可能是( )
A.和 B.和 C.和 D.和
二、填空题(含4小题,共58分)
15.(14分)按要求完成下列问题
(1)实验室制备乙烯的反应________________________________________;
(2)写出由在催化剂下生成高分子化合物有机玻璃的加聚反应________________。
(3)丙醇的催化氧化反应________________________________________;
(4)甲酸和丙醇的酯化反应________________________________________。
(5)的系统命名为________________;
(6)的系统命名为________________;
(7)的系统命名为________________;
(8)A的分子式为,已知A只有一种类型的等效氢原子,则A的结构简式为________________;
(9)立方烷的一氯代物有________种,六氯代物有________种。
16.(14分)某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体():
一定条件下,溶液中各金属离子开始沉淀和完全沉淀的pH如下表所示,回答下列问题:
金属离子
开始沉淀时的pH 7.2 3.7 2.2 7.5
沉淀完全时的pH 8.7 4.7 3.2 9.0
(1)“碱浸”中NaOH的两个作用分别是溶解表面油脂和________;为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀,写出该反应的离子方程式________________________________________;
(2)“酸浸”过程,为加快浸出率,可采取的措施是________________________;(至少两条)
(3)“调pH”应控制的pH范围是________;若工艺流程改为先“调pH”后“转化”,即,则“滤液③”中可能含有的杂质离子为________;
(4)为得到,“系列操作”包括________、过滤、洗涤、干燥;
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式________________________________________________。
17.(15分)二甲醚()既是一种有机燃料,又是一种重要的有机化工原料。利用催化氢化制备二甲醚的反应原理如下:
Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
(1)________。
(2)一定温度下,在恒容密闭容器中发生反应Ⅲ,下列事实能说明已经达到平衡的是________(填标号)。
A.混合气体的密度不再发生变化
B.容器内混合气体的压强不再发生变化
C.
D.体系温度不再发生变化
E.
(3)在有催化剂存在的条件下,反应Ⅲ的反应过程如图1所示,吸附在催化剂表面上的物种用“*”标注。该反应过程的决速步骤为________(填“①”或“②”),判断的理由是________________________。
(4)CO也能和反应制取二甲醚,反应原理为。一定条件下,将和CO按投料比通入1L反应器中发生该反应,其中CO的平衡转化率随温度、压强的变化关系如图2所示。
①图2中、、由大到小的关系是________;
②实际生产中一般采用的温度为300-340℃,而不采用200℃,原因是________________________________________;
③若在和316℃时,将和CO按投料比通入该1L反应器中,反应达到平衡时,CO的转化率________50%(填“>”“<”或“=”)。
(5)高温时二甲醚蒸气发生分解反应:。迅速将二甲醚引入一个500℃的抽成真空的恒温恒容的密闭瓶中,在不同时刻测得的瓶内气体压强如下表所示。
t/min 0 10 20 30 40 50
40.0 78.0 92.0 99.0 100 100
①该反应达到平衡状态时,二甲醚的转化率为________。
②保持温度不变,在上述平衡体系中再充入、、1molCO和,列式计算说明、的大小关系________________________________________________________。
18.(15分)气态烃A是一种水果催熟剂,B的分子式为且能使溴水褪色。由A、B经如下反应可制得软质隐形眼镜材料W()。
已知:①(R代表烃基或氢);
②E分子中只含有1个甲基。
(1)A→C的反应类型是________;
(2)E的结构简式为________;
(3)由F→G的有机反应式为________________________________________。
(4)H的官能团名称是________;D和Ⅰ生成J的有机反应式为________________________________;
(5)已知有机物M是F的同系物且相对分子质量大28,则M的可能结构有________种;
(6)2,丁二醇可经过如下路线合成:
结合题干信息,回答问题:
I、“反应条件1”为________;
Ⅱ、X的结构简式为________。
南宁二中2023~2024学年下学期高一期考
参考答案
1-5 CCBDD 6-10 BDAAC 11-14 BCCB
15.【答案】除特别标注外,每空2分
(1)(不写条件扣一分)
(2)
(3)(不写条件扣1分)
(4)(不写可逆或条件扣1分)
(5)2,二甲基乙基戊烷(1分)
(6)乙基,丁二烯(1分)
(7)甲基丁醇(1分)
(8)(1分)
(9)1(1分) 3(1分)
16.【答案】每空2分
(1)除去铝及其氧化物
(2)粉碎固体、搅拌、适当提高温度、适当增加酸的浓度、延长浸取时间等
(3)3.2~7.2
(4)蒸发(加热)浓缩、冷却结晶
(5)
17.【答案】除特别标注外,其余每空2分
(1)(不写单位扣1分)
(2)CD
(3)②(1分) 第二步反应活化能较高,反应速率较慢
(4)(1分) 温度降低会使化学反应速率减小,达到平衡所需时间变长,同时考虑到催化剂的催化活性最佳温度(答案合理即可) >(1分)
(5)75%(或0.75或3/4) 计算得,,有,则平衡正向进行,
18.【答案】除特别标注外,其余每空2分
(1)加成反应(1分)
(2)
(3)
(4)羧基
(5)8
(6)Ⅰ、浓硫酸、170℃ Ⅱ、
化学
(时间75分钟,满分100分)
可能用到的原子量:H-1 C-12 O-16
一、单选题(含14小题,每小题3分共42分;每小题只有一个选项最符合题意)
1.化学与生产、生活、科技息息相关,下列叙述正确的是( )
A.利用合成了硬脂酸():实现了无机小分子向有机高分子的转变
B.医用酒精可用于杀菌消毒,其成分主要是95%的乙醇溶液
C.用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯
D.医用防护口罩中层为超细聚丙烯纤维熔喷材料层,其中聚丙烯的链节为
2.下列化学用语表示正确的是( )
A.乙炔的电子式: B.乙醇的键线式:
C.丙烷的球棍模型: D.乙烯的结构简式:
3.为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,所含分子数目为
B.1.7g羟基(—OH)中含有的电子数为
C.分子中所含键的数目为
D.浓硫酸共热条件下,1mol乙醇与1mol冰醋酸充分反应后生成的乙酸乙酯分子总数为
4.下列实验装置的有关说法正确的是( )
A.实验室制备乙酸乙酯
B.检验乙醇与浓硫酸共热生成乙烯
C.制取并收集乙炔
D.验证乙醇的结构简式
5.已知乙烯分子是平面结构,1,二氯乙烯可形成和两种不同的空间异构体,称为顺反异构,下列能形成类似上述空间异构体的是( )
A.丙烯 B.甲基丙烯 C.丁烯 D.己烯
6.下列醇类物质中既能发生消去反应,又能发生催化氧化反应生成醛类的物质是( )
A. B. C. D.
7.下列关于有机物除杂和鉴别的叙述正确的是( )
①.除去乙醇中的乙酸:先加生石灰后蒸馏
②.除去乙烯中少量的乙醇蒸气:通入酸性高锰酸钾溶液,洗气
③.溴的四氯化碳溶液可鉴别环己烷和己烯
④.酸性高锰酸钾可以鉴别苯、乙醇、乙酸
⑤.用燃烧法不能鉴别乙醇、乙炔和四氯化碳
A.①④⑤ B.②③④ C.③④⑤ D.①③④
8.分支酸可用于生化研究,在微生物、植物的芳香族氨基酸的生物合成系统中作为中间体,其结构简式如图。一定条件下,1mol分支酸与、反应,最多消耗两者的物质的量分别为( )
A.3mol、2mol B.5mol、2mol C.3mol、3mol D.5mol、3mol
9.薄荷是常用中药之一,从薄荷中提取的薄荷醇可制成医药。薄荷醇的结构简式如图,下列说法正确的是( )
A.薄荷醇和环己醇互为同系物
B.薄荷醇的分子中至少有12个原子处于同一平面上
C.薄荷醇在Cu或Ag作催化剂、加热条件下能被氧化为醛
D.一定条件下,薄荷醇能发生取代反应、消去反应,不能发生氧化反应
10.工业上可通过甲醇羰基化法制取甲酸甲酯():,在容积固定的密闭容器中,投入等物质的量和CO,测得相同时间内CO的转化率随温度变化曲线如图所示。下列说法不正确的是( )
A.增大甲醇蒸气的浓度,CO的转化率增大 B.平衡常数
C.其他条件不变的情况下,反应速率 D.生产时反应温度控制在80~85℃为宜
11.乙醇与有机物A在浓硫酸催化下加热,得到有芳香气味的液体有机物B,经测定该有机物B的分子式为。则A的结构可能有(不考虑立体异构)( )
A.3种 B.4种 C.5种 D.6种
12.食品用合成香料—丙烯酸乙酯()天然存在于菠萝等水果中,可用乙烯、丙烯等石油化工产品为原料进行合成:
下列说法错误的是( )
A.生成丙烯酸乙酯的过程中,应按A→浓硫酸→B的顺序添加试剂
B.1molB与足量Na反应,最多生成11.2L气体(折算成标准状况)
C.仅用水无法鉴别A和丙烯酸乙酯
D.丙烯酸乙酯在NaOH溶液中反应:
13.已知C—C键可以绕键轴旋转,结构简式为的化合物中,处于同一平面内的原子最多有( )
A.20个 B.19个 C.18个 D.17个
14.某混合气体由两种气态烃组成。2.24L该混合气体完全燃烧后,得到4.48L二氧化碳(所有气体均已折算成标准状况)和3.6g水。则这两种气体可能是( )
A.和 B.和 C.和 D.和
二、填空题(含4小题,共58分)
15.(14分)按要求完成下列问题
(1)实验室制备乙烯的反应________________________________________;
(2)写出由在催化剂下生成高分子化合物有机玻璃的加聚反应________________。
(3)丙醇的催化氧化反应________________________________________;
(4)甲酸和丙醇的酯化反应________________________________________。
(5)的系统命名为________________;
(6)的系统命名为________________;
(7)的系统命名为________________;
(8)A的分子式为,已知A只有一种类型的等效氢原子,则A的结构简式为________________;
(9)立方烷的一氯代物有________种,六氯代物有________种。
16.(14分)某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体():
一定条件下,溶液中各金属离子开始沉淀和完全沉淀的pH如下表所示,回答下列问题:
金属离子
开始沉淀时的pH 7.2 3.7 2.2 7.5
沉淀完全时的pH 8.7 4.7 3.2 9.0
(1)“碱浸”中NaOH的两个作用分别是溶解表面油脂和________;为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀,写出该反应的离子方程式________________________________________;
(2)“酸浸”过程,为加快浸出率,可采取的措施是________________________;(至少两条)
(3)“调pH”应控制的pH范围是________;若工艺流程改为先“调pH”后“转化”,即,则“滤液③”中可能含有的杂质离子为________;
(4)为得到,“系列操作”包括________、过滤、洗涤、干燥;
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式________________________________________________。
17.(15分)二甲醚()既是一种有机燃料,又是一种重要的有机化工原料。利用催化氢化制备二甲醚的反应原理如下:
Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
(1)________。
(2)一定温度下,在恒容密闭容器中发生反应Ⅲ,下列事实能说明已经达到平衡的是________(填标号)。
A.混合气体的密度不再发生变化
B.容器内混合气体的压强不再发生变化
C.
D.体系温度不再发生变化
E.
(3)在有催化剂存在的条件下,反应Ⅲ的反应过程如图1所示,吸附在催化剂表面上的物种用“*”标注。该反应过程的决速步骤为________(填“①”或“②”),判断的理由是________________________。
(4)CO也能和反应制取二甲醚,反应原理为。一定条件下,将和CO按投料比通入1L反应器中发生该反应,其中CO的平衡转化率随温度、压强的变化关系如图2所示。
①图2中、、由大到小的关系是________;
②实际生产中一般采用的温度为300-340℃,而不采用200℃,原因是________________________________________;
③若在和316℃时,将和CO按投料比通入该1L反应器中,反应达到平衡时,CO的转化率________50%(填“>”“<”或“=”)。
(5)高温时二甲醚蒸气发生分解反应:。迅速将二甲醚引入一个500℃的抽成真空的恒温恒容的密闭瓶中,在不同时刻测得的瓶内气体压强如下表所示。
t/min 0 10 20 30 40 50
40.0 78.0 92.0 99.0 100 100
①该反应达到平衡状态时,二甲醚的转化率为________。
②保持温度不变,在上述平衡体系中再充入、、1molCO和,列式计算说明、的大小关系________________________________________________________。
18.(15分)气态烃A是一种水果催熟剂,B的分子式为且能使溴水褪色。由A、B经如下反应可制得软质隐形眼镜材料W()。
已知:①(R代表烃基或氢);
②E分子中只含有1个甲基。
(1)A→C的反应类型是________;
(2)E的结构简式为________;
(3)由F→G的有机反应式为________________________________________。
(4)H的官能团名称是________;D和Ⅰ生成J的有机反应式为________________________________;
(5)已知有机物M是F的同系物且相对分子质量大28,则M的可能结构有________种;
(6)2,丁二醇可经过如下路线合成:
结合题干信息,回答问题:
I、“反应条件1”为________;
Ⅱ、X的结构简式为________。
南宁二中2023~2024学年下学期高一期考
参考答案
1-5 CCBDD 6-10 BDAAC 11-14 BCCB
15.【答案】除特别标注外,每空2分
(1)(不写条件扣一分)
(2)
(3)(不写条件扣1分)
(4)(不写可逆或条件扣1分)
(5)2,二甲基乙基戊烷(1分)
(6)乙基,丁二烯(1分)
(7)甲基丁醇(1分)
(8)(1分)
(9)1(1分) 3(1分)
16.【答案】每空2分
(1)除去铝及其氧化物
(2)粉碎固体、搅拌、适当提高温度、适当增加酸的浓度、延长浸取时间等
(3)3.2~7.2
(4)蒸发(加热)浓缩、冷却结晶
(5)
17.【答案】除特别标注外,其余每空2分
(1)(不写单位扣1分)
(2)CD
(3)②(1分) 第二步反应活化能较高,反应速率较慢
(4)(1分) 温度降低会使化学反应速率减小,达到平衡所需时间变长,同时考虑到催化剂的催化活性最佳温度(答案合理即可) >(1分)
(5)75%(或0.75或3/4) 计算得,,有,则平衡正向进行,
18.【答案】除特别标注外,其余每空2分
(1)加成反应(1分)
(2)
(3)
(4)羧基
(5)8
(6)Ⅰ、浓硫酸、170℃ Ⅱ、
同课章节目录
