2.2.2 化学平衡状态 课件(共32张ppt) 2023-2024学年高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 2.2.2 化学平衡状态 课件(共32张ppt) 2023-2024学年高二上学期化学苏教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-03 21:26:49 | ||
图片预览





文档简介
(共32张PPT)
专题2 化学反应速率与化学平衡
第二单元 化学反应的方向和限度
化学平衡状态
第一课时
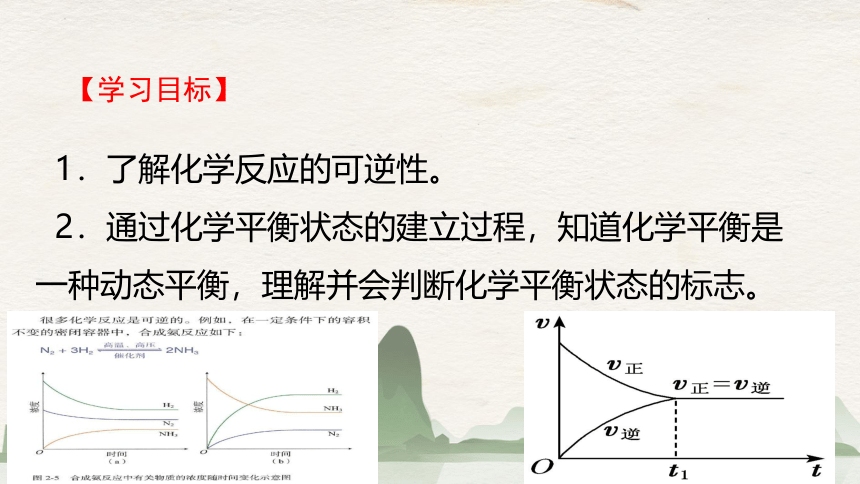
1.了解化学反应的可逆性。
2.通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡,理解并会判断化学平衡状态的标志。
【学习目标】
高炉炼铁的主要反应是:
2C(焦炭) + O2(空气) =2CO(放出热量),Fe2O3 + 3CO 2Fe+3CO2。
炼制1吨生铁所需焦炭的实际用量远高于按照化学方程式计算所需的量,且从高炉中出来的气体中含有没利用的CO气体。
开始,炼铁工程师们认为是CO与铁矿石接触不充分之故,于是设法增加高炉的高度,然而高炉增高后,高炉尾气中的CO比例竟没有改变,这是什么原因呢?
复习回顾
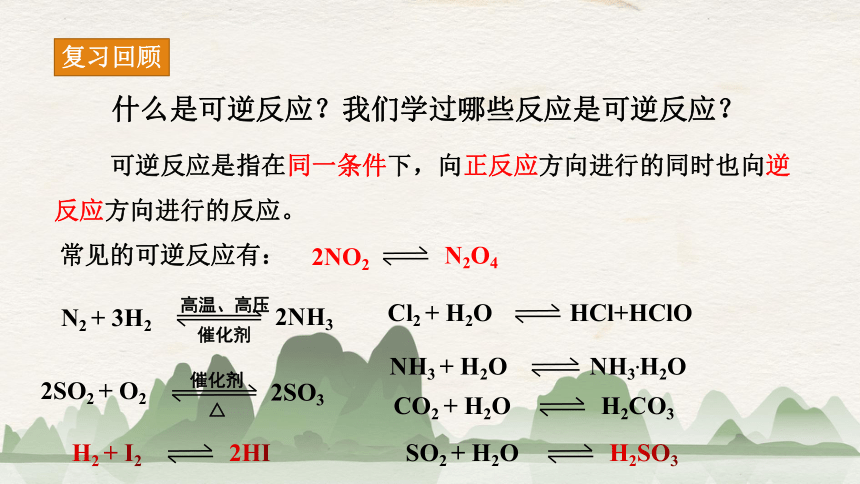
什么是可逆反应?我们学过哪些反应是可逆反应?
可逆反应是指在同一条件下,向正反应方向进行的同时也向逆反应方向进行的反应。
常见的可逆反应有:
2NH3
N2 + 3H2
催化剂
高温、高压
2SO3
2SO2 + O2
△
催化剂
2HI
H2 + I2
N2O4
2NO2
HCl+HClO
Cl2 + H2O
NH3.H2O
NH3 + H2O
H2SO3
SO2 + H2O
H2CO3
CO2 + H2O
课堂练习
下列反应属于可逆反应的是( )
A.H2和O2点燃生成H2O的反应与H2O电解生成H2和O2的反应
B.CuSO4吸水形成晶体蓝矾与蓝矾加热失去水分生成CuSO4
C.Cl2溶于水
D.Na2O溶于水
答案:C
解析:A、B项的反应不是在同一条件下进行,不属于可逆反应;D项反应能进行到底,不属于可逆反应;同一条件下,Cl2与水反应生成HCl和HClO,同时,HCl和HClO反应生成Cl2与水,属于可逆反应。
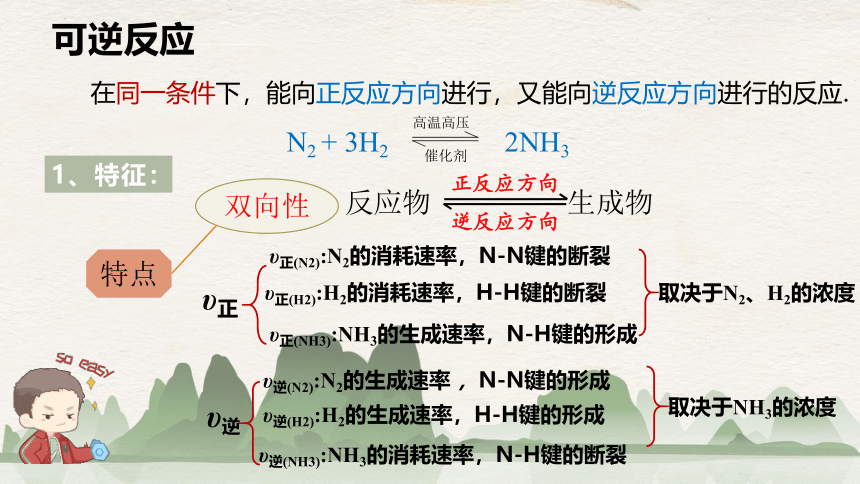
可逆反应
在同一条件下,能向正反应方向进行,又能向逆反应方向进行的反应.
N2 + 3H2 2NH3
催化剂
高温高压
1、特征:
特点
双向性
反应物 生成物
正反应方向
逆反应方向
υ正
υ正(N2):N2的消耗速率,N-N键的断裂
υ正(H2):H2的消耗速率,H-H键的断裂
υ正(NH3):NH3的生成速率,N-H键的形成
取决于N2、H2的浓度
υ逆
υ逆(N2):N2的生成速率 ,N-N键的形成
υ逆(H2):H2的生成速率,H-H键的形成
υ逆(NH3):NH3的消耗速率,N-H键的断裂
取决于NH3的浓度
可逆反应
在同一条件下,能向正反应方向进行,又能向逆反应方向进行的反应.
N2 + 3H2 2NH3
催化剂
高温高压
1、特征:
2、表示:
方程式而用“ ”连接,而不用 “ = ”
特点
双同性
共存性
双向性
反应物 生成物
正反应方向
逆反应方向
在相同条件下,正、逆反应同时进行
反应物和生成物共同存在
任一组分的转化率都小于100%
【练习】下列对可逆反应的认识正确的是( )
A、2H2O == 2H2↑+O2↑与2H2+O2 == 2H2O互为可逆反应
B、一定条件下,1molSO2与足量的O2反应可生成1molSO3
C、化学反应,一种反应物过量,另一种反应物少量,充分反应, 若少量的反应物仍存在,则证明为可逆反应
通电 点燃
C
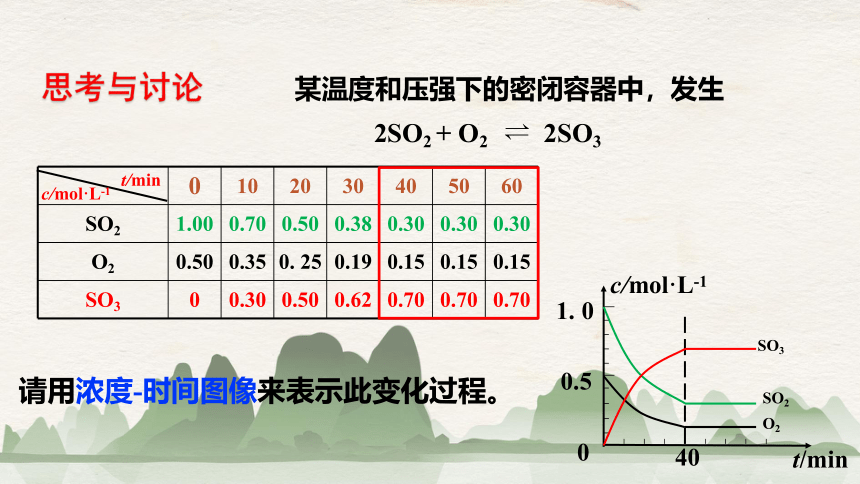
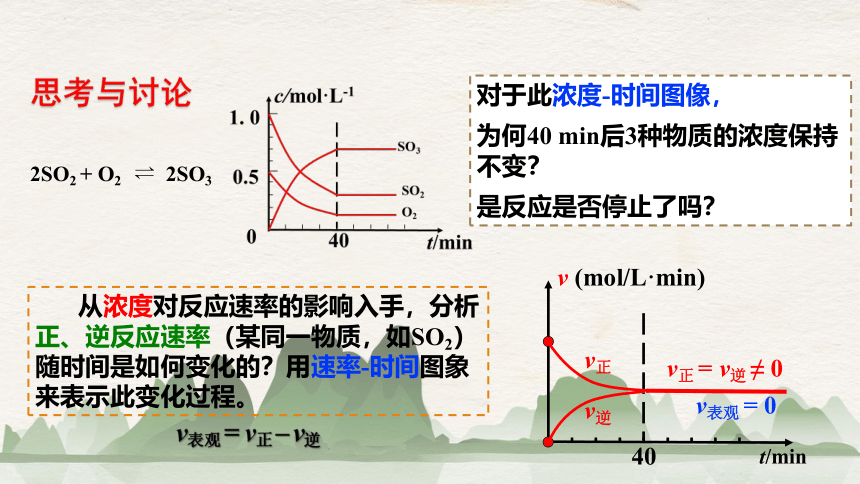
思考与讨论
0 10 20 30 40 50 60
SO2 1.00 0.70 0.50 0.38 0.30 0.30 0.30
O2 0.50 0.35 0. 25 0.19 0.15 0.15 0.15
SO3 0 0.30 0.50 0.62 0.70 0.70 0.70
t/min
c/mol·L-1
请用浓度-时间图像来表示此变化过程。
某温度和压强下的密闭容器中,发生
2SO2 + O2 2SO3
c/mol·L-1
t/min
1. 0
0.5
0
40
SO2
O2
SO3
从浓度对反应速率的影响入手,分析正、逆反应速率(某同一物质,如SO2)随时间是如何变化的?用速率-时间图象来表示此变化过程。
v (mol/L·min)
t/min
40
v正
v逆
对于此浓度-时间图像,
为何40 min后3种物质的浓度保持不变?
是反应是否停止了吗?
v正 = v逆 ≠ 0
思考与讨论
v表观 = v正 – v逆
v表观 = 0
2SO2 + O2 2SO3
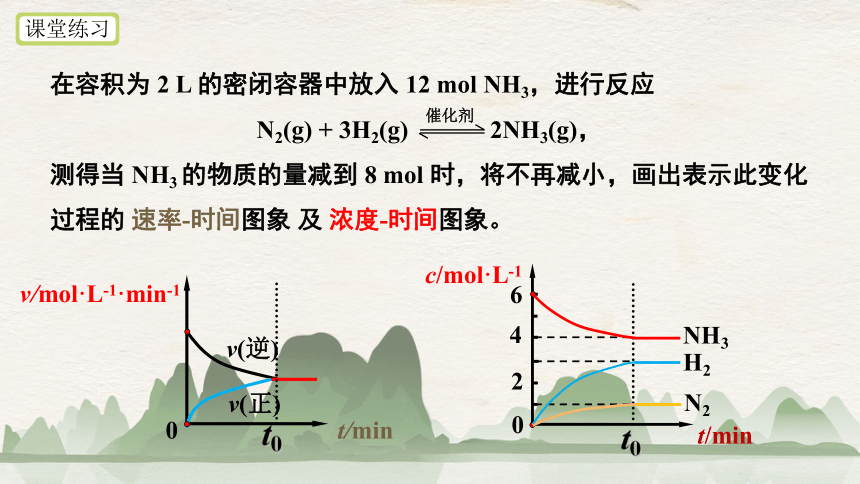
在容积为 2 L 的密闭容器中放入 12 mol NH3,进行反应
N2(g) + 3H2(g) 2NH3(g),
测得当 NH3 的物质的量减到 8 mol 时,将不再减小,画出表示此变化过程的 速率-时间图象 及 浓度-时间图象。
课堂练习
催化剂
v/mol·L-1·min-1
t/min
0
v(逆)
v(正)
t0
t/min
c/mol·L-1
2
4
6
0
NH3
H2
N2
t0
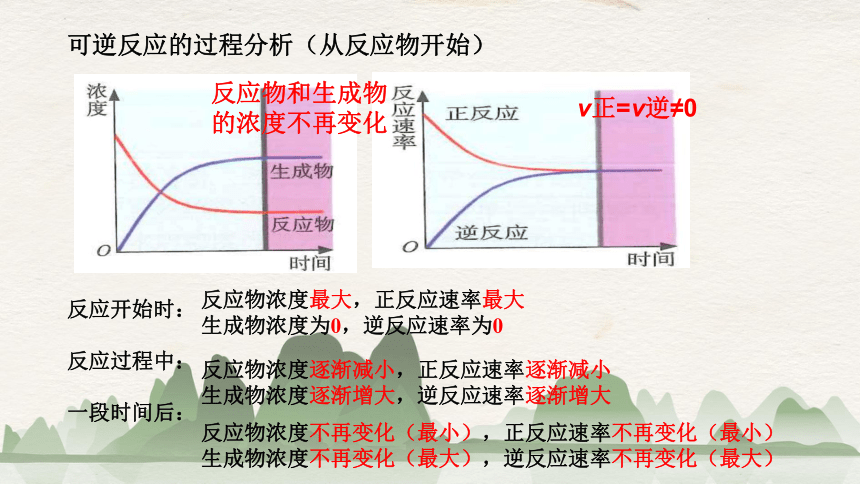
可逆反应的过程分析(从反应物开始)
反应开始时:
反应过程中:
一段时间后:
反应物浓度最大,正反应速率最大
生成物浓度为0,逆反应速率为0
反应物浓度逐渐减小,正反应速率逐渐减小
生成物浓度逐渐增大,逆反应速率逐渐增大
反应物浓度不再变化(最小),正反应速率不再变化(最小)
生成物浓度不再变化(最大),逆反应速率不再变化(最大)
反应物和生成物
的浓度不再变化
v正=v逆≠0
当正反应速率与逆反应速率相等时,达到一种平衡状态,反应物的浓度和生成物的浓度不再改变,正反应和逆反应都没有停止。
化学平衡状态的概念
当外界条件不变时,可逆反应进行到一定程度,反应物和生成物的浓度不再随时间的变化而发生变化。
达到化学平衡时,反应达到该条件下物质转化的最大“限度”,
即反应物的转化率最大。
电梯
v逆
v正
化学平衡状态
4.化学平衡状态的特征
可逆反应
相等
v正=v逆
v正=v逆≠0
一定
υ正= υ逆
化学平衡状态
υ正
υ逆
时间
速率
t1
此条件下进行到什么时候达到了这个反应的限度
此时的反应是否停止了?
此时为何3种物质的浓度保持不变
某温度和压强下的密闭容器中,2SO2+O2 2SO3
△
催化剂
时间 (min) 物质的量 浓度(mol/L) 0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
微观本质
t0
已知反应2SO2+O2 2SO3,在密闭容器中,充入SO2和18O原子组成的氧气,在一定条件下开始反应,在达到平衡后,18O存在于( )
A.只存在于氧气中 B.只存在于SO3中
C.只存在于SO2和SO3中 D.SO2、SO3、O2中都存在
答案:D
解析:该反应是可逆反应,正反应、逆反应同时存在;化学平衡是动态平衡,正反应发生时,18O存在于SO3中,逆反应发生时,SO3中的18O又可以转化到SO2中。
课堂练习
t1 t2 t3
D
t3时,n(M)、n(N)不变,达平衡
2N M
【练习】
【问题】
如何判断可逆反应是否已达平衡状态?
判断可逆反应达到平衡状态的依据:
① v正=v逆≠0
②各组分的含量(浓度、物质的量、质量分数、体积分数等)为恒定值
交流讨论
如何判断可逆反应达到平衡状态?
若某个物理量在建立平衡的过程中发生变化,平衡时不变,则该反应一定达到平衡状态。
若某个物理量在建立平衡的过程中始终保持不变,则不能确定该反应是否达到平衡状态。
化学平衡
化学平衡状态的判断
动态标志
静态标志
ν (正) = ν (逆)
≠0
变量不变
同一物质: ν生成(A) = ν消耗(A)
不同物质: v正(A) : v逆(B) = 化学计量数之比
① 各物质的 m 、n 或 c 不变
② 各物质的百分含量不变
(物质的量分数、质量分数、转化率、产率等)
③ 颜色、温度(绝热体系)不再改变
“正逆相等,变量不变”
必须是“一正一逆”,
在1L密闭容器中充入1mol N2 (g)与3mol H2 (g) ,在一定条件下进行反应。下列哪些图象能判断该反应达到平衡状态的是________。
N2(g) + 3H2(g) 2NH3(g)
气体平均密度
反应进程
O
气体平均摩尔质量
反应进程
O
NH3的浓度
反应进程
O
N2 的物质的量分数
反应进程
O
化学平衡标志的判断要注意“三关注”:
一要关注反应条件,是恒温恒容、恒温恒压还是绝热容器;
二要关注反应特点,是等体积反应,还是非等体积反应;
三要关注特殊情况,是否有固体或液体参加或生成,或固体的分解反应。
① NH3 (g)的浓度c(NH3)不变
②容器中气体的密度 不变
气
③ N2的物质的量分数 不变
④混合气体的平均摩尔质量 不变
气体平均密度
反应进程
O
气体平均摩尔质量
反应进程
O
NH3的浓度
反应进程
O
N2 的物质的量分数
反应进程
O
写出下列含量的化学表达式,试利用表达式解释图像变化趋势。
解析 B项,对于一个特定反应,ΔH固定不变,不能作为判断反应是否达到平衡状态的依据;
C项,在t1时刻,2v正(N2O4)=v逆(NO2),反应达到平衡状态。
√
化学平衡状态的判断
分析目标反
应及外界条
件
确定分
析角度
明确变与定
得出正确结论
看清恒容、恒压、
绝热等外界条件,
反应前后气体分
子数目及物质状
态等
从速率还是定
的角度着手
ρ=
m气总
v容器
M=
m气总
n总
P始
P终
=
n始
n终
气体的平均相对分子质量、密度和体系颜色变化等特征
混合气体的平均相对分子质量:各气体的相对分子质量乘以该气体的物质的量分数(或体积分数)的和。
2.下列各关系中能说明反应N2+3H2 2NH3已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
CEF
E.消耗1mol N2,同时生成1molN2
F.一个N≡N键断裂同时,有6个N-H键断裂
3.可逆反应:2NO2(g) 2NO(g)+O2(g)在恒容的密闭容器中进行,达到平衡状态的标志是
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
√
2
2
1
化学反应速率
是否定量?
绝热容器中温度不变?
解析 依据v正=v逆≠0判断:①单位时间内生成n mol O2的同时生成 2n mol NO2,能说明反应已达平衡;
②描述的均是正反应速率,无法判断;
③无论反应是否达平衡,均有此关系。
依据组成一定判断:④NO2为有颜色的气体(红棕色),颜色不变能说明反应体系中NO2的浓度一定,已达到平衡;
特别注意
化学平衡状态的判断
间接依据 :变量不再改变。
这些都不是某一种物质的数据,而是所有气体的整体量。
对于这三个量,若反应为等体反应,不能作为判断依据,若反应为非等体反应,则可以作为判断依据。
第一类:气体的总物质的量n、体积V、压强P,要具体分析:
A(g) + B(g) 2C(g)
A(g) + B(g) C(g)
气体的总物质的量n
恒温恒容时的压强P
减少
不变
不变
减少
不变
减少
恒温恒压时的体积V
等体反应
缩体反应
间接依据 :变量不再改变。
恒容时,凡是有固体参与的气体反应,其气体密度都会变,此时ρ是变量,可以作为判断依据。
第二类:恒温恒容时,气体的密度ρ不再变化时,要具体分析
ρ=
m总
v
不会变
气体质量增加,ρ是变量,可以作为判断依据。
对于反应:A(s)+B(g) C(g)
mA+m B= mC (质量守恒)
找固体,若方程式中有固体,则气体总质量会变化
对于反应:A(g)+B(g) C(g)
质量守恒,气体质量不变,ρ是不变量,不能作为判断依据。
特别注意
间接依据 :变量不再改变。
找固体
看气体系数
第三类:混合气体的平均摩尔质量M,不再变化时,要具体分析
M=
m总
n总
分子、分母只要有一个是变量,
M即可作为判断平衡的依据
A(g)+B(g) 2C(g)
A(g)+B(g) C(g)
A(s)+B(g) C(g)
m总
n总
M
不变
不变
不变
不变
变
变
变
变
不变
等体反应
缩体反应
有固体参加的等体反应
特别注意
专题2 化学反应速率与化学平衡
第二单元 化学反应的方向和限度
化学平衡状态
第一课时
1.了解化学反应的可逆性。
2.通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡,理解并会判断化学平衡状态的标志。
【学习目标】
高炉炼铁的主要反应是:
2C(焦炭) + O2(空气) =2CO(放出热量),Fe2O3 + 3CO 2Fe+3CO2。
炼制1吨生铁所需焦炭的实际用量远高于按照化学方程式计算所需的量,且从高炉中出来的气体中含有没利用的CO气体。
开始,炼铁工程师们认为是CO与铁矿石接触不充分之故,于是设法增加高炉的高度,然而高炉增高后,高炉尾气中的CO比例竟没有改变,这是什么原因呢?
复习回顾
什么是可逆反应?我们学过哪些反应是可逆反应?
可逆反应是指在同一条件下,向正反应方向进行的同时也向逆反应方向进行的反应。
常见的可逆反应有:
2NH3
N2 + 3H2
催化剂
高温、高压
2SO3
2SO2 + O2
△
催化剂
2HI
H2 + I2
N2O4
2NO2
HCl+HClO
Cl2 + H2O
NH3.H2O
NH3 + H2O
H2SO3
SO2 + H2O
H2CO3
CO2 + H2O
课堂练习
下列反应属于可逆反应的是( )
A.H2和O2点燃生成H2O的反应与H2O电解生成H2和O2的反应
B.CuSO4吸水形成晶体蓝矾与蓝矾加热失去水分生成CuSO4
C.Cl2溶于水
D.Na2O溶于水
答案:C
解析:A、B项的反应不是在同一条件下进行,不属于可逆反应;D项反应能进行到底,不属于可逆反应;同一条件下,Cl2与水反应生成HCl和HClO,同时,HCl和HClO反应生成Cl2与水,属于可逆反应。
可逆反应
在同一条件下,能向正反应方向进行,又能向逆反应方向进行的反应.
N2 + 3H2 2NH3
催化剂
高温高压
1、特征:
特点
双向性
反应物 生成物
正反应方向
逆反应方向
υ正
υ正(N2):N2的消耗速率,N-N键的断裂
υ正(H2):H2的消耗速率,H-H键的断裂
υ正(NH3):NH3的生成速率,N-H键的形成
取决于N2、H2的浓度
υ逆
υ逆(N2):N2的生成速率 ,N-N键的形成
υ逆(H2):H2的生成速率,H-H键的形成
υ逆(NH3):NH3的消耗速率,N-H键的断裂
取决于NH3的浓度
可逆反应
在同一条件下,能向正反应方向进行,又能向逆反应方向进行的反应.
N2 + 3H2 2NH3
催化剂
高温高压
1、特征:
2、表示:
方程式而用“ ”连接,而不用 “ = ”
特点
双同性
共存性
双向性
反应物 生成物
正反应方向
逆反应方向
在相同条件下,正、逆反应同时进行
反应物和生成物共同存在
任一组分的转化率都小于100%
【练习】下列对可逆反应的认识正确的是( )
A、2H2O == 2H2↑+O2↑与2H2+O2 == 2H2O互为可逆反应
B、一定条件下,1molSO2与足量的O2反应可生成1molSO3
C、化学反应,一种反应物过量,另一种反应物少量,充分反应, 若少量的反应物仍存在,则证明为可逆反应
通电 点燃
C
思考与讨论
0 10 20 30 40 50 60
SO2 1.00 0.70 0.50 0.38 0.30 0.30 0.30
O2 0.50 0.35 0. 25 0.19 0.15 0.15 0.15
SO3 0 0.30 0.50 0.62 0.70 0.70 0.70
t/min
c/mol·L-1
请用浓度-时间图像来表示此变化过程。
某温度和压强下的密闭容器中,发生
2SO2 + O2 2SO3
c/mol·L-1
t/min
1. 0
0.5
0
40
SO2
O2
SO3
从浓度对反应速率的影响入手,分析正、逆反应速率(某同一物质,如SO2)随时间是如何变化的?用速率-时间图象来表示此变化过程。
v (mol/L·min)
t/min
40
v正
v逆
对于此浓度-时间图像,
为何40 min后3种物质的浓度保持不变?
是反应是否停止了吗?
v正 = v逆 ≠ 0
思考与讨论
v表观 = v正 – v逆
v表观 = 0
2SO2 + O2 2SO3
在容积为 2 L 的密闭容器中放入 12 mol NH3,进行反应
N2(g) + 3H2(g) 2NH3(g),
测得当 NH3 的物质的量减到 8 mol 时,将不再减小,画出表示此变化过程的 速率-时间图象 及 浓度-时间图象。
课堂练习
催化剂
v/mol·L-1·min-1
t/min
0
v(逆)
v(正)
t0
t/min
c/mol·L-1
2
4
6
0
NH3
H2
N2
t0
可逆反应的过程分析(从反应物开始)
反应开始时:
反应过程中:
一段时间后:
反应物浓度最大,正反应速率最大
生成物浓度为0,逆反应速率为0
反应物浓度逐渐减小,正反应速率逐渐减小
生成物浓度逐渐增大,逆反应速率逐渐增大
反应物浓度不再变化(最小),正反应速率不再变化(最小)
生成物浓度不再变化(最大),逆反应速率不再变化(最大)
反应物和生成物
的浓度不再变化
v正=v逆≠0
当正反应速率与逆反应速率相等时,达到一种平衡状态,反应物的浓度和生成物的浓度不再改变,正反应和逆反应都没有停止。
化学平衡状态的概念
当外界条件不变时,可逆反应进行到一定程度,反应物和生成物的浓度不再随时间的变化而发生变化。
达到化学平衡时,反应达到该条件下物质转化的最大“限度”,
即反应物的转化率最大。
电梯
v逆
v正
化学平衡状态
4.化学平衡状态的特征
可逆反应
相等
v正=v逆
v正=v逆≠0
一定
υ正= υ逆
化学平衡状态
υ正
υ逆
时间
速率
t1
此条件下进行到什么时候达到了这个反应的限度
此时的反应是否停止了?
此时为何3种物质的浓度保持不变
某温度和压强下的密闭容器中,2SO2+O2 2SO3
△
催化剂
时间 (min) 物质的量 浓度(mol/L) 0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
微观本质
t0
已知反应2SO2+O2 2SO3,在密闭容器中,充入SO2和18O原子组成的氧气,在一定条件下开始反应,在达到平衡后,18O存在于( )
A.只存在于氧气中 B.只存在于SO3中
C.只存在于SO2和SO3中 D.SO2、SO3、O2中都存在
答案:D
解析:该反应是可逆反应,正反应、逆反应同时存在;化学平衡是动态平衡,正反应发生时,18O存在于SO3中,逆反应发生时,SO3中的18O又可以转化到SO2中。
课堂练习
t1 t2 t3
D
t3时,n(M)、n(N)不变,达平衡
2N M
【练习】
【问题】
如何判断可逆反应是否已达平衡状态?
判断可逆反应达到平衡状态的依据:
① v正=v逆≠0
②各组分的含量(浓度、物质的量、质量分数、体积分数等)为恒定值
交流讨论
如何判断可逆反应达到平衡状态?
若某个物理量在建立平衡的过程中发生变化,平衡时不变,则该反应一定达到平衡状态。
若某个物理量在建立平衡的过程中始终保持不变,则不能确定该反应是否达到平衡状态。
化学平衡
化学平衡状态的判断
动态标志
静态标志
ν (正) = ν (逆)
≠0
变量不变
同一物质: ν生成(A) = ν消耗(A)
不同物质: v正(A) : v逆(B) = 化学计量数之比
① 各物质的 m 、n 或 c 不变
② 各物质的百分含量不变
(物质的量分数、质量分数、转化率、产率等)
③ 颜色、温度(绝热体系)不再改变
“正逆相等,变量不变”
必须是“一正一逆”,
在1L密闭容器中充入1mol N2 (g)与3mol H2 (g) ,在一定条件下进行反应。下列哪些图象能判断该反应达到平衡状态的是________。
N2(g) + 3H2(g) 2NH3(g)
气体平均密度
反应进程
O
气体平均摩尔质量
反应进程
O
NH3的浓度
反应进程
O
N2 的物质的量分数
反应进程
O
化学平衡标志的判断要注意“三关注”:
一要关注反应条件,是恒温恒容、恒温恒压还是绝热容器;
二要关注反应特点,是等体积反应,还是非等体积反应;
三要关注特殊情况,是否有固体或液体参加或生成,或固体的分解反应。
① NH3 (g)的浓度c(NH3)不变
②容器中气体的密度 不变
气
③ N2的物质的量分数 不变
④混合气体的平均摩尔质量 不变
气体平均密度
反应进程
O
气体平均摩尔质量
反应进程
O
NH3的浓度
反应进程
O
N2 的物质的量分数
反应进程
O
写出下列含量的化学表达式,试利用表达式解释图像变化趋势。
解析 B项,对于一个特定反应,ΔH固定不变,不能作为判断反应是否达到平衡状态的依据;
C项,在t1时刻,2v正(N2O4)=v逆(NO2),反应达到平衡状态。
√
化学平衡状态的判断
分析目标反
应及外界条
件
确定分
析角度
明确变与定
得出正确结论
看清恒容、恒压、
绝热等外界条件,
反应前后气体分
子数目及物质状
态等
从速率还是定
的角度着手
ρ=
m气总
v容器
M=
m气总
n总
P始
P终
=
n始
n终
气体的平均相对分子质量、密度和体系颜色变化等特征
混合气体的平均相对分子质量:各气体的相对分子质量乘以该气体的物质的量分数(或体积分数)的和。
2.下列各关系中能说明反应N2+3H2 2NH3已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
CEF
E.消耗1mol N2,同时生成1molN2
F.一个N≡N键断裂同时,有6个N-H键断裂
3.可逆反应:2NO2(g) 2NO(g)+O2(g)在恒容的密闭容器中进行,达到平衡状态的标志是
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
√
2
2
1
化学反应速率
是否定量?
绝热容器中温度不变?
解析 依据v正=v逆≠0判断:①单位时间内生成n mol O2的同时生成 2n mol NO2,能说明反应已达平衡;
②描述的均是正反应速率,无法判断;
③无论反应是否达平衡,均有此关系。
依据组成一定判断:④NO2为有颜色的气体(红棕色),颜色不变能说明反应体系中NO2的浓度一定,已达到平衡;
特别注意
化学平衡状态的判断
间接依据 :变量不再改变。
这些都不是某一种物质的数据,而是所有气体的整体量。
对于这三个量,若反应为等体反应,不能作为判断依据,若反应为非等体反应,则可以作为判断依据。
第一类:气体的总物质的量n、体积V、压强P,要具体分析:
A(g) + B(g) 2C(g)
A(g) + B(g) C(g)
气体的总物质的量n
恒温恒容时的压强P
减少
不变
不变
减少
不变
减少
恒温恒压时的体积V
等体反应
缩体反应
间接依据 :变量不再改变。
恒容时,凡是有固体参与的气体反应,其气体密度都会变,此时ρ是变量,可以作为判断依据。
第二类:恒温恒容时,气体的密度ρ不再变化时,要具体分析
ρ=
m总
v
不会变
气体质量增加,ρ是变量,可以作为判断依据。
对于反应:A(s)+B(g) C(g)
mA+m B= mC (质量守恒)
找固体,若方程式中有固体,则气体总质量会变化
对于反应:A(g)+B(g) C(g)
质量守恒,气体质量不变,ρ是不变量,不能作为判断依据。
特别注意
间接依据 :变量不再改变。
找固体
看气体系数
第三类:混合气体的平均摩尔质量M,不再变化时,要具体分析
M=
m总
n总
分子、分母只要有一个是变量,
M即可作为判断平衡的依据
A(g)+B(g) 2C(g)
A(g)+B(g) C(g)
A(s)+B(g) C(g)
m总
n总
M
不变
不变
不变
不变
变
变
变
变
不变
等体反应
缩体反应
有固体参加的等体反应
特别注意
