四川省德阳市2023-2024学年高一下学期期末教学质量监测化学试卷(含答案)
文档属性
| 名称 | 四川省德阳市2023-2024学年高一下学期期末教学质量监测化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 709.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-04 07:19:23 | ||
图片预览



文档简介
德阳市2023-2024学年高一下学期期末教学质量监测
化学试卷
说明:
1.本试卷分第Ⅰ卷和第Ⅱ卷,共8页。考生作答时,须将答案答在答题卡上,在本试卷、草稿纸上答题无效。考试结束后,将答题卡交回。
2.本试卷满分100分,90分钟完卷。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Br—80 Fe—56 Ba—137
第Ⅰ卷(选择题 共42分)
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项最符合题意)
1.劳动可以“树德、增智、强体、育美”。下列有关劳动实践的分析错误的是
A.自制“大葱煎鸡蛋饼”,加热时蛋白质变性
B.施用铵态氮肥,将肥料深埋土中防止铵盐挥发
C.将成熟的水果与未成熟的水果混放,利用乙烯催熟果实
D.在铁制品表面刷油漆,与调控反应速率有关
2.下列说法正确的是
A.石油的分馏发生了化学变化 B.铁的冶炼是通过高温分解来完成的
C.用于轴承的耐高温材料碳化硅是传统陶瓷 D.竹简的成分之一纤维素属于天然高分子材料
3.“科学、安全、有效和合理地使用化学品”人人有责。下列说法错误的是
A.抗坏血酸常作食物保存的氧化剂 B.豆腐的制作过程与胶体的性质有关
C.非处方药的包装上印有“OTC”标识 D.合成农药要向高效、低毒和低残留的方向发展
4.下列化学用语表达错误的是
A.中子数为6的硼原子: B.的电子式:
C.的结构式:H—O—O—H D.甲烷分子的空间填充模型:
5.含4个碳原子的部分烃分子结构中,碳原子相互结合的方式如下图:
下列说法正确的是
A.②③互为同系物 B.③④互为同分异构体
C.①分子中所有碳原子在同一平面上 D.②能使酸性高锰酸钾溶液褪色
6.硅是太阳能电池的重要材料,工业制备高纯硅的主要过程如下:
石英砂粗硅高纯硅
反应③的能量变化如右图所示。下列说法正确的是
A.反应①中气体产物为 B.反应②是吸热反应
C.反应③中生成1mol Si时,有5mol化学键断裂 D.反应①②③中,还原剂分别为焦炭、HCl、
7.镁、海水、溶解氧可构成原电池,为水下小功率设备长时间供电,电池结构示意图如下,电池总反应为:。下列说法正确的是
A.Mg作电池的正极
B.电子由Mg电极经海水流向石墨电极
C.石器电极的电极反应式为:
D.电池工作一段时间,海水浓度减小
8.表示阿伏加德罗常数的值。下列说法正确的是
A.1mol 与3mol 在密闭容器中充分反应后分子数目大于2
B.标准状况下,11.2L 含有的原子数目为2.5
C.15g甲基()中所含电子数目为7
D.1mol/L 溶液比1mol/L NaCl溶液中含有的离子数目多
9.下列实验装置能达到实验目的的是
装置
目的 提取碘时将海带灼烧为灰烬 除去中少量杂质 光照条件下制取纯净 证明是分解的催化剂
选项 A B C D
10.已知工业上制备下列物质的流程,相关的离子方程式错误的是
A.海水MgOMg
B.铝土矿
C.海带含溶液含溶液→
D.饱和食盐水、HCl盐酸
11.根据下列实验操作及现象推出的相应结论正确的是
选项 实验操作及现象 结论
A 蔗糖溶液中加入稀硫酸,煮沸、冷却后,加入银氨溶液,水浴加热,没有银镜产生 蔗糖在稀硫酸、加热条件下,未发生水解反应
B 取两支试管,各加入2mL 0.1mol/L 溶液,分别置于冷水和热水中,再向两试管同时加入2mL 0.1mol/L 溶液,热水中先出现浑浊 其他条件相同时,反应温度越高,反应速率越快
C 将和另一无色气体的混合物通入溶液中,产生白色沉淀 白色沉淀一定为
D 某含铁矿石中加入足量浓硝酸、酸浸,再滴入几滴KSCN溶液,溶液出现红色 该矿石中铁元素为+3价
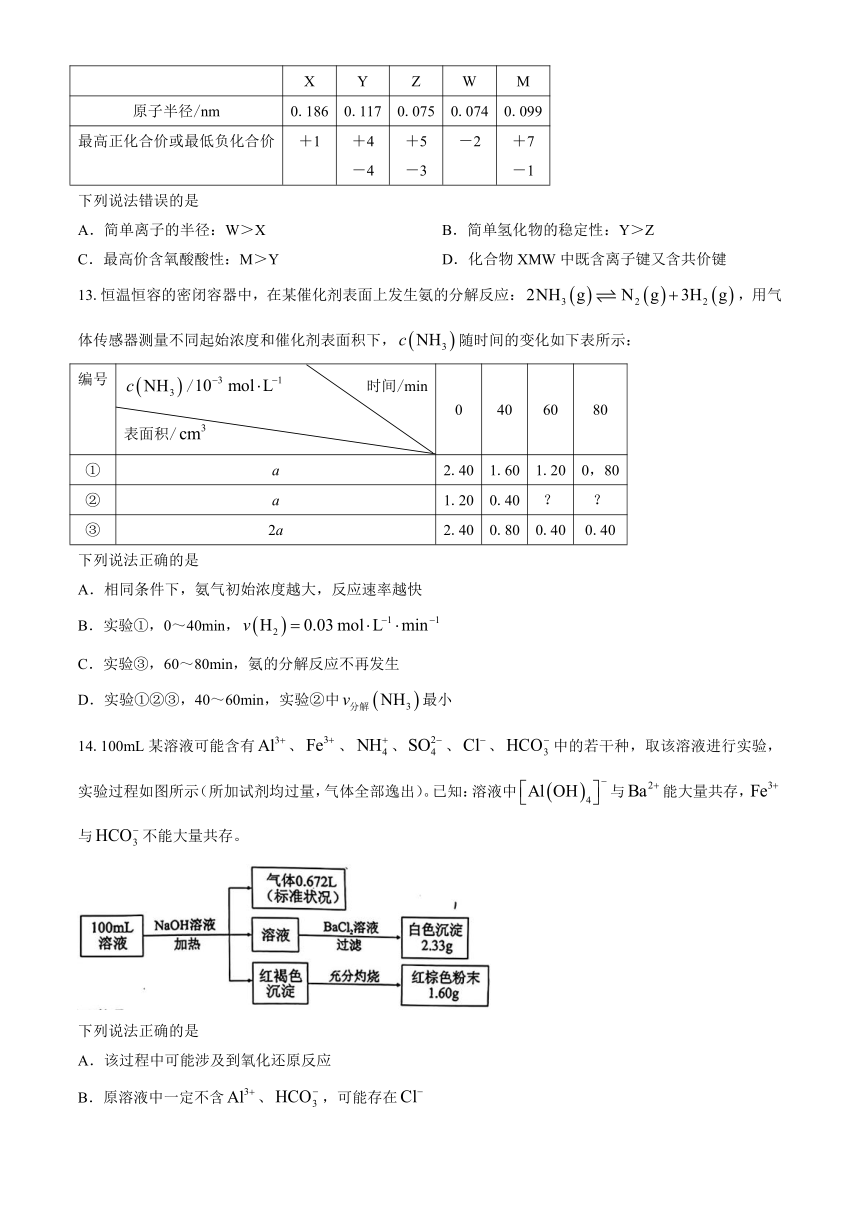
12.下表是短周期主族元素X、Y、Z、W、M的部分性质数据;Z与W同周期。
X Y Z W M
原子半径/nm 0.186 0.117 0.075 0.074 0.099
最高正化合价或最低负化合价 +1 +4 -4 +5 -3 -2 +7 -1
下列说法错误的是
A.简单离子的半径:W>X B.简单氢化物的稳定性:Y>Z
C.最高价含氧酸酸性:M>Y D.化合物XMW中既含离子键又含共价键
13.恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:,用气体传感器测量不同起始浓度和催化剂表面积下,随时间的变化如下表所示:
编号 / 时间/min 表面积/ 0 40 60 80
① a 2.40 1.60 1.20 0,80
② a 1.20 0.40 ? ?
③ 2a 2.40 0.80 0.40 0.40
下列说法正确的是
A.相同条件下,氨气初始浓度越大,反应速率越快
B.实验①,0~40min,
C.实验③,60~80min,氨的分解反应不再发生
D.实验①②③,40~60min,实验②中最小
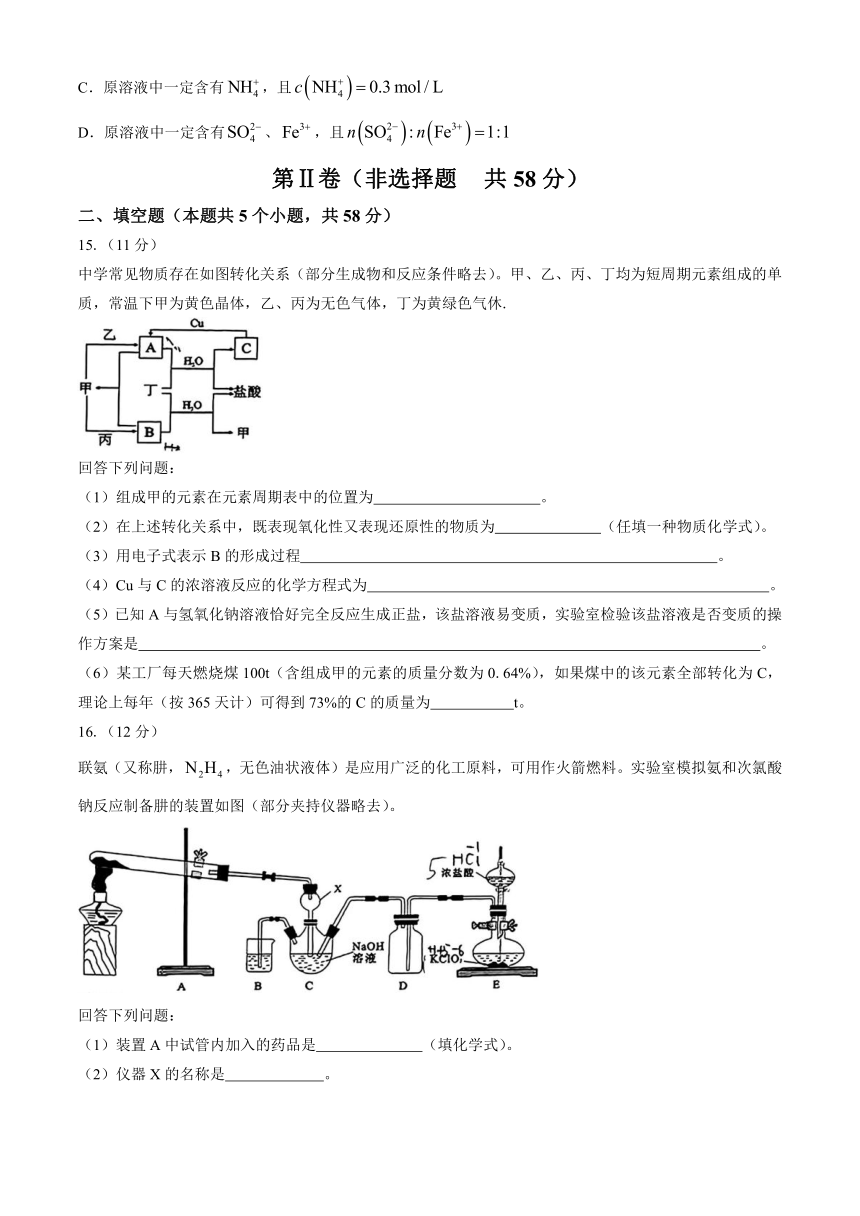
14.100mL某溶液可能含有、、、、、中的若干种,取该溶液进行实验,实验过程如图所示(所加试剂均过量,气体全部逸出)。已知:溶液中与能大量共存,与不能大量共存。
下列说法正确的是
A.该过程中可能涉及到氧化还原反应
B.原溶液中一定不含、,可能存在
C.原溶液中一定含有,且
D.原溶液中一定含有、,且
第Ⅱ卷(非选择题 共58分)
二、填空题(本题共5个小题,共58分)
15.(11分)
中学常见物质存在如图转化关系(部分生成物和反应条件略去)。甲、乙、丙、丁均为短周期元素组成的单质,常温下甲为黄色晶体,乙、丙为无色气体,丁为黄绿色气休.
回答下列问题:
(1)组成甲的元素在元素周期表中的位置为 。
(2)在上述转化关系中,既表现氧化性又表现还原性的物质为 (任填一种物质化学式)。
(3)用电子式表示B的形成过程 。
(4)Cu与C的浓溶液反应的化学方程式为 。
(5)已知A与氢氧化钠溶液恰好完全反应生成正盐,该盐溶液易变质,实验室检验该盐溶液是否变质的操作方案是 。
(6)某工厂每天燃烧煤100t(含组成甲的元素的质量分数为0.64%),如果煤中的该元素全部转化为C,理论上每年(按365天计)可得到73%的C的质量为 t。
16.(12分)
联氨(又称肼,,无色油状液体)是应用广泛的化工原料,可用作火箭燃料。实验室模拟氨和次氯酸钠反应制备肼的装置如图(部分夹持仪器略去)。
回答下列问题:
(1)装置A中试管内加入的药品是 (填化学式)。
(2)仪器X的名称是 。
(3)为了使C中NaOH更多地转化为NaClO,能要在D中盛放的试剂为 (填标号)。
a.硫酸亚铁溶液 b.浓硫酸 c.碱石灰 d.饱和食盐水
(4)装置C中制备肼的离子方程式为 。
(5)装置E中发生的反应中,还原剂和氧化剂的物质的量之比为 。
(6)装置B中存在的明显缺陷是 。
17.(12分)
“碳中和”是目前社会备受关注的重要议题。“碳中和”是指的排放总量和减少总量相当,对于改善环境,实现绿色发展至关重要。
已知:
回答下列问题:
(1)结合上图信息可知,催化分解2mol (g)生成CO(g)和(g),反应需要吸收 kJ能量。
(2)利用和能化合成甲烷:。能使合成甲烷速率减小的措施是 (任写一条);T℃,在恒容密闭容器中进行该反应,下列说法正确的是 (填标号)。
a.反应过程中
b.容器内气体的密度不再改变,说明反应达到平衡状态
c.当该反应达到平衡后,一定为4
d.反应一段时间测得反应物的转化率相等,则起始时
(3)180℃时将1mol 和0.5mol 通入1L的恒容密闭容器中,反应生成甲醇蒸气()和某副产物,测得各物质的物质的量随时间的部分变化如图所示。
①该反应的化学方程式为 。
②在0~3min内,用表示的平均化学反应速率为 。在3~10min内,反应 (填“达到”或“未达到”)平衡状态。
(4)以和为原料制备HCOOH和的原电池装置如右图所示。其中,电极a作 (填“正极”或“负极”);电极b的电极反应式为 。
18.(12分)
以淀粉或重油为原料合成乳酸的流程如下图所示,其中A是重要的有机化工原料,其产量是衡量国家石油化工发展水平的标志。
回答下列问题:
(1)A的官能团名称为 ;B的结构简式为 。
(2)通过淀粉、重油均可获得B,下列说法正确的是 (填标号)
a.淀粉、重油均为混合物
b.两种途径获得B,原子利用率均为100%
c.两种途径获得B,涉及的转化均发生了化学变化
(3)反应①的反应类型为 ;反应②的化学方程式为 。
(4)等物质的最的A和乳酸分别充分燃烧,消耗氧气的物质的量前者 后者(填“>”“=”或“<”)。
(5)1mol乳酸与足量钠完全反应,得到 L氢气(标准状况);乳酸转化为
的反应条件为
19.(11分)
溴及其化合物可被用来作为阻燃剂、净水剂、杀虫剂等,海水是提取溴的主要来源。已知某浓缩海水中含、、、、、(其他离子忽略),探究从该海水提溴的主要工艺流程的两条途径如图所示:
已知:
①的沸点为58.5℃;
②将流程中“溴蒸气”等分为两等份,分别提取得到产品1和产品2。
回答下列问题:
(1)向“粗产品溴”通入“热”空气的原因是 。
(2)溶液a和“粗产品溴”中都含有的离子为 (填化学式)。
(3)提取“产品2”时,用溶液吸收热空气吹出的。
①补全以下化学方程式:
②充分反应后,分析溶液b中含少量,部分离子浓度如下表:
离子
c/(mol/L) 1.00 1.21 0.78 4.00
忽略吸收溴蒸气时溶液体积变化,则所用溶液溶质的物质的量浓度为 mol/L(计算结果保留两位小数)。
(4)关于上述工艺流程的说法正确的是 (填标号)。
A.操作1和操作2都包含冷凝操作
B.两次“酸化”,加酸时都发生了氧化还原反应
C.流程中涉及2种有毒气体,生产中要防止环境污染
D.从浓缩海水中得到产品,提取过程都达到了富集溴的目的
(5)测得浓缩海水中溴的含量为800,按上述流程得产品1损失了15%的溴,得产品2损失了20%的溴。处理12该浓缩海水,实际可得到液溴共 mol(计算结果保留一位小数)。
化学参考答案与评分标准
一、选择题(本题包括14小题,每小题3分,共42分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 B D A B D C C A A D B B D C
二、填空题(本题包括5小题,共58分)
15.(除标注外每空2分,共11分)
(1)第三周期,ⅥA族
(2)S或
(3)
(4)
(5)取该盐溶液少量于试管中,先滴入稀盐酸酸化,然后加入溶液,若出现白色沉淀,说明该盐溶液已变质,反之,该盐溶液未变质
(6)980
16.(每空2分,共12分)
(1)、
(2)长颈漏斗
(3)d
(4)(或)
(5)5∶1
(6)装置B中导气管直接伸入液面下,未采用防倒吸措施
17.(除标注外每空2分,共12分)
(1)556
(2)降低温度、减小压强(合理均给分) ad
(3)①
②0.1 达到
(4)负极
18.(除标注外每空2分,共12分)
(1)碳碳双键
(2)ac
(3)氧化反应
(4)=
(5)22.4 浓硫酸、加热
19.(除标注外每空2分,共11分)
(1)的沸点为58.5℃,受热易从粗产品中挥发出来
(2)、
(3)①3 6 5 1
②2.00
(4)AD
(5)49.5
化学试卷
说明:
1.本试卷分第Ⅰ卷和第Ⅱ卷,共8页。考生作答时,须将答案答在答题卡上,在本试卷、草稿纸上答题无效。考试结束后,将答题卡交回。
2.本试卷满分100分,90分钟完卷。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Br—80 Fe—56 Ba—137
第Ⅰ卷(选择题 共42分)
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项最符合题意)
1.劳动可以“树德、增智、强体、育美”。下列有关劳动实践的分析错误的是
A.自制“大葱煎鸡蛋饼”,加热时蛋白质变性
B.施用铵态氮肥,将肥料深埋土中防止铵盐挥发
C.将成熟的水果与未成熟的水果混放,利用乙烯催熟果实
D.在铁制品表面刷油漆,与调控反应速率有关
2.下列说法正确的是
A.石油的分馏发生了化学变化 B.铁的冶炼是通过高温分解来完成的
C.用于轴承的耐高温材料碳化硅是传统陶瓷 D.竹简的成分之一纤维素属于天然高分子材料
3.“科学、安全、有效和合理地使用化学品”人人有责。下列说法错误的是
A.抗坏血酸常作食物保存的氧化剂 B.豆腐的制作过程与胶体的性质有关
C.非处方药的包装上印有“OTC”标识 D.合成农药要向高效、低毒和低残留的方向发展
4.下列化学用语表达错误的是
A.中子数为6的硼原子: B.的电子式:
C.的结构式:H—O—O—H D.甲烷分子的空间填充模型:
5.含4个碳原子的部分烃分子结构中,碳原子相互结合的方式如下图:
下列说法正确的是
A.②③互为同系物 B.③④互为同分异构体
C.①分子中所有碳原子在同一平面上 D.②能使酸性高锰酸钾溶液褪色
6.硅是太阳能电池的重要材料,工业制备高纯硅的主要过程如下:
石英砂粗硅高纯硅
反应③的能量变化如右图所示。下列说法正确的是
A.反应①中气体产物为 B.反应②是吸热反应
C.反应③中生成1mol Si时,有5mol化学键断裂 D.反应①②③中,还原剂分别为焦炭、HCl、
7.镁、海水、溶解氧可构成原电池,为水下小功率设备长时间供电,电池结构示意图如下,电池总反应为:。下列说法正确的是
A.Mg作电池的正极
B.电子由Mg电极经海水流向石墨电极
C.石器电极的电极反应式为:
D.电池工作一段时间,海水浓度减小
8.表示阿伏加德罗常数的值。下列说法正确的是
A.1mol 与3mol 在密闭容器中充分反应后分子数目大于2
B.标准状况下,11.2L 含有的原子数目为2.5
C.15g甲基()中所含电子数目为7
D.1mol/L 溶液比1mol/L NaCl溶液中含有的离子数目多
9.下列实验装置能达到实验目的的是
装置
目的 提取碘时将海带灼烧为灰烬 除去中少量杂质 光照条件下制取纯净 证明是分解的催化剂
选项 A B C D
10.已知工业上制备下列物质的流程,相关的离子方程式错误的是
A.海水MgOMg
B.铝土矿
C.海带含溶液含溶液→
D.饱和食盐水、HCl盐酸
11.根据下列实验操作及现象推出的相应结论正确的是
选项 实验操作及现象 结论
A 蔗糖溶液中加入稀硫酸,煮沸、冷却后,加入银氨溶液,水浴加热,没有银镜产生 蔗糖在稀硫酸、加热条件下,未发生水解反应
B 取两支试管,各加入2mL 0.1mol/L 溶液,分别置于冷水和热水中,再向两试管同时加入2mL 0.1mol/L 溶液,热水中先出现浑浊 其他条件相同时,反应温度越高,反应速率越快
C 将和另一无色气体的混合物通入溶液中,产生白色沉淀 白色沉淀一定为
D 某含铁矿石中加入足量浓硝酸、酸浸,再滴入几滴KSCN溶液,溶液出现红色 该矿石中铁元素为+3价
12.下表是短周期主族元素X、Y、Z、W、M的部分性质数据;Z与W同周期。
X Y Z W M
原子半径/nm 0.186 0.117 0.075 0.074 0.099
最高正化合价或最低负化合价 +1 +4 -4 +5 -3 -2 +7 -1
下列说法错误的是
A.简单离子的半径:W>X B.简单氢化物的稳定性:Y>Z
C.最高价含氧酸酸性:M>Y D.化合物XMW中既含离子键又含共价键
13.恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:,用气体传感器测量不同起始浓度和催化剂表面积下,随时间的变化如下表所示:
编号 / 时间/min 表面积/ 0 40 60 80
① a 2.40 1.60 1.20 0,80
② a 1.20 0.40 ? ?
③ 2a 2.40 0.80 0.40 0.40
下列说法正确的是
A.相同条件下,氨气初始浓度越大,反应速率越快
B.实验①,0~40min,
C.实验③,60~80min,氨的分解反应不再发生
D.实验①②③,40~60min,实验②中最小
14.100mL某溶液可能含有、、、、、中的若干种,取该溶液进行实验,实验过程如图所示(所加试剂均过量,气体全部逸出)。已知:溶液中与能大量共存,与不能大量共存。
下列说法正确的是
A.该过程中可能涉及到氧化还原反应
B.原溶液中一定不含、,可能存在
C.原溶液中一定含有,且
D.原溶液中一定含有、,且
第Ⅱ卷(非选择题 共58分)
二、填空题(本题共5个小题,共58分)
15.(11分)
中学常见物质存在如图转化关系(部分生成物和反应条件略去)。甲、乙、丙、丁均为短周期元素组成的单质,常温下甲为黄色晶体,乙、丙为无色气体,丁为黄绿色气休.
回答下列问题:
(1)组成甲的元素在元素周期表中的位置为 。
(2)在上述转化关系中,既表现氧化性又表现还原性的物质为 (任填一种物质化学式)。
(3)用电子式表示B的形成过程 。
(4)Cu与C的浓溶液反应的化学方程式为 。
(5)已知A与氢氧化钠溶液恰好完全反应生成正盐,该盐溶液易变质,实验室检验该盐溶液是否变质的操作方案是 。
(6)某工厂每天燃烧煤100t(含组成甲的元素的质量分数为0.64%),如果煤中的该元素全部转化为C,理论上每年(按365天计)可得到73%的C的质量为 t。
16.(12分)
联氨(又称肼,,无色油状液体)是应用广泛的化工原料,可用作火箭燃料。实验室模拟氨和次氯酸钠反应制备肼的装置如图(部分夹持仪器略去)。
回答下列问题:
(1)装置A中试管内加入的药品是 (填化学式)。
(2)仪器X的名称是 。
(3)为了使C中NaOH更多地转化为NaClO,能要在D中盛放的试剂为 (填标号)。
a.硫酸亚铁溶液 b.浓硫酸 c.碱石灰 d.饱和食盐水
(4)装置C中制备肼的离子方程式为 。
(5)装置E中发生的反应中,还原剂和氧化剂的物质的量之比为 。
(6)装置B中存在的明显缺陷是 。
17.(12分)
“碳中和”是目前社会备受关注的重要议题。“碳中和”是指的排放总量和减少总量相当,对于改善环境,实现绿色发展至关重要。
已知:
回答下列问题:
(1)结合上图信息可知,催化分解2mol (g)生成CO(g)和(g),反应需要吸收 kJ能量。
(2)利用和能化合成甲烷:。能使合成甲烷速率减小的措施是 (任写一条);T℃,在恒容密闭容器中进行该反应,下列说法正确的是 (填标号)。
a.反应过程中
b.容器内气体的密度不再改变,说明反应达到平衡状态
c.当该反应达到平衡后,一定为4
d.反应一段时间测得反应物的转化率相等,则起始时
(3)180℃时将1mol 和0.5mol 通入1L的恒容密闭容器中,反应生成甲醇蒸气()和某副产物,测得各物质的物质的量随时间的部分变化如图所示。
①该反应的化学方程式为 。
②在0~3min内,用表示的平均化学反应速率为 。在3~10min内,反应 (填“达到”或“未达到”)平衡状态。
(4)以和为原料制备HCOOH和的原电池装置如右图所示。其中,电极a作 (填“正极”或“负极”);电极b的电极反应式为 。
18.(12分)
以淀粉或重油为原料合成乳酸的流程如下图所示,其中A是重要的有机化工原料,其产量是衡量国家石油化工发展水平的标志。
回答下列问题:
(1)A的官能团名称为 ;B的结构简式为 。
(2)通过淀粉、重油均可获得B,下列说法正确的是 (填标号)
a.淀粉、重油均为混合物
b.两种途径获得B,原子利用率均为100%
c.两种途径获得B,涉及的转化均发生了化学变化
(3)反应①的反应类型为 ;反应②的化学方程式为 。
(4)等物质的最的A和乳酸分别充分燃烧,消耗氧气的物质的量前者 后者(填“>”“=”或“<”)。
(5)1mol乳酸与足量钠完全反应,得到 L氢气(标准状况);乳酸转化为
的反应条件为
19.(11分)
溴及其化合物可被用来作为阻燃剂、净水剂、杀虫剂等,海水是提取溴的主要来源。已知某浓缩海水中含、、、、、(其他离子忽略),探究从该海水提溴的主要工艺流程的两条途径如图所示:
已知:
①的沸点为58.5℃;
②将流程中“溴蒸气”等分为两等份,分别提取得到产品1和产品2。
回答下列问题:
(1)向“粗产品溴”通入“热”空气的原因是 。
(2)溶液a和“粗产品溴”中都含有的离子为 (填化学式)。
(3)提取“产品2”时,用溶液吸收热空气吹出的。
①补全以下化学方程式:
②充分反应后,分析溶液b中含少量,部分离子浓度如下表:
离子
c/(mol/L) 1.00 1.21 0.78 4.00
忽略吸收溴蒸气时溶液体积变化,则所用溶液溶质的物质的量浓度为 mol/L(计算结果保留两位小数)。
(4)关于上述工艺流程的说法正确的是 (填标号)。
A.操作1和操作2都包含冷凝操作
B.两次“酸化”,加酸时都发生了氧化还原反应
C.流程中涉及2种有毒气体,生产中要防止环境污染
D.从浓缩海水中得到产品,提取过程都达到了富集溴的目的
(5)测得浓缩海水中溴的含量为800,按上述流程得产品1损失了15%的溴,得产品2损失了20%的溴。处理12该浓缩海水,实际可得到液溴共 mol(计算结果保留一位小数)。
化学参考答案与评分标准
一、选择题(本题包括14小题,每小题3分,共42分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 B D A B D C C A A D B B D C
二、填空题(本题包括5小题,共58分)
15.(除标注外每空2分,共11分)
(1)第三周期,ⅥA族
(2)S或
(3)
(4)
(5)取该盐溶液少量于试管中,先滴入稀盐酸酸化,然后加入溶液,若出现白色沉淀,说明该盐溶液已变质,反之,该盐溶液未变质
(6)980
16.(每空2分,共12分)
(1)、
(2)长颈漏斗
(3)d
(4)(或)
(5)5∶1
(6)装置B中导气管直接伸入液面下,未采用防倒吸措施
17.(除标注外每空2分,共12分)
(1)556
(2)降低温度、减小压强(合理均给分) ad
(3)①
②0.1 达到
(4)负极
18.(除标注外每空2分,共12分)
(1)碳碳双键
(2)ac
(3)氧化反应
(4)=
(5)22.4 浓硫酸、加热
19.(除标注外每空2分,共11分)
(1)的沸点为58.5℃,受热易从粗产品中挥发出来
(2)、
(3)①3 6 5 1
②2.00
(4)AD
(5)49.5
同课章节目录
