江西省南昌市2023-2024学年高一下学期7月期末调研检测化学试题(含答案)
文档属性
| 名称 | 江西省南昌市2023-2024学年高一下学期7月期末调研检测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-04 09:36:54 | ||
图片预览


文档简介
南昌市2023-2024学年高一下学期7月期末调研检测
化学
可能用到的相对原子质量H-1 C-12 N-14 O-16 S-32
一、选择题(本大题包括14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求)
1.南昌美食小吃吸引了无数游客品尝。下列物质的主要成分不属于有机物的是
A.藜蒿炒腊肉——藜蒿中的纤维素 B.瓦罐煨汤——盛汤的瓦罐
C.米粉蒸肉——肉中的蛋白质 D.南昌米粉——米粉中的淀粉
2.近年我国在科技领域不断取得新成就。下列说法正确的是
A.我国实现了高性能纤维锂离子电池的规模化制备,锂离子电池放电时将电能转化为化学能
B.“深海一号”开采深海的天然气可作清洁燃料,实现零碳排放
C.“天和核心舱”电推进系统中的腔体采用的氮化硼陶瓷属于新型无机非金属材料
D.“破风8676”的5G射频收发芯片的主要成分是
3.用NA表示阿伏加德罗常数,下列叙述正确的是
A.等物质的量的CO和所含分子数为NA
B.在标准状况下,NA个任何分子所占的体积约为22.4L
C.在常温常压下,28g与CO混合物气体中所含的分子数目一定为NA
D.1mol/L溶液中含有Cl 的数目为2NA
4.(核磁共振)、可用于测定蛋白质、核酸等生物大分子的空间结构。下列有关、的叙述正确的是
A.、具有相同的中子数 B.与互称同位素
C.的核外电子数与中子数相同 D.与的核外电子排布相同
5.下列关于有机物的说法正确的是
A.、均属于烃
B.每个苯乙烯()分子中含有4个碳碳双键
C.一定是纯净物
D.分子式为与的两种有机物互为同系物
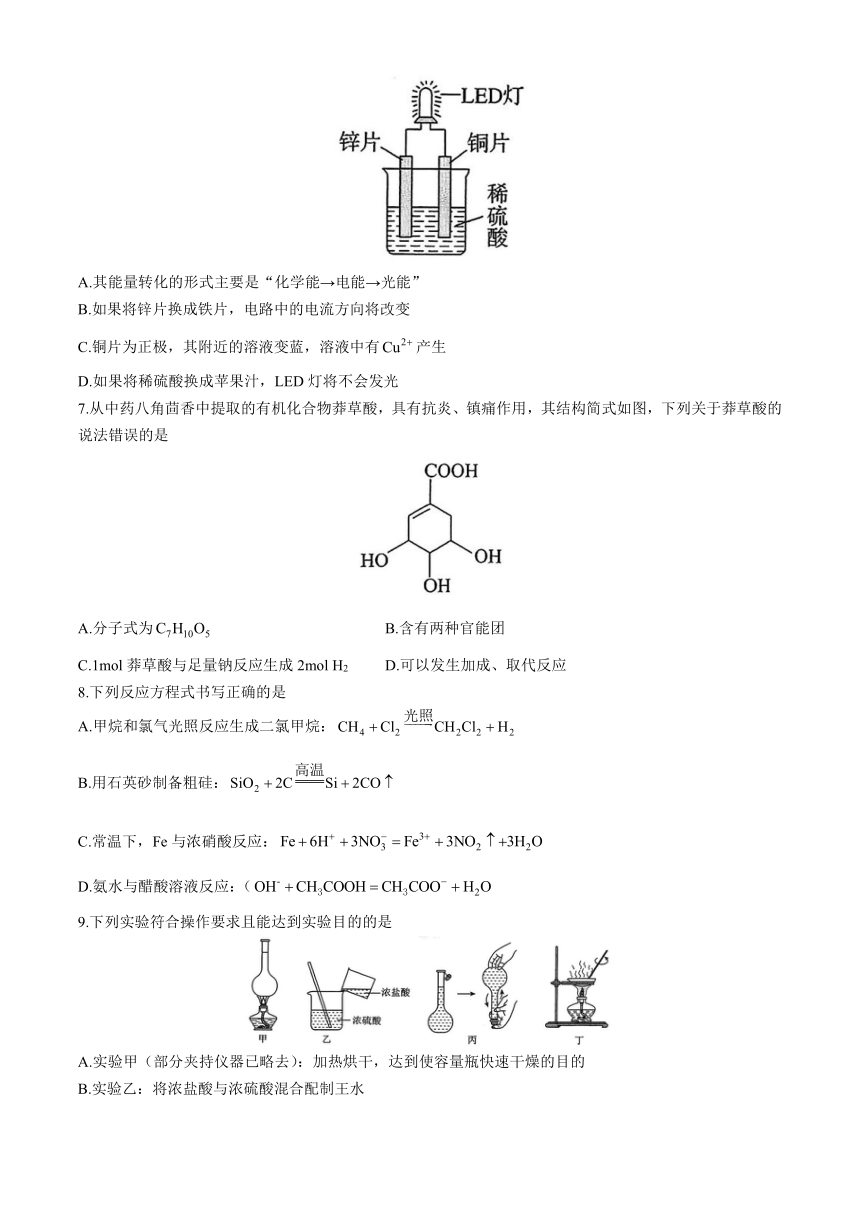
6.如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是
A.其能量转化的形式主要是“化学能→电能→光能”
B.如果将锌片换成铁片,电路中的电流方向将改变
C.铜片为正极,其附近的溶液变蓝,溶液中有产生
D.如果将稀硫酸换成苹果汁,LED灯将不会发光
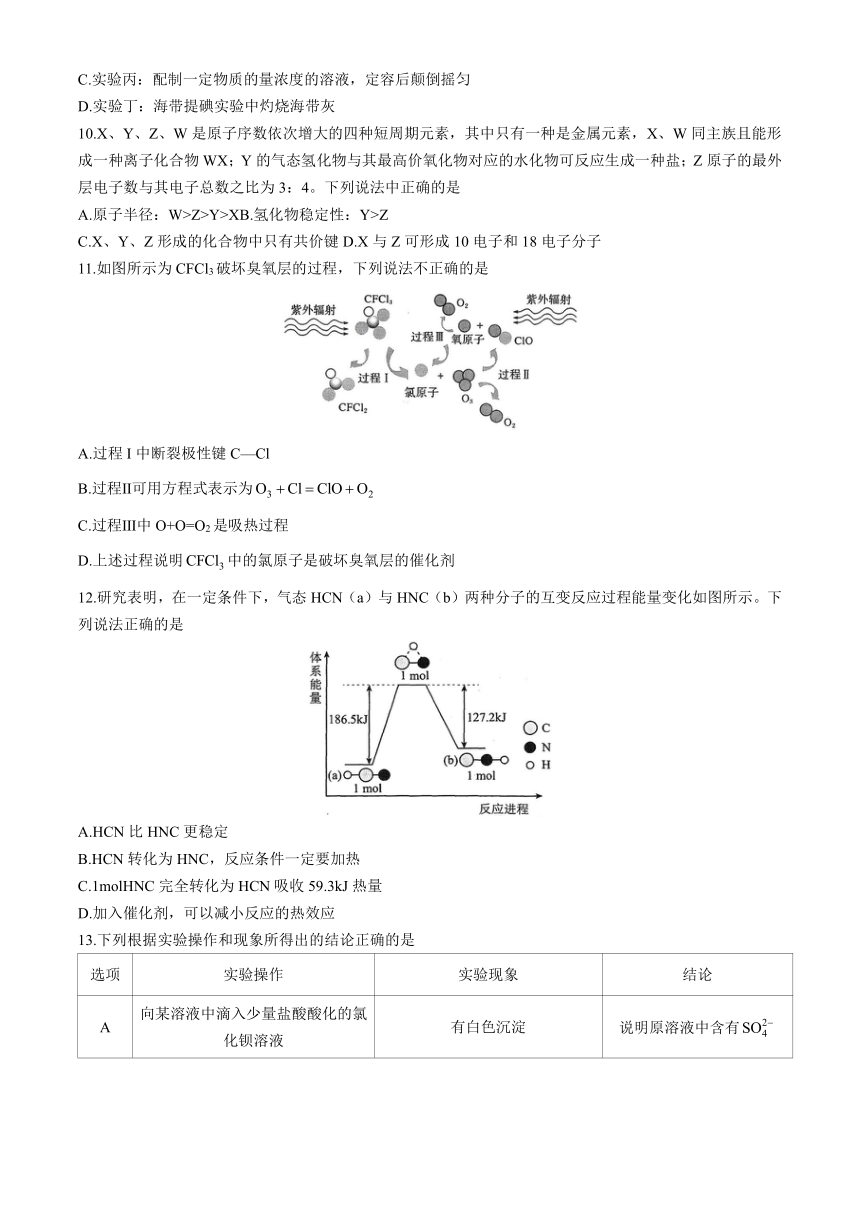
7.从中药八角茴香中提取的有机化合物莽草酸,具有抗炎、镇痛作用,其结构简式如图,下列关于莽草酸的说法错误的是
A.分子式为 B.含有两种官能团
C.1mol莽草酸与足量钠反应生成2mol H2 D.可以发生加成、取代反应
8.下列反应方程式书写正确的是
A.甲烷和氯气光照反应生成二氯甲烷:
B.用石英砂制备粗硅:
C.常温下,Fe与浓硝酸反应:
D.氨水与醋酸溶液反应:(
9.下列实验符合操作要求且能达到实验目的的是
A.实验甲(部分夹持仪器已略去):加热烘干,达到使容量瓶快速干燥的目的
B.实验乙:将浓盐酸与浓硫酸混合配制王水
C.实验丙:配制一定物质的量浓度的溶液,定容后颠倒摇匀
D.实验丁:海带提碘实验中灼烧海带灰
10.X、Y、Z、W是原子序数依次增大的四种短周期元素,其中只有一种是金属元素,X、W同主族且能形成一种离子化合物WX;Y的气态氢化物与其最高价氧化物对应的水化物可反应生成一种盐;Z原子的最外层电子数与其电子总数之比为3:4。下列说法中正确的是
A.原子半径:W>Z>Y>XB.氢化物稳定性:Y>Z
C.X、Y、Z形成的化合物中只有共价键D.X与Z可形成10电子和18电子分子
11.如图所示为CFCl3破坏臭氧层的过程,下列说法不正确的是
A.过程I中断裂极性键C—Cl
B.过程Ⅱ可用方程式表示为
C.过程Ⅲ中O+O=O2是吸热过程
D.上述过程说明中的氯原子是破坏臭氧层的催化剂
12.研究表明,在一定条件下,气态HCN(a)与HNC(b)两种分子的互变反应过程能量变化如图所示。下列说法正确的是
A.HCN比HNC更稳定
B.HCN转化为HNC,反应条件一定要加热
C.1molHNC完全转化为HCN吸收59.3kJ热量
D.加入催化剂,可以减小反应的热效应
13.下列根据实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结论
A 向某溶液中滴入少量盐酸酸化的氯化钡溶液 有白色沉淀 说明原溶液中含有
B 将二氧化硫气体通入滴有酚酞的NaOH稀溶液中 溶液褪色 SO2具有漂白性
C 向两支均盛有5mL 10%的溶液的试管中分别加入0.1mol/L的溶液和0.1mol/L溶液 加入的试管中产生气泡快,加入的试管产生气泡慢 、均可以加快的分解;比的催化效果更好
D 分别向盛有溶液的a、b试管中滴加淀粉溶液和溶液 a中溶液变蓝,b中产生黄色沉淀 溶液中可能存在:
14.某工业废水中含有大量的和,都可以在碱性条件下被次氯酸钠氧化:反应①反应②,再进行一系列操作,回收锰和铬,以达到回收利用且降低污染的目的。下列说法不正确的是
A.在氧化处理过程中用代替NaClO效果更好
B.反应①中氧化剂与还原剂的物质的量之比为1:1
C.反应②为
D.在酸性条件下转化为不是氧化还原反应
二、非选择题(本大题包括4小题,共58分)
15.(10分)氢气是极具发展潜力的清洁能源,氢燃料为代表的燃料电池有良好的应用前景。
(1)氢化钠(NaH)是一种常用的储氢剂,请写出NaH的电子式__________。
(2)H2和在一定条件下可合成甲醇是一个放热反应。将 和 H2充入体积为3L的恒温密闭容器中发生此反应。的物质的量随时间的变化如图中实线所示。
①其他条件不变,下列情况能说明反应已达平衡的是___________(填字母,下同)。
A.体系的压强保持不变
B.混合物中的含量保持不变
C.容器中混合气体的密度保持不变
D.单位时间体系内每减少 的同时生成
②观察图中实线,该反应在0~4min内的平均反应速率___mol/(L·min)(保留2位小数),比较b、c两点的正反应速率:b____________c(填“>”、“<”或“=”)。
③保持其他条件不变,小李同学在较高温度下完成该反应,H2的物质的量随时间变化如图中虚线所示。其他条件一定,关于该反应的说法正确的是___________。
A.温度越高,H2的平衡转化率越大
B.温度越高,反应速率越快
C.温度越高,达到平衡时反应释放的热量越多
D.a点时,两种情况的瞬时速率相等
16.(16分)海洋约占地球表面积的71%,其中的水资源和其他化学资源具有巨大的开发潜力。根据下列流程回答问题:
(1)海水提溴工艺也叫做“吹出法”,其过程包括氧化、吹出、吸收、蒸馏等环节。吸收环节中,用的水溶液吸收“吹出”的溴单质时,发生反应的化学方程式为__________。
(2)“提镁”工序中分离出氢氧化镁的操作是___________,工业上获取氢氧化镁用石灰乳而不用氢氧化钠溶液的原因是____________________________________________________。
(3)产品A的主要成分是__________。
(4)“联合制碱”工序中,是将CO2和NH3通入饱和食盐水中,析出碳酸氢钠晶体,将其分离出来,再加热分解得到纯碱。为提高产率,应向饱和食盐水中先通入_______________(填化学式),生成碳酸氢钠晶体的化学方程式为___________。
(5)我省深居内陆,居民可通过食用加碘食盐的方式补充碘元素的摄入,要测定食盐中的碘元素(以形式存在),可在酸性条件下加入KI将其转化为进行定量检测,该转化过程的离子方程式为_______。
(6)科学家开发了一种二氧化碳淡化海水技术,其循环如图所示。
与淡化前的海水相比,淡化后的海水导电能力会______(填“增强”或“减弱”)。
17.(16分)某化学兴趣小组利用如下装置,制备并探究的部分性质,实验装置如图所示(装置的气密性已检查)。回答下列问题:
(1)仪器a的名称是________。
(2)浓硫酸试剂瓶上应有的标识是________(填序号)。
A. B. C.
(3)请写出该实验中制备的化学反应方程式_____________________________________。
(4)湿润的pH试纸的变化______________,装置C中的反应体现了的___________性。
(5)拆装置前,需要进行的操作是________________________________,工业上通常使用氨水吸收,获得的产物有什么用途(列举一种即可)____________________。
(6)实验完成后,该小组同学将实验室内空气样品经过管道通入密闭容器中的500mL 0.1mol/L的酸性溶液中。已知与该溶液反应的化学方程式为(未配平)若管道中空气流量为a L/min,经过b min溶液恰好褪色,假定样品中的,可被溶液充分吸收。则空气样品中的含量是________g/L(用含a、b代数式表示)。
18.(16分)
Ⅰ.已知A是一种气态烃,可用作水果的催熟剂。下列关系图中部分产物可能略去,试回答下列问题:
已知反应:(R代表烃基,X代表卤素原子)
(1)A分子中官能团的名称_________,E生成H的反应类型是_______。
(2)绿色化学的核心内容之一是“原子经济性”,即原子的理论利用率为100%,则反应①~⑦中符合绿色化学要求的是___________(填序号)。
(3)C与F以物质的量之比2:1反应生成G,反应④的化学方程式为___________。
(4)聚苯乙烯的结构简式为__________。
(5)用化学方法可以鉴别B和C的试剂是(填字母)___________。
a.蒸馏水 b.NaOH溶液 c.紫色的石蕊溶液
Ⅱ.某学习小组设计乙醇的催化氧化的实验装置如图所示,试回答下列问题。
(6)甲的锥形瓶中盛放的固体药品可能为___________(填字母)。
A. B.KCl C. D.
(7)实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为___________。
南昌市2023-2024学年高一下学期7月期末调研检测
化学 参考答案及评分意见
一、选择题(本大题包括14小题,每小题3分,共42分)
序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 B C C D D A B B C D C A D A
二、非选择题(本大题包括4小题,共58分)
15.(10分,每空2分)
(1)
(2)①AB ②0.16 > ③B
16.(16分,每空2分)
(1)
(2)过滤;石灰乳原料丰富,成本低
(3)CaSO4
(4);
(5)
(6)减弱
17.(16分,每空2分)
(1)干燥管 (2)C
(3)
(4)pH试纸变红;氧化性
(5)打开止水夹,推动下面注射器的活塞,排尽装置内残余的至烧杯中吸收完全;用作氮肥;
(6)8/ab。
18.(16分,每空2分)
(1)碳碳双键 取代 (2)①②⑦
(3)
(4)
(5)C
(6)AD
(7)
化学
可能用到的相对原子质量H-1 C-12 N-14 O-16 S-32
一、选择题(本大题包括14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求)
1.南昌美食小吃吸引了无数游客品尝。下列物质的主要成分不属于有机物的是
A.藜蒿炒腊肉——藜蒿中的纤维素 B.瓦罐煨汤——盛汤的瓦罐
C.米粉蒸肉——肉中的蛋白质 D.南昌米粉——米粉中的淀粉
2.近年我国在科技领域不断取得新成就。下列说法正确的是
A.我国实现了高性能纤维锂离子电池的规模化制备,锂离子电池放电时将电能转化为化学能
B.“深海一号”开采深海的天然气可作清洁燃料,实现零碳排放
C.“天和核心舱”电推进系统中的腔体采用的氮化硼陶瓷属于新型无机非金属材料
D.“破风8676”的5G射频收发芯片的主要成分是
3.用NA表示阿伏加德罗常数,下列叙述正确的是
A.等物质的量的CO和所含分子数为NA
B.在标准状况下,NA个任何分子所占的体积约为22.4L
C.在常温常压下,28g与CO混合物气体中所含的分子数目一定为NA
D.1mol/L溶液中含有Cl 的数目为2NA
4.(核磁共振)、可用于测定蛋白质、核酸等生物大分子的空间结构。下列有关、的叙述正确的是
A.、具有相同的中子数 B.与互称同位素
C.的核外电子数与中子数相同 D.与的核外电子排布相同
5.下列关于有机物的说法正确的是
A.、均属于烃
B.每个苯乙烯()分子中含有4个碳碳双键
C.一定是纯净物
D.分子式为与的两种有机物互为同系物
6.如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是
A.其能量转化的形式主要是“化学能→电能→光能”
B.如果将锌片换成铁片,电路中的电流方向将改变
C.铜片为正极,其附近的溶液变蓝,溶液中有产生
D.如果将稀硫酸换成苹果汁,LED灯将不会发光
7.从中药八角茴香中提取的有机化合物莽草酸,具有抗炎、镇痛作用,其结构简式如图,下列关于莽草酸的说法错误的是
A.分子式为 B.含有两种官能团
C.1mol莽草酸与足量钠反应生成2mol H2 D.可以发生加成、取代反应
8.下列反应方程式书写正确的是
A.甲烷和氯气光照反应生成二氯甲烷:
B.用石英砂制备粗硅:
C.常温下,Fe与浓硝酸反应:
D.氨水与醋酸溶液反应:(
9.下列实验符合操作要求且能达到实验目的的是
A.实验甲(部分夹持仪器已略去):加热烘干,达到使容量瓶快速干燥的目的
B.实验乙:将浓盐酸与浓硫酸混合配制王水
C.实验丙:配制一定物质的量浓度的溶液,定容后颠倒摇匀
D.实验丁:海带提碘实验中灼烧海带灰
10.X、Y、Z、W是原子序数依次增大的四种短周期元素,其中只有一种是金属元素,X、W同主族且能形成一种离子化合物WX;Y的气态氢化物与其最高价氧化物对应的水化物可反应生成一种盐;Z原子的最外层电子数与其电子总数之比为3:4。下列说法中正确的是
A.原子半径:W>Z>Y>XB.氢化物稳定性:Y>Z
C.X、Y、Z形成的化合物中只有共价键D.X与Z可形成10电子和18电子分子
11.如图所示为CFCl3破坏臭氧层的过程,下列说法不正确的是
A.过程I中断裂极性键C—Cl
B.过程Ⅱ可用方程式表示为
C.过程Ⅲ中O+O=O2是吸热过程
D.上述过程说明中的氯原子是破坏臭氧层的催化剂
12.研究表明,在一定条件下,气态HCN(a)与HNC(b)两种分子的互变反应过程能量变化如图所示。下列说法正确的是
A.HCN比HNC更稳定
B.HCN转化为HNC,反应条件一定要加热
C.1molHNC完全转化为HCN吸收59.3kJ热量
D.加入催化剂,可以减小反应的热效应
13.下列根据实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结论
A 向某溶液中滴入少量盐酸酸化的氯化钡溶液 有白色沉淀 说明原溶液中含有
B 将二氧化硫气体通入滴有酚酞的NaOH稀溶液中 溶液褪色 SO2具有漂白性
C 向两支均盛有5mL 10%的溶液的试管中分别加入0.1mol/L的溶液和0.1mol/L溶液 加入的试管中产生气泡快,加入的试管产生气泡慢 、均可以加快的分解;比的催化效果更好
D 分别向盛有溶液的a、b试管中滴加淀粉溶液和溶液 a中溶液变蓝,b中产生黄色沉淀 溶液中可能存在:
14.某工业废水中含有大量的和,都可以在碱性条件下被次氯酸钠氧化:反应①反应②,再进行一系列操作,回收锰和铬,以达到回收利用且降低污染的目的。下列说法不正确的是
A.在氧化处理过程中用代替NaClO效果更好
B.反应①中氧化剂与还原剂的物质的量之比为1:1
C.反应②为
D.在酸性条件下转化为不是氧化还原反应
二、非选择题(本大题包括4小题,共58分)
15.(10分)氢气是极具发展潜力的清洁能源,氢燃料为代表的燃料电池有良好的应用前景。
(1)氢化钠(NaH)是一种常用的储氢剂,请写出NaH的电子式__________。
(2)H2和在一定条件下可合成甲醇是一个放热反应。将 和 H2充入体积为3L的恒温密闭容器中发生此反应。的物质的量随时间的变化如图中实线所示。
①其他条件不变,下列情况能说明反应已达平衡的是___________(填字母,下同)。
A.体系的压强保持不变
B.混合物中的含量保持不变
C.容器中混合气体的密度保持不变
D.单位时间体系内每减少 的同时生成
②观察图中实线,该反应在0~4min内的平均反应速率___mol/(L·min)(保留2位小数),比较b、c两点的正反应速率:b____________c(填“>”、“<”或“=”)。
③保持其他条件不变,小李同学在较高温度下完成该反应,H2的物质的量随时间变化如图中虚线所示。其他条件一定,关于该反应的说法正确的是___________。
A.温度越高,H2的平衡转化率越大
B.温度越高,反应速率越快
C.温度越高,达到平衡时反应释放的热量越多
D.a点时,两种情况的瞬时速率相等
16.(16分)海洋约占地球表面积的71%,其中的水资源和其他化学资源具有巨大的开发潜力。根据下列流程回答问题:
(1)海水提溴工艺也叫做“吹出法”,其过程包括氧化、吹出、吸收、蒸馏等环节。吸收环节中,用的水溶液吸收“吹出”的溴单质时,发生反应的化学方程式为__________。
(2)“提镁”工序中分离出氢氧化镁的操作是___________,工业上获取氢氧化镁用石灰乳而不用氢氧化钠溶液的原因是____________________________________________________。
(3)产品A的主要成分是__________。
(4)“联合制碱”工序中,是将CO2和NH3通入饱和食盐水中,析出碳酸氢钠晶体,将其分离出来,再加热分解得到纯碱。为提高产率,应向饱和食盐水中先通入_______________(填化学式),生成碳酸氢钠晶体的化学方程式为___________。
(5)我省深居内陆,居民可通过食用加碘食盐的方式补充碘元素的摄入,要测定食盐中的碘元素(以形式存在),可在酸性条件下加入KI将其转化为进行定量检测,该转化过程的离子方程式为_______。
(6)科学家开发了一种二氧化碳淡化海水技术,其循环如图所示。
与淡化前的海水相比,淡化后的海水导电能力会______(填“增强”或“减弱”)。
17.(16分)某化学兴趣小组利用如下装置,制备并探究的部分性质,实验装置如图所示(装置的气密性已检查)。回答下列问题:
(1)仪器a的名称是________。
(2)浓硫酸试剂瓶上应有的标识是________(填序号)。
A. B. C.
(3)请写出该实验中制备的化学反应方程式_____________________________________。
(4)湿润的pH试纸的变化______________,装置C中的反应体现了的___________性。
(5)拆装置前,需要进行的操作是________________________________,工业上通常使用氨水吸收,获得的产物有什么用途(列举一种即可)____________________。
(6)实验完成后,该小组同学将实验室内空气样品经过管道通入密闭容器中的500mL 0.1mol/L的酸性溶液中。已知与该溶液反应的化学方程式为(未配平)若管道中空气流量为a L/min,经过b min溶液恰好褪色,假定样品中的,可被溶液充分吸收。则空气样品中的含量是________g/L(用含a、b代数式表示)。
18.(16分)
Ⅰ.已知A是一种气态烃,可用作水果的催熟剂。下列关系图中部分产物可能略去,试回答下列问题:
已知反应:(R代表烃基,X代表卤素原子)
(1)A分子中官能团的名称_________,E生成H的反应类型是_______。
(2)绿色化学的核心内容之一是“原子经济性”,即原子的理论利用率为100%,则反应①~⑦中符合绿色化学要求的是___________(填序号)。
(3)C与F以物质的量之比2:1反应生成G,反应④的化学方程式为___________。
(4)聚苯乙烯的结构简式为__________。
(5)用化学方法可以鉴别B和C的试剂是(填字母)___________。
a.蒸馏水 b.NaOH溶液 c.紫色的石蕊溶液
Ⅱ.某学习小组设计乙醇的催化氧化的实验装置如图所示,试回答下列问题。
(6)甲的锥形瓶中盛放的固体药品可能为___________(填字母)。
A. B.KCl C. D.
(7)实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为___________。
南昌市2023-2024学年高一下学期7月期末调研检测
化学 参考答案及评分意见
一、选择题(本大题包括14小题,每小题3分,共42分)
序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 B C C D D A B B C D C A D A
二、非选择题(本大题包括4小题,共58分)
15.(10分,每空2分)
(1)
(2)①AB ②0.16 > ③B
16.(16分,每空2分)
(1)
(2)过滤;石灰乳原料丰富,成本低
(3)CaSO4
(4);
(5)
(6)减弱
17.(16分,每空2分)
(1)干燥管 (2)C
(3)
(4)pH试纸变红;氧化性
(5)打开止水夹,推动下面注射器的活塞,排尽装置内残余的至烧杯中吸收完全;用作氮肥;
(6)8/ab。
18.(16分,每空2分)
(1)碳碳双键 取代 (2)①②⑦
(3)
(4)
(5)C
(6)AD
(7)
同课章节目录
