江西省宜春中学2023-2024学年高一下学期期末考试化学试卷(含答案)
文档属性
| 名称 | 江西省宜春中学2023-2024学年高一下学期期末考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-04 11:25:02 | ||
图片预览


文档简介
江西省宜春中学2023-2024学年度下学期高一期末试卷
化学
考试时间:75分钟
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Fe-56
一、单选题(本大题共14小题,共42分,每小题只有一个选项符合题意。)
1.从石器时代到青铜器时代,再到铁器时代,金属的冶炼体现了人类文明的发展历程和水平。下列关于金属冶炼的说法正确的是( )
A.制钠:高温分解NaCl制备Na
B.炼铁:用焦炭和空气反应产生的CO2在高温下还原铁矿石中铁的氧化物
C.制铜:“曾青(CuSO4)得铁,则化为铜”《淮南子》的过程发生置换反应
D.制铝:将Al(OH)3溶于盐酸中,电解所得AlCl3溶液
2.化学与人类生活、生产和社会可持续发展密切相关,下列有关说法正确的是( )
A.有“OTC”标志的是处方药,需要凭医生处方才能购买
B.山梨酸钾是常用的食品防腐剂、抗坏血酸是常用的食品抗氧化剂
C.中国天眼FAST用到的高性能碳化硅是一种新型的有机高分子材料
D.绿色化学的核心思想是“先污染后治理”,其设计遵循原子经济性和高选择性等原则
3.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.1.6g CH4电子总数为0.8 NA
B.常温下,2mol丙烷中含有共价键的数目为16 NA
C.标准状况下6.72 L Cl2通入足量水中被完全吸收,转移电子数目小于0.3 NA
D.在密闭容器中,使1 mol N2和3 mol H2充分反应,生成NH3的分子数为2 NA
4.下图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示。下列选项中正确的是( )
选项 发生装置中的药品 干燥和集气装置
A 氧化钙和浓氨水 图1
B 大理石和稀盐酸 图1
C 铜和稀硝酸 图2
D 锌和稀硫酸 图2
5.下列关于有机化合物的说法正确的是( )
A.油脂和蛋白质都属于天然高分子化合物,且在一定条件下都能水解
B.煤的干馏、煤的气化及液化都是化学变化,石油的分馏是物理变化
C.乙烯使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的反应原理相同
D.一般选用饱和氢氧化钠溶液除去乙酸乙酯中的乙酸
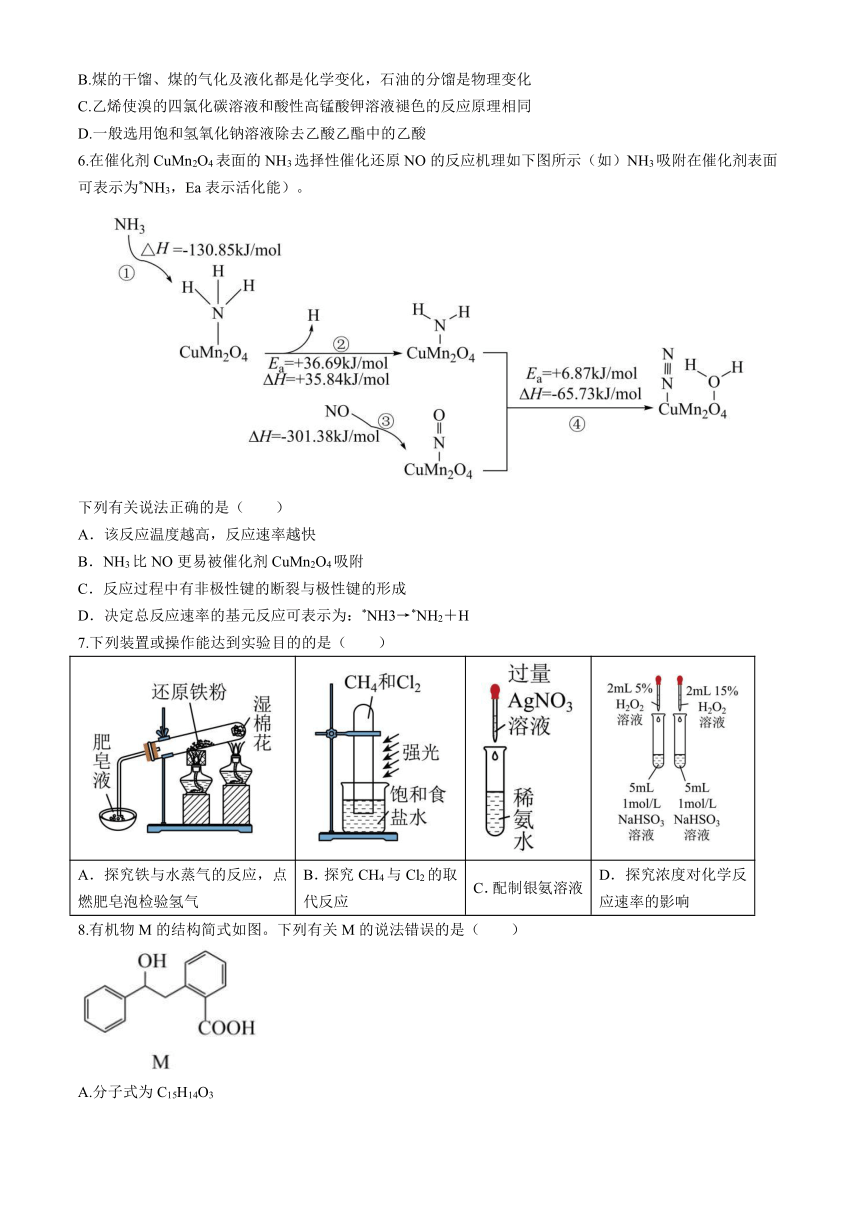
6.在催化剂CuMn2O4表面的NH3选择性催化还原NO的反应机理如下图所示(如)NH3吸附在催化剂表面可表示为*NH3,Ea表示活化能)。
下列有关说法正确的是( )
A.该反应温度越高,反应速率越快
B.NH3比NO更易被催化剂CuMn2O4吸附
C.反应过程中有非极性键的断裂与极性键的形成
D.决定总反应速率的基元反应可表示为:*NH3→*NH2+H
7.下列装置或操作能达到实验目的的是( )
A.探究铁与水蒸气的反应,点燃肥皂泡检验氢气 B.探究CH4与Cl2的取代反应 C.配制银氨溶液 D.探究浓度对化学反应速率的影响
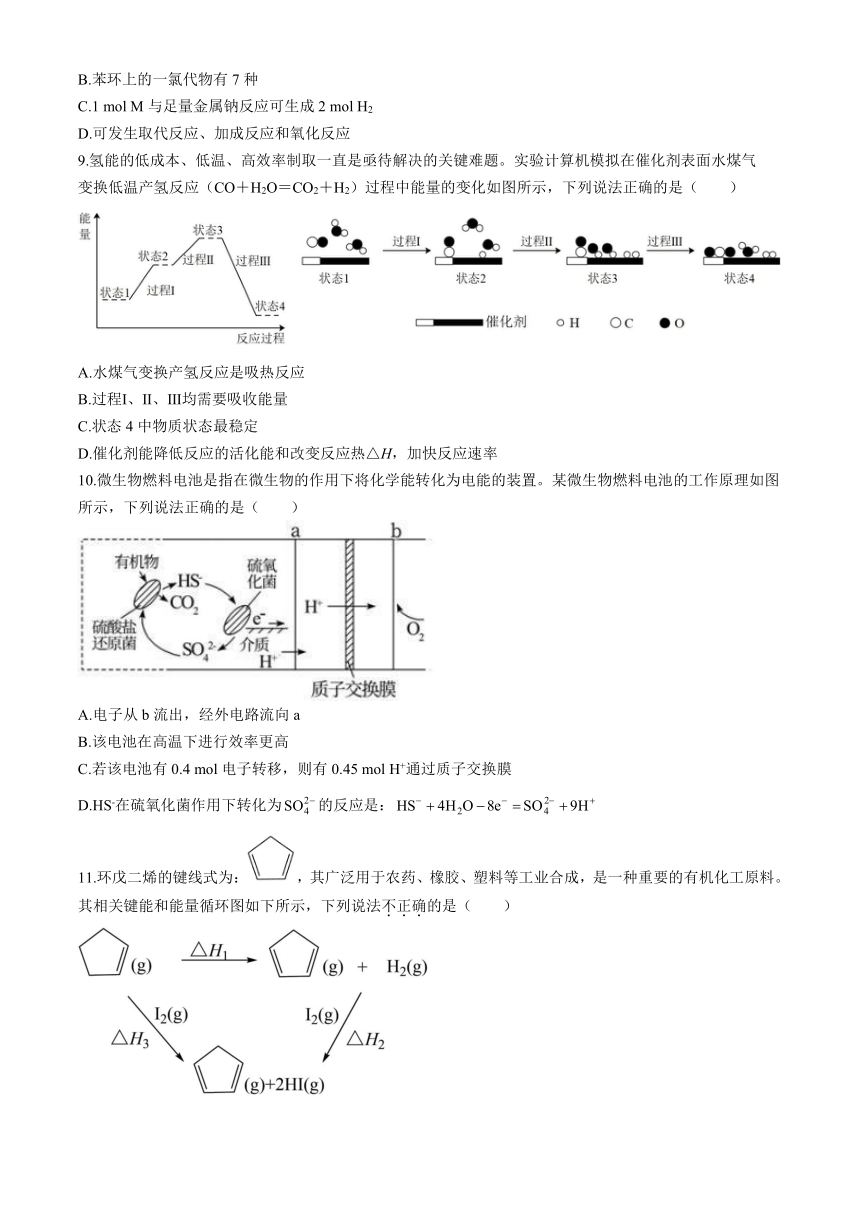
8.有机物M的结构简式如图。下列有关M的说法错误的是( )
A.分子式为C15H14O3
B.苯环上的一氯代物有7种
C.1 mol M与足量金属钠反应可生成2 mol H2
D.可发生取代反应、加成反应和氧化反应
9.氢能的低成本、低温、高效率制取一直是亟待解决的关键难题。实验计算机模拟在催化剂表面水煤气
变换低温产氢反应(CO+H2O=CO2+H2)过程中能量的变化如图所示,下列说法正确的是( )
A.水煤气变换产氢反应是吸热反应
B.过程Ⅰ、Ⅱ、Ⅲ均需要吸收能量
C.状态4中物质状态最稳定
D.催化剂能降低反应的活化能和改变反应热△H,加快反应速率
10.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是( )
A.电子从b流出,经外电路流向a
B.该电池在高温下进行效率更高
C.若该电池有0.4 mol电子转移,则有0.45 mol H+通过质子交换膜
D.HS-在硫氧化菌作用下转化为的反应是:
11.环戊二烯的键线式为:,其广泛用于农药、橡胶、塑料等工业合成,是一种重要的有机化工原料。其相关键能和能量循环图如下所示,下列说法不正确的是( )
共价键 键能 /(kJ·mol-1)
H-H 436
H-I 299
I-I 151
A.kJ/mol
B.在相同条件下,反应:,则
C.实验测得在25 ℃和101 KPa时,1 g氢气完全燃烧生成液态水放出142.9 KJ的热量,氢气燃烧热方程式为:
D.(g)转化为(g)的过程属于氧化反应
12.在一定温度下,在体积为2 L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( )
A.反应的化学方程式为2X=3Y+Z
B.若t=4,则0~t的X的化学反应速率为0.1mol·L-1·min-1
C.t时,正、逆反应都不再继续进行,反应达到化学平衡
D.温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都加快
13.某溶液可能含有Cl-、、、、Al3+、Cu2+、Fe3+和K+中的若干种。为检验其中含有的离子,进行如下实验:取该溶液10mL,加入过量的氢氧化钡溶液并加热,产生使湿润的红色石蕊试纸变蓝色的气体,同时产生白色沉淀,过滤;向上述滤液中通入足量CO2气体,产生白色沉淀。下列关于原溶液的说法正确的是( )
A.Al3+、一定存在,Cl-可能不存在 B.至少存在4种离子
C.、至少含有一种 D.Al3+、Cu2+、Fe3+一定不存在,K+可能存在
14.向100 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是( )
A.产生H2的体积为2.24 L
B.m2=8.4
C.所用混合溶液中
D.AB段发生的反应为置换反应
二、填空题(本大题共4小题,共58分)
15.(每空2分,共16分)硝酸是重要的化工原料。如图是以合成氨为基础的传统硝酸生产工艺流程(其中空气等基础原料已略去)。
(1)关于合成氨工艺,下列说法正确的是__________(填序号)。
a.合成氨是一种重要的人工固氮方法
b.该反应过程中氮元素被氧化
c.合成的氨气还可以用于化肥工业
d.在工业生产中该反应采用更高的温度、更高的高压等条件能提高综合效益
(2)氨催化氧化装置中,产生的含氮物质主要为NO,反应的化学方程式为_______________________。
(3)吸收装置中,发生的反应为,若用Va L xmol·L-1稀硝酸作为吸收液,反应后得到Vb L ymol·L-1的浓硝酸,则理论上吸收装置中需消耗的O2的物质的量为___________mol(写出计算式)。
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示:
若催化剂表面参与反应的NO和NO2物质的量之比为1∶1,则总反应的化学方程式为________________。
(5)采用酸化处理的NaClO溶液液相氧化法脱除烟气中的NOx是目前常见方法,其主要过程如下:
Ⅰ.
Ⅱ.
研究不同温度下对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是___________________________________________________。
(6)还原吸收法
方法1:直接使用尿素[CO(NH2)2]溶液吸收烟气中的NOx。
方法2:先用合适的氧化剂将NOx中的NO氧化为NO2,再用CO(NH2)2溶液还原吸收。还原吸收等量的NOx,消耗尿素较少的是_____________(填“方法1”或“方法2”)。工业上选择方法2处理NOx的原因是_______________________________________。
(7)据报道,意大利科学家获得了极具研究价值的N4,其分子结构如图所示。
已知:Ⅰ.断裂1 mol N-N键吸收167 KJ热量,形成1 mol N≡N键放出942 KJ热量
Ⅱ.
写出N4(g)和H2反应合成NH3的热化学方程式_______________________________________________。
16.(每空2分,共14分)某同学设计了如下装置用于制取SO2和验证SO2的漂白性、酸性、还原性。
回答下列问题:
(1)装置A中发生反应的化学方程式为__________________________________________________。
(2)在框图内选择合适装置依次验证SO2的漂白性、酸性、还原性,上述各装置按气流从左到右方向连接顺序为A→______________________________________________(填装置字母,还原性设计两个装置)。
(3)装置D中发生反应的离子方程式为_____________________________________________。
(4)装置A中①的作用是_____________________________________。
(5)已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,装置F中产生了白色沉淀,其成分是___________(填化学式),分析F中产生白色沉淀的原因____________________________________________。
(6)装置A中的反应物Na2SO3可能部分被氧化,现需测定Na2SO3的纯度:称取10.00 g Na2SO3样品,配成100 mL溶液;移取25.00 mL溶液,用0.10 mol·L-1酸性KMnO4溶液慢慢滴加,加到KMnO4溶液20.00mL时,紫色恰好不再消失(被还原成Mn2+)样品中Na2SO3的质量分数为__________________。
17.(每空2分,共14分)
(1)向某体积固定的密闭容器中加入0.3 mol A、0.1 mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
①若t1=15,则t0~t1内反应速率v(C)=_________________,A的转化率为_________________;
②写出反应的化学方程式:__________________________,B最初的的物质的量为_________________;
(2)工业上可以通过CO2(g)与H2(g)反应制备CH3OH(g): 。在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是____。
A.反应中CO2与CH3OH的物质的量之比为1∶1
B.
C.混合气体的压强不随时间的变化而变化
D.混合气体的密度不再改变
(3)燃料电池是一种高效、环境友好的供电装置,如图乙为CH3OH燃料电池的工作原理示意图,a、b均为惰性电极。
①使用时,空气从口通入______(填“A”或“B”);
②a极的电极反应为:____________________________________。
18.(每空2分,共14分)以淀粉和油脂为原料,制备生活中某些物质。
已知:醛基易在氧气中被催化氧化为羧基:反应⑤生成D、E、F的物质的量之比为2∶1∶1,E与等物质的量H2反应生成D,D只含有一个甲基。请回答:
(1)F的名称___________________C分子中官能团的名称为___________________
(2)A反应生成B的反应方程式______________________________________,反应类型_____________
(3)写出N的一种结构简式:___________________。
(4)下列说法正确的是___________________。
A.此油脂甲能用于萃取溴水中的溴单质
B.上述①~⑥中属于取代反应的为③⑤⑥
C.C、D属同系物,M、N也属同系物
D.A、B、E含有不同的官能团,但都能使酸性高锰酸钾溶液褪色
(5)写出反应③(A+D→M)的化学方程式:______________________________________。
参考答案
一、选择题(每小题3分)
1 2 3 4 5 6 7
C B C A B D A
8 9 10 11 12 13 14
C C D A B A B
二、填空题(本大题共4小题,共58分)
15.(每空2分,共16分)
(1)ac (2) (3)
(4)
(5)HClO受热分解,溶液中c(HClO)减小
(6)方法1 NO2在水中溶解性好,与尿素溶液反应速率快,NO2的氧化性强于NO
(7)
16.(每空2分,共14分)
(1)
(2)C→E→D→F→B
(3);
(4)平衡压强,使液体顺利流下
(5)BaSO4 在酸性条件下SO2与反应生成
(6)25.2%
17.(每空2分,共14分)
(1)①0.004mol·L-1·s-1 60% ② 0.04 mol
(2)BC (3)①B
18.(每空2分,共14分)
(1)甘油(丙三醇) 羧基; (2) 氧化反应
(3)或 (4)BD
(5)
化学
考试时间:75分钟
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Fe-56
一、单选题(本大题共14小题,共42分,每小题只有一个选项符合题意。)
1.从石器时代到青铜器时代,再到铁器时代,金属的冶炼体现了人类文明的发展历程和水平。下列关于金属冶炼的说法正确的是( )
A.制钠:高温分解NaCl制备Na
B.炼铁:用焦炭和空气反应产生的CO2在高温下还原铁矿石中铁的氧化物
C.制铜:“曾青(CuSO4)得铁,则化为铜”《淮南子》的过程发生置换反应
D.制铝:将Al(OH)3溶于盐酸中,电解所得AlCl3溶液
2.化学与人类生活、生产和社会可持续发展密切相关,下列有关说法正确的是( )
A.有“OTC”标志的是处方药,需要凭医生处方才能购买
B.山梨酸钾是常用的食品防腐剂、抗坏血酸是常用的食品抗氧化剂
C.中国天眼FAST用到的高性能碳化硅是一种新型的有机高分子材料
D.绿色化学的核心思想是“先污染后治理”,其设计遵循原子经济性和高选择性等原则
3.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.1.6g CH4电子总数为0.8 NA
B.常温下,2mol丙烷中含有共价键的数目为16 NA
C.标准状况下6.72 L Cl2通入足量水中被完全吸收,转移电子数目小于0.3 NA
D.在密闭容器中,使1 mol N2和3 mol H2充分反应,生成NH3的分子数为2 NA
4.下图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示。下列选项中正确的是( )
选项 发生装置中的药品 干燥和集气装置
A 氧化钙和浓氨水 图1
B 大理石和稀盐酸 图1
C 铜和稀硝酸 图2
D 锌和稀硫酸 图2
5.下列关于有机化合物的说法正确的是( )
A.油脂和蛋白质都属于天然高分子化合物,且在一定条件下都能水解
B.煤的干馏、煤的气化及液化都是化学变化,石油的分馏是物理变化
C.乙烯使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的反应原理相同
D.一般选用饱和氢氧化钠溶液除去乙酸乙酯中的乙酸
6.在催化剂CuMn2O4表面的NH3选择性催化还原NO的反应机理如下图所示(如)NH3吸附在催化剂表面可表示为*NH3,Ea表示活化能)。
下列有关说法正确的是( )
A.该反应温度越高,反应速率越快
B.NH3比NO更易被催化剂CuMn2O4吸附
C.反应过程中有非极性键的断裂与极性键的形成
D.决定总反应速率的基元反应可表示为:*NH3→*NH2+H
7.下列装置或操作能达到实验目的的是( )
A.探究铁与水蒸气的反应,点燃肥皂泡检验氢气 B.探究CH4与Cl2的取代反应 C.配制银氨溶液 D.探究浓度对化学反应速率的影响
8.有机物M的结构简式如图。下列有关M的说法错误的是( )
A.分子式为C15H14O3
B.苯环上的一氯代物有7种
C.1 mol M与足量金属钠反应可生成2 mol H2
D.可发生取代反应、加成反应和氧化反应
9.氢能的低成本、低温、高效率制取一直是亟待解决的关键难题。实验计算机模拟在催化剂表面水煤气
变换低温产氢反应(CO+H2O=CO2+H2)过程中能量的变化如图所示,下列说法正确的是( )
A.水煤气变换产氢反应是吸热反应
B.过程Ⅰ、Ⅱ、Ⅲ均需要吸收能量
C.状态4中物质状态最稳定
D.催化剂能降低反应的活化能和改变反应热△H,加快反应速率
10.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是( )
A.电子从b流出,经外电路流向a
B.该电池在高温下进行效率更高
C.若该电池有0.4 mol电子转移,则有0.45 mol H+通过质子交换膜
D.HS-在硫氧化菌作用下转化为的反应是:
11.环戊二烯的键线式为:,其广泛用于农药、橡胶、塑料等工业合成,是一种重要的有机化工原料。其相关键能和能量循环图如下所示,下列说法不正确的是( )
共价键 键能 /(kJ·mol-1)
H-H 436
H-I 299
I-I 151
A.kJ/mol
B.在相同条件下,反应:,则
C.实验测得在25 ℃和101 KPa时,1 g氢气完全燃烧生成液态水放出142.9 KJ的热量,氢气燃烧热方程式为:
D.(g)转化为(g)的过程属于氧化反应
12.在一定温度下,在体积为2 L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( )
A.反应的化学方程式为2X=3Y+Z
B.若t=4,则0~t的X的化学反应速率为0.1mol·L-1·min-1
C.t时,正、逆反应都不再继续进行,反应达到化学平衡
D.温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都加快
13.某溶液可能含有Cl-、、、、Al3+、Cu2+、Fe3+和K+中的若干种。为检验其中含有的离子,进行如下实验:取该溶液10mL,加入过量的氢氧化钡溶液并加热,产生使湿润的红色石蕊试纸变蓝色的气体,同时产生白色沉淀,过滤;向上述滤液中通入足量CO2气体,产生白色沉淀。下列关于原溶液的说法正确的是( )
A.Al3+、一定存在,Cl-可能不存在 B.至少存在4种离子
C.、至少含有一种 D.Al3+、Cu2+、Fe3+一定不存在,K+可能存在
14.向100 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是( )
A.产生H2的体积为2.24 L
B.m2=8.4
C.所用混合溶液中
D.AB段发生的反应为置换反应
二、填空题(本大题共4小题,共58分)
15.(每空2分,共16分)硝酸是重要的化工原料。如图是以合成氨为基础的传统硝酸生产工艺流程(其中空气等基础原料已略去)。
(1)关于合成氨工艺,下列说法正确的是__________(填序号)。
a.合成氨是一种重要的人工固氮方法
b.该反应过程中氮元素被氧化
c.合成的氨气还可以用于化肥工业
d.在工业生产中该反应采用更高的温度、更高的高压等条件能提高综合效益
(2)氨催化氧化装置中,产生的含氮物质主要为NO,反应的化学方程式为_______________________。
(3)吸收装置中,发生的反应为,若用Va L xmol·L-1稀硝酸作为吸收液,反应后得到Vb L ymol·L-1的浓硝酸,则理论上吸收装置中需消耗的O2的物质的量为___________mol(写出计算式)。
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示:
若催化剂表面参与反应的NO和NO2物质的量之比为1∶1,则总反应的化学方程式为________________。
(5)采用酸化处理的NaClO溶液液相氧化法脱除烟气中的NOx是目前常见方法,其主要过程如下:
Ⅰ.
Ⅱ.
研究不同温度下对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是___________________________________________________。
(6)还原吸收法
方法1:直接使用尿素[CO(NH2)2]溶液吸收烟气中的NOx。
方法2:先用合适的氧化剂将NOx中的NO氧化为NO2,再用CO(NH2)2溶液还原吸收。还原吸收等量的NOx,消耗尿素较少的是_____________(填“方法1”或“方法2”)。工业上选择方法2处理NOx的原因是_______________________________________。
(7)据报道,意大利科学家获得了极具研究价值的N4,其分子结构如图所示。
已知:Ⅰ.断裂1 mol N-N键吸收167 KJ热量,形成1 mol N≡N键放出942 KJ热量
Ⅱ.
写出N4(g)和H2反应合成NH3的热化学方程式_______________________________________________。
16.(每空2分,共14分)某同学设计了如下装置用于制取SO2和验证SO2的漂白性、酸性、还原性。
回答下列问题:
(1)装置A中发生反应的化学方程式为__________________________________________________。
(2)在框图内选择合适装置依次验证SO2的漂白性、酸性、还原性,上述各装置按气流从左到右方向连接顺序为A→______________________________________________(填装置字母,还原性设计两个装置)。
(3)装置D中发生反应的离子方程式为_____________________________________________。
(4)装置A中①的作用是_____________________________________。
(5)已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,装置F中产生了白色沉淀,其成分是___________(填化学式),分析F中产生白色沉淀的原因____________________________________________。
(6)装置A中的反应物Na2SO3可能部分被氧化,现需测定Na2SO3的纯度:称取10.00 g Na2SO3样品,配成100 mL溶液;移取25.00 mL溶液,用0.10 mol·L-1酸性KMnO4溶液慢慢滴加,加到KMnO4溶液20.00mL时,紫色恰好不再消失(被还原成Mn2+)样品中Na2SO3的质量分数为__________________。
17.(每空2分,共14分)
(1)向某体积固定的密闭容器中加入0.3 mol A、0.1 mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
①若t1=15,则t0~t1内反应速率v(C)=_________________,A的转化率为_________________;
②写出反应的化学方程式:__________________________,B最初的的物质的量为_________________;
(2)工业上可以通过CO2(g)与H2(g)反应制备CH3OH(g): 。在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是____。
A.反应中CO2与CH3OH的物质的量之比为1∶1
B.
C.混合气体的压强不随时间的变化而变化
D.混合气体的密度不再改变
(3)燃料电池是一种高效、环境友好的供电装置,如图乙为CH3OH燃料电池的工作原理示意图,a、b均为惰性电极。
①使用时,空气从口通入______(填“A”或“B”);
②a极的电极反应为:____________________________________。
18.(每空2分,共14分)以淀粉和油脂为原料,制备生活中某些物质。
已知:醛基易在氧气中被催化氧化为羧基:反应⑤生成D、E、F的物质的量之比为2∶1∶1,E与等物质的量H2反应生成D,D只含有一个甲基。请回答:
(1)F的名称___________________C分子中官能团的名称为___________________
(2)A反应生成B的反应方程式______________________________________,反应类型_____________
(3)写出N的一种结构简式:___________________。
(4)下列说法正确的是___________________。
A.此油脂甲能用于萃取溴水中的溴单质
B.上述①~⑥中属于取代反应的为③⑤⑥
C.C、D属同系物,M、N也属同系物
D.A、B、E含有不同的官能团,但都能使酸性高锰酸钾溶液褪色
(5)写出反应③(A+D→M)的化学方程式:______________________________________。
参考答案
一、选择题(每小题3分)
1 2 3 4 5 6 7
C B C A B D A
8 9 10 11 12 13 14
C C D A B A B
二、填空题(本大题共4小题,共58分)
15.(每空2分,共16分)
(1)ac (2) (3)
(4)
(5)HClO受热分解,溶液中c(HClO)减小
(6)方法1 NO2在水中溶解性好,与尿素溶液反应速率快,NO2的氧化性强于NO
(7)
16.(每空2分,共14分)
(1)
(2)C→E→D→F→B
(3);
(4)平衡压强,使液体顺利流下
(5)BaSO4 在酸性条件下SO2与反应生成
(6)25.2%
17.(每空2分,共14分)
(1)①0.004mol·L-1·s-1 60% ② 0.04 mol
(2)BC (3)①B
18.(每空2分,共14分)
(1)甘油(丙三醇) 羧基; (2) 氧化反应
(3)或 (4)BD
(5)
同课章节目录
