期末模拟预测卷(试题)2023-2024学年高一化学下学期人教版2019必修第二册(含解析)
文档属性
| 名称 | 期末模拟预测卷(试题)2023-2024学年高一化学下学期人教版2019必修第二册(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-04 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
期末模拟预测卷(试题)2023-2024学年高一化学下学期人教版2019必修第二册
一、单项选择题:本题共13小题,每小题3分,共39分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.我国提出争取在2030年前实现碳达峰、2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。下列做法不应该提倡的是
A.使用一次性餐具 B.发展捕集技术
C.开发新能源 D.开发清洁燃烧技术
2.化学与人的健康、生活密不可分,下列说法正确的是
A.长期食用加碘食盐,会造成人体中毒
B.挂在墙上的油田——“碲化镉发电玻璃”能将光能转化为电能
C.纳米铁粉主要通过物理吸附作用除去污水中的、、
D.新型水处理剂高铁酸钠(),其工作原理与明矾净水原理完全相同
3.下列有关石油和煤的利用叙述不正确的是
A.煤的干馏就是将煤隔绝空气在高温条件下使之分解,得到焦炭、煤焦油等物质的过程
B.煤的液化就是将煤转化成甲醇、乙醇等液态物质的过程
C.煤的气化就是将煤在高温条件下由固态转化为气态的物理变化过程
D.石油通过催化裂化,可以提高汽油的质量和产量
4.下列物质的名称与化学式对应关系正确的是
A.乙炔: B.金刚砂: C.胆矾: D.石英:
5.下列关于硝态氮肥和铵态氮肥的比较错误的是
A.都易溶于水 B.受热都容易分解
C.都不能和碱性物质混运共施 D.土壤胶粒对的吸附效果更好
6.某同学利用如图所示装置(夹持装置已省略)在通风橱内进行铜与稀硝酸反应的探究实验,下列说法错误的是
A.注射器A中的稀硝酸与NaHCO3反应体现了硝酸的酸性
B.当观察到澄清石灰水变浑浊后关闭止水夹1、2,将铜丝伸入稀硝酸中,观察到铜丝溶解,有无色气体产生
C.铜与稀硝酸反应后,将注射器B中的空气注入具支试管,试管内气体会变成红棕色
D.澄清石灰水可吸收挥发出来的NO,同时防止外界空气进入具支试管中干扰实验
7.氮化铝(AlN)陶瓷具有耐腐蚀、耐高温的优点,一种制备氮化铝的方法为将氧化铝高能球磨至纳米级,然后与炭粉混合后通入氮气,发生反应:Al2O3+3C+N22AlN+3CO。设NA为阿伏加德罗常数的值,下列说法错误的是
A.AlN为新型无机非金属材料
B.反应中每生成4.1gAlN,转移电子数为0.6NA
C.上述反应属于固氮反应
D.纳米级Al2O3粉末分散在空气中能形成气溶胶
8.在密闭容器中进行度应,下列是在不同条件下测得的反应速率,其中反应速率最快的是
A. B.
C. D.
9.某实验小组用5%的溶液、粉末和蒸馏水探究外界条件对双氧水分解反应速率的影响,实验记录如下表。
实验序号 温度/℃ 5% 溶液体积/mL 粉末质量/g 体积/mL 收集150mL 所需的时间/s
Ⅰ 20 50 无 0 几乎无气体产生
Ⅱ 20 50 0.5 0 45
Ⅲ 20 25 0.5 a 85
Ⅳ 60 50 0.5 0
下列说法不正确的是
A.对比实验Ⅰ、Ⅱ可知,催化剂可加快反应速率
B.研究浓度对该反应速率的影响,a=25
C.实验Ⅰ、Ⅳ研究温度对双氧水分解反应速率的影响
D.结合表中数据,推测
10.下列原因分析能正确解释递变规律的是
选项 递变规律 原因分析
A 酸性: 非金属性:
B 离子半径: 电子层结构相同时,核电荷数:
C 与水反应的剧烈程度: 最外层电子数:
D 稳定性: 断键吸收的能量:
A.A B.B C.C D.D
11.理论研究表明,在101 kPa和298 K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是
A.一分子HCN中的总键能比一分子HNC的总键能大
B.该异构化反应的ΔH=+59.3 kJ·mol-1
C.HCN的能量小于HNC的能量
D.使用催化剂,可以改变该反应的ΔH
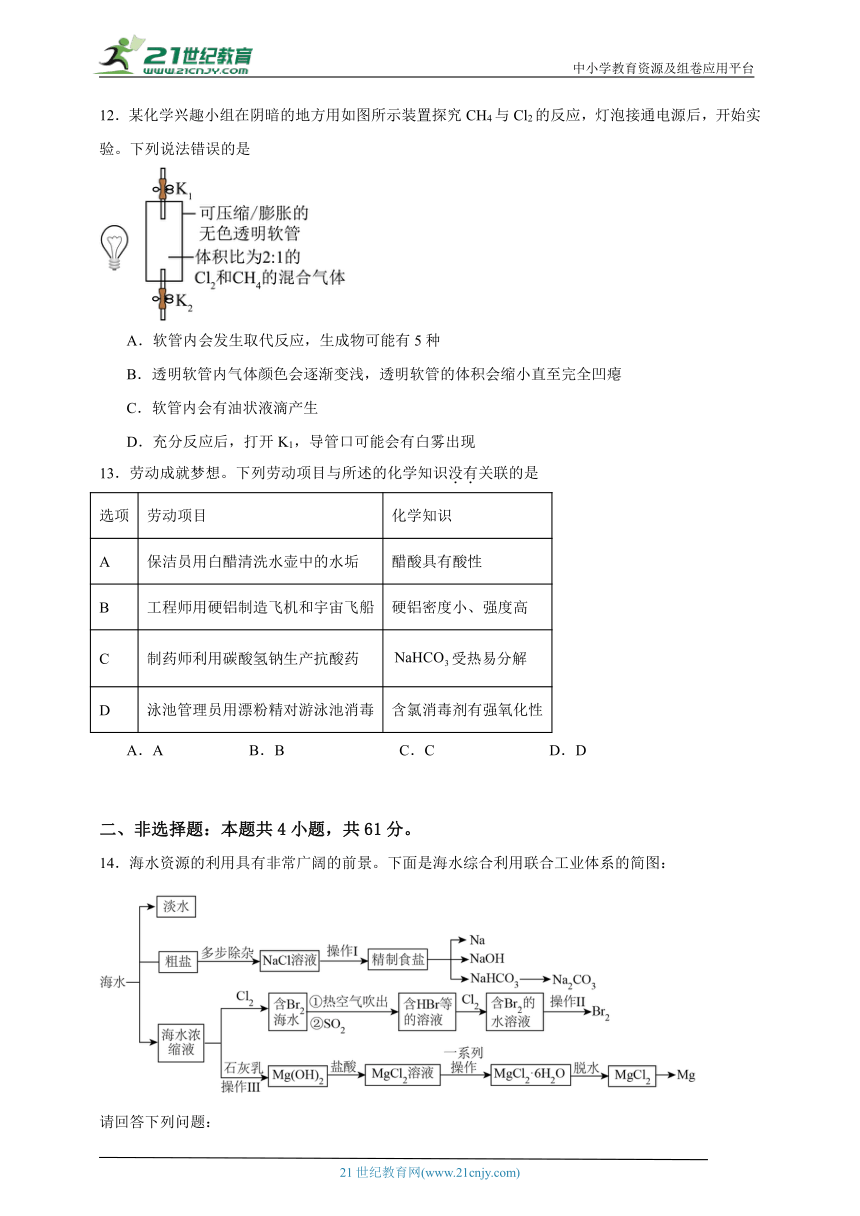
12.某化学兴趣小组在阴暗的地方用如图所示装置探究CH4与Cl2的反应,灯泡接通电源后,开始实验。下列说法错误的是
A.软管内会发生取代反应,生成物可能有5种
B.透明软管内气体颜色会逐渐变浅,透明软管的体积会缩小直至完全凹瘪
C.软管内会有油状液滴产生
D.充分反应后,打开K1,导管口可能会有白雾出现
13.劳动成就梦想。下列劳动项目与所述的化学知识没有关联的是
选项 劳动项目 化学知识
A 保洁员用白醋清洗水壶中的水垢 醋酸具有酸性
B 工程师用硬铝制造飞机和宇宙飞船 硬铝密度小、强度高
C 制药师利用碳酸氢钠生产抗酸药 受热易分解
D 泳池管理员用漂粉精对游泳池消毒 含氯消毒剂有强氧化性
A.A B.B C.C D.D
二、非选择题:本题共4小题,共61分。
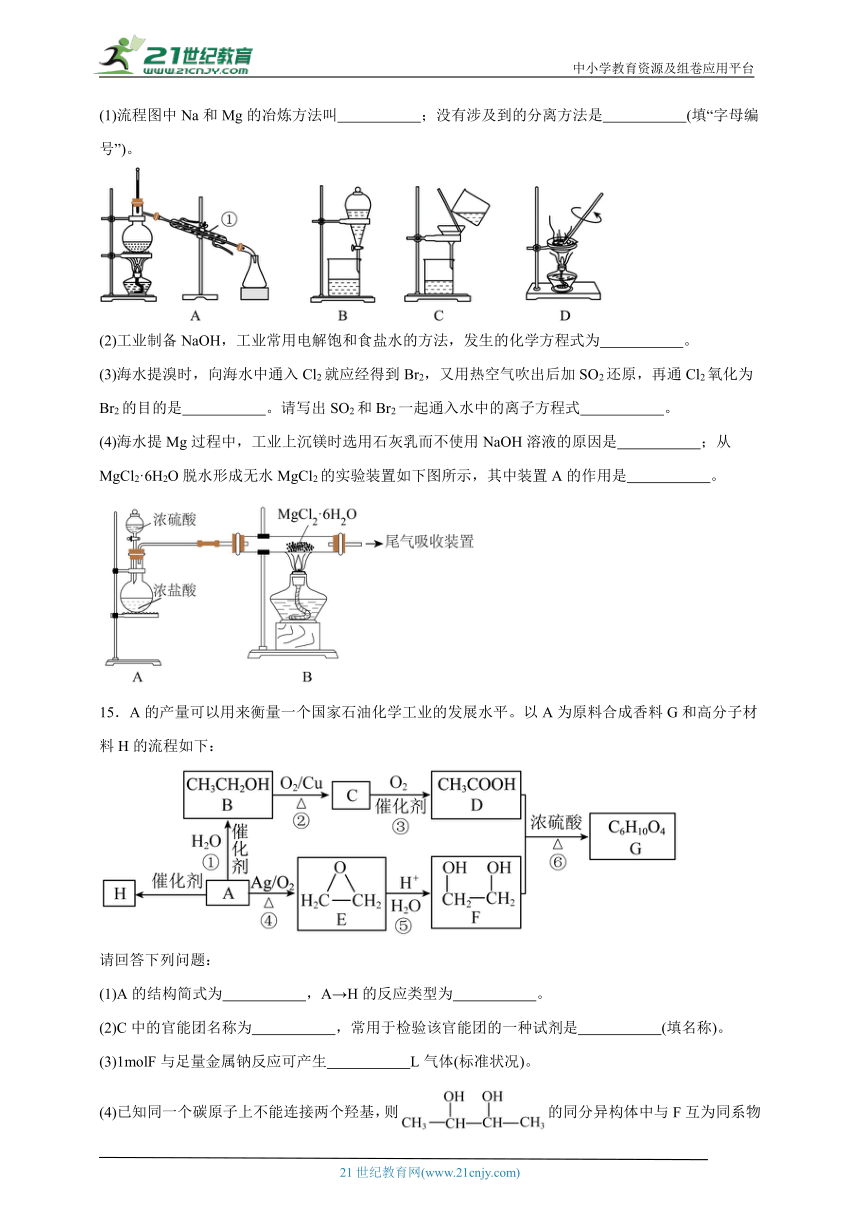
14.海水资源的利用具有非常广阔的前景。下面是海水综合利用联合工业体系的简图:
请回答下列问题:
(1)流程图中Na和Mg的冶炼方法叫 ;没有涉及到的分离方法是 (填“字母编号”)。
(2)工业制备NaOH,工业常用电解饱和食盐水的方法,发生的化学方程式为 。
(3)海水提溴时,向海水中通入Cl2就应经得到Br2,又用热空气吹出后加SO2还原,再通Cl2氧化为Br2的目的是 。请写出SO2和Br2一起通入水中的离子方程式 。
(4)海水提Mg过程中,工业上沉镁时选用石灰乳而不使用NaOH溶液的原因是 ;从MgCl2·6H2O脱水形成无水MgCl2的实验装置如下图所示,其中装置A的作用是 。
15.A的产量可以用来衡量一个国家石油化学工业的发展水平。以A为原料合成香料G和高分子材料H的流程如下:
请回答下列问题:
(1)A的结构简式为 ,A→H的反应类型为 。
(2)C中的官能团名称为 ,常用于检验该官能团的一种试剂是 (填名称)。
(3)1molF与足量金属钠反应可产生 L气体(标准状况)。
(4)已知同一个碳原子上不能连接两个羟基,则的同分异构体中与F互为同系物的有 种。(不考虑立体异构)
(5)写出反应⑥的化学方程式 。
(6)有关上述物质的说法错误的是 。
a.可通过酸性高锰酸钾溶液洗气的方法除去乙烷中含有的A杂质
b.B可以与酸性重铬酸钾溶液反应生成D
c.反应②中B断裂了C-H键和O-H键
d.C和E互为同分异构体
e.H可以使溴水褪色
16.探究原电池中的能量转化。图中注射器用来收集气体并读取气体体积(在标准状况下),记录实验数据如表。
实验数据时间/min ① ②
气体体积/mL 溶液温度/℃ 气体体积/mL 溶液温度/℃
0 0 22.0 0 22.0
6 33.6 24.8 56 23.8
10 56 26.0 — —
(1)判断两装置中反应的快慢① ②(填“>”、“=”或“<”),6至10min内①中产生氢气的平均速率是 。
(2)装置①中的反应是放热反应,实验证据是 ;该反应的能量变化可用图中的 (填“a”或“b”)表示。
(3)有明显的气泡冒出现象的金属是 (填“a”、“b”、“c”、“d”),当都生成56ml气体时,装置中释放的总能量① ②(填“>”、“=”或“<”),请对两装置温度变化不同进行解释 。
17.以为载体的银催化剂是工业上氧化乙烯常用的催化剂,其中Ag质量占催化剂质量的10%~40%。从某废银催化剂(主要成分为Ag、、等)中回收银的工艺流程如图1。
已知;不溶于硝酸。
(1)“酸浸”时通常会适当搅拌,搅拌的目的是 。
(2)“滤渣”的主要成分为 (写化学式)。
(3)“酸浸”过程中生成NO的离子方程式为 ;NO易与空气中的反应转化为,该转化过程发生反应的化学方程式为 。
(4)“沉银”时发生反应的离子方程式为 ;“转化”过程中Fe粉作 (填“氧化”或“还原”)剂。
(5)工业上,在空气中用5%稀硝酸连续吸收加碱液吸收,并不断搅拌,基本可实现将废气中的完全吸收,其工艺流程如图2。
当时,“吸收(1)”中发生反应的化学方程式为 ,“吸收(4)”所得钠盐的成分为 (任写一种,填化学式)。
参考答案:
1.A
【详解】A. 使用一次性餐具,导致环境的污染及资源的浪费,故A错误;
B. 发展捕集技术,减少大气中的,减少了温室效应,利于改善环境,故B正确;
C. 开发新能源替代传统能源,实现可持续的绿色发展,故C正确;
D. 开发清洁燃烧技术,减少污染性气体的排放,利于环保,故D正确。
答案为:A。
2.B
【详解】A.加碘食盐中没有单质碘,不会造成人体中毒,A错误;
B.“碲化镉发电玻璃”能将光能转化为电能,B正确;
C.纳米铁粉主要通过化学反应除去污水中的、、,C错误;
D.型水处理剂高铁酸钠()的工作原理是利用其强氧化性,明矾净水的原理是利用Al3+水解生成的氢氧化铝胶体吸附水中的悬浮物,D错误;
故选B。
3.C
【详解】A.煤的干馏是将煤隔绝空气加强热使之分解的过程,煤的干馏产品主要有焦炭、煤焦油、焦炉气等,A正确;
B.煤的液化是将煤转化为液体燃料(如甲醇等)的过程,B正确;
C.煤的气化是将煤转化为气体燃料(如CO、H2)的过程,为化学变化,C错误;
D.石油的催化裂化是将相对分子质量大、沸点高的烃断裂为相对分子质量小、沸点低的烃的过程,从而获得轻质油,D正确;
故选C。
4.D
【详解】A.乙炔的化学式为C2H2,A错误;
B.金刚砂即碳化硅,化学式为SiC,B错误;
C.胆矾化学式为CuSO4 5H2O,C错误;
D.石英主要成分SiO2,化学式为SiO2,D正确;
故选D。
5.C
【分析】硝态氮肥通常为硝酸盐,主要包括硝酸钠、硝酸钙、硝酸铵等;铵态氮肥通常为铵盐,包括硫酸铵、碳酸氢铵、氯化铵等等;
【详解】A.硝态氮肥和铵态氮肥都易溶于水,A正确;
B. 硝酸及硝酸盐、氨水及铵盐都具有热不稳定性,受热都容易分解,B正确;
C. 铵盐和碱性物质反应、不能和碱性物质混运共施,硝酸钠硝酸钙等硝酸盐不与碱性物质反应,C不正确;
D. 土壤胶粒带负电荷,则土壤胶粒对的吸附效果更好,D正确;
答案选C。
6.D
【分析】先打开止水夹1、2,将注射器A中的稀硝酸注入,与NaHCO3反应生成二氧化碳,排尽装置内空气,当观察到澄清石灰水变浑浊,说明装置内空气被排尽了,然后关闭止水夹1、2,将铜丝伸入稀硝酸中,进行铜与稀硝酸的反应,有无色气体NO产生,再注射器B的空气注入具支试管中,观察气体颜色变化,据此分析解答。
【详解】A.注射器A中的稀硝酸与NaHCO3反应生成硝酸钠、水和二氧化碳,发生的是复分解反应,体现了硝酸的酸性,故A正确;
B.当观察到澄清石灰水变浑浊,说明装置内空气被排尽了,然后关闭止水夹1、2,铜与稀硝酸反应生成NO,故将铜丝伸入稀硝酸中,观察到铜丝溶解,有无色气体产生,故B正确;
C.铜与稀硝酸反应后,将注射器B中的空气注入具支试管,发生反应,故试管内气体会变成红棕色,故C正确;
D.NO难溶于水,也不碱溶液反应,澄清石灰水不能吸收挥发出来的NO,故D错误;
故选D。
7.B
【分析】
该反应的双线桥为:
【详解】A.氮化铝陶瓷是新型陶瓷,属于新型无机非金属材料,A正确;
B.根据双线桥可知:生成2molAlN时,转移6mole-,4.1gAlN()参加反应转移电子数应为0.3NA,B错误;
C.固氮指的是将游离态的氮转化为化合态的氮,C正确;
D.纳米级Al2O3粉末分散在空气中,分散质粒子直径在纳米级,属于胶体,分散剂是空气,所以形成的是气溶胶,D正确;
故选B。
8.C
【分析】不同物质表示的速率之比等于化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示出的反应速率越快,注意保持单位一致,据此判断。
【详解】A.;
B.;
C.;
D.;
故反应速率最快的选项C;
故答案选C。
9.C
【详解】A.实验Ⅰ和Ⅱ在相同温度下,相同浓度的,在有和无的条件下反应,所以对比实验Ⅰ、Ⅱ可知,催化剂可加快反应速率,A正确;
B.在相同温度和都加入催化剂的条件下,实验Ⅱ和ⅡI可以研究浓度对该反应速率的影响,溶液的总体积相同,所以a=25,B正确;
C.实验Ⅰ、Ⅳ中,温度不同,Ⅰ中没有催化剂,Ⅳ加了催化剂,有2个变量,不能研究温度对双氧水分解反应速率的影响,C错误;
D.结合表中数据,对比实验Ⅱ和Ⅳ,Ⅳ的温度高于Ⅱ,所以反应速率较快,可以推测,D正确;
故选C。
10.B
【详解】A.通过比较最高价氧化物对应水化物的酸性比较非金属性,S的最高价氧化物对应水化物为H2SO4,A错误;
B.具有相同电子层结构的阳离子核电荷数大于阴离子核电荷数,具有相同电子层的阴离子核电荷数,所带电荷数越多,核电荷数越小,根据离子半径:,可得电子层结构相同时,核电荷数:Ca>Cl>S,B正确;
C.与水反应的剧烈程度:,金属性,元素的非金属性和最外层电子数没有必然联系,C错误;
D.同主族元素从上往下非金属性在减弱,非金属性越强形成的共价键越稳定,断键时所需吸收的能量越高,稳定性:,因此断键吸收的能量:,D错误;
故答案选B。
11.D
【详解】A.根据图中信息得到HCN转化为HNC为吸热反应,1 mol HCN断键吸收的能量大于1 mol HNC成键放出的能量,故一分子HCN中的总键能比一分子HNC的总键能大,故A正确;
B.根据焓变等于生成物总能量减去反应物总能量可知该反应的ΔH=+59.3 kJ·mol-1,故B正确;
C.该反应为吸热反应,HCN的能量小于HNC的能量,故C正确;
D.使用催化剂,不改变反应物和生成物的能量,该反应的ΔH不变,D错误;
本题选D。
12.B
【详解】A.软管内会发生取代反应,生成物可能有5种,分别是一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷和氯化氢,故A正确;
B.透明软管内氯气消耗,气体颜色会逐渐变浅,透明软管的体积会缩小,但由于有氯化氢和一氯甲烷两种气体生成,所以不会完全凹瘪,故B错误;
C.软管内会发生取代反应,生成的二氯甲烷、三氯甲烷、四氯甲烷都是油状液体,故C正确;
D.充分反应后,打开K1,由于反应有氯化氢生成,所以导管口可能会有白雾出现,故D正确;
故答案为:B。
13.C
【详解】A.醋酸具有酸性,能与水垢中的碳酸盐等反应,使其转化为可溶性盐而除去,A正确;
B.硬铝密度小,强度高,可用于制造飞机和宇宙飞船,B正确;
C.碳酸氢钠能与盐酸反应从而消耗多余的胃酸,且其腐蚀性较小,故可用于生产抗酸药,C错误;
D.漂粉精中的次氯酸钙具有强氧化性,故可用其对游泳池进行消毒,D正确;
故答案选C。
14.(1) 电解法 B
(2)2NaCl+2H2O2NaOH+Cl2↑+H2↑
(3) 富集溴元素(或富集Br2或使Br2浓度增大等) SO2+Br2+2H2O=4H++2Br-+SO
(4) 制取石灰乳原料丰富且制备成本低,而NaOH制备成本高 制取所需的HCl(意思相近即可)
【分析】海水淡化后得到淡水、粗盐和海水浓缩液,粗盐多步除杂后,得到氯化钠溶液,得到精制食盐可以制得Na、NaOH、NaHCO3;海水浓缩液通入氯气,得到含有Br2的海水,利用热空气吹出生成的Br2,并用SO2、水吸收得到含有HBr等物质的溶液,再通入氯气氧化,蒸馏得到工业液溴;海水浓缩液中加入石灰乳得到Mg(OH)2沉淀,再用盐酸溶解生成MgCl2溶液,浓缩结晶得到MgCl2·6H2O,脱水得无水氯化镁,电解熔融氯化镁生成镁单质和氯气。
【详解】(1)Na和Mg的冶炼方法叫电解法;反应涉及分离方法为蒸馏、过滤、蒸发结晶,没有涉及到的分离方法是分液,故选B。·
(2)工业常用电解饱和食盐水的方法制备NaOH,发生的化学方程式为2NaCl+2H2O2NaOH+Cl2↑+H2↑。
(3)海水提溴时,向海水中通入Cl2就应经得到Br2,又用热空气吹出后加SO2还原,再通Cl2氧化为Br2的目的是富集溴元素(或富集Br2或使Br2浓度增大等)。SO2和Br2一起通入水中生成硫酸和溴化氢,离子方程式SO2+Br2+2H2O=4H++2Br-+SO。
(4)NaOH价格较贵且不易获得,海水提Mg过程中,工业上沉镁时选用石灰乳而不使用NaOH溶液的原因是制取石灰乳原料丰富且制备成本低,而NaOH制备成本高;从MgCl2·6H2O脱水形成无水MgCl2需要通入HCl,装置A的作用是制取所需的HCl(意思相近即可)。
15.(1) CH2=CH2 加聚反应
(2) 醛基 银氨溶液或新制氢氧化铜
(3)22.4
(4)5
(5)2CH3COOH+HOCH2CH2OHCH3COOCH2CH2OOCCH3+2H2O
(6)ae
【分析】有机物A的产量用来衡量一个国家石油化学工业的发展水平,A为乙烯,乙烯与水发生加成反应生成乙醇,乙醇催化氧化得到C为乙醛,乙醛氧化得到乙酸。乙烯经过催化氧化得到环氧乙烷,环氧乙烷与水反应得到乙二醇(HOCH2CH2OH),乙酸和乙二醇发生酯化反应得到G的结构简式为CH3COOCH2CH2OOCCH3,乙烯在催化剂作用下发生加聚反应得到H为聚乙烯。
【详解】(1)A的结构简式为CH2=CH2,根据分析,A→H的反应类型为加聚反应。
(2)C为乙醛,官能团名称为醛基,检验醛基常用银氨溶液或新制氢氧化铜。
(3)1molF含2mol羟基,与足量金属钠反应可产生1mol氢气,标况下体积为22.4L。
(4)
可以采用定一移一法,固定一个羟基的位置,移动另一个羟基,去除重复的即得答案。或者参照C4H10的二氯代物,用羟基代替氯原子,去除两个氯原子连在同一个碳上的情况。则的同分异构体中与F互为同系物的有CH2(OH) CH(OH) CH2CH3、CH2(OH) CH2 CH(OH) CH3、CH2(OH) CH2 CH2 CH2(OH)、、CH2(OH) CH(CH3) CH2(OH)共5种。
(5)乙酸和乙二醇发生酯化反应时酸脱羟基,醇脱羟基上的氢,生成酯和水,故方程式为2CH3COOH+HOCH2CH2OHCH3COOCH2CH2OOCCH3+2H2O。
(6)a.乙烯被高锰酸钾溶液氧化成二氧化碳引入新的杂质,应该用溴水,a错误;
b.乙醇可以被酸性重铬酸钾溶液氧化生成乙酸,b正确;
c.乙醇的催化氧化断裂C-H键和O-H键形成碳氧双键,c正确;
d.乙醛和环氧乙烷分子式相同,结构不同,是同分异构体,d正确;
e.聚乙烯中不含碳碳双键,不能使溴水褪色,e错误;
故答案选ae。
16.(1) <
(2) 溶液温度升高 a
(3) ad = 装置化学能转化为热能
【详解】(1)由表中数据可知,①中反应慢,6至10min,①中生成的平均速度,故答案为:<;。
(2)装置①中溶液温度升高,可知反应是放热反应;放热反应生成物的总能量低于反应物的总能量,该反应的能量变化可用图中的a表示,故答案为:溶液温度升高;a。
(3)①中Zn与稀接触发生化学反应,产生。②中形成原电池。Cu做正极,发生电极反应:,所以有明显的气泡冒出的是a、d,两装置发生的总反应相同,当生成相同体积气体时,释放的总能量相同。由于装置①化学能转化为热能,装置②中部分转化为电能,所以两装置温度变化不同,故答案为:ad;=;装置化学能转化为热能。
17.(1)提高“酸浸”速率
(2)、
(3)
(4) 还原
(5) (或)
【分析】用硝酸溶解废银催化剂,过滤得到的滤渣中含有不溶于水和硝酸的二氧化硅和α-氧化铝,同时产生NO废气,所得滤液中含有硝酸银和过量的稀硝酸,向滤液中加入氯化钠生成氯化银沉淀,将过滤得到的氯化银和Fe粉反应生成银,据此解答。
【详解】(1)“酸浸”时通常会适当搅拌,搅拌的目的是提高“酸浸”速率。
(2)由分析可知,“滤渣”的主要成分为、。
(3)“酸浸”过程中Ag和稀硝酸反应生成硝酸银、一氧化氮和水,根据得失电子守恒和电荷守恒配平离子方程式为:,NO易与空气中的反应转化为,该转化过程发生反应的化学方程式为。
(4)“沉银”时Cl-和Ag+结合生成AgCl沉淀,离子方程式为:,“转化”过程中Fe粉和AgCl沉淀反应生成Ag和FeCl2,Fe元素化合价上升,Fe粉作还原剂。
(5)当时,和稀硝酸溶液中的水反应生成硝酸和NO,化学方程式为:,“吸收(4)”过程中、和NaOH溶液反应生成和,发生化学方程式为:2NO2+ 2NaOH=NaNO3+ NaNO2+ H2O、NO+NO2+2NaOH=2NaNO2+H2O,所得钠盐的成分为(或)。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
期末模拟预测卷(试题)2023-2024学年高一化学下学期人教版2019必修第二册
一、单项选择题:本题共13小题,每小题3分,共39分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.我国提出争取在2030年前实现碳达峰、2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。下列做法不应该提倡的是
A.使用一次性餐具 B.发展捕集技术
C.开发新能源 D.开发清洁燃烧技术
2.化学与人的健康、生活密不可分,下列说法正确的是
A.长期食用加碘食盐,会造成人体中毒
B.挂在墙上的油田——“碲化镉发电玻璃”能将光能转化为电能
C.纳米铁粉主要通过物理吸附作用除去污水中的、、
D.新型水处理剂高铁酸钠(),其工作原理与明矾净水原理完全相同
3.下列有关石油和煤的利用叙述不正确的是
A.煤的干馏就是将煤隔绝空气在高温条件下使之分解,得到焦炭、煤焦油等物质的过程
B.煤的液化就是将煤转化成甲醇、乙醇等液态物质的过程
C.煤的气化就是将煤在高温条件下由固态转化为气态的物理变化过程
D.石油通过催化裂化,可以提高汽油的质量和产量
4.下列物质的名称与化学式对应关系正确的是
A.乙炔: B.金刚砂: C.胆矾: D.石英:
5.下列关于硝态氮肥和铵态氮肥的比较错误的是
A.都易溶于水 B.受热都容易分解
C.都不能和碱性物质混运共施 D.土壤胶粒对的吸附效果更好
6.某同学利用如图所示装置(夹持装置已省略)在通风橱内进行铜与稀硝酸反应的探究实验,下列说法错误的是
A.注射器A中的稀硝酸与NaHCO3反应体现了硝酸的酸性
B.当观察到澄清石灰水变浑浊后关闭止水夹1、2,将铜丝伸入稀硝酸中,观察到铜丝溶解,有无色气体产生
C.铜与稀硝酸反应后,将注射器B中的空气注入具支试管,试管内气体会变成红棕色
D.澄清石灰水可吸收挥发出来的NO,同时防止外界空气进入具支试管中干扰实验
7.氮化铝(AlN)陶瓷具有耐腐蚀、耐高温的优点,一种制备氮化铝的方法为将氧化铝高能球磨至纳米级,然后与炭粉混合后通入氮气,发生反应:Al2O3+3C+N22AlN+3CO。设NA为阿伏加德罗常数的值,下列说法错误的是
A.AlN为新型无机非金属材料
B.反应中每生成4.1gAlN,转移电子数为0.6NA
C.上述反应属于固氮反应
D.纳米级Al2O3粉末分散在空气中能形成气溶胶
8.在密闭容器中进行度应,下列是在不同条件下测得的反应速率,其中反应速率最快的是
A. B.
C. D.
9.某实验小组用5%的溶液、粉末和蒸馏水探究外界条件对双氧水分解反应速率的影响,实验记录如下表。
实验序号 温度/℃ 5% 溶液体积/mL 粉末质量/g 体积/mL 收集150mL 所需的时间/s
Ⅰ 20 50 无 0 几乎无气体产生
Ⅱ 20 50 0.5 0 45
Ⅲ 20 25 0.5 a 85
Ⅳ 60 50 0.5 0
下列说法不正确的是
A.对比实验Ⅰ、Ⅱ可知,催化剂可加快反应速率
B.研究浓度对该反应速率的影响,a=25
C.实验Ⅰ、Ⅳ研究温度对双氧水分解反应速率的影响
D.结合表中数据,推测
10.下列原因分析能正确解释递变规律的是
选项 递变规律 原因分析
A 酸性: 非金属性:
B 离子半径: 电子层结构相同时,核电荷数:
C 与水反应的剧烈程度: 最外层电子数:
D 稳定性: 断键吸收的能量:
A.A B.B C.C D.D
11.理论研究表明,在101 kPa和298 K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是
A.一分子HCN中的总键能比一分子HNC的总键能大
B.该异构化反应的ΔH=+59.3 kJ·mol-1
C.HCN的能量小于HNC的能量
D.使用催化剂,可以改变该反应的ΔH
12.某化学兴趣小组在阴暗的地方用如图所示装置探究CH4与Cl2的反应,灯泡接通电源后,开始实验。下列说法错误的是
A.软管内会发生取代反应,生成物可能有5种
B.透明软管内气体颜色会逐渐变浅,透明软管的体积会缩小直至完全凹瘪
C.软管内会有油状液滴产生
D.充分反应后,打开K1,导管口可能会有白雾出现
13.劳动成就梦想。下列劳动项目与所述的化学知识没有关联的是
选项 劳动项目 化学知识
A 保洁员用白醋清洗水壶中的水垢 醋酸具有酸性
B 工程师用硬铝制造飞机和宇宙飞船 硬铝密度小、强度高
C 制药师利用碳酸氢钠生产抗酸药 受热易分解
D 泳池管理员用漂粉精对游泳池消毒 含氯消毒剂有强氧化性
A.A B.B C.C D.D
二、非选择题:本题共4小题,共61分。
14.海水资源的利用具有非常广阔的前景。下面是海水综合利用联合工业体系的简图:
请回答下列问题:
(1)流程图中Na和Mg的冶炼方法叫 ;没有涉及到的分离方法是 (填“字母编号”)。
(2)工业制备NaOH,工业常用电解饱和食盐水的方法,发生的化学方程式为 。
(3)海水提溴时,向海水中通入Cl2就应经得到Br2,又用热空气吹出后加SO2还原,再通Cl2氧化为Br2的目的是 。请写出SO2和Br2一起通入水中的离子方程式 。
(4)海水提Mg过程中,工业上沉镁时选用石灰乳而不使用NaOH溶液的原因是 ;从MgCl2·6H2O脱水形成无水MgCl2的实验装置如下图所示,其中装置A的作用是 。
15.A的产量可以用来衡量一个国家石油化学工业的发展水平。以A为原料合成香料G和高分子材料H的流程如下:
请回答下列问题:
(1)A的结构简式为 ,A→H的反应类型为 。
(2)C中的官能团名称为 ,常用于检验该官能团的一种试剂是 (填名称)。
(3)1molF与足量金属钠反应可产生 L气体(标准状况)。
(4)已知同一个碳原子上不能连接两个羟基,则的同分异构体中与F互为同系物的有 种。(不考虑立体异构)
(5)写出反应⑥的化学方程式 。
(6)有关上述物质的说法错误的是 。
a.可通过酸性高锰酸钾溶液洗气的方法除去乙烷中含有的A杂质
b.B可以与酸性重铬酸钾溶液反应生成D
c.反应②中B断裂了C-H键和O-H键
d.C和E互为同分异构体
e.H可以使溴水褪色
16.探究原电池中的能量转化。图中注射器用来收集气体并读取气体体积(在标准状况下),记录实验数据如表。
实验数据时间/min ① ②
气体体积/mL 溶液温度/℃ 气体体积/mL 溶液温度/℃
0 0 22.0 0 22.0
6 33.6 24.8 56 23.8
10 56 26.0 — —
(1)判断两装置中反应的快慢① ②(填“>”、“=”或“<”),6至10min内①中产生氢气的平均速率是 。
(2)装置①中的反应是放热反应,实验证据是 ;该反应的能量变化可用图中的 (填“a”或“b”)表示。
(3)有明显的气泡冒出现象的金属是 (填“a”、“b”、“c”、“d”),当都生成56ml气体时,装置中释放的总能量① ②(填“>”、“=”或“<”),请对两装置温度变化不同进行解释 。
17.以为载体的银催化剂是工业上氧化乙烯常用的催化剂,其中Ag质量占催化剂质量的10%~40%。从某废银催化剂(主要成分为Ag、、等)中回收银的工艺流程如图1。
已知;不溶于硝酸。
(1)“酸浸”时通常会适当搅拌,搅拌的目的是 。
(2)“滤渣”的主要成分为 (写化学式)。
(3)“酸浸”过程中生成NO的离子方程式为 ;NO易与空气中的反应转化为,该转化过程发生反应的化学方程式为 。
(4)“沉银”时发生反应的离子方程式为 ;“转化”过程中Fe粉作 (填“氧化”或“还原”)剂。
(5)工业上,在空气中用5%稀硝酸连续吸收加碱液吸收,并不断搅拌,基本可实现将废气中的完全吸收,其工艺流程如图2。
当时,“吸收(1)”中发生反应的化学方程式为 ,“吸收(4)”所得钠盐的成分为 (任写一种,填化学式)。
参考答案:
1.A
【详解】A. 使用一次性餐具,导致环境的污染及资源的浪费,故A错误;
B. 发展捕集技术,减少大气中的,减少了温室效应,利于改善环境,故B正确;
C. 开发新能源替代传统能源,实现可持续的绿色发展,故C正确;
D. 开发清洁燃烧技术,减少污染性气体的排放,利于环保,故D正确。
答案为:A。
2.B
【详解】A.加碘食盐中没有单质碘,不会造成人体中毒,A错误;
B.“碲化镉发电玻璃”能将光能转化为电能,B正确;
C.纳米铁粉主要通过化学反应除去污水中的、、,C错误;
D.型水处理剂高铁酸钠()的工作原理是利用其强氧化性,明矾净水的原理是利用Al3+水解生成的氢氧化铝胶体吸附水中的悬浮物,D错误;
故选B。
3.C
【详解】A.煤的干馏是将煤隔绝空气加强热使之分解的过程,煤的干馏产品主要有焦炭、煤焦油、焦炉气等,A正确;
B.煤的液化是将煤转化为液体燃料(如甲醇等)的过程,B正确;
C.煤的气化是将煤转化为气体燃料(如CO、H2)的过程,为化学变化,C错误;
D.石油的催化裂化是将相对分子质量大、沸点高的烃断裂为相对分子质量小、沸点低的烃的过程,从而获得轻质油,D正确;
故选C。
4.D
【详解】A.乙炔的化学式为C2H2,A错误;
B.金刚砂即碳化硅,化学式为SiC,B错误;
C.胆矾化学式为CuSO4 5H2O,C错误;
D.石英主要成分SiO2,化学式为SiO2,D正确;
故选D。
5.C
【分析】硝态氮肥通常为硝酸盐,主要包括硝酸钠、硝酸钙、硝酸铵等;铵态氮肥通常为铵盐,包括硫酸铵、碳酸氢铵、氯化铵等等;
【详解】A.硝态氮肥和铵态氮肥都易溶于水,A正确;
B. 硝酸及硝酸盐、氨水及铵盐都具有热不稳定性,受热都容易分解,B正确;
C. 铵盐和碱性物质反应、不能和碱性物质混运共施,硝酸钠硝酸钙等硝酸盐不与碱性物质反应,C不正确;
D. 土壤胶粒带负电荷,则土壤胶粒对的吸附效果更好,D正确;
答案选C。
6.D
【分析】先打开止水夹1、2,将注射器A中的稀硝酸注入,与NaHCO3反应生成二氧化碳,排尽装置内空气,当观察到澄清石灰水变浑浊,说明装置内空气被排尽了,然后关闭止水夹1、2,将铜丝伸入稀硝酸中,进行铜与稀硝酸的反应,有无色气体NO产生,再注射器B的空气注入具支试管中,观察气体颜色变化,据此分析解答。
【详解】A.注射器A中的稀硝酸与NaHCO3反应生成硝酸钠、水和二氧化碳,发生的是复分解反应,体现了硝酸的酸性,故A正确;
B.当观察到澄清石灰水变浑浊,说明装置内空气被排尽了,然后关闭止水夹1、2,铜与稀硝酸反应生成NO,故将铜丝伸入稀硝酸中,观察到铜丝溶解,有无色气体产生,故B正确;
C.铜与稀硝酸反应后,将注射器B中的空气注入具支试管,发生反应,故试管内气体会变成红棕色,故C正确;
D.NO难溶于水,也不碱溶液反应,澄清石灰水不能吸收挥发出来的NO,故D错误;
故选D。
7.B
【分析】
该反应的双线桥为:
【详解】A.氮化铝陶瓷是新型陶瓷,属于新型无机非金属材料,A正确;
B.根据双线桥可知:生成2molAlN时,转移6mole-,4.1gAlN()参加反应转移电子数应为0.3NA,B错误;
C.固氮指的是将游离态的氮转化为化合态的氮,C正确;
D.纳米级Al2O3粉末分散在空气中,分散质粒子直径在纳米级,属于胶体,分散剂是空气,所以形成的是气溶胶,D正确;
故选B。
8.C
【分析】不同物质表示的速率之比等于化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示出的反应速率越快,注意保持单位一致,据此判断。
【详解】A.;
B.;
C.;
D.;
故反应速率最快的选项C;
故答案选C。
9.C
【详解】A.实验Ⅰ和Ⅱ在相同温度下,相同浓度的,在有和无的条件下反应,所以对比实验Ⅰ、Ⅱ可知,催化剂可加快反应速率,A正确;
B.在相同温度和都加入催化剂的条件下,实验Ⅱ和ⅡI可以研究浓度对该反应速率的影响,溶液的总体积相同,所以a=25,B正确;
C.实验Ⅰ、Ⅳ中,温度不同,Ⅰ中没有催化剂,Ⅳ加了催化剂,有2个变量,不能研究温度对双氧水分解反应速率的影响,C错误;
D.结合表中数据,对比实验Ⅱ和Ⅳ,Ⅳ的温度高于Ⅱ,所以反应速率较快,可以推测,D正确;
故选C。
10.B
【详解】A.通过比较最高价氧化物对应水化物的酸性比较非金属性,S的最高价氧化物对应水化物为H2SO4,A错误;
B.具有相同电子层结构的阳离子核电荷数大于阴离子核电荷数,具有相同电子层的阴离子核电荷数,所带电荷数越多,核电荷数越小,根据离子半径:,可得电子层结构相同时,核电荷数:Ca>Cl>S,B正确;
C.与水反应的剧烈程度:,金属性,元素的非金属性和最外层电子数没有必然联系,C错误;
D.同主族元素从上往下非金属性在减弱,非金属性越强形成的共价键越稳定,断键时所需吸收的能量越高,稳定性:,因此断键吸收的能量:,D错误;
故答案选B。
11.D
【详解】A.根据图中信息得到HCN转化为HNC为吸热反应,1 mol HCN断键吸收的能量大于1 mol HNC成键放出的能量,故一分子HCN中的总键能比一分子HNC的总键能大,故A正确;
B.根据焓变等于生成物总能量减去反应物总能量可知该反应的ΔH=+59.3 kJ·mol-1,故B正确;
C.该反应为吸热反应,HCN的能量小于HNC的能量,故C正确;
D.使用催化剂,不改变反应物和生成物的能量,该反应的ΔH不变,D错误;
本题选D。
12.B
【详解】A.软管内会发生取代反应,生成物可能有5种,分别是一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷和氯化氢,故A正确;
B.透明软管内氯气消耗,气体颜色会逐渐变浅,透明软管的体积会缩小,但由于有氯化氢和一氯甲烷两种气体生成,所以不会完全凹瘪,故B错误;
C.软管内会发生取代反应,生成的二氯甲烷、三氯甲烷、四氯甲烷都是油状液体,故C正确;
D.充分反应后,打开K1,由于反应有氯化氢生成,所以导管口可能会有白雾出现,故D正确;
故答案为:B。
13.C
【详解】A.醋酸具有酸性,能与水垢中的碳酸盐等反应,使其转化为可溶性盐而除去,A正确;
B.硬铝密度小,强度高,可用于制造飞机和宇宙飞船,B正确;
C.碳酸氢钠能与盐酸反应从而消耗多余的胃酸,且其腐蚀性较小,故可用于生产抗酸药,C错误;
D.漂粉精中的次氯酸钙具有强氧化性,故可用其对游泳池进行消毒,D正确;
故答案选C。
14.(1) 电解法 B
(2)2NaCl+2H2O2NaOH+Cl2↑+H2↑
(3) 富集溴元素(或富集Br2或使Br2浓度增大等) SO2+Br2+2H2O=4H++2Br-+SO
(4) 制取石灰乳原料丰富且制备成本低,而NaOH制备成本高 制取所需的HCl(意思相近即可)
【分析】海水淡化后得到淡水、粗盐和海水浓缩液,粗盐多步除杂后,得到氯化钠溶液,得到精制食盐可以制得Na、NaOH、NaHCO3;海水浓缩液通入氯气,得到含有Br2的海水,利用热空气吹出生成的Br2,并用SO2、水吸收得到含有HBr等物质的溶液,再通入氯气氧化,蒸馏得到工业液溴;海水浓缩液中加入石灰乳得到Mg(OH)2沉淀,再用盐酸溶解生成MgCl2溶液,浓缩结晶得到MgCl2·6H2O,脱水得无水氯化镁,电解熔融氯化镁生成镁单质和氯气。
【详解】(1)Na和Mg的冶炼方法叫电解法;反应涉及分离方法为蒸馏、过滤、蒸发结晶,没有涉及到的分离方法是分液,故选B。·
(2)工业常用电解饱和食盐水的方法制备NaOH,发生的化学方程式为2NaCl+2H2O2NaOH+Cl2↑+H2↑。
(3)海水提溴时,向海水中通入Cl2就应经得到Br2,又用热空气吹出后加SO2还原,再通Cl2氧化为Br2的目的是富集溴元素(或富集Br2或使Br2浓度增大等)。SO2和Br2一起通入水中生成硫酸和溴化氢,离子方程式SO2+Br2+2H2O=4H++2Br-+SO。
(4)NaOH价格较贵且不易获得,海水提Mg过程中,工业上沉镁时选用石灰乳而不使用NaOH溶液的原因是制取石灰乳原料丰富且制备成本低,而NaOH制备成本高;从MgCl2·6H2O脱水形成无水MgCl2需要通入HCl,装置A的作用是制取所需的HCl(意思相近即可)。
15.(1) CH2=CH2 加聚反应
(2) 醛基 银氨溶液或新制氢氧化铜
(3)22.4
(4)5
(5)2CH3COOH+HOCH2CH2OHCH3COOCH2CH2OOCCH3+2H2O
(6)ae
【分析】有机物A的产量用来衡量一个国家石油化学工业的发展水平,A为乙烯,乙烯与水发生加成反应生成乙醇,乙醇催化氧化得到C为乙醛,乙醛氧化得到乙酸。乙烯经过催化氧化得到环氧乙烷,环氧乙烷与水反应得到乙二醇(HOCH2CH2OH),乙酸和乙二醇发生酯化反应得到G的结构简式为CH3COOCH2CH2OOCCH3,乙烯在催化剂作用下发生加聚反应得到H为聚乙烯。
【详解】(1)A的结构简式为CH2=CH2,根据分析,A→H的反应类型为加聚反应。
(2)C为乙醛,官能团名称为醛基,检验醛基常用银氨溶液或新制氢氧化铜。
(3)1molF含2mol羟基,与足量金属钠反应可产生1mol氢气,标况下体积为22.4L。
(4)
可以采用定一移一法,固定一个羟基的位置,移动另一个羟基,去除重复的即得答案。或者参照C4H10的二氯代物,用羟基代替氯原子,去除两个氯原子连在同一个碳上的情况。则的同分异构体中与F互为同系物的有CH2(OH) CH(OH) CH2CH3、CH2(OH) CH2 CH(OH) CH3、CH2(OH) CH2 CH2 CH2(OH)、、CH2(OH) CH(CH3) CH2(OH)共5种。
(5)乙酸和乙二醇发生酯化反应时酸脱羟基,醇脱羟基上的氢,生成酯和水,故方程式为2CH3COOH+HOCH2CH2OHCH3COOCH2CH2OOCCH3+2H2O。
(6)a.乙烯被高锰酸钾溶液氧化成二氧化碳引入新的杂质,应该用溴水,a错误;
b.乙醇可以被酸性重铬酸钾溶液氧化生成乙酸,b正确;
c.乙醇的催化氧化断裂C-H键和O-H键形成碳氧双键,c正确;
d.乙醛和环氧乙烷分子式相同,结构不同,是同分异构体,d正确;
e.聚乙烯中不含碳碳双键,不能使溴水褪色,e错误;
故答案选ae。
16.(1) <
(2) 溶液温度升高 a
(3) ad = 装置化学能转化为热能
【详解】(1)由表中数据可知,①中反应慢,6至10min,①中生成的平均速度,故答案为:<;。
(2)装置①中溶液温度升高,可知反应是放热反应;放热反应生成物的总能量低于反应物的总能量,该反应的能量变化可用图中的a表示,故答案为:溶液温度升高;a。
(3)①中Zn与稀接触发生化学反应,产生。②中形成原电池。Cu做正极,发生电极反应:,所以有明显的气泡冒出的是a、d,两装置发生的总反应相同,当生成相同体积气体时,释放的总能量相同。由于装置①化学能转化为热能,装置②中部分转化为电能,所以两装置温度变化不同,故答案为:ad;=;装置化学能转化为热能。
17.(1)提高“酸浸”速率
(2)、
(3)
(4) 还原
(5) (或)
【分析】用硝酸溶解废银催化剂,过滤得到的滤渣中含有不溶于水和硝酸的二氧化硅和α-氧化铝,同时产生NO废气,所得滤液中含有硝酸银和过量的稀硝酸,向滤液中加入氯化钠生成氯化银沉淀,将过滤得到的氯化银和Fe粉反应生成银,据此解答。
【详解】(1)“酸浸”时通常会适当搅拌,搅拌的目的是提高“酸浸”速率。
(2)由分析可知,“滤渣”的主要成分为、。
(3)“酸浸”过程中Ag和稀硝酸反应生成硝酸银、一氧化氮和水,根据得失电子守恒和电荷守恒配平离子方程式为:,NO易与空气中的反应转化为,该转化过程发生反应的化学方程式为。
(4)“沉银”时Cl-和Ag+结合生成AgCl沉淀,离子方程式为:,“转化”过程中Fe粉和AgCl沉淀反应生成Ag和FeCl2,Fe元素化合价上升,Fe粉作还原剂。
(5)当时,和稀硝酸溶液中的水反应生成硝酸和NO,化学方程式为:,“吸收(4)”过程中、和NaOH溶液反应生成和,发生化学方程式为:2NO2+ 2NaOH=NaNO3+ NaNO2+ H2O、NO+NO2+2NaOH=2NaNO2+H2O,所得钠盐的成分为(或)。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
