福建省福州市九县(市、区)一中(高中)2023-2024学年高一下学期7月期末联考化学试题(无答案)
文档属性
| 名称 | 福建省福州市九县(市、区)一中(高中)2023-2024学年高一下学期7月期末联考化学试题(无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 322.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-04 21:51:08 | ||
图片预览



文档简介
2023——2024学年第二学期九县(区、市)一中(高中)期末联考
高中一年化学科试卷
考试日期:7月4日:完卷时间:75分钟满分:100分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Fe-56
第Ⅰ卷(选择题)
一、单选题(每题3分,共45分)
1.化学与人类生产、生活、社会可持续发展密切相关,下列说法错误的是( )
A.北京奥运会礼仪服内胆添加了第二代石墨烯发热材料,石墨烯属于新型无机非金属材料
B.定浓度的含氯消毒液可使病毒中的蛋白质变性
C.锌具有还原性和导电性,所以可用作锌锰干电池的负极材料
D.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋里放入硅胶
2.甲酸和乙醇在浓硫酸作用下反应生成甲酸乙酯,该反应各物质的化学用语错误的是( )
A.甲酸的结构式为: B.乙醇的球棍模型:
C.甲酸乙酯的结构简式:CH3COOCH3 D.H2O的电子式:
3.以下过程没有发生化学反应的是( )
A.石油裂解 B.植物油皂化
C.煤的干馏 D.蛋白质盐析
4.NH4Cl是一种常用氮肥,下列关于NH4Cl的说法正确的是( )
A.氯离子的结构示意图:
B.0.1mol中含有NA个质子
C.NH4Cl不宜与碱性化肥混合使用
D.人工固氮的反应:NH3+HCl=NH4Cl
5.下列关于乙醇的反应中,不涉及电子转移的是( )
A.乙醇与乙酸反应生成乙酸乙酯 B.乙醇使酸性K2Cr2O7溶液变绿
C.乙醇使酸性KMnO4溶液褪色 D.乙醇与金属钠反应产生气体
6.下列除杂方法(括号内为杂质)正确的是( )
A.乙烷(乙烯) 通过酸性高锰酸钾溶液,洗气
B.乙醇(水) 加新制生石灰,蒸馏
C.乙酸乙酯(乙酸) 加饱和碳酸钠溶液,蒸馏
D.苯(溴) 加水,振荡后静置分液
7.以下物质间的每步转化通过-步反应能实现的是( )
AAl→Al2O3→Al(OH)3→NaAlO2 B.N2→NO→NO2→HNO3
C.S→SO3→H2SO4→MgSO4 D.Fe→FeO→Fe(OH)2→Fe(OH)3
8.下列关于有机化合物的认识中,正确的是( )
A.分子式为C4H10O的醇共有4种
B.淀粉、纤维素的分子式都是(C6H10O5)n,二者互为同分异构体
C.乙酸(CH3COOH)与油酸(C17H33COOH)互为同系物
D.包装用的材料聚乙烯和聚氯乙烯都属于烃
9.下列离子方程式中正确的是( )
A.过量铁粉加入稀硝酸中:Fe+4H++=Fe3++NO↑+2H2O
B.NH4HCO3溶液与过量KOH浓溶液共热:+OH-NH3↑+H2O
C.用浓氯化铁溶液制作印刷电路板:2Fe3++Cu=2Fe2++Cu2+
D向FeI2溶液中加入少量氯水:2Fe2++Cl2=2Fe3++2Cl-
10.废水脱氮工艺中有一种方法是在废水中加入过量NaClO使完全转化为N2,该反应可表示为2+3ClO-=N2+3Cl-+2H++3H2O。下列说法中,不正确的是
A.反应中氮元素被氧化,氯元素被还原
B.还原性>Cl-
C.反应中每生成lmolN2,转移6mol电子
D.经此法处理过的废水可以直接排放
11.下列关于金属冶炼的说法正确的是( )
A.用电解熔融AlCl3的方法来冶炼金属铝
B.铜的湿法冶炼是将金属钠投入到CuSO4溶液中,从而置换出铜
C.通常采用CO高温还原法冶炼金属铁
D.用海水为原料制得精盐,再电解纯净的NaCl溶液可制得金属钠
12.一种高活性有机物中间体分子结构如图,下列有关该物质说法错误的是( )
A.含有两种官能团
B.1mol该有机物与足量金属Na反应可产生H222.4L(标况下)
C.分子式为C10H12O2
D.苯环上的一氯代物有4种
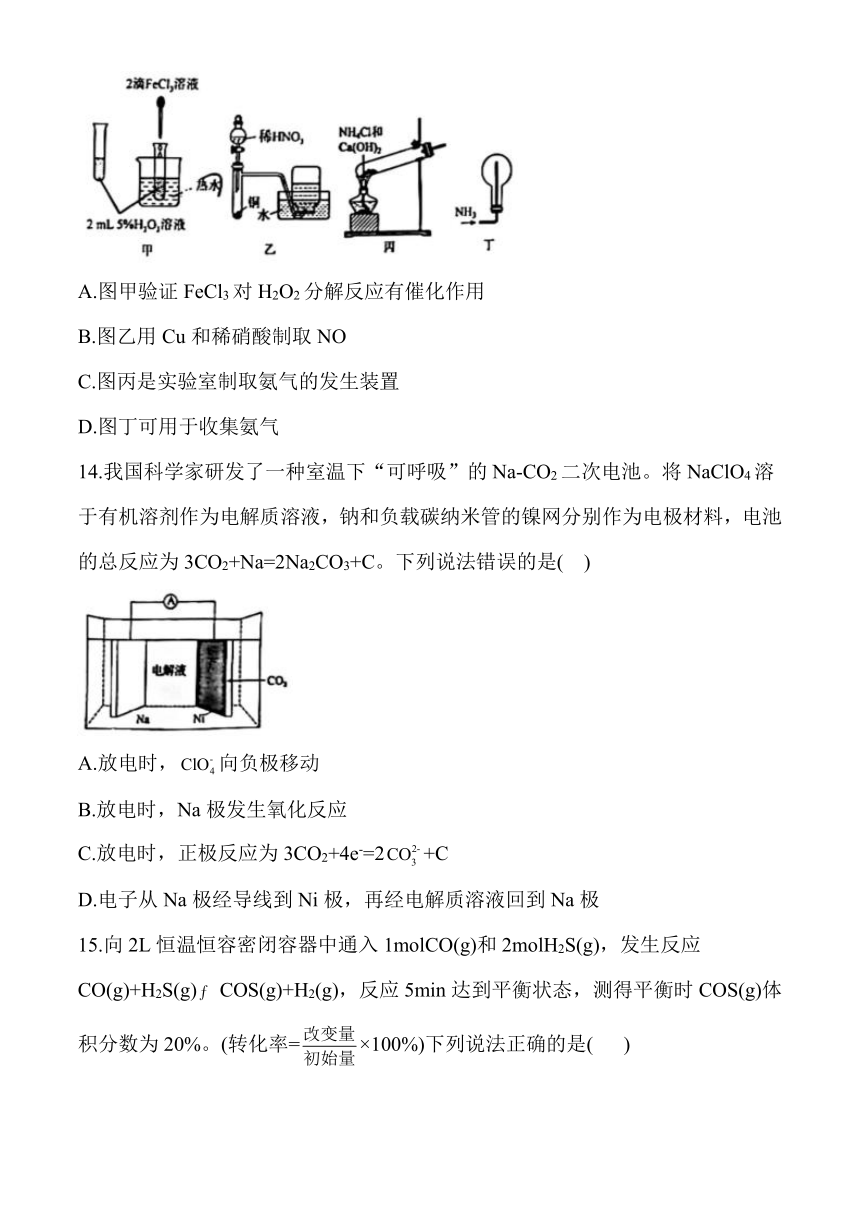
13.如图所示的实验方案能达到实验目的的是( )
A.图甲验证FeCl3对H2O2分解反应有催化作用
B.图乙用Cu和稀硝酸制取NO
C.图丙是实验室制取氨气的发生装置
D.图丁可用于收集氨气
14.我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解质溶液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+Na=2Na2CO3+C。下列说法错误的是( )
A.放电时,向负极移动
B.放电时,Na极发生氧化反应
C.放电时,正极反应为3CO2+4e-=2+C
D.电子从Na极经导线到Ni极,再经电解质溶液回到Na极
15.向2L恒温恒容密闭容器中通入1molCO(g)和2molH2S(g),发生反应CO(g)+H2S(g)COS(g)+H2(g),反应5min达到平衡状态,测得平衡时COS(g)体积分数为20%。(转化率=×100%)下列说法正确的是( )
A.CO和H2S的平衡转化率均为60%
B.v(COS)=v(H2S)=0.12mol·L-1·min-1
C.混合气体的平均相对分子质量始终保持不变
D.若保持不变,可判断该反应已达到平衡状态
第Ⅱ卷(非选择题)
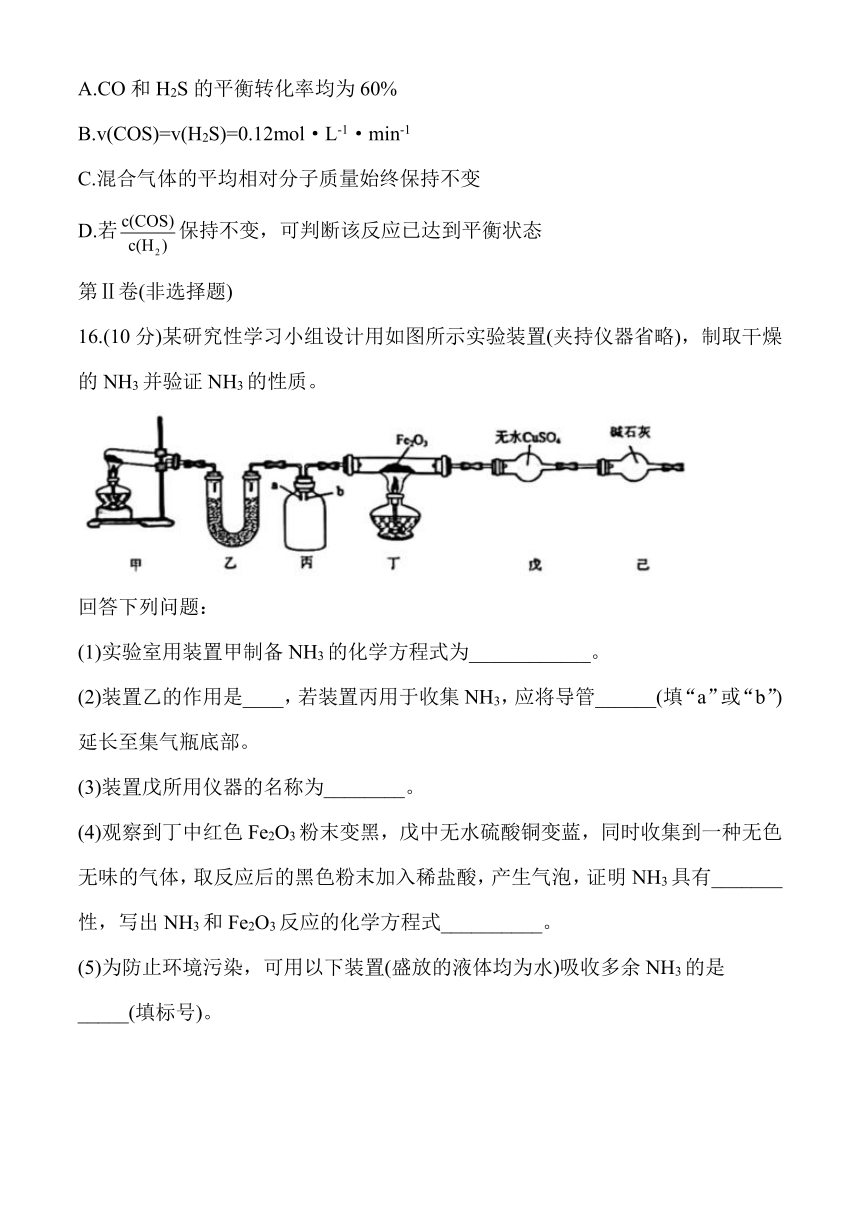
16.(10分)某研究性学习小组设计用如图所示实验装置(夹持仪器省略),制取干燥的NH3并验证NH3的性质。
回答下列问题:
(1)实验室用装置甲制备NH3的化学方程式为____________。
(2)装置乙的作用是____,若装置丙用于收集NH3,应将导管______(填“a”或“b”)延长至集气瓶底部。
(3)装置戊所用仪器的名称为________。
(4)观察到丁中红色Fe2O3粉末变黑,戊中无水硫酸铜变蓝,同时收集到一种无色无味的气体,取反应后的黑色粉末加入稀盐酸,产生气泡,证明NH3具有_______性,写出NH3和Fe2O3反应的化学方程式__________。
(5)为防止环境污染,可用以下装置(盛放的液体均为水)吸收多余NH3的是_____(填标号)。
a. b. c. d.
17.(11分)氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。
I.某一兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约为10%,其余为空气),实验装置如图所示:
(1)装置A中SO2与Fe2(SO4)3溶液反应生成FeSO4,写出该反应的离子方程式:___________;
(2)反应后,若要检验装置A中Fe3+是否过量,可用试剂为_______(填化学式);若要检验SO2是否过量,可用试剂为_______(填名称)。
(3)装置B中所用X溶液常为碱溶液,其作用是____________。
(4)若实验测得反应后的装置A中不再含有SO2,为测定其中所含FeSO4的物质的量浓度,现进行如下实验:取20.00mL装置A中溶液,向其中逐滴加入0.1000mol/LCe(SO4)2溶液,发生反应Fe2++Ce4+=Ce3++Fe3+,当反应恰好完全时,共消耗Ce(SO4)2溶液18.00mL。则FeSO4的物质的量浓度为________。
Ⅱ.工业制硝酸时尾气中含有NO、NO2,可用以下方法吸收:
(5)水吸收法。请用化学方程式说明用水吸收NO2的缺陷:________。
(6)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其离子方程式:________。
18.(12分)高分子化合物H是一种重要工业原料,其单体d不溶于水,可以发生如图变化。请回答下列问题:
(1)有机物C的分子式是______。
(2)有机物A中官能团的名称为_______、______。
(3)反应①的反应类型为_______;反应⑤的反应类型为_______。
(4)反应②的化学方程式是_____________。
(5)反应④的化学反应方程式____________。
(6)有机物E的结构简式是_______。
(7)E的某种同分异构体符合下列条件,其结构简式为_______。
①能发生银镜反应
②分子中含两个甲基
③能和金属钠反应生成氢气
19.(10分)某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、胆矾晶体(CuSO4●5H2O)和水处理剂高铁酸钾(K2FeO4)。
请回答:
(1)试剂X是______(填化学式):试剂Y是______(填化学式);步骤Ⅰ涉及到的分离操作是______。
(2)写出溶液A转化为固体C的离子方程式____________。
(3)在步骤Ⅱ时,若用大理石与浓盐酸制取CO2并直接通入溶液A中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,可能的原因是______(用化学方程式表示)。
(4)由溶液E制取K2FeO4时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有以下影响,由图可知工业生产中最佳条件为________(填温度和Fe3+的质量浓度)。
(5)在固体F中加入稀硫酸和H2O2来制备CuSO4溶液是一种环保工艺,该反应的总的化学方程式为____________。
20.(12分)研究NOx、SO2、CO等气体的无害化处理对建设生态文明有重要意义。
(1)利用反应2NO(g)+2CO(g)=2CO2(g)+N2(g),可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示:
①X代表的物质是____(填化学式)
②从反应开始到达到平衡,v(NO)=________。
(2)可用电化学原理处理SO2制备硫酸,装置如图,电极为多孔材料。写出N极的电极方程式________,若电路中有2mol电子转移,理论上可制得硫酸___g。
(3)转化反应CO(g)+N2O(g)CO2(g)+N2(g),在Fe*的催化作用下反应历程可分为:
第一步:Fe*+N2O(g)=FeO*+N2(g);
第二步:FeO*+_____=______+______(将化学方程式补充完整)
(4)已知反应CO(g)+2H2(g)CH3OH(g)中相关的化学键键能数据如表:
化学键 H-H C-O C≡O(CO) H-O C-H
E(kJ/mol) 436 343 1076 465 413
①若有1molCH3OH生成,该反应放出_______kJ能量。
②一定温度下,在恒容的密闭容器中充入lmolCO和2molH2发生上述反应,对于该反应,下列说法正确的是_____(填序号)。
A.反应过程中n(CO):n(H2)不变
B.容器内混合气体的密度不再发生变化时,说明在该条件下,此反应已达到了最大的限度
C.往容器中充入He,压强增大,反应速率加快
D.容器内混合气体的压强保持不变时说明反应已达平衡
高中一年化学科试卷
考试日期:7月4日:完卷时间:75分钟满分:100分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Fe-56
第Ⅰ卷(选择题)
一、单选题(每题3分,共45分)
1.化学与人类生产、生活、社会可持续发展密切相关,下列说法错误的是( )
A.北京奥运会礼仪服内胆添加了第二代石墨烯发热材料,石墨烯属于新型无机非金属材料
B.定浓度的含氯消毒液可使病毒中的蛋白质变性
C.锌具有还原性和导电性,所以可用作锌锰干电池的负极材料
D.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋里放入硅胶
2.甲酸和乙醇在浓硫酸作用下反应生成甲酸乙酯,该反应各物质的化学用语错误的是( )
A.甲酸的结构式为: B.乙醇的球棍模型:
C.甲酸乙酯的结构简式:CH3COOCH3 D.H2O的电子式:
3.以下过程没有发生化学反应的是( )
A.石油裂解 B.植物油皂化
C.煤的干馏 D.蛋白质盐析
4.NH4Cl是一种常用氮肥,下列关于NH4Cl的说法正确的是( )
A.氯离子的结构示意图:
B.0.1mol中含有NA个质子
C.NH4Cl不宜与碱性化肥混合使用
D.人工固氮的反应:NH3+HCl=NH4Cl
5.下列关于乙醇的反应中,不涉及电子转移的是( )
A.乙醇与乙酸反应生成乙酸乙酯 B.乙醇使酸性K2Cr2O7溶液变绿
C.乙醇使酸性KMnO4溶液褪色 D.乙醇与金属钠反应产生气体
6.下列除杂方法(括号内为杂质)正确的是( )
A.乙烷(乙烯) 通过酸性高锰酸钾溶液,洗气
B.乙醇(水) 加新制生石灰,蒸馏
C.乙酸乙酯(乙酸) 加饱和碳酸钠溶液,蒸馏
D.苯(溴) 加水,振荡后静置分液
7.以下物质间的每步转化通过-步反应能实现的是( )
AAl→Al2O3→Al(OH)3→NaAlO2 B.N2→NO→NO2→HNO3
C.S→SO3→H2SO4→MgSO4 D.Fe→FeO→Fe(OH)2→Fe(OH)3
8.下列关于有机化合物的认识中,正确的是( )
A.分子式为C4H10O的醇共有4种
B.淀粉、纤维素的分子式都是(C6H10O5)n,二者互为同分异构体
C.乙酸(CH3COOH)与油酸(C17H33COOH)互为同系物
D.包装用的材料聚乙烯和聚氯乙烯都属于烃
9.下列离子方程式中正确的是( )
A.过量铁粉加入稀硝酸中:Fe+4H++=Fe3++NO↑+2H2O
B.NH4HCO3溶液与过量KOH浓溶液共热:+OH-NH3↑+H2O
C.用浓氯化铁溶液制作印刷电路板:2Fe3++Cu=2Fe2++Cu2+
D向FeI2溶液中加入少量氯水:2Fe2++Cl2=2Fe3++2Cl-
10.废水脱氮工艺中有一种方法是在废水中加入过量NaClO使完全转化为N2,该反应可表示为2+3ClO-=N2+3Cl-+2H++3H2O。下列说法中,不正确的是
A.反应中氮元素被氧化,氯元素被还原
B.还原性>Cl-
C.反应中每生成lmolN2,转移6mol电子
D.经此法处理过的废水可以直接排放
11.下列关于金属冶炼的说法正确的是( )
A.用电解熔融AlCl3的方法来冶炼金属铝
B.铜的湿法冶炼是将金属钠投入到CuSO4溶液中,从而置换出铜
C.通常采用CO高温还原法冶炼金属铁
D.用海水为原料制得精盐,再电解纯净的NaCl溶液可制得金属钠
12.一种高活性有机物中间体分子结构如图,下列有关该物质说法错误的是( )
A.含有两种官能团
B.1mol该有机物与足量金属Na反应可产生H222.4L(标况下)
C.分子式为C10H12O2
D.苯环上的一氯代物有4种
13.如图所示的实验方案能达到实验目的的是( )
A.图甲验证FeCl3对H2O2分解反应有催化作用
B.图乙用Cu和稀硝酸制取NO
C.图丙是实验室制取氨气的发生装置
D.图丁可用于收集氨气
14.我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解质溶液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+Na=2Na2CO3+C。下列说法错误的是( )
A.放电时,向负极移动
B.放电时,Na极发生氧化反应
C.放电时,正极反应为3CO2+4e-=2+C
D.电子从Na极经导线到Ni极,再经电解质溶液回到Na极
15.向2L恒温恒容密闭容器中通入1molCO(g)和2molH2S(g),发生反应CO(g)+H2S(g)COS(g)+H2(g),反应5min达到平衡状态,测得平衡时COS(g)体积分数为20%。(转化率=×100%)下列说法正确的是( )
A.CO和H2S的平衡转化率均为60%
B.v(COS)=v(H2S)=0.12mol·L-1·min-1
C.混合气体的平均相对分子质量始终保持不变
D.若保持不变,可判断该反应已达到平衡状态
第Ⅱ卷(非选择题)
16.(10分)某研究性学习小组设计用如图所示实验装置(夹持仪器省略),制取干燥的NH3并验证NH3的性质。
回答下列问题:
(1)实验室用装置甲制备NH3的化学方程式为____________。
(2)装置乙的作用是____,若装置丙用于收集NH3,应将导管______(填“a”或“b”)延长至集气瓶底部。
(3)装置戊所用仪器的名称为________。
(4)观察到丁中红色Fe2O3粉末变黑,戊中无水硫酸铜变蓝,同时收集到一种无色无味的气体,取反应后的黑色粉末加入稀盐酸,产生气泡,证明NH3具有_______性,写出NH3和Fe2O3反应的化学方程式__________。
(5)为防止环境污染,可用以下装置(盛放的液体均为水)吸收多余NH3的是_____(填标号)。
a. b. c. d.
17.(11分)氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。
I.某一兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约为10%,其余为空气),实验装置如图所示:
(1)装置A中SO2与Fe2(SO4)3溶液反应生成FeSO4,写出该反应的离子方程式:___________;
(2)反应后,若要检验装置A中Fe3+是否过量,可用试剂为_______(填化学式);若要检验SO2是否过量,可用试剂为_______(填名称)。
(3)装置B中所用X溶液常为碱溶液,其作用是____________。
(4)若实验测得反应后的装置A中不再含有SO2,为测定其中所含FeSO4的物质的量浓度,现进行如下实验:取20.00mL装置A中溶液,向其中逐滴加入0.1000mol/LCe(SO4)2溶液,发生反应Fe2++Ce4+=Ce3++Fe3+,当反应恰好完全时,共消耗Ce(SO4)2溶液18.00mL。则FeSO4的物质的量浓度为________。
Ⅱ.工业制硝酸时尾气中含有NO、NO2,可用以下方法吸收:
(5)水吸收法。请用化学方程式说明用水吸收NO2的缺陷:________。
(6)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其离子方程式:________。
18.(12分)高分子化合物H是一种重要工业原料,其单体d不溶于水,可以发生如图变化。请回答下列问题:
(1)有机物C的分子式是______。
(2)有机物A中官能团的名称为_______、______。
(3)反应①的反应类型为_______;反应⑤的反应类型为_______。
(4)反应②的化学方程式是_____________。
(5)反应④的化学反应方程式____________。
(6)有机物E的结构简式是_______。
(7)E的某种同分异构体符合下列条件,其结构简式为_______。
①能发生银镜反应
②分子中含两个甲基
③能和金属钠反应生成氢气
19.(10分)某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、胆矾晶体(CuSO4●5H2O)和水处理剂高铁酸钾(K2FeO4)。
请回答:
(1)试剂X是______(填化学式):试剂Y是______(填化学式);步骤Ⅰ涉及到的分离操作是______。
(2)写出溶液A转化为固体C的离子方程式____________。
(3)在步骤Ⅱ时,若用大理石与浓盐酸制取CO2并直接通入溶液A中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,可能的原因是______(用化学方程式表示)。
(4)由溶液E制取K2FeO4时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有以下影响,由图可知工业生产中最佳条件为________(填温度和Fe3+的质量浓度)。
(5)在固体F中加入稀硫酸和H2O2来制备CuSO4溶液是一种环保工艺,该反应的总的化学方程式为____________。
20.(12分)研究NOx、SO2、CO等气体的无害化处理对建设生态文明有重要意义。
(1)利用反应2NO(g)+2CO(g)=2CO2(g)+N2(g),可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示:
①X代表的物质是____(填化学式)
②从反应开始到达到平衡,v(NO)=________。
(2)可用电化学原理处理SO2制备硫酸,装置如图,电极为多孔材料。写出N极的电极方程式________,若电路中有2mol电子转移,理论上可制得硫酸___g。
(3)转化反应CO(g)+N2O(g)CO2(g)+N2(g),在Fe*的催化作用下反应历程可分为:
第一步:Fe*+N2O(g)=FeO*+N2(g);
第二步:FeO*+_____=______+______(将化学方程式补充完整)
(4)已知反应CO(g)+2H2(g)CH3OH(g)中相关的化学键键能数据如表:
化学键 H-H C-O C≡O(CO) H-O C-H
E(kJ/mol) 436 343 1076 465 413
①若有1molCH3OH生成,该反应放出_______kJ能量。
②一定温度下,在恒容的密闭容器中充入lmolCO和2molH2发生上述反应,对于该反应,下列说法正确的是_____(填序号)。
A.反应过程中n(CO):n(H2)不变
B.容器内混合气体的密度不再发生变化时,说明在该条件下,此反应已达到了最大的限度
C.往容器中充入He,压强增大,反应速率加快
D.容器内混合气体的压强保持不变时说明反应已达平衡
同课章节目录
