四川省眉山市仁寿第一中学校(北校区)2023~2024学年高一下学期期末考试化学试题(含解析)
文档属性
| 名称 | 四川省眉山市仁寿第一中学校(北校区)2023~2024学年高一下学期期末考试化学试题(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 504.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-04 22:20:38 | ||
图片预览


文档简介
2023~2024学年度下期
仁寿一中北校区高2023级期末考试
化学
本试卷分为试题卷和答题卡两部分,其中试题卷由第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)组成,共6页;答题卡共2页。满分100分,考试时间75分钟。
注意事项:
1. 答题前,考生务必将自己的学校、班级、姓名用0.5毫米黑色墨水签字笔填写清楚,同时用2B铅笔将考号准确填涂在“考号”栏目内。
2. 选择题使用2B铅笔填涂在答题卡对应题目标号的位置上,如需改动,用橡皮擦擦干净后再选涂其它答案;非选择题用0.5毫米黑色墨水签字笔书写在答题卡的对应框内,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
3. 考试结束后将答题卡收回。
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Al 27 Cu 64
第Ⅰ卷(选择题,共42分)
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项最符合题意)
1.(2023·河北沧州高一期末)硫黄即硫单质。下列说法中正确的是( )
A.根据化合价可知,S在化学反应中只能做还原剂
B.硫单质可以溶于热碱,体现氧化性和还原性
C.过量的硫与铜反应生成CuS,表现硫单质的氧化性
D.S+O2SO2,S被氧化,做氧化剂
2.(2023·浙江杭州师大附中高一期中)下列有关说法正确的是( )
A.常温下浓硫酸不能与铁、铝发生反应而使铁、铝等金属钝化
B.用浓硫酸能在白纸上写出黑色文字,这体现了浓硫酸的吸水性
C.浓硫酸中硫酸主要以H2SO4分子形式存在
D.稀硫酸和浓硫酸因为均含有硫酸,所以其性质相同
3.(2023·山西忻州高一期中)下列措施能减慢化学反应速率的是( )
A.用Zn和2 mol·L-1 H2SO4溶液反应制取H2时,向溶液中滴加少量CuSO4溶液
B.日常生活中,将食物储存在冰箱中
C.用过氧化氢溶液制氧气时添加少量二氧化锰粉末
D.用相同质量的锌粉替代锌粒与同浓度、同体积的盐酸反应制氢气
4.对于在恒容密闭容器中进行的反应C(s)+H2O(g)CO(g)+H2(g),下列说法错误的是( )
A.其他条件不变,充入少量He,则反应速率增大
B.若v正(CO)=v逆(H2O),则反应达到平衡状态
C.其他条件不变,增加C(s)的质量,反应速率不变
D.若混合气体的平均相对分子质量不再改变,则反应达到平衡状态
5.(2023·辽宁本溪高一期中)乙酸分子的结构式为,下列关于断键部位的叙述正确的是( )
①乙酸在水溶液中电离时断裂a键
②乙酸与乙醇发生酯化反应时断裂b键
③在红磷存在时,Br2与CH3COOH的反应方程式可表示为CH3COOH+Br2CH2Br—COOH+HBr,乙酸在该反应中断裂c键
④一定条件下,2 mol乙酸生成1 mol乙酸酐的方程式可表示为2CH3COOH+H2O,乙酸在反应中分别断裂a、b键
A.①③④ B.①②④
C.②③ D.①②③④
6.(2023·湖北黄冈高一期末)某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如下。下列说法错误的是( )
盐卤Mg(OH)2MgCl2溶液MgCl2·6H2OMgCl2Mg
A.操作①发生的反应为非氧化还原反应
B.操作②是蒸发浓缩、结晶、过滤
C.若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器
D.在整个制备过程中,未发生置换反应
7.下列有机化合物中互为同分异构体的是( )
①CH2CHCH3 ② ③CH3CH2CH3 ④HC≡CCH3 ⑤ ⑥CH3CH2CH2CH3
A.①和② B.①和③
C.①和④ D.⑤和⑥
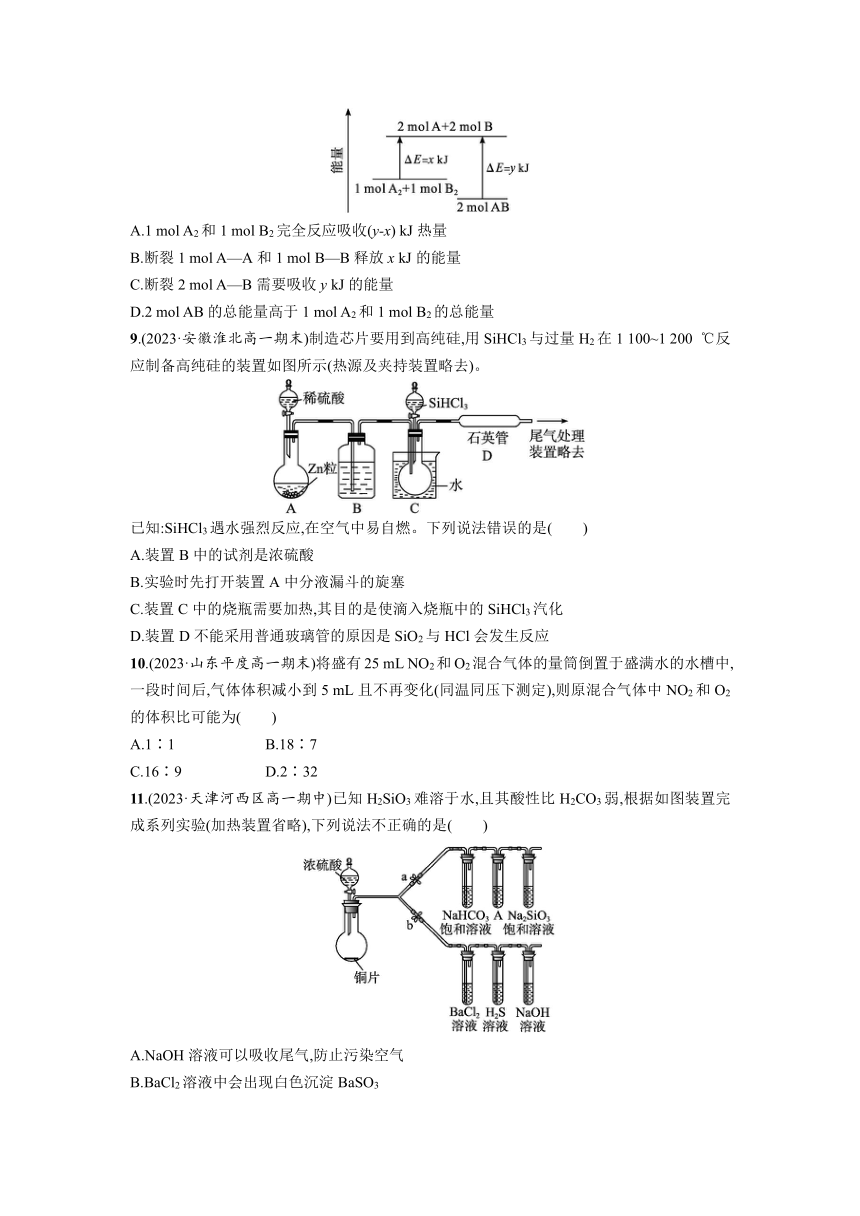
8.(2023·河南信阳高一期中)化学反应A2+B22AB的能量变化如图所示,则下列说法正确的是(ΔE表示能量变化)( )
A.1 mol A2和1 mol B2完全反应吸收(y-x) kJ热量
B.断裂1 mol A—A和1 mol B—B释放x kJ的能量
C.断裂2 mol A—B需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
9.(2023·安徽淮北高一期末)制造芯片要用到高纯硅,用SiHCl3与过量H2在1 100~1 200 ℃反应制备高纯硅的装置如图所示(热源及夹持装置略去)。
已知:SiHCl3遇水强烈反应,在空气中易自燃。下列说法错误的是( )
A.装置B中的试剂是浓硫酸
B.实验时先打开装置A中分液漏斗的旋塞
C.装置C中的烧瓶需要加热,其目的是使滴入烧瓶中的SiHCl3汽化
D.装置D不能采用普通玻璃管的原因是SiO2与HCl会发生反应
10.(2023·山东平度高一期末)将盛有25 mL NO2和O2混合气体的量筒倒置于盛满水的水槽中,一段时间后,气体体积减小到5 mL且不再变化(同温同压下测定),则原混合气体中NO2和O2的体积比可能为( )
A.1∶1 B.18∶7
C.16∶9 D.2∶32
11.(2023·天津河西区高一期中)已知H2SiO3难溶于水,且其酸性比H2CO3弱,根据如图装置完成系列实验(加热装置省略),下列说法不正确的是( )
A.NaOH溶液可以吸收尾气,防止污染空气
B.BaCl2溶液中会出现白色沉淀BaSO3
C.H2S溶液中会出现淡黄色沉淀,体现SO2的氧化性
D.为验证碳、硅两种元素非金属性的强弱,A中的试剂可以是酸性KMnO4溶液
12.(2023·广东广州高一期中)某化学课外活动小组通过下列实验验证Cl2与NH3的反应,下列有关说法错误的是( )
资料:氯气易溶于四氯化碳,氨气极易溶于水,却难溶于四氯化碳
A.用KMnO4和浓盐酸制备Cl2时,氧化剂与还原剂的物质的量之比为1∶5
B.A装置制备NH3,E装置制备Cl2
C.反应时,装置C中能观察到的现象是黄绿色变浅,有白烟产生,说明生成NH4Cl
D.尾气中的NH3可用F装置来吸收
13.(2023·河南驻马店高一期中)常温下,将除去表面氧化膜的Al、Cu片插入浓硝酸中构成原电池(图1),测得原电池的电流(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
下列说法错误的是( )
A.0~t1时,原电池的负极是Al片
B.0~t1时,正极的电极反应式是N+2H++e-NO2↑+H2O
C.t1后,原电池的正、负极发生互变
D.t1后,正极上每得到0.3 mol电子,则负极质量减少2.7 g
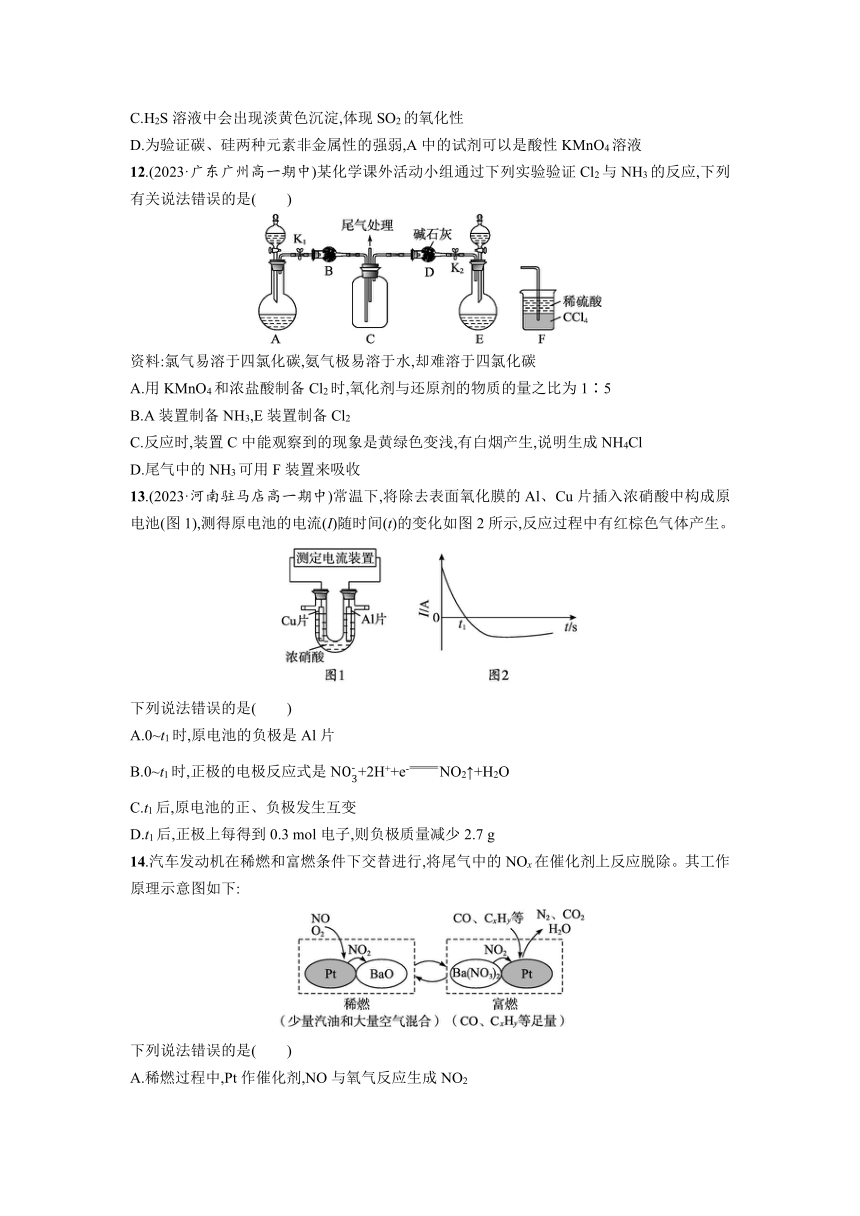
14.汽车发动机在稀燃和富燃条件下交替进行,将尾气中的NOx在催化剂上反应脱除。其工作原理示意图如下:
下列说法错误的是( )
A.稀燃过程中,Pt作催化剂,NO与氧气反应生成NO2
B.稀燃过程中,NO2与BaO反应可能生成NO和Ba(NO3)2
C.富燃过程中,在Pt催化下NO2被CO还原的反应为2NO2+4CON2+4CO2
D.富燃过程中,还原产物为N2和CO2
第Ⅱ卷(非选择题,共58分)
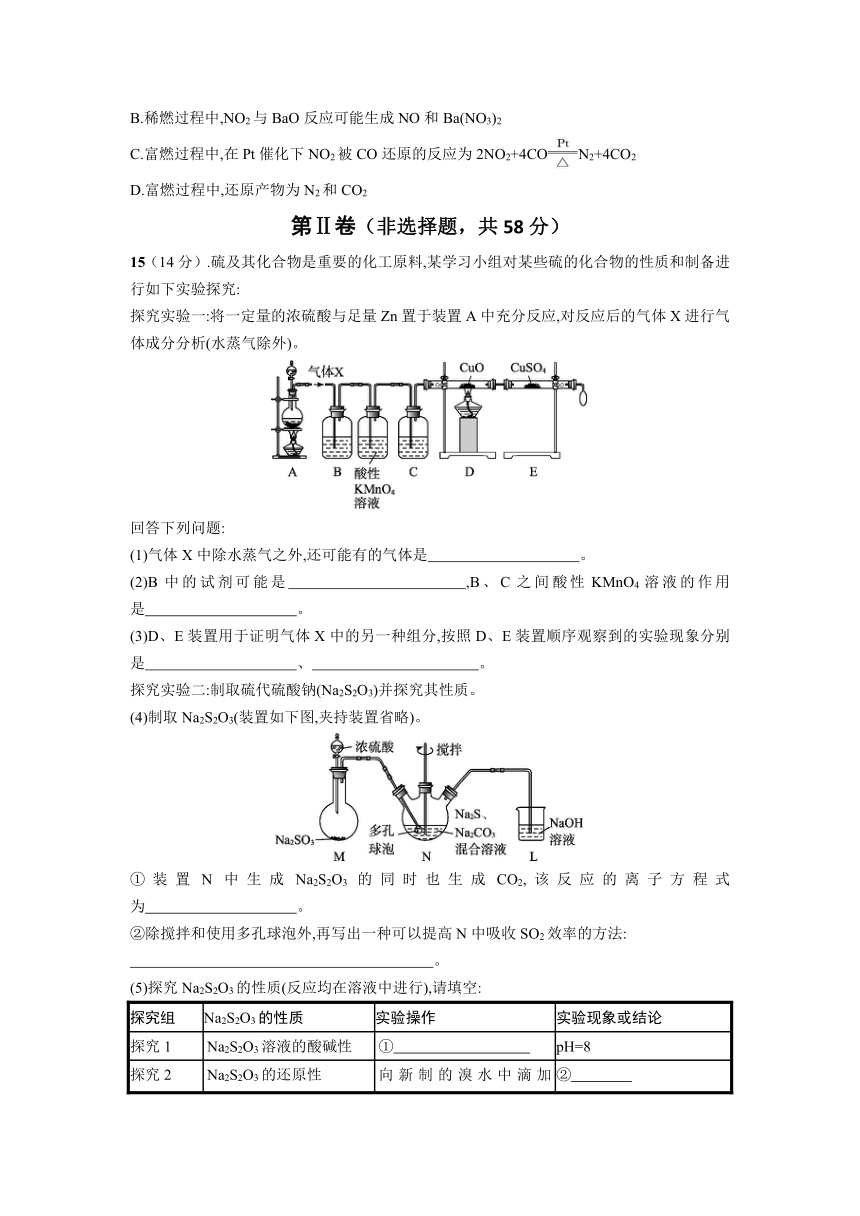
15(14分).硫及其化合物是重要的化工原料,某学习小组对某些硫的化合物的性质和制备进行如下实验探究:
探究实验一:将一定量的浓硫酸与足量Zn置于装置A中充分反应,对反应后的气体X进行气体成分分析(水蒸气除外)。
回答下列问题:
(1)气体X中除水蒸气之外,还可能有的气体是 。
(2)B中的试剂可能是 ,B、C之间酸性KMnO4溶液的作用是 。
(3)D、E装置用于证明气体X中的另一种组分,按照D、E装置顺序观察到的实验现象分别是 、 。
探究实验二:制取硫代硫酸钠(Na2S2O3)并探究其性质。
(4)制取Na2S2O3(装置如下图,夹持装置省略)。
①装置N中生成Na2S2O3的同时也生成CO2,该反应的离子方程式为 。
②除搅拌和使用多孔球泡外,再写出一种可以提高N中吸收SO2效率的方法:
。
(5)探究Na2S2O3的性质(反应均在溶液中进行),请填空:
探究组 Na2S2O3的性质 实验操作 实验现象或结论
探究1 Na2S2O3溶液的酸碱性 ① pH=8
探究2 Na2S2O3的还原性 向新制的溴水中滴加Na2S2O3溶液 ②
16(14分).电池是人类生产生活能源的重要来源之一。
Ⅰ.如图是一个原电池装置。
(1)该装置是利用反应a设计的原电池装置,反应a的离子方程式是 ;
反应b为NaOH+HClNaCl+H2O,该反应是否也可以设计成原电池,理由是 。
(2)按照构成原电池的基本要素来看,上述原电池中负极反应物是 (填化学式,下同),正极反应物是 ,正极材料是 。
(3)铜电极上的电极反应式为 。
(4)完整说明该原电池装置是如何形成电流的 。
Ⅱ.如图是利用反应c设计的原电池装置。
(5)反应c的离子方程式是 。
(6)该装置将氧化反应和还原反应分开进行,还原反应在 (填“铁”或“石墨”)电极上发生。
17(14分).立德粉(主要成分为BaSO4ZnS)常用作颜料。以粗氧化锌(主要成分为ZnO,还含少量CuO、Fe3O4等杂质)和BaS为原料制备立德粉的流程如图所示:
(1)写出“酸浸”过程中CuO发生反应的化学方程式: 。
(2)加入H2O2发生反应的离子方程式为 。
(3)分离出Fe(OH)3的实验操作名称为 。
(4)“除杂Ⅱ”中加入过量的锌粉主要除去 (填离子符号),该反应的反应类型为 。
(5)“滤渣”的成分是 。
(6)8.34g绿矾()晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示:
温度为时固体N的化学式为 ,取适量时所得的样品P,隔绝空气加热至得到一种红棕色固体物质Q,同时有两种无色气体生成,请写出该反应的化学方程式 。
18(16分).Ⅰ如图所示:在B水槽中装有500 mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B水槽的水中。充分反应后,试管A中余下气体的体积为0.5a mL。
(1)将A倒插入B槽中发生的反应为 ,该反应中氧化剂与还原剂的质量比为 ,原混合气体中NO2和NO的物质的量之比为 。
(2)通过导气管C向余下0.5a mL气体的试管A中持续通入氧气,A中可能观察到的现象是 。
(3)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度
为 mol·L-1(设溶液的体积仍为500 mL)。
Ⅱ、N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(4)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为 。
(5)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH-2N+H2O
2NO2+2OH-N+N+H2O
①下列措施一定能提高尾气中NO和NO2去除率的有 (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是 (填化学式);吸收后排放的尾气中含量较高的氮氧化物是 (填化学式)。
解析
1.B 解析 S单质的化合价为0,是硫元素的中间价态,故S既可做氧化剂,又可做还原剂,A错误;硫和热碱液反应生成金属硫化物、亚硫酸盐和水,金属硫化物中硫元素的化合价为-2价,亚硫酸盐里硫元素的化合价为+4价,在反应中,硫既体现氧化性,又体现还原性,B正确;硫的氧化性较弱,与变价金属化合时只能生成低价态金属硫化物,如S与Fe、Cu反应分别生成FeS、Cu2S,C错误;S和O2的反应中S被氧化,化合价升高,做还原剂,D错误。
2.C 解析 钝化过程为化学变化,铁、铝被浓硫酸氧化,A错误;用浓硫酸能在白纸上写出黑色文字,体现了浓硫酸的脱水性,而不是吸水性,B错误;浓硫酸中H2SO4难电离,主要以分子形式存在,C正确;浓硫酸具有强氧化性、吸水性、脱水性,而稀硫酸不具有,D错误。
3.B 解析 向溶液中滴加少量CuSO4溶液,锌置换出铜,可形成原电池,反应速率增大,A不符合题意;将食物储存在冰箱里,温度降低,反应速率减小,B符合题意;加入二氧化锰,在H2O2分解反应中起到催化剂作用,反应速率增大,C不符合题意;固体的表面积增大,反应速率增大,D不符合题意。
4.A 解析 恒容条件下,充入少量He,反应物的浓度不变,反应速率不变,A错误;其他条件不变,增加C(s)的质量,不能改变其浓度,故反应速率不变,C正确;该反应中C(s)是固体,平衡建立过程中气体总质量和总物质的量不断变化,混合气体的平均相对分子质量不断变化,当其不变时,该反应达到平衡状态,D正确。
5.D 解析 乙酸电离产生CH3COO-和H+,断裂a键,①正确;乙酸与乙醇发生酯化反应时,断裂乙酸中b键,②正确;Br2与乙酸发生取代反应生成BrCH2COOH,断裂c键,③正确;2分子乙酸反应生成1分子水和1分子乙酸酐,其中1分子乙酸断裂a键,1分子乙酸断裂b键,④正确。
6.C 解析 操作①发生的反应为复分解反应,为非氧化还原反应,A正确;由氯化镁溶液得MgCl2·6H2O晶体,需要采用蒸发浓缩、结晶、过滤的操作,B正确;由流程图可知,操作①为过滤,需要的玻璃仪器有烧杯、漏斗和玻璃棒,C错误;由流程图可知,整个制备过程中,发生的反应都不是置换反应,D正确。
7.A 解析 ①的分子式是C3H6,②的分子式是C3H6,③的分子式是C3H8,④的分子式是C3H4,⑤的分子式是C4H8,⑥的分子式是C4H10。只有①和②的分子式相同,其结构不同,互为同分异构体。
8.C 解析 由图示可知,反应物的总能量高于生成物的总能量,则该反应是放热反应,A错误;化学键的断裂需要吸收能量,而不是释放能量,B错误;化学键的断裂吸收能量,由图可知,断裂2 mol A—B需要吸收y kJ的能量,C正确;由图示可知,2 mol AB的总能量低于1 mol A2和1 mol B2的总能量,D错误。
9.D 解析 由于SiHCl3遇水强烈水解,H2应干燥,则装置B中的试剂是浓硫酸,A正确;SiHCl3在空气中易自燃,实验前应排尽装置内的空气,应先打开A中分液漏斗活塞产生H2,利用生成的H2排出装置内的空气,后打开装置C中分液漏斗的旋塞,B正确;SiHCl3呈液态,需转化为蒸气进入石英管中与H2反应,装置C中的烧瓶需要加热,C正确;制高纯硅时温度在1 100~1 200 ℃,在该反应温度下,普通玻璃管会软化,故不能采用普通玻璃管,D错误。
10.C 解析 NO2和O2的混合气体与水发生反应:4NO2+O2+2H2O4HNO3,充分反应后剩余5mL气体,讨论:①若剩余气体为O2,结合反应可知,反应消耗16 mL NO2和4 mL O2,则原混合气体中NO2和O2的体积比为16 mL∶(4 mL+5 mL)=16∶9,C正确。②若剩余气体为NO,结合反应3NO2+H2O2HNO3+NO,则参与该反应的NO2为15 mL,结合反应4NO2+O2+2H2O4HNO3可知,参与该反应的NO2为8 mL,O2为2 mL,则原混合气体中NO2和O2的体积比为(15 mL+8 mL)∶2 mL=23∶2,D错误。
11.B 解析 浓硫酸和铜在加热条件下反应可生成二氧化硫,二氧化硫是酸性氧化物,二氧化硫与NaOH溶液反应生成亚硫酸钠和水,NaOH溶液可以吸收尾气防止污染空气,A正确;SO2溶于水生成的亚硫酸的酸性较盐酸弱,不能与BaCl2发生反应,BaCl2溶液中不会出现白色沉淀,B错误;二氧化硫中硫元素的化合价是+4价,有氧化性,二氧化硫气体与H2S溶液在常温下反应生成淡黄色固体硫(单质)和水,体现SO2的氧化性,C正确;二氧化硫具有还原性,当A中KMnO4溶液没有褪色,说明二氧化硫已经被完全除尽,避免了二氧化硫和可溶性硅酸盐反应,二氧化碳和水反应生成碳酸,碳酸与可溶性硅酸盐反应析出硅酸白色沉淀,说明碳酸能制取硅酸,能证明碳酸酸性强于硅酸,D正确。
12.B 解析 A中反应为16HCl(浓)+2KMnO42KCl+2MnCl2+8H2O+5Cl2↑,氧化剂为KMnO4,还原剂为HCl,则氧化剂与还原剂物质的量之比为1∶5,A正确;根据C中导气管的位置可知,A中制备的气体密度大于空气,A装置制备Cl2,E装置中制备的气体密度小于空气,且干燥氨气用碱石灰,氯气不能用碱石灰干燥,会吸收氯气,故E装置制备NH3,B错误;装置C中观察到的现象是黄绿色变浅,有白烟产生,说明氯气和氨气反应生成NH4Cl,根据化合价的变化可知,氯气中氯元素的化合价从0价降低到-1价,则氮元素的化合价升高,另一种生成物是N2,C正确;NH3极易溶于水,难溶于四氯化碳,氨气进入有机层会上升,上升到稀硫酸中被吸收,可以防止倒吸,D正确。
13.D 解析 0~t1时,铝为原电池的负极,铜为正极,到t1时,铝在浓硝酸中钝化后不再反应,此时铜又成了原电池的负极。0~t1时,原电池的负极是Al片,A正确;0~t1时,硝酸根离子在正极得电子生成红棕色气体NO2,正极反应式为N+2H++e-NO2↑+H2O,B正确;t1后,铝发生钝化,铜作负极,故电池的正、负极发生互变,C正确;t1后,铜是负极,有0.3 mol电子发生转移,就有0.15 mol铜失去电子,负极质量减少9.6 g,D错误。
14.D 解析 稀燃过程中,NO和O2在Pt表面反应生成NO2,Pt是催化剂,A正确;稀燃过程中,NO2与BaO反应生成Ba(NO3)2,该过程中NO2被氧化,根据氧化还原反应规律推知,NO2可能被还原生成NO,B正确;富燃过程中,NO2与CO、CxHy等在Pt催化下反应生成N2、CO2和H2O,C正确;富燃过程中,还原产物为N2,氧化产物为CO2,D错误。
15.答案 (1)二氧化硫、氢气
(2)品红溶液(或酸性高锰酸钾溶液、溴水) 除去气体中残余的二氧化硫
(3)黑色粉末变红色 白色粉末变蓝色
(4)①4SO2+2S2-+C3S2+CO2
②控制二氧化硫的流速、适当增大N中混合溶液的浓度、适当升高N中溶液的温度等
(5)①把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在pH试纸的中部,试纸变色后,与标准比色卡比较确定溶液的pH
②溴水颜色变浅(或溴水褪色)
解析 (1)浓硫酸与足量Zn反应产生硫酸锌、二氧化硫和水,当反应进行到一定程度时,浓硫酸变为稀硫酸,Zn与稀硫酸反应产生硫酸锌和氢气。所以气体X除水蒸气外还可能含有SO2、H2。
(2)装置B的作用是检验SO2,SO2具有漂白性、还原性,可以选择品红溶液、酸性高锰酸钾溶液(或溴水)作为检验试剂;检验H2之前,应先排除SO2的干扰,故B、C之间的酸性高锰酸钾溶液用来除去气体中残余的SO2。
(3)D、E装置用于证明气体X中的H2,D中H2还原黑色CuO粉末生成红色的Cu单质,反应生成的水进入盛有无水硫酸铜的E装置中,会看到白色粉末硫酸铜结合水得到蓝色硫酸铜晶体。
(4)①装置N中由M制得的SO2与Na2S、Na2CO3反应生成Na2S2O3的同时也生成CO2,根据原子守恒、得失电子守恒、电荷守恒可得,反应的离子方程式为4SO2+2S2-+C3S2+CO2。②控制SO2的流速、适当增大N中混合溶液的浓度、适当升高N中溶液的温度等都可以提高N中吸收SO2的效率。
(5)探究1:由pH=8可知探究1为测定Na2S2O3溶液的pH,操作:把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在pH试纸的中部,待试纸变色后,与标准比色卡比较确定溶液的pH。
探究2:探究Na2S2O3溶液的还原性,向Na2S2O3溶液中加入溴水,溴水呈橙色,Na2S2O3溶液无色,若二者发生氧化还原反应,则溴水颜色变浅(或溴水褪色)。
16.答案 (1)Zn+2H+Zn2++H2↑ 不可以,不是氧化还原反应,无电子转移
(2)Zn H2SO4(H+) Cu
(3)2H++2e-H2↑
(4)锌电极失去电子,电子通过导线传导到铜电极上,溶液中的氢离子在铜电极得到电子。同时,电解质溶液中的离子定向移动,形成闭合回路,形成电流
(5)Fe+2Fe3+3Fe2+
(6)石墨
解析 (1)铜与稀硫酸不反应,锌与稀硫酸能反应生成硫酸锌和氢气,反应的离子方程式是Zn+2H+Zn2++H2↑;反应b(NaOH+HClNaCl+H2O)不是氧化还原反应,没有电子转移,不能设计成原电池。
(2)按照构成电池的基本要素来看,锌的活泼性强于铜,负极反应物是Zn,氢离子在正极得电子生成氢气,正极反应物是H2SO4(H+),正极材料是Cu。
(3)铜电极是正极,正极反应式是2H++2e-H2↑。
(4)锌电极失去电子,电子通过导线传导到铜电极上,溶液中的氢离子在铜电极得到电子。同时,电解质溶液中的离子定向移动,形成闭合回路,形成电流。
(5)根据图示,铁和氯化铁反应生成氯化亚铁,反应的离子方程式为Fe+2Fe3+3Fe2+。
(6)该装置将氧化反应和还原反应分开进行,铁电极发生反应Fe-2e-Fe2+,石墨电极上发生反应Fe3++e-Fe2+,故还原反应在石墨电极上发生。
17.【答案】(1)(2分)
(2)(2分)
(3)过滤(2分)
(4)Cu2+(2分) 置换反应(2分)
(5)Cu和Zn(2分)
(6)FeSO4·H2O(2分) 2FeSO4Fe2O3+SO2↑+SO3↑(2分)
【解析】(1)根据以上分析,“酸浸”过程中CuO和硫酸反应生成硫酸铜和水,反应的离子方程式为。(2)加入H2O2是为了将Fe2+氧化为Fe3+,发生反应的离子方程式为:。(3)溶液中分离沉淀用过滤。(4)根据以上分析,向所得滤液中加入过量锌粉,置换出铜,过滤除Cu2+,该反应为置换反应。(5)根据以上分析,“滤渣”的成分是置换出的Cu和剩余的Zn。(6)温度为159℃时,固体N的质量为5.10g,其中m(FeSO4)=0.03mol×152g/mol=4.56g,m(H2O)=5.10g-4.56g=0.54g,n(H2O)==0.03mol,n(H2O)∶n(FeSO4)=0.03mol∶0.03mol=1∶1,则N的化学式为FeSO4·H2O,加热至635℃时,固体质量为2.40g,其中n(Fe)=n(FeSO4·7H2O)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g-1.68g=0.72g,n(O)==0.045mol,n(Fe)∶n(O)=0.03mol∶0.045mol=2∶3,所以固体Q的化学式为Fe2O3,则由P的得到Q的化学方程式为2FeSO4Fe2O3+SO2↑+SO3↑。
18.答案 (1)3NO2+H2O2HNO3+NO 1∶2 3∶1
(2)无色气体变为红棕色,试管中液面不断上升至全充满;继续通入氧气后,试管中液面下降,最后充满无色气体
(3)
(4)2NH3+2O2N2O+3H2O
(5)①BC ②NaNO3 NO
解析 (1)试管A倒插入B水槽水中后,发生反应为3NO2+H2O2HNO3+NO,氧化剂与还原剂均为NO2,质量比为1∶2。根据题意有n(NO2)+n(NO)=[n(NO2)+n(NO)],n(NO2)∶n(NO)=3∶1。(2)试管A中剩余的0.5a mL 气体为NO,通入氧气后,发生反应2NO+O22NO2、4NO2+O2+2H2O4HNO3,可写为4NO+3O2+2H2O4HNO3。故可观察到的现象为无色气体变为红棕色气体,试管中液面不断上升至全充满;继续通入氧气后,试管中液面下降,最后充满无色气体(O2)。(3)试管中充满气体时,根据氮原子守恒,水槽B溶液中n(HNO3)=n(气体)=×10-3 mol, c(HNO3)= mol·L-1。
(4)NH3与O2反应生成N2O和H2O。
(5)①加速通入尾气可能导致尾气吸收不完全,去除率降低,A错误;气、液逆流的目的是将气体与液体充分接触,可提高尾气的去除率,B正确;定期补加适量NaOH溶液,可吸收更多的尾气,C正确。②NO2与NaOH反应生成NaNO2和NaNO3,则主要杂质为NaNO3;根据题给方程式可知,n(NO2)∶n(NO)≥1时,可以被NaOH溶液完全吸收,n(NO2)∶n(NO)<1时,多余的NO不能被NaOH溶液吸收,故尾气中含量较高的氮氧化物是NO。
仁寿一中北校区高2023级期末考试
化学
本试卷分为试题卷和答题卡两部分,其中试题卷由第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)组成,共6页;答题卡共2页。满分100分,考试时间75分钟。
注意事项:
1. 答题前,考生务必将自己的学校、班级、姓名用0.5毫米黑色墨水签字笔填写清楚,同时用2B铅笔将考号准确填涂在“考号”栏目内。
2. 选择题使用2B铅笔填涂在答题卡对应题目标号的位置上,如需改动,用橡皮擦擦干净后再选涂其它答案;非选择题用0.5毫米黑色墨水签字笔书写在答题卡的对应框内,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
3. 考试结束后将答题卡收回。
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Al 27 Cu 64
第Ⅰ卷(选择题,共42分)
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项最符合题意)
1.(2023·河北沧州高一期末)硫黄即硫单质。下列说法中正确的是( )
A.根据化合价可知,S在化学反应中只能做还原剂
B.硫单质可以溶于热碱,体现氧化性和还原性
C.过量的硫与铜反应生成CuS,表现硫单质的氧化性
D.S+O2SO2,S被氧化,做氧化剂
2.(2023·浙江杭州师大附中高一期中)下列有关说法正确的是( )
A.常温下浓硫酸不能与铁、铝发生反应而使铁、铝等金属钝化
B.用浓硫酸能在白纸上写出黑色文字,这体现了浓硫酸的吸水性
C.浓硫酸中硫酸主要以H2SO4分子形式存在
D.稀硫酸和浓硫酸因为均含有硫酸,所以其性质相同
3.(2023·山西忻州高一期中)下列措施能减慢化学反应速率的是( )
A.用Zn和2 mol·L-1 H2SO4溶液反应制取H2时,向溶液中滴加少量CuSO4溶液
B.日常生活中,将食物储存在冰箱中
C.用过氧化氢溶液制氧气时添加少量二氧化锰粉末
D.用相同质量的锌粉替代锌粒与同浓度、同体积的盐酸反应制氢气
4.对于在恒容密闭容器中进行的反应C(s)+H2O(g)CO(g)+H2(g),下列说法错误的是( )
A.其他条件不变,充入少量He,则反应速率增大
B.若v正(CO)=v逆(H2O),则反应达到平衡状态
C.其他条件不变,增加C(s)的质量,反应速率不变
D.若混合气体的平均相对分子质量不再改变,则反应达到平衡状态
5.(2023·辽宁本溪高一期中)乙酸分子的结构式为,下列关于断键部位的叙述正确的是( )
①乙酸在水溶液中电离时断裂a键
②乙酸与乙醇发生酯化反应时断裂b键
③在红磷存在时,Br2与CH3COOH的反应方程式可表示为CH3COOH+Br2CH2Br—COOH+HBr,乙酸在该反应中断裂c键
④一定条件下,2 mol乙酸生成1 mol乙酸酐的方程式可表示为2CH3COOH+H2O,乙酸在反应中分别断裂a、b键
A.①③④ B.①②④
C.②③ D.①②③④
6.(2023·湖北黄冈高一期末)某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如下。下列说法错误的是( )
盐卤Mg(OH)2MgCl2溶液MgCl2·6H2OMgCl2Mg
A.操作①发生的反应为非氧化还原反应
B.操作②是蒸发浓缩、结晶、过滤
C.若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器
D.在整个制备过程中,未发生置换反应
7.下列有机化合物中互为同分异构体的是( )
①CH2CHCH3 ② ③CH3CH2CH3 ④HC≡CCH3 ⑤ ⑥CH3CH2CH2CH3
A.①和② B.①和③
C.①和④ D.⑤和⑥
8.(2023·河南信阳高一期中)化学反应A2+B22AB的能量变化如图所示,则下列说法正确的是(ΔE表示能量变化)( )
A.1 mol A2和1 mol B2完全反应吸收(y-x) kJ热量
B.断裂1 mol A—A和1 mol B—B释放x kJ的能量
C.断裂2 mol A—B需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
9.(2023·安徽淮北高一期末)制造芯片要用到高纯硅,用SiHCl3与过量H2在1 100~1 200 ℃反应制备高纯硅的装置如图所示(热源及夹持装置略去)。
已知:SiHCl3遇水强烈反应,在空气中易自燃。下列说法错误的是( )
A.装置B中的试剂是浓硫酸
B.实验时先打开装置A中分液漏斗的旋塞
C.装置C中的烧瓶需要加热,其目的是使滴入烧瓶中的SiHCl3汽化
D.装置D不能采用普通玻璃管的原因是SiO2与HCl会发生反应
10.(2023·山东平度高一期末)将盛有25 mL NO2和O2混合气体的量筒倒置于盛满水的水槽中,一段时间后,气体体积减小到5 mL且不再变化(同温同压下测定),则原混合气体中NO2和O2的体积比可能为( )
A.1∶1 B.18∶7
C.16∶9 D.2∶32
11.(2023·天津河西区高一期中)已知H2SiO3难溶于水,且其酸性比H2CO3弱,根据如图装置完成系列实验(加热装置省略),下列说法不正确的是( )
A.NaOH溶液可以吸收尾气,防止污染空气
B.BaCl2溶液中会出现白色沉淀BaSO3
C.H2S溶液中会出现淡黄色沉淀,体现SO2的氧化性
D.为验证碳、硅两种元素非金属性的强弱,A中的试剂可以是酸性KMnO4溶液
12.(2023·广东广州高一期中)某化学课外活动小组通过下列实验验证Cl2与NH3的反应,下列有关说法错误的是( )
资料:氯气易溶于四氯化碳,氨气极易溶于水,却难溶于四氯化碳
A.用KMnO4和浓盐酸制备Cl2时,氧化剂与还原剂的物质的量之比为1∶5
B.A装置制备NH3,E装置制备Cl2
C.反应时,装置C中能观察到的现象是黄绿色变浅,有白烟产生,说明生成NH4Cl
D.尾气中的NH3可用F装置来吸收
13.(2023·河南驻马店高一期中)常温下,将除去表面氧化膜的Al、Cu片插入浓硝酸中构成原电池(图1),测得原电池的电流(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
下列说法错误的是( )
A.0~t1时,原电池的负极是Al片
B.0~t1时,正极的电极反应式是N+2H++e-NO2↑+H2O
C.t1后,原电池的正、负极发生互变
D.t1后,正极上每得到0.3 mol电子,则负极质量减少2.7 g
14.汽车发动机在稀燃和富燃条件下交替进行,将尾气中的NOx在催化剂上反应脱除。其工作原理示意图如下:
下列说法错误的是( )
A.稀燃过程中,Pt作催化剂,NO与氧气反应生成NO2
B.稀燃过程中,NO2与BaO反应可能生成NO和Ba(NO3)2
C.富燃过程中,在Pt催化下NO2被CO还原的反应为2NO2+4CON2+4CO2
D.富燃过程中,还原产物为N2和CO2
第Ⅱ卷(非选择题,共58分)
15(14分).硫及其化合物是重要的化工原料,某学习小组对某些硫的化合物的性质和制备进行如下实验探究:
探究实验一:将一定量的浓硫酸与足量Zn置于装置A中充分反应,对反应后的气体X进行气体成分分析(水蒸气除外)。
回答下列问题:
(1)气体X中除水蒸气之外,还可能有的气体是 。
(2)B中的试剂可能是 ,B、C之间酸性KMnO4溶液的作用是 。
(3)D、E装置用于证明气体X中的另一种组分,按照D、E装置顺序观察到的实验现象分别是 、 。
探究实验二:制取硫代硫酸钠(Na2S2O3)并探究其性质。
(4)制取Na2S2O3(装置如下图,夹持装置省略)。
①装置N中生成Na2S2O3的同时也生成CO2,该反应的离子方程式为 。
②除搅拌和使用多孔球泡外,再写出一种可以提高N中吸收SO2效率的方法:
。
(5)探究Na2S2O3的性质(反应均在溶液中进行),请填空:
探究组 Na2S2O3的性质 实验操作 实验现象或结论
探究1 Na2S2O3溶液的酸碱性 ① pH=8
探究2 Na2S2O3的还原性 向新制的溴水中滴加Na2S2O3溶液 ②
16(14分).电池是人类生产生活能源的重要来源之一。
Ⅰ.如图是一个原电池装置。
(1)该装置是利用反应a设计的原电池装置,反应a的离子方程式是 ;
反应b为NaOH+HClNaCl+H2O,该反应是否也可以设计成原电池,理由是 。
(2)按照构成原电池的基本要素来看,上述原电池中负极反应物是 (填化学式,下同),正极反应物是 ,正极材料是 。
(3)铜电极上的电极反应式为 。
(4)完整说明该原电池装置是如何形成电流的 。
Ⅱ.如图是利用反应c设计的原电池装置。
(5)反应c的离子方程式是 。
(6)该装置将氧化反应和还原反应分开进行,还原反应在 (填“铁”或“石墨”)电极上发生。
17(14分).立德粉(主要成分为BaSO4ZnS)常用作颜料。以粗氧化锌(主要成分为ZnO,还含少量CuO、Fe3O4等杂质)和BaS为原料制备立德粉的流程如图所示:
(1)写出“酸浸”过程中CuO发生反应的化学方程式: 。
(2)加入H2O2发生反应的离子方程式为 。
(3)分离出Fe(OH)3的实验操作名称为 。
(4)“除杂Ⅱ”中加入过量的锌粉主要除去 (填离子符号),该反应的反应类型为 。
(5)“滤渣”的成分是 。
(6)8.34g绿矾()晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示:
温度为时固体N的化学式为 ,取适量时所得的样品P,隔绝空气加热至得到一种红棕色固体物质Q,同时有两种无色气体生成,请写出该反应的化学方程式 。
18(16分).Ⅰ如图所示:在B水槽中装有500 mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B水槽的水中。充分反应后,试管A中余下气体的体积为0.5a mL。
(1)将A倒插入B槽中发生的反应为 ,该反应中氧化剂与还原剂的质量比为 ,原混合气体中NO2和NO的物质的量之比为 。
(2)通过导气管C向余下0.5a mL气体的试管A中持续通入氧气,A中可能观察到的现象是 。
(3)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度
为 mol·L-1(设溶液的体积仍为500 mL)。
Ⅱ、N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(4)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为 。
(5)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH-2N+H2O
2NO2+2OH-N+N+H2O
①下列措施一定能提高尾气中NO和NO2去除率的有 (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是 (填化学式);吸收后排放的尾气中含量较高的氮氧化物是 (填化学式)。
解析
1.B 解析 S单质的化合价为0,是硫元素的中间价态,故S既可做氧化剂,又可做还原剂,A错误;硫和热碱液反应生成金属硫化物、亚硫酸盐和水,金属硫化物中硫元素的化合价为-2价,亚硫酸盐里硫元素的化合价为+4价,在反应中,硫既体现氧化性,又体现还原性,B正确;硫的氧化性较弱,与变价金属化合时只能生成低价态金属硫化物,如S与Fe、Cu反应分别生成FeS、Cu2S,C错误;S和O2的反应中S被氧化,化合价升高,做还原剂,D错误。
2.C 解析 钝化过程为化学变化,铁、铝被浓硫酸氧化,A错误;用浓硫酸能在白纸上写出黑色文字,体现了浓硫酸的脱水性,而不是吸水性,B错误;浓硫酸中H2SO4难电离,主要以分子形式存在,C正确;浓硫酸具有强氧化性、吸水性、脱水性,而稀硫酸不具有,D错误。
3.B 解析 向溶液中滴加少量CuSO4溶液,锌置换出铜,可形成原电池,反应速率增大,A不符合题意;将食物储存在冰箱里,温度降低,反应速率减小,B符合题意;加入二氧化锰,在H2O2分解反应中起到催化剂作用,反应速率增大,C不符合题意;固体的表面积增大,反应速率增大,D不符合题意。
4.A 解析 恒容条件下,充入少量He,反应物的浓度不变,反应速率不变,A错误;其他条件不变,增加C(s)的质量,不能改变其浓度,故反应速率不变,C正确;该反应中C(s)是固体,平衡建立过程中气体总质量和总物质的量不断变化,混合气体的平均相对分子质量不断变化,当其不变时,该反应达到平衡状态,D正确。
5.D 解析 乙酸电离产生CH3COO-和H+,断裂a键,①正确;乙酸与乙醇发生酯化反应时,断裂乙酸中b键,②正确;Br2与乙酸发生取代反应生成BrCH2COOH,断裂c键,③正确;2分子乙酸反应生成1分子水和1分子乙酸酐,其中1分子乙酸断裂a键,1分子乙酸断裂b键,④正确。
6.C 解析 操作①发生的反应为复分解反应,为非氧化还原反应,A正确;由氯化镁溶液得MgCl2·6H2O晶体,需要采用蒸发浓缩、结晶、过滤的操作,B正确;由流程图可知,操作①为过滤,需要的玻璃仪器有烧杯、漏斗和玻璃棒,C错误;由流程图可知,整个制备过程中,发生的反应都不是置换反应,D正确。
7.A 解析 ①的分子式是C3H6,②的分子式是C3H6,③的分子式是C3H8,④的分子式是C3H4,⑤的分子式是C4H8,⑥的分子式是C4H10。只有①和②的分子式相同,其结构不同,互为同分异构体。
8.C 解析 由图示可知,反应物的总能量高于生成物的总能量,则该反应是放热反应,A错误;化学键的断裂需要吸收能量,而不是释放能量,B错误;化学键的断裂吸收能量,由图可知,断裂2 mol A—B需要吸收y kJ的能量,C正确;由图示可知,2 mol AB的总能量低于1 mol A2和1 mol B2的总能量,D错误。
9.D 解析 由于SiHCl3遇水强烈水解,H2应干燥,则装置B中的试剂是浓硫酸,A正确;SiHCl3在空气中易自燃,实验前应排尽装置内的空气,应先打开A中分液漏斗活塞产生H2,利用生成的H2排出装置内的空气,后打开装置C中分液漏斗的旋塞,B正确;SiHCl3呈液态,需转化为蒸气进入石英管中与H2反应,装置C中的烧瓶需要加热,C正确;制高纯硅时温度在1 100~1 200 ℃,在该反应温度下,普通玻璃管会软化,故不能采用普通玻璃管,D错误。
10.C 解析 NO2和O2的混合气体与水发生反应:4NO2+O2+2H2O4HNO3,充分反应后剩余5mL气体,讨论:①若剩余气体为O2,结合反应可知,反应消耗16 mL NO2和4 mL O2,则原混合气体中NO2和O2的体积比为16 mL∶(4 mL+5 mL)=16∶9,C正确。②若剩余气体为NO,结合反应3NO2+H2O2HNO3+NO,则参与该反应的NO2为15 mL,结合反应4NO2+O2+2H2O4HNO3可知,参与该反应的NO2为8 mL,O2为2 mL,则原混合气体中NO2和O2的体积比为(15 mL+8 mL)∶2 mL=23∶2,D错误。
11.B 解析 浓硫酸和铜在加热条件下反应可生成二氧化硫,二氧化硫是酸性氧化物,二氧化硫与NaOH溶液反应生成亚硫酸钠和水,NaOH溶液可以吸收尾气防止污染空气,A正确;SO2溶于水生成的亚硫酸的酸性较盐酸弱,不能与BaCl2发生反应,BaCl2溶液中不会出现白色沉淀,B错误;二氧化硫中硫元素的化合价是+4价,有氧化性,二氧化硫气体与H2S溶液在常温下反应生成淡黄色固体硫(单质)和水,体现SO2的氧化性,C正确;二氧化硫具有还原性,当A中KMnO4溶液没有褪色,说明二氧化硫已经被完全除尽,避免了二氧化硫和可溶性硅酸盐反应,二氧化碳和水反应生成碳酸,碳酸与可溶性硅酸盐反应析出硅酸白色沉淀,说明碳酸能制取硅酸,能证明碳酸酸性强于硅酸,D正确。
12.B 解析 A中反应为16HCl(浓)+2KMnO42KCl+2MnCl2+8H2O+5Cl2↑,氧化剂为KMnO4,还原剂为HCl,则氧化剂与还原剂物质的量之比为1∶5,A正确;根据C中导气管的位置可知,A中制备的气体密度大于空气,A装置制备Cl2,E装置中制备的气体密度小于空气,且干燥氨气用碱石灰,氯气不能用碱石灰干燥,会吸收氯气,故E装置制备NH3,B错误;装置C中观察到的现象是黄绿色变浅,有白烟产生,说明氯气和氨气反应生成NH4Cl,根据化合价的变化可知,氯气中氯元素的化合价从0价降低到-1价,则氮元素的化合价升高,另一种生成物是N2,C正确;NH3极易溶于水,难溶于四氯化碳,氨气进入有机层会上升,上升到稀硫酸中被吸收,可以防止倒吸,D正确。
13.D 解析 0~t1时,铝为原电池的负极,铜为正极,到t1时,铝在浓硝酸中钝化后不再反应,此时铜又成了原电池的负极。0~t1时,原电池的负极是Al片,A正确;0~t1时,硝酸根离子在正极得电子生成红棕色气体NO2,正极反应式为N+2H++e-NO2↑+H2O,B正确;t1后,铝发生钝化,铜作负极,故电池的正、负极发生互变,C正确;t1后,铜是负极,有0.3 mol电子发生转移,就有0.15 mol铜失去电子,负极质量减少9.6 g,D错误。
14.D 解析 稀燃过程中,NO和O2在Pt表面反应生成NO2,Pt是催化剂,A正确;稀燃过程中,NO2与BaO反应生成Ba(NO3)2,该过程中NO2被氧化,根据氧化还原反应规律推知,NO2可能被还原生成NO,B正确;富燃过程中,NO2与CO、CxHy等在Pt催化下反应生成N2、CO2和H2O,C正确;富燃过程中,还原产物为N2,氧化产物为CO2,D错误。
15.答案 (1)二氧化硫、氢气
(2)品红溶液(或酸性高锰酸钾溶液、溴水) 除去气体中残余的二氧化硫
(3)黑色粉末变红色 白色粉末变蓝色
(4)①4SO2+2S2-+C3S2+CO2
②控制二氧化硫的流速、适当增大N中混合溶液的浓度、适当升高N中溶液的温度等
(5)①把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在pH试纸的中部,试纸变色后,与标准比色卡比较确定溶液的pH
②溴水颜色变浅(或溴水褪色)
解析 (1)浓硫酸与足量Zn反应产生硫酸锌、二氧化硫和水,当反应进行到一定程度时,浓硫酸变为稀硫酸,Zn与稀硫酸反应产生硫酸锌和氢气。所以气体X除水蒸气外还可能含有SO2、H2。
(2)装置B的作用是检验SO2,SO2具有漂白性、还原性,可以选择品红溶液、酸性高锰酸钾溶液(或溴水)作为检验试剂;检验H2之前,应先排除SO2的干扰,故B、C之间的酸性高锰酸钾溶液用来除去气体中残余的SO2。
(3)D、E装置用于证明气体X中的H2,D中H2还原黑色CuO粉末生成红色的Cu单质,反应生成的水进入盛有无水硫酸铜的E装置中,会看到白色粉末硫酸铜结合水得到蓝色硫酸铜晶体。
(4)①装置N中由M制得的SO2与Na2S、Na2CO3反应生成Na2S2O3的同时也生成CO2,根据原子守恒、得失电子守恒、电荷守恒可得,反应的离子方程式为4SO2+2S2-+C3S2+CO2。②控制SO2的流速、适当增大N中混合溶液的浓度、适当升高N中溶液的温度等都可以提高N中吸收SO2的效率。
(5)探究1:由pH=8可知探究1为测定Na2S2O3溶液的pH,操作:把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在pH试纸的中部,待试纸变色后,与标准比色卡比较确定溶液的pH。
探究2:探究Na2S2O3溶液的还原性,向Na2S2O3溶液中加入溴水,溴水呈橙色,Na2S2O3溶液无色,若二者发生氧化还原反应,则溴水颜色变浅(或溴水褪色)。
16.答案 (1)Zn+2H+Zn2++H2↑ 不可以,不是氧化还原反应,无电子转移
(2)Zn H2SO4(H+) Cu
(3)2H++2e-H2↑
(4)锌电极失去电子,电子通过导线传导到铜电极上,溶液中的氢离子在铜电极得到电子。同时,电解质溶液中的离子定向移动,形成闭合回路,形成电流
(5)Fe+2Fe3+3Fe2+
(6)石墨
解析 (1)铜与稀硫酸不反应,锌与稀硫酸能反应生成硫酸锌和氢气,反应的离子方程式是Zn+2H+Zn2++H2↑;反应b(NaOH+HClNaCl+H2O)不是氧化还原反应,没有电子转移,不能设计成原电池。
(2)按照构成电池的基本要素来看,锌的活泼性强于铜,负极反应物是Zn,氢离子在正极得电子生成氢气,正极反应物是H2SO4(H+),正极材料是Cu。
(3)铜电极是正极,正极反应式是2H++2e-H2↑。
(4)锌电极失去电子,电子通过导线传导到铜电极上,溶液中的氢离子在铜电极得到电子。同时,电解质溶液中的离子定向移动,形成闭合回路,形成电流。
(5)根据图示,铁和氯化铁反应生成氯化亚铁,反应的离子方程式为Fe+2Fe3+3Fe2+。
(6)该装置将氧化反应和还原反应分开进行,铁电极发生反应Fe-2e-Fe2+,石墨电极上发生反应Fe3++e-Fe2+,故还原反应在石墨电极上发生。
17.【答案】(1)(2分)
(2)(2分)
(3)过滤(2分)
(4)Cu2+(2分) 置换反应(2分)
(5)Cu和Zn(2分)
(6)FeSO4·H2O(2分) 2FeSO4Fe2O3+SO2↑+SO3↑(2分)
【解析】(1)根据以上分析,“酸浸”过程中CuO和硫酸反应生成硫酸铜和水,反应的离子方程式为。(2)加入H2O2是为了将Fe2+氧化为Fe3+,发生反应的离子方程式为:。(3)溶液中分离沉淀用过滤。(4)根据以上分析,向所得滤液中加入过量锌粉,置换出铜,过滤除Cu2+,该反应为置换反应。(5)根据以上分析,“滤渣”的成分是置换出的Cu和剩余的Zn。(6)温度为159℃时,固体N的质量为5.10g,其中m(FeSO4)=0.03mol×152g/mol=4.56g,m(H2O)=5.10g-4.56g=0.54g,n(H2O)==0.03mol,n(H2O)∶n(FeSO4)=0.03mol∶0.03mol=1∶1,则N的化学式为FeSO4·H2O,加热至635℃时,固体质量为2.40g,其中n(Fe)=n(FeSO4·7H2O)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g-1.68g=0.72g,n(O)==0.045mol,n(Fe)∶n(O)=0.03mol∶0.045mol=2∶3,所以固体Q的化学式为Fe2O3,则由P的得到Q的化学方程式为2FeSO4Fe2O3+SO2↑+SO3↑。
18.答案 (1)3NO2+H2O2HNO3+NO 1∶2 3∶1
(2)无色气体变为红棕色,试管中液面不断上升至全充满;继续通入氧气后,试管中液面下降,最后充满无色气体
(3)
(4)2NH3+2O2N2O+3H2O
(5)①BC ②NaNO3 NO
解析 (1)试管A倒插入B水槽水中后,发生反应为3NO2+H2O2HNO3+NO,氧化剂与还原剂均为NO2,质量比为1∶2。根据题意有n(NO2)+n(NO)=[n(NO2)+n(NO)],n(NO2)∶n(NO)=3∶1。(2)试管A中剩余的0.5a mL 气体为NO,通入氧气后,发生反应2NO+O22NO2、4NO2+O2+2H2O4HNO3,可写为4NO+3O2+2H2O4HNO3。故可观察到的现象为无色气体变为红棕色气体,试管中液面不断上升至全充满;继续通入氧气后,试管中液面下降,最后充满无色气体(O2)。(3)试管中充满气体时,根据氮原子守恒,水槽B溶液中n(HNO3)=n(气体)=×10-3 mol, c(HNO3)= mol·L-1。
(4)NH3与O2反应生成N2O和H2O。
(5)①加速通入尾气可能导致尾气吸收不完全,去除率降低,A错误;气、液逆流的目的是将气体与液体充分接触,可提高尾气的去除率,B正确;定期补加适量NaOH溶液,可吸收更多的尾气,C正确。②NO2与NaOH反应生成NaNO2和NaNO3,则主要杂质为NaNO3;根据题给方程式可知,n(NO2)∶n(NO)≥1时,可以被NaOH溶液完全吸收,n(NO2)∶n(NO)<1时,多余的NO不能被NaOH溶液吸收,故尾气中含量较高的氮氧化物是NO。
同课章节目录
