安徽省宣城市2023-2024学年高一下学期7月期末考试化学试题(含答案)
文档属性
| 名称 | 安徽省宣城市2023-2024学年高一下学期7月期末考试化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 606.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-05 08:30:12 | ||
图片预览

文档简介
宣城市2023-2024学年高一下学期7月期末考试
化学试题
注意事项:
本试卷分选择题和非选择题两部分,满分100分,考试时间75分钟。
1.答题前,考生务必将自己的姓名、考号填写在答题卷上并将条形码粘贴在指定区域。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卷上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卷上,写在本试卷上无效。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Cl-35.5 I-127
一、选择题:本题共15小题,共50分。第1~10小题,每小题3分;第11~15小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下图是我国自主研制的“飞天"舱外航天服。下列有关航天服涉及的材料中,不属于有机高分子材料的是
A.羊毛 B.玻璃纤维 C.聚氯乙烯 D.聚四氟乙烯
2.宣城美食享誉省内外。下列叙述错误的是
A.水阳鸭脚包中的鸭掌含有蛋白质
B.绩溪一品锅中的冬笋含有纤维素
C.泾县发糕使用的糯米主要成分是淀粉
D.宁国粑粑使用的植物油主要成分为饱和高级脂肪酸甘油酯
3.利用4个碳原子,以碳碳单键相连,拼插合理的链状碳骨架有
A.2种 B.3种 C.4种 D.5种
4.日常生活中的下列措施,与调控反应速率无关的是
A.疫苗冷藏储存 B.食品抽真空包装
C.门窗合页里注润滑油 D.铁制品表面刷油漆
5.已知反应CH4+Cl2CH3Cl+HCl,下列说法正确的是
A.CH4的空间填充模型为
B.Cl2的电子式为Cl:Cl
C.CH3C1的官能团为—CH3
D.C1-的结构示意图为
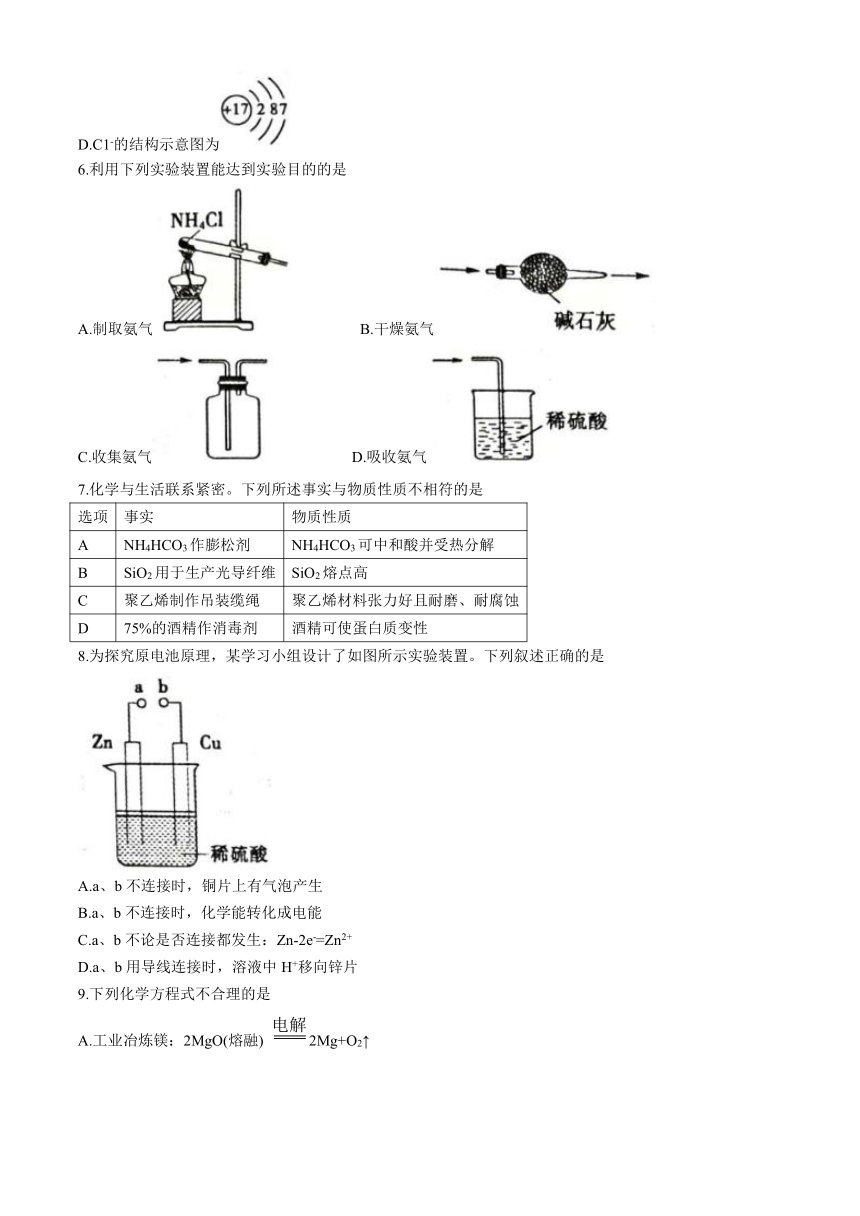
6.利用下列实验装置能达到实验目的的是
A.制取氨气 B.干燥氨气
C.收集氨气 D.吸收氨气
7.化学与生活联系紧密。下列所述事实与物质性质不相符的是
选项 事实 物质性质
A NH4HCO3作膨松剂 NH4HCO3可中和酸并受热分解
B SiO2用于生产光导纤维 SiO2熔点高
C 聚乙烯制作吊装缆绳 聚乙烯材料张力好且耐磨、耐腐蚀
D 75%的酒精作消毒剂 酒精可使蛋白质变性
8.为探究原电池原理,某学习小组设计了如图所示实验装置。下列叙述正确的是
A.a、b不连接时,铜片上有气泡产生
B.a、b不连接时,化学能转化成电能
C.a、b不论是否连接都发生:Zn-2e-=Zn2+
D.a、b用导线连接时,溶液中H+移向锌片
9.下列化学方程式不合理的是
A.工业冶炼镁:2MgO(熔融) 2Mg+O2↑
B.工业制粗硅:2C+SiO2Si+2CO↑
C.煤的气化:C+H2O(g)CO+H2
D.蔗糖水解:C12H22O11+H2OC6H12O6(葡萄糖)+C6H12O6(果糖)
阅读下列材料,完成10~11小题。
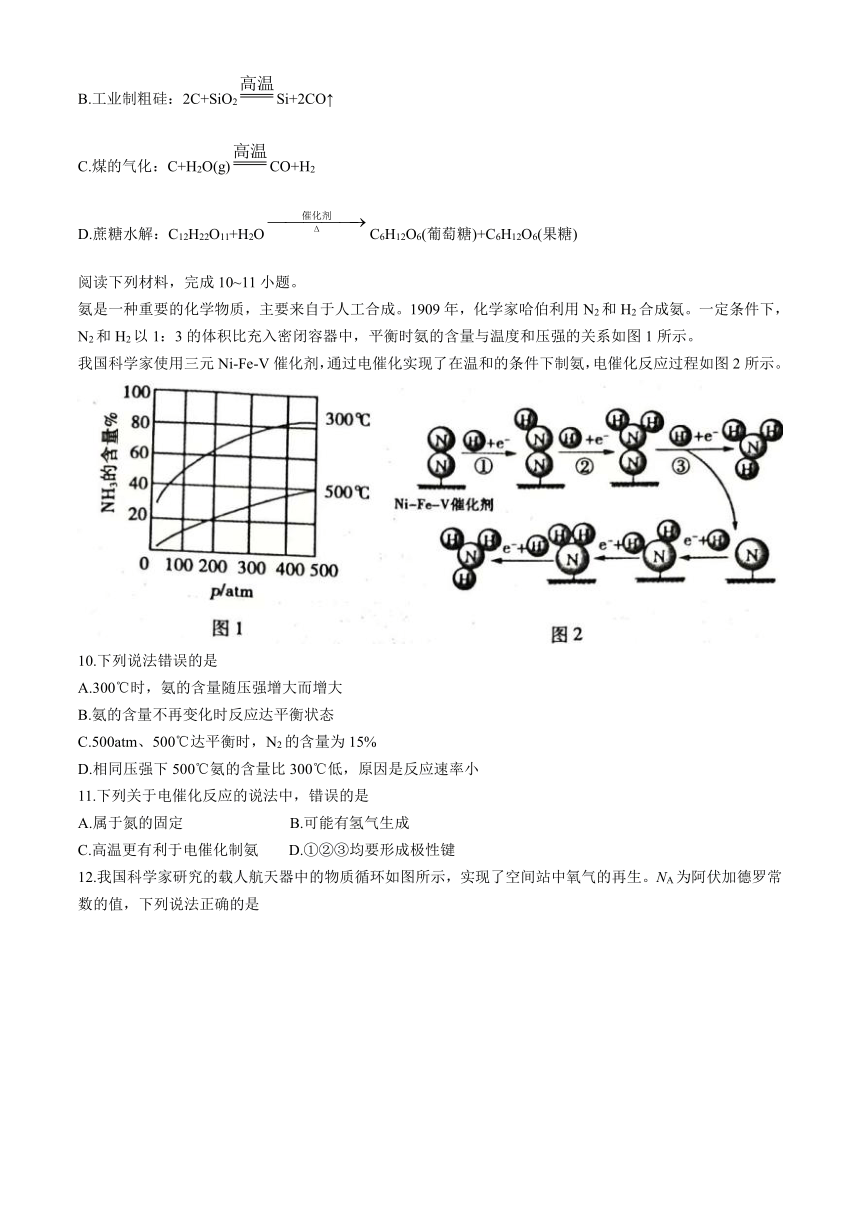
氨是一种重要的化学物质,主要来自于人工合成。1909年,化学家哈伯利用N2和H2合成氨。一定条件下,N2和H2以1:3的体积比充入密闭容器中,平衡时氨的含量与温度和压强的关系如图1所示。
我国科学家使用三元Ni-Fe-V催化剂,通过电催化实现了在温和的条件下制氨,电催化反应过程如图2所示。
10.下列说法错误的是
A.300℃时,氨的含量随压强增大而增大
B.氨的含量不再变化时反应达平衡状态
C.500atm、500℃达平衡时,N2的含量为15%
D.相同压强下500℃氨的含量比300℃低,原因是反应速率小
11.下列关于电催化反应的说法中,错误的是
A.属于氮的固定 B.可能有氢气生成
C.高温更有利于电催化制氨 D.①②③均要形成极性键
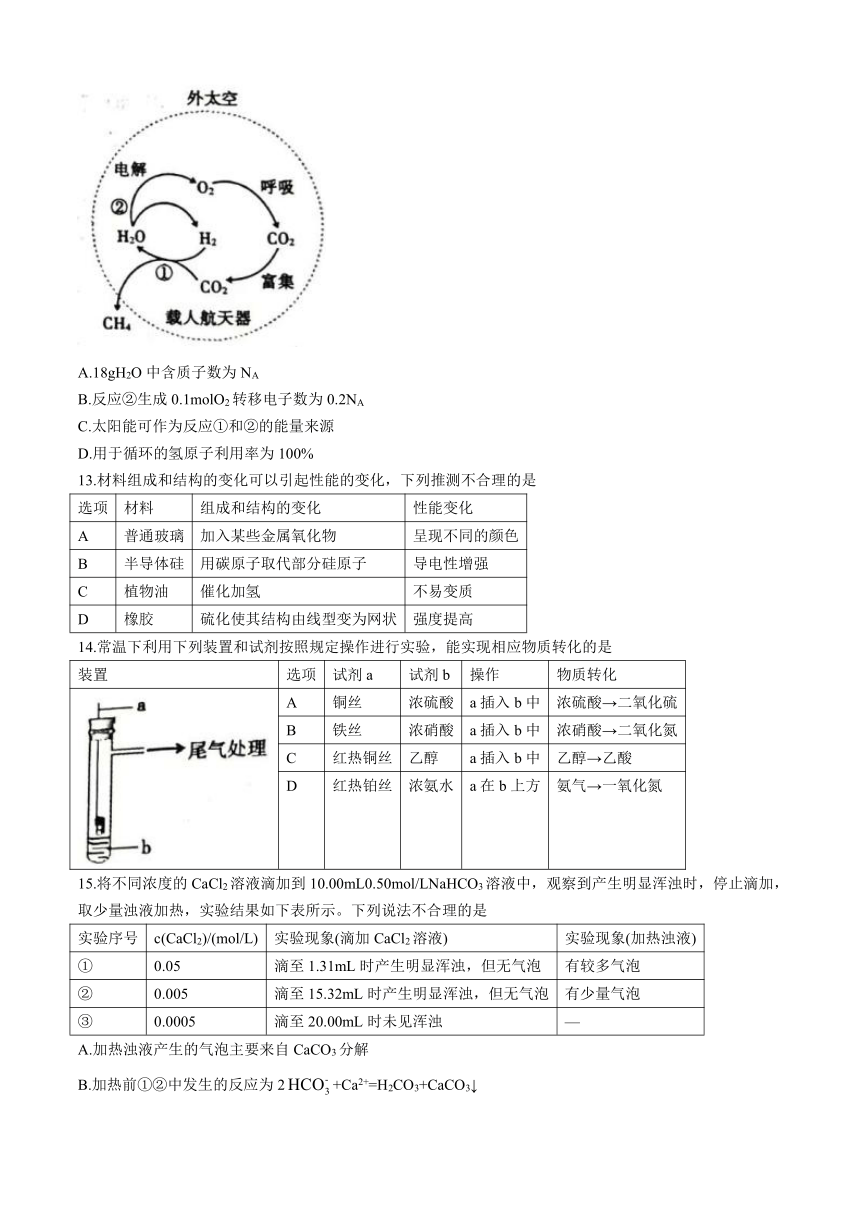
12.我国科学家研究的载人航天器中的物质循环如图所示,实现了空间站中氧气的再生。NA为阿伏加德罗常数的值,下列说法正确的是
A.18gH2O中含质子数为NA
B.反应②生成0.1molO2转移电子数为0.2NA
C.太阳能可作为反应①和②的能量来源
D.用于循环的氢原子利用率为100%
13.材料组成和结构的变化可以引起性能的变化,下列推测不合理的是
选项 材料 组成和结构的变化 性能变化
A 普通玻璃 加入某些金属氧化物 呈现不同的颜色
B 半导体硅 用碳原子取代部分硅原子 导电性增强
C 植物油 催化加氢 不易变质
D 橡胶 硫化使其结构由线型变为网状 强度提高
14.常温下利用下列装置和试剂按照规定操作进行实验,能实现相应物质转化的是
装置 选项 试剂a 试剂b 操作 物质转化
A 铜丝 浓硫酸 a插入b中 浓硫酸→二氧化硫
B 铁丝 浓硝酸 a插入b中 浓硝酸→二氧化氮
C 红热铜丝 乙醇 a插入b中 乙醇→乙酸
D 红热铂丝 浓氨水 a在b上方 氨气→一氧化氮
15.将不同浓度的CaCl2溶液滴加到10.00mL0.50mol/LNaHCO3溶液中,观察到产生明显浑浊时,停止滴加,取少量浊液加热,实验结果如下表所示。下列说法不合理的是
实验序号 c(CaCl2)/(mol/L) 实验现象(滴加CaCl2溶液) 实验现象(加热浊液)
① 0.05 滴至1.31mL时产生明显浑浊,但无气泡 有较多气泡
② 0.005 滴至15.32mL时产生明显浑浊,但无气泡 有少量气泡
③ 0.0005 滴至20.00mL时未见浑浊 —
A.加热浊液产生的气泡主要来自CaCO3分解
B.加热前①②中发生的反应为2+Ca2+=H2CO3+CaCO3↓
C.若加入足量0.50mol/LCaCl2溶液,可能同时产生浑浊和气泡
D.一定条件下,可以使用CaCl2溶液鉴别NaHCO3和Na2CO3溶液
二、非选择题:本题共4小题,共50分。
16.(11分)学习了“化学反应与能量”后,某兴趣小组开展了如下探究活动。
(1)利用NH4NO3和Na2CO3·10H2O按下图所示装置进行实验:
根据图中现象,可以表示该反应能量变化的是______(填“a”或“b”),能量转化形式是___转化为化学能。
(2)甲~丁装置都可以把化学能转化为电能。
电池总反应为2Al+6H+=2Al3++3H2↑的装置是____________(填标号)。
(3)为探究(2)中甲~丁装置中铝电极在原电池中的作用,实验结果记录如下:
装置 电流表指针偏转方向
甲 偏向Al
乙 偏向Cu
丙 偏向石墨
丁 偏向Mg
①装置丙中铝为_______极,电极反应式为____________。
②由实验可知,相对活泼的金属作正极还是负极的影响因素有_____(写出1点即可)。
(4)下图是该小组同学组装的原电池装置,下列关于该电池工作原理的说法正确的是__________。
A.铁环作负极,发生还原反应 B.电池工作时,电子从铁环经LED灯流向铜线
C.电池工作时,铁环变细铜线变粗 D.电池工作结束后柠檬的酸性变强
17.(14分)LiBr溶液可作为替代氟利昂的绿色制冷剂。制备LiBr的一种工艺流程如下:
回答下列问题:
(1)“还原”工序加入BaS溶液可以除去Br2,反应的离子方程式为___________。
(2)若“还原”工序用NaOH溶液吸收Br2,吸收液_____(填“可以”或“不可以”)直接返回“还原”工序,原因是______________。
(3)滤渣中除硫外,还有_________(填化学式),可选用______(填标号)作溶剂溶解后进行分离。
A.水 B.酒精 C.二硫化碳
(4)参与反应的n(Br2):n(BaS):n(H2SO4)为____________。
(5)“中和”工序反应的化学方程式为____________。
18.(12分)有机物A的相对分子质量为28,其产量可以用来衡量一个国家石油化学工业的发展水平。一定条件下相关物质能发生如下图所示的转化(部分反应条件和生成物已略去)。
回答下列问题:
(1)A的结构简式为___________,A和B互为___________。
(2)B转化为H的反应类型为__________。
(3)E中官能团的名称为___________,E在生活中的一种用途为_________。
(4)C与F反应生成C的化学方程式为______________。
19.(13分)二氧化氯(ClO2)和亚氯酸钠(NaClO2)常用作高效、光谱、安全的杀菌消毒剂。实验室用下列装置(部分夹持仪器略去)制备少量亚氯酸钠。
已知:①ClO2的沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。
②NaClO2饱和溶液加热到38℃以上时会析出NaClO2,60℃以上时NaClO2分解为NaClO3和NaCl。
③装置B中的反应为2NaClO3+H2SO4+H2C2O4=Na2SO4+2C1O2↑+2CO2↑+2H2O
回答下列问题:
(1)实验过程中需持续通入一定量的CO2,原因是_______,反应结束后仍需通入一定量的CO2,原因是_______________。
(2)装置C中生成NaClO2的化学方程式为_____________。
(3)要从反应后的溶液中得到NaClO2固体,操作方法是:在_____(填温度范围)蒸发浓缩、冷却结晶、______、洗涤、干燥。
(4)水样用ClO2处理后,有少量ClO2残留,可用下列方法检测残留浓度:取50.00mL水样,加入过量KI和稀硫酸(2ClO2+10KI+4H2SO4=2KCl+4K2SO4+5I2+4H2O),再加入淀粉溶液,溶液变蓝色。将溶液调节为弱酸性后滴加5.00×10-4mol/LNa2S2O3溶液,恰好反应时消耗Na2S2O3溶液20.00mL(2Na2S2O3+I2=Na2S4O6+2NaI)。计算该水样中ClO2的残留浓度(mg/L,要求写出计算过程)。
宣城市2023-2024学年高一下学期7月期末考试
化学试题参考答案
一、选择题:本题共15小题,共50分。第1 ~10小题,每小题3分;第11~15小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 B D A C A B B C A D C C B D A
二、非选择题:本题共4小题,共50分。
16. (11分)
(1)a(1分) 热能(1分)
(2)乙、丙(2分)
(3)①负(1分) Al-3e-=Al3+(2分)
②金属本身的还原性或电解质溶液成分(2分,其他合理答案也给分)
(4)B(2分)
17. (14 分)
(1)Br2+S2-=2Br- +S↓(2分)
(2)不可以(2分) 返回还原工序会引入Na+,导致产品的纯度降低(2分,其他合理答案也给分)
(3) BaSO4(2分) C(2分)
(4)1:1:1(2分)
(5)2HBr+Li2CO3=2LiBr+H2O+CO2↑(2分)
18. (12 分)
(1)CH2=CH2(2分) 同系物(2分)
(2)聚合反应或加聚反应(2分)
(3)羧基(2分)作调味 品或清除水壶中的少量水垢(2分,其他合理答案也给分)
(4)CH3CH2OH+CH2=CHCOOHCH2=CHCOOCH2CH3+ H2O(2分)
19. (13 分)
(1)降低ClO2的浓度,防止发生爆炸(2分)将装 置中残留的ClO2排尽,防止污染(2分)
(2)2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O(2 分)
(3)38 ~60℃(2分) 过滤(1分)
(4)2. 70 mg/L(4分,要求写出计算过程)
化学试题
注意事项:
本试卷分选择题和非选择题两部分,满分100分,考试时间75分钟。
1.答题前,考生务必将自己的姓名、考号填写在答题卷上并将条形码粘贴在指定区域。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卷上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卷上,写在本试卷上无效。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Cl-35.5 I-127
一、选择题:本题共15小题,共50分。第1~10小题,每小题3分;第11~15小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下图是我国自主研制的“飞天"舱外航天服。下列有关航天服涉及的材料中,不属于有机高分子材料的是
A.羊毛 B.玻璃纤维 C.聚氯乙烯 D.聚四氟乙烯
2.宣城美食享誉省内外。下列叙述错误的是
A.水阳鸭脚包中的鸭掌含有蛋白质
B.绩溪一品锅中的冬笋含有纤维素
C.泾县发糕使用的糯米主要成分是淀粉
D.宁国粑粑使用的植物油主要成分为饱和高级脂肪酸甘油酯
3.利用4个碳原子,以碳碳单键相连,拼插合理的链状碳骨架有
A.2种 B.3种 C.4种 D.5种
4.日常生活中的下列措施,与调控反应速率无关的是
A.疫苗冷藏储存 B.食品抽真空包装
C.门窗合页里注润滑油 D.铁制品表面刷油漆
5.已知反应CH4+Cl2CH3Cl+HCl,下列说法正确的是
A.CH4的空间填充模型为
B.Cl2的电子式为Cl:Cl
C.CH3C1的官能团为—CH3
D.C1-的结构示意图为
6.利用下列实验装置能达到实验目的的是
A.制取氨气 B.干燥氨气
C.收集氨气 D.吸收氨气
7.化学与生活联系紧密。下列所述事实与物质性质不相符的是
选项 事实 物质性质
A NH4HCO3作膨松剂 NH4HCO3可中和酸并受热分解
B SiO2用于生产光导纤维 SiO2熔点高
C 聚乙烯制作吊装缆绳 聚乙烯材料张力好且耐磨、耐腐蚀
D 75%的酒精作消毒剂 酒精可使蛋白质变性
8.为探究原电池原理,某学习小组设计了如图所示实验装置。下列叙述正确的是
A.a、b不连接时,铜片上有气泡产生
B.a、b不连接时,化学能转化成电能
C.a、b不论是否连接都发生:Zn-2e-=Zn2+
D.a、b用导线连接时,溶液中H+移向锌片
9.下列化学方程式不合理的是
A.工业冶炼镁:2MgO(熔融) 2Mg+O2↑
B.工业制粗硅:2C+SiO2Si+2CO↑
C.煤的气化:C+H2O(g)CO+H2
D.蔗糖水解:C12H22O11+H2OC6H12O6(葡萄糖)+C6H12O6(果糖)
阅读下列材料,完成10~11小题。
氨是一种重要的化学物质,主要来自于人工合成。1909年,化学家哈伯利用N2和H2合成氨。一定条件下,N2和H2以1:3的体积比充入密闭容器中,平衡时氨的含量与温度和压强的关系如图1所示。
我国科学家使用三元Ni-Fe-V催化剂,通过电催化实现了在温和的条件下制氨,电催化反应过程如图2所示。
10.下列说法错误的是
A.300℃时,氨的含量随压强增大而增大
B.氨的含量不再变化时反应达平衡状态
C.500atm、500℃达平衡时,N2的含量为15%
D.相同压强下500℃氨的含量比300℃低,原因是反应速率小
11.下列关于电催化反应的说法中,错误的是
A.属于氮的固定 B.可能有氢气生成
C.高温更有利于电催化制氨 D.①②③均要形成极性键
12.我国科学家研究的载人航天器中的物质循环如图所示,实现了空间站中氧气的再生。NA为阿伏加德罗常数的值,下列说法正确的是
A.18gH2O中含质子数为NA
B.反应②生成0.1molO2转移电子数为0.2NA
C.太阳能可作为反应①和②的能量来源
D.用于循环的氢原子利用率为100%
13.材料组成和结构的变化可以引起性能的变化,下列推测不合理的是
选项 材料 组成和结构的变化 性能变化
A 普通玻璃 加入某些金属氧化物 呈现不同的颜色
B 半导体硅 用碳原子取代部分硅原子 导电性增强
C 植物油 催化加氢 不易变质
D 橡胶 硫化使其结构由线型变为网状 强度提高
14.常温下利用下列装置和试剂按照规定操作进行实验,能实现相应物质转化的是
装置 选项 试剂a 试剂b 操作 物质转化
A 铜丝 浓硫酸 a插入b中 浓硫酸→二氧化硫
B 铁丝 浓硝酸 a插入b中 浓硝酸→二氧化氮
C 红热铜丝 乙醇 a插入b中 乙醇→乙酸
D 红热铂丝 浓氨水 a在b上方 氨气→一氧化氮
15.将不同浓度的CaCl2溶液滴加到10.00mL0.50mol/LNaHCO3溶液中,观察到产生明显浑浊时,停止滴加,取少量浊液加热,实验结果如下表所示。下列说法不合理的是
实验序号 c(CaCl2)/(mol/L) 实验现象(滴加CaCl2溶液) 实验现象(加热浊液)
① 0.05 滴至1.31mL时产生明显浑浊,但无气泡 有较多气泡
② 0.005 滴至15.32mL时产生明显浑浊,但无气泡 有少量气泡
③ 0.0005 滴至20.00mL时未见浑浊 —
A.加热浊液产生的气泡主要来自CaCO3分解
B.加热前①②中发生的反应为2+Ca2+=H2CO3+CaCO3↓
C.若加入足量0.50mol/LCaCl2溶液,可能同时产生浑浊和气泡
D.一定条件下,可以使用CaCl2溶液鉴别NaHCO3和Na2CO3溶液
二、非选择题:本题共4小题,共50分。
16.(11分)学习了“化学反应与能量”后,某兴趣小组开展了如下探究活动。
(1)利用NH4NO3和Na2CO3·10H2O按下图所示装置进行实验:
根据图中现象,可以表示该反应能量变化的是______(填“a”或“b”),能量转化形式是___转化为化学能。
(2)甲~丁装置都可以把化学能转化为电能。
电池总反应为2Al+6H+=2Al3++3H2↑的装置是____________(填标号)。
(3)为探究(2)中甲~丁装置中铝电极在原电池中的作用,实验结果记录如下:
装置 电流表指针偏转方向
甲 偏向Al
乙 偏向Cu
丙 偏向石墨
丁 偏向Mg
①装置丙中铝为_______极,电极反应式为____________。
②由实验可知,相对活泼的金属作正极还是负极的影响因素有_____(写出1点即可)。
(4)下图是该小组同学组装的原电池装置,下列关于该电池工作原理的说法正确的是__________。
A.铁环作负极,发生还原反应 B.电池工作时,电子从铁环经LED灯流向铜线
C.电池工作时,铁环变细铜线变粗 D.电池工作结束后柠檬的酸性变强
17.(14分)LiBr溶液可作为替代氟利昂的绿色制冷剂。制备LiBr的一种工艺流程如下:
回答下列问题:
(1)“还原”工序加入BaS溶液可以除去Br2,反应的离子方程式为___________。
(2)若“还原”工序用NaOH溶液吸收Br2,吸收液_____(填“可以”或“不可以”)直接返回“还原”工序,原因是______________。
(3)滤渣中除硫外,还有_________(填化学式),可选用______(填标号)作溶剂溶解后进行分离。
A.水 B.酒精 C.二硫化碳
(4)参与反应的n(Br2):n(BaS):n(H2SO4)为____________。
(5)“中和”工序反应的化学方程式为____________。
18.(12分)有机物A的相对分子质量为28,其产量可以用来衡量一个国家石油化学工业的发展水平。一定条件下相关物质能发生如下图所示的转化(部分反应条件和生成物已略去)。
回答下列问题:
(1)A的结构简式为___________,A和B互为___________。
(2)B转化为H的反应类型为__________。
(3)E中官能团的名称为___________,E在生活中的一种用途为_________。
(4)C与F反应生成C的化学方程式为______________。
19.(13分)二氧化氯(ClO2)和亚氯酸钠(NaClO2)常用作高效、光谱、安全的杀菌消毒剂。实验室用下列装置(部分夹持仪器略去)制备少量亚氯酸钠。
已知:①ClO2的沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。
②NaClO2饱和溶液加热到38℃以上时会析出NaClO2,60℃以上时NaClO2分解为NaClO3和NaCl。
③装置B中的反应为2NaClO3+H2SO4+H2C2O4=Na2SO4+2C1O2↑+2CO2↑+2H2O
回答下列问题:
(1)实验过程中需持续通入一定量的CO2,原因是_______,反应结束后仍需通入一定量的CO2,原因是_______________。
(2)装置C中生成NaClO2的化学方程式为_____________。
(3)要从反应后的溶液中得到NaClO2固体,操作方法是:在_____(填温度范围)蒸发浓缩、冷却结晶、______、洗涤、干燥。
(4)水样用ClO2处理后,有少量ClO2残留,可用下列方法检测残留浓度:取50.00mL水样,加入过量KI和稀硫酸(2ClO2+10KI+4H2SO4=2KCl+4K2SO4+5I2+4H2O),再加入淀粉溶液,溶液变蓝色。将溶液调节为弱酸性后滴加5.00×10-4mol/LNa2S2O3溶液,恰好反应时消耗Na2S2O3溶液20.00mL(2Na2S2O3+I2=Na2S4O6+2NaI)。计算该水样中ClO2的残留浓度(mg/L,要求写出计算过程)。
宣城市2023-2024学年高一下学期7月期末考试
化学试题参考答案
一、选择题:本题共15小题,共50分。第1 ~10小题,每小题3分;第11~15小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 B D A C A B B C A D C C B D A
二、非选择题:本题共4小题,共50分。
16. (11分)
(1)a(1分) 热能(1分)
(2)乙、丙(2分)
(3)①负(1分) Al-3e-=Al3+(2分)
②金属本身的还原性或电解质溶液成分(2分,其他合理答案也给分)
(4)B(2分)
17. (14 分)
(1)Br2+S2-=2Br- +S↓(2分)
(2)不可以(2分) 返回还原工序会引入Na+,导致产品的纯度降低(2分,其他合理答案也给分)
(3) BaSO4(2分) C(2分)
(4)1:1:1(2分)
(5)2HBr+Li2CO3=2LiBr+H2O+CO2↑(2分)
18. (12 分)
(1)CH2=CH2(2分) 同系物(2分)
(2)聚合反应或加聚反应(2分)
(3)羧基(2分)作调味 品或清除水壶中的少量水垢(2分,其他合理答案也给分)
(4)CH3CH2OH+CH2=CHCOOHCH2=CHCOOCH2CH3+ H2O(2分)
19. (13 分)
(1)降低ClO2的浓度,防止发生爆炸(2分)将装 置中残留的ClO2排尽,防止污染(2分)
(2)2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O(2 分)
(3)38 ~60℃(2分) 过滤(1分)
(4)2. 70 mg/L(4分,要求写出计算过程)
同课章节目录
