2024年广东省高考化学真题(PDF版,含答案)
文档属性
| 名称 | 2024年广东省高考化学真题(PDF版,含答案) |  | |
| 格式 | |||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-05 09:30:26 | ||
图片预览



文档简介
启用前★绝密 试卷类型:A
2024年广东省普通高中学业水平选择性考试
化 学
本试卷共 8页,20小题,满分 100分。考试用时 75分钟。
注意事项:1. 答卷前,考生务必用黑色字迹钢笔或签字笔将自己的姓名、考生号、考场号和座位号填写
在答题卡上。用 2B铅笔将试卷类型(A)填涂在答题卡相应位置上。将条形码横贴在答题
卡右上角“条形码粘贴处”。
2. 作答选择题时,选出每小题答案后,用 2B铅笔把答题卡上对应题目选项的答案信息点涂黑;
如需改动,用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。
3. 非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应
位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。
不按以上要求作答的答案无效。
4. 考生必须保持答题卡的整洁。考试结束后,将试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5 Ca 40 Fe 56
一、选择题:本题共 16小题,共 44分。第 1~10小题,每小题 2分;第 11~16小题,每小题 4分。在每
小题给出的四个选项中,只有一项是符合题目要求的。
1. 龙是中华民族重要的精神象征和文化符号。下列与龙有关的历史文物中,主要材质为有机高分子的是
A.红山玉龙 B.鎏金铁芯铜龙 C.云龙纹丝绸 D.云龙纹瓷瓶
2. “极地破冰”“太空养鱼”等彰显了我国科技发展的巨大成就。下列说法正确的是
A.“雪龙 2”号破冰船极地科考:破冰过程中水发生了化学变化
B.大型液化天然气运输船成功建造:天然气液化过程中形成了新的化学键
C.嫦娥六号的运载火箭助推器采用液氧煤油发动机:燃烧时存在化学能转化为热能
D.神舟十八号乘组带着水和斑马鱼进入空间站进行科学实验:水的电子式为 H : O : H
化学试卷 A 第 1 页 (共 8 页)
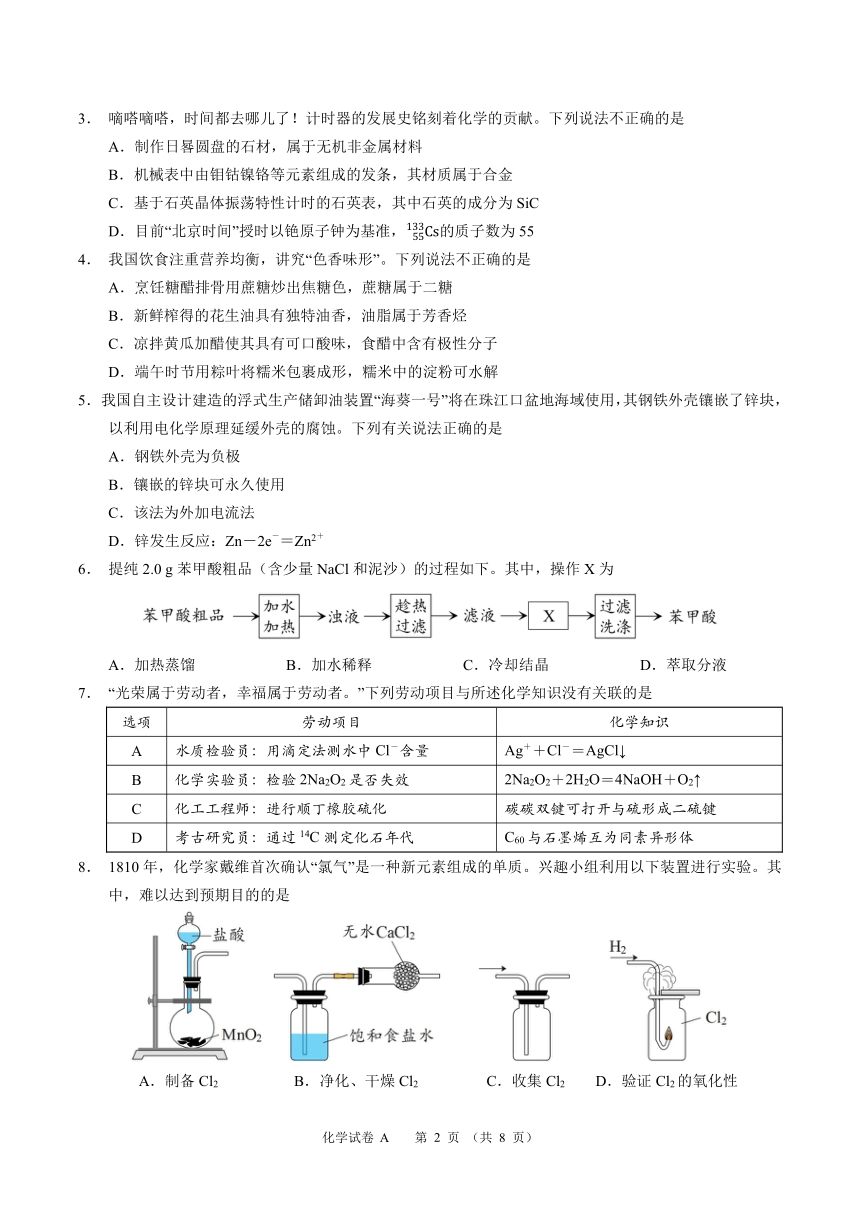
3. 嘀嗒嘀嗒,时间都去哪儿了!计时器的发展史铭刻着化学的贡献。下列说法不正确的是
A.制作日晷圆盘的石材,属于无机非金属材料
B.机械表中由钼钴镍铬等元素组成的发条,其材质属于合金
C.基于石英晶体振荡特性计时的石英表,其中石英的成分为 SiC
D.目前“北京时间”授时以铯原子钟为基准,13355Cs的质子数为 55
4. 我国饮食注重营养均衡,讲究“色香味形”。下列说法不正确的是
A.烹饪糖醋排骨用蔗糖炒出焦糖色,蔗糖属于二糖
B.新鲜榨得的花生油具有独特油香,油脂属于芳香烃
C.凉拌黄瓜加醋使其具有可口酸味,食醋中含有极性分子
D.端午时节用粽叶将糯米包裹成形,糯米中的淀粉可水解
5.我国自主设计建造的浮式生产储卸油装置“海葵一号”将在珠江口盆地海域使用,其钢铁外壳镶嵌了锌块,
以利用电化学原理延缓外壳的腐蚀。下列有关说法正确的是
A.钢铁外壳为负极
B.镶嵌的锌块可永久使用
C.该法为外加电流法
D - +.锌发生反应:Zn-2e =Zn2
6. 提纯 2.0 g苯甲酸粗品(含少量 NaCl和泥沙)的过程如下。其中,操作 X为
A.加热蒸馏 B.加水稀释 C.冷却结晶 D.萃取分液
7. “光荣属于劳动者,幸福属于劳动者。”下列劳动项目与所述化学知识没有关联的是
选项 劳动项目 化学知识
A 水质检验员:用滴定法测水中 Cl-含量 Ag++Cl-=AgCl↓
B 化学实验员:检验 2Na2O2是否失效 2Na2O2+2H2O=4NaOH+O2↑
C 化工工程师:进行顺丁橡胶硫化 碳碳双键可打开与硫形成二硫键
D 考古研究员:通过 14C测定化石年代 C60与石墨烯互为同素异形体
8. 1810年,化学家戴维首次确认“氯气”是一种新元素组成的单质。兴趣小组利用以下装置进行实验。其
中,难以达到预期目的的是
A.制备 Cl2 B.净化、干燥 Cl2 C.收集 Cl2 D.验证 Cl2的氧化性
化学试卷 A 第 2 页 (共 8 页)
9. 从我国南海的柳珊瑚中分离得到的柳珊瑚酸(图 1),具有独特的环系结构。下列关于柳珊瑚酸的说法
不正确的是
A.能使溴的四氯化碳溶液褪色
B.能与氨基酸的氨基发生反应
C.其环系结构中 3个五元环共平面
D.其中碳原子的杂化方式有 sp2和 sp3 图 1
10.设 NA为阿伏加德罗常数的值。下列说法正确的是
A.26 g H—C ≡ C—H中含有σ键的数目为 3NA
B.1 L 1 mol·L-1 NH4NO3溶液中含 NH +4 的数目为 NA
C.1 mol CO和 H 的混合气体含有的分子数目为 3NA
D.Na 与 H2O反应生成 11.2 L H2,转移电子数目为 NA
11.按图 2装置进行实验。搅拌一段时间后,滴加浓盐酸。
不同反应阶段的预期现象及其相应推理均合理的是
A.烧瓶壁会变冷,说明存在ΔH<0的反应
B.试纸会变蓝,说明有 NH3生成,产氨过程熵增
C.加浓盐酸后,有白烟产生,说明有 NH4Cl升华
D.实验过程中,气球会一直变大,说明体系压强增大 图 2
12.一种可为运动员补充能量的物质,其分子结构式如图 3。已知 R、W、Z、X、Y为原子序数依次增大
的短周期主族元素,Z和 Y同族,则
A.沸点:ZR3<YR3
B.最高价氧化物的水化物的酸性:Z<W
C.第一电离能:Z<X<W
D.ZX -3 和WX32-空间结构均为平面三角形 图 3
13.下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项 陈述Ⅰ 陈述Ⅱ
A 酸性:CF3COOH<CCl3COOH 电负性:F>Cl
B 某冠醚与 Li+能形成超分子,与 K+则不能 Li+与 K+的离子半径不同
C 由氨制硝酸:NH3→NO→NO2→HNO3 NH3和 NO2均具有氧化性
D 苯酚与甲醛反应,可合成酚醛树脂 合成酚醛树脂的反应是加聚反应
化学试卷 A 第 3 页 (共 8 页)
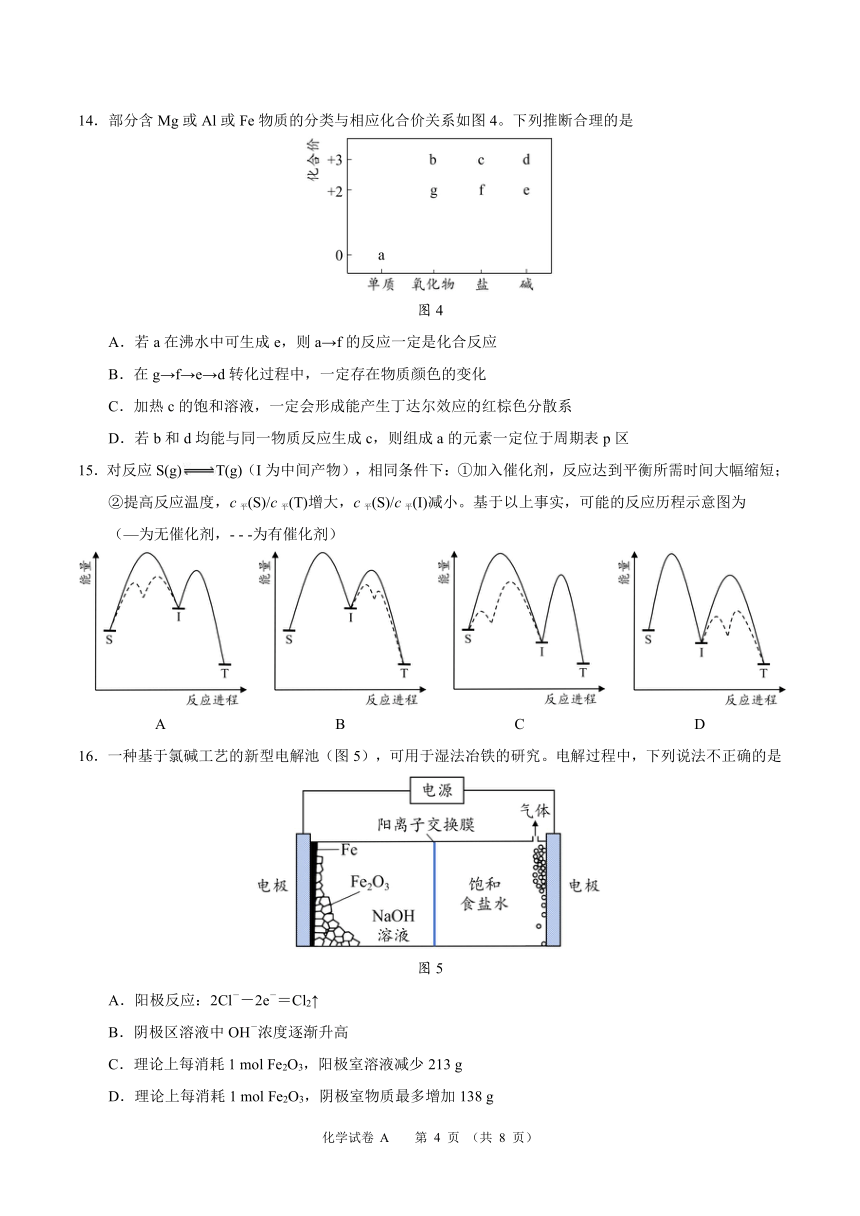
14.部分含Mg或 Al或 Fe物质的分类与相应化合价关系如图 4。下列推断合理的是
图 4
A.若 a在沸水中可生成 e,则 a→f的反应一定是化合反应
B.在 g→f→e→d转化过程中,一定存在物质颜色的变化
C.加热 c的饱和溶液,一定会形成能产生丁达尔效应的红棕色分散系
D.若 b和 d均能与同一物质反应生成 c,则组成 a的元素一定位于周期表 p区
15.对反应 S(g) T(g)(I为中间产物),相同条件下:①加入催化剂,反应达到平衡所需时间大幅缩短;
②提高反应温度,c 平(S)/c 平(T)增大,c 平(S)/c 平(I)减小。基于以上事实,可能的反应历程示意图为
(—为无催化剂,- - -为有催化剂)
A B C D
16.一种基于氯碱工艺的新型电解池(图 5),可用于湿法冶铁的研究。电解过程中,下列说法不正确的是
图 5
A - -.阳极反应:2Cl -2e =Cl2↑
B -.阴极区溶液中 OH 浓度逐渐升高
C.理论上每消耗 1 mol Fe2O3,阳极室溶液减少 213 g
D.理论上每消耗 1 mol Fe2O3,阴极室物质最多增加 138 g
化学试卷 A 第 4 页 (共 8 页)
二、非选择题:本题共 4小题,共 56分。
17.(14分)含硫物质种类繁多,在一定条件下可相互转化。
(1) 实验室中,浓硫酸与铜丝反应,所产生的尾气可用 (填化学式)溶液吸收。
(2) 工业上,烟气中的 SO 可在通空气条件下用石灰石的浆液吸收,生成石膏。该过程中, (填
元素符号)被氧化。
(3) 工业锅炉需定期除水垢,其中的硫酸钙用纯碱溶液处理时,发生反应:
CaSO4(s)+CO32-(aq) CaCO3(s)+SO42-(aq) (I)
兴趣小组在实验室探究 Na2CO3溶液的浓度对反应(I)的反应速率的影响。
①用 Na2CO3固体配制溶液,以滴定法测定其浓度。
i.该过程中用到的仪器有 。
A B C D
ii.滴定数据及处理:Na2CO3溶液 V0 mL,消耗 c1 mol·L-1盐酸 V1 mL(滴定终点时,CO32-转化为HCO3-),
则 c(Na2CO3) = mol·L-1。
②实验探究:取①中的 Na2CO3溶液,按下表配制总体积相同的系列溶液,分别加入 m1 g硫酸钙固体,
反应 t1 min后,过滤,取 V0 mL滤液,用 c1 mol·L-1盐酸参照①进行滴定。记录的部分数据如下表(忽
略 CO32-水解的影响)。
序号 V(Na2CO3)/mL V(H2O)/mL V(滤液)/mL V 消耗(盐酸)/mL
a 100.0 0 V0 2V1/5
b 80.0 x V0 3V1/10
则 x = ,测得的平均反应速率之比 va : vb = 。
(4) 兴趣小组继续探究反应(I)平衡的建立,进行实验。
①初步实验 将 1.00 g硫酸钙(M =136 g·mol-1)加入到 100.0 mL 0.100 mol·L-1Na2CO3溶液中,在 25℃
和搅拌条件下,利用 pH计测得体系的 pH随时间 t的变化曲线如图 6。
②分析讨论 甲同学根据 t2 min后 pH不改变,认为反应(I)已达到平衡;
乙同学认为证据不足,并提出如下假设:
假设 1 硫酸钙固体已完全消耗;
假设 2 硫酸钙固体有剩余,但被碳酸钙沉淀包裹。
图 6
③验证假设乙同学设计如下方案,进行实验。
步骤 现象
i.将①实验中的反应混合物进行固液分离 /
ii.取少量分离出的沉淀置于试管中,滴加 ,沉淀完全溶解
iii.继续向 ii的试管中滴加 无白色沉淀生成
④实验小结 假设 1成立,假设 2不成立。①实验中反应(I)平衡未建立。
⑤优化方案、建立平衡 写出优化的实验方案,并给出反应(I)平衡已建立的判断依据:
。
化学试卷 A 第 5 页 (共 8 页)
18.(14分)镓(Ga)在半导体、记忆合金等高精尖材料领域有重要应用。一种从电解铝的副产品炭渣(含
C、Na、Al、F和少量的 Ga、Fe、K、Ca等元素)中提取镓及循环利用铝的工艺如下。
工艺中,LAEM是一种新型阴离子交换膜,允许带负电荷的配离子从高浓度区扩散至低浓度区。
用 LAEM提取金属离子Mn+的原理如图 7。已知:
①pKa(HF) = 3.2。
②Na [AlF ](冰晶石)的 Ksp为 4.0×10-10。
③浸取液中,Ga(Ⅲ)和 Fe(Ⅲ)以[MClm](m-3)-(m = 0~4)微粒形式存在,
Fe2+ - -最多可与 2个 Cl 配位,其他金属离子与 Cl 的配位可忽略。 图 7
(1) “电解”中,反应的化学方程式为 。
(2) “浸取”中,由 Ga3+ -形成[GaCl4] 的离子方程式为 。
(3) “还原”的目的:避免 元素以 (填化学式)微粒的形式通过 LAEM,从而有利于
Ga的分离。
(4) “LAEM -提取”中,原料液的 Cl 浓度越 ,越有利于 Ga的提取;研究表明,原料液酸度过高,
会降低 Ga 的提取率。因此,在不提高原料液酸度的前提下,可向 I室中加入 (填化学
式),以进一步提高 Ga的提取率。
(5) “调 pH”中,pH -至少应大于 ,使溶液中 c(F )>c(HF),有利于[AlF6]3-配离子及 Na [AlF ]晶体
的生成。若“结晶”后溶液中 c(Na+) = 0.10 mol·L-1 ,则[AlF6]3-的浓度为 mol·L-1。
(6) 一种含 Ga、Ni、Co元素的记忆合金的晶体结构可描述为 Ga与 Ni交替填充在 Co构成的立方体体心,
形成如图 8 所示的结构单元。该合金的晶胞中,粒子个数最简比 Co : Ga : Ni = ,其立方
晶胞的体积为 nm3。
图 8
化学试卷 A 第 6 页 (共 8 页)
19.(14分)酸在多种反应中具有广泛应用,其性能通常与酸的强度密切相关。
(1) 酸催化下NaNO2与NH4Cl混合溶液的反应(反应a),可用于石油开采中油路解堵。
①基态N原子价层电子的轨道表示式为: 。
- +
②反应a:NO2 (aq)+NH4 (aq)=N2(g)+2H2O(l)
已知:
则反应a的ΔH = 。 图 9
③某小组研究了3种酸对反应a的催化作用。在相同条件下,向反应体系中滴加等物质的量的少量酸,
测得体系的温度T随时间t的变化如图9。据图可知,在该过程中, 。
A.催化剂酸性增强,可增大反应焓变
B.催化剂酸性增强,有利于提高反应速率
C.催化剂分子中含H越多,越有利于加速反应
D.反应速率并不始终随着反应物浓度下降而减小
(2) 在非水溶剂中,将CO2转化为化合物ii(一种重要的电子化学品)的催化机理示意图如图10,其中的
催化剂有 和 。
图10 图11
(3) 在非水溶剂中研究弱酸的电离平衡具有重要科学价值。一定温度下,某研究组通过分光光度法测定
了两种一元弱酸HX(X为A或B)在某非水溶剂中的Ka。
a.选择合适的指示剂HIn,Ka(HIn) = 3.6×10-20;其钾盐为KIn。
b - -.向KIn溶液中加入HX,发生反应:In +HX X +HIn。KIn起始的物质的量为n0(KIn),加入
HX的物质的量为n(HX),平衡时,测得c平(In )/c平(HIn)随n(HX)/n0(KIn)的变化曲线如图11。
已知:该溶剂本身不电离,钾盐在该溶剂中完全电离。
①计算Ka(HA)。(写出计算过程,结果保留两位有效数字)
②在该溶剂中,Ka(HB) Ka(HA);Ka(HB) Ka(HIn)。(填“>”“<”或“=”)
化学试卷 A 第 7 页 (共 8 页)
20.(14分)将3D打印制备的固载铜离子陶瓷催化材料,用于化学催化和生物催化一体化技术,以实现化合
物Ⅲ的绿色合成,示意图如下(反应条件略)。
(1) 化合物Ⅰ的分子式为 ,名称为 。
(2) 化合物Ⅱ中含氧官能团的名称是 。化合物Ⅱ的某同分异构体含有苯环,在核磁共
振氢谱图上只有4组峰,且能够发生银镜反应,其结构简式为 。
(3) 关于上述示意图中的相关物质及转化,下列说法正确的有 。
A.由化合物Ⅰ到Ⅱ的转化中,有π键的断裂与形成
B.由葡萄糖到葡萄糖酸内酯的转化中,葡萄糖被还原
C.葡萄糖易溶于水,是因为其分子中有多个羟基,,能与水分子形成氢键
D.由化合物Ⅱ到Ⅲ的转化中,存在C、O原子杂化方式的改变,有手性碳原子形成
(4) 对化合物Ⅲ,分析预测其可能的化学性质,完成下表。
序号 反应试剂、条件 反应形成的新结构 反应类型
①
② 取代反应
(5) 在一定条件下,以原子利用率100%的反应制备HOCH(CH3)2。该反应中,
①若反应物之一为非极性分子,则另一反应物为 (写结构简式)。
②若反应物之一为V形结构分子,则另一反应物为 (写结构简式)。
(6) 以2-溴丙烷为唯一有机原料,合成CH3COOCH(CH3)2。基于你设计的合成路线,回答下列问题:
①最后一步反应的化学方程式为 (注明反应条件)。
②第一步反应的化学方程式为 (写一个即可,注明反应条件)。
化学试卷 A 第 8 页 (共 8 页)
2024年广东省普通高中学业水平选择性考试
化学参考答案
一、选择题:本题共 16小题,共 44分。第 1~10小题,每小题 2分;第 11~16小题,每小题 4分。在每
小题给出的四个选项中,只有一项是符合题目要求的。
题号 1 2 3 4 5 6 7 8
选项 C C C B D C D A
题号 9 10 11 12 13 14 15 16
选项 C A B D B B A C
二、非选择题:本题共 4小题,共 56分。
17.(14分)
(1)NaOH;
(2)S;
3 BD 1 1( )① ; ; ② 20.0;6 : 5;
0
(4)③ 足量稀盐酸;有气泡生成;少量BaCl2溶液;
④ 将2.36g(或大于此量的)硫酸钙加入到100 mL 0.1 mol·L-1 Na2CO3溶液中,在25℃和搅拌条件下,
利用pH计测量混合液的pH,待混合液pH不变时,加入Na2SO4固体,pH增大,说明反应(Ⅰ)平
衡已建立。
18.(14分)
(1)2Al2O3 4Al+3O2↑(1分);
(2)Ga3++4Cl-=[GaCl -4] ;
(3)Fe; [FeCl ]-4 ;
(4)高;NaCl;
(5)3.2;4.0×10-7;
(6)2 : 1 : 1;8a3。
化学试卷 A 参考答案 第 1 页 (共 2 页)
19.(14分)
(1)① ; ② ΔH1+ΔH4-ΔH2-ΔH3; ③ BD;
(2)AcOH;KI;
(3)① 解:由图11知当n(HX)/n0(KIn) = 1时,c平(In )/c平(HIn) = 3;设n0(KIn) = n0,则有
In- + HX X- + HIn
起始量(mol) n0 n0 0 0
变化量(mol) x x x x
平衡量(mol) n0-x n0-x x x
即 c平(In )/c平(HIn) =
0
= 3 x =
0 n -x = 3 解得 04 0 4
(A )· (HIn) (A )· (HIn) 0 · 0 1
可得 K = = = 4 4 =
(HA)· (In ) (HA)· (In ) 3 0 · 3 0 94 4
(A )· (HIn) (HA)
又 K = =
a = a(HA)
(HA)· (In ) a(HIn) 3.6×10 20
解得 Ka(HA) = 4.0×10-21
② >;>。
20.(14分)
(1)C8H8;苯乙烯
(2)酮羰基; ;
(3)ACD;
(4)① H2,催化剂,加热; 加成反应(或 还原反应);
② 浓HBr,加热; —Br;(或 CH3COOH,浓硫酸,加热; ;)
(5)① ; ② ;
(6) ;
。
化学试卷 A 参考答案 第 2 页 (共 2 页)
2024年广东省普通高中学业水平选择性考试
化 学
本试卷共 8页,20小题,满分 100分。考试用时 75分钟。
注意事项:1. 答卷前,考生务必用黑色字迹钢笔或签字笔将自己的姓名、考生号、考场号和座位号填写
在答题卡上。用 2B铅笔将试卷类型(A)填涂在答题卡相应位置上。将条形码横贴在答题
卡右上角“条形码粘贴处”。
2. 作答选择题时,选出每小题答案后,用 2B铅笔把答题卡上对应题目选项的答案信息点涂黑;
如需改动,用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。
3. 非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应
位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。
不按以上要求作答的答案无效。
4. 考生必须保持答题卡的整洁。考试结束后,将试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5 Ca 40 Fe 56
一、选择题:本题共 16小题,共 44分。第 1~10小题,每小题 2分;第 11~16小题,每小题 4分。在每
小题给出的四个选项中,只有一项是符合题目要求的。
1. 龙是中华民族重要的精神象征和文化符号。下列与龙有关的历史文物中,主要材质为有机高分子的是
A.红山玉龙 B.鎏金铁芯铜龙 C.云龙纹丝绸 D.云龙纹瓷瓶
2. “极地破冰”“太空养鱼”等彰显了我国科技发展的巨大成就。下列说法正确的是
A.“雪龙 2”号破冰船极地科考:破冰过程中水发生了化学变化
B.大型液化天然气运输船成功建造:天然气液化过程中形成了新的化学键
C.嫦娥六号的运载火箭助推器采用液氧煤油发动机:燃烧时存在化学能转化为热能
D.神舟十八号乘组带着水和斑马鱼进入空间站进行科学实验:水的电子式为 H : O : H
化学试卷 A 第 1 页 (共 8 页)
3. 嘀嗒嘀嗒,时间都去哪儿了!计时器的发展史铭刻着化学的贡献。下列说法不正确的是
A.制作日晷圆盘的石材,属于无机非金属材料
B.机械表中由钼钴镍铬等元素组成的发条,其材质属于合金
C.基于石英晶体振荡特性计时的石英表,其中石英的成分为 SiC
D.目前“北京时间”授时以铯原子钟为基准,13355Cs的质子数为 55
4. 我国饮食注重营养均衡,讲究“色香味形”。下列说法不正确的是
A.烹饪糖醋排骨用蔗糖炒出焦糖色,蔗糖属于二糖
B.新鲜榨得的花生油具有独特油香,油脂属于芳香烃
C.凉拌黄瓜加醋使其具有可口酸味,食醋中含有极性分子
D.端午时节用粽叶将糯米包裹成形,糯米中的淀粉可水解
5.我国自主设计建造的浮式生产储卸油装置“海葵一号”将在珠江口盆地海域使用,其钢铁外壳镶嵌了锌块,
以利用电化学原理延缓外壳的腐蚀。下列有关说法正确的是
A.钢铁外壳为负极
B.镶嵌的锌块可永久使用
C.该法为外加电流法
D - +.锌发生反应:Zn-2e =Zn2
6. 提纯 2.0 g苯甲酸粗品(含少量 NaCl和泥沙)的过程如下。其中,操作 X为
A.加热蒸馏 B.加水稀释 C.冷却结晶 D.萃取分液
7. “光荣属于劳动者,幸福属于劳动者。”下列劳动项目与所述化学知识没有关联的是
选项 劳动项目 化学知识
A 水质检验员:用滴定法测水中 Cl-含量 Ag++Cl-=AgCl↓
B 化学实验员:检验 2Na2O2是否失效 2Na2O2+2H2O=4NaOH+O2↑
C 化工工程师:进行顺丁橡胶硫化 碳碳双键可打开与硫形成二硫键
D 考古研究员:通过 14C测定化石年代 C60与石墨烯互为同素异形体
8. 1810年,化学家戴维首次确认“氯气”是一种新元素组成的单质。兴趣小组利用以下装置进行实验。其
中,难以达到预期目的的是
A.制备 Cl2 B.净化、干燥 Cl2 C.收集 Cl2 D.验证 Cl2的氧化性
化学试卷 A 第 2 页 (共 8 页)
9. 从我国南海的柳珊瑚中分离得到的柳珊瑚酸(图 1),具有独特的环系结构。下列关于柳珊瑚酸的说法
不正确的是
A.能使溴的四氯化碳溶液褪色
B.能与氨基酸的氨基发生反应
C.其环系结构中 3个五元环共平面
D.其中碳原子的杂化方式有 sp2和 sp3 图 1
10.设 NA为阿伏加德罗常数的值。下列说法正确的是
A.26 g H—C ≡ C—H中含有σ键的数目为 3NA
B.1 L 1 mol·L-1 NH4NO3溶液中含 NH +4 的数目为 NA
C.1 mol CO和 H 的混合气体含有的分子数目为 3NA
D.Na 与 H2O反应生成 11.2 L H2,转移电子数目为 NA
11.按图 2装置进行实验。搅拌一段时间后,滴加浓盐酸。
不同反应阶段的预期现象及其相应推理均合理的是
A.烧瓶壁会变冷,说明存在ΔH<0的反应
B.试纸会变蓝,说明有 NH3生成,产氨过程熵增
C.加浓盐酸后,有白烟产生,说明有 NH4Cl升华
D.实验过程中,气球会一直变大,说明体系压强增大 图 2
12.一种可为运动员补充能量的物质,其分子结构式如图 3。已知 R、W、Z、X、Y为原子序数依次增大
的短周期主族元素,Z和 Y同族,则
A.沸点:ZR3<YR3
B.最高价氧化物的水化物的酸性:Z<W
C.第一电离能:Z<X<W
D.ZX -3 和WX32-空间结构均为平面三角形 图 3
13.下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项 陈述Ⅰ 陈述Ⅱ
A 酸性:CF3COOH<CCl3COOH 电负性:F>Cl
B 某冠醚与 Li+能形成超分子,与 K+则不能 Li+与 K+的离子半径不同
C 由氨制硝酸:NH3→NO→NO2→HNO3 NH3和 NO2均具有氧化性
D 苯酚与甲醛反应,可合成酚醛树脂 合成酚醛树脂的反应是加聚反应
化学试卷 A 第 3 页 (共 8 页)
14.部分含Mg或 Al或 Fe物质的分类与相应化合价关系如图 4。下列推断合理的是
图 4
A.若 a在沸水中可生成 e,则 a→f的反应一定是化合反应
B.在 g→f→e→d转化过程中,一定存在物质颜色的变化
C.加热 c的饱和溶液,一定会形成能产生丁达尔效应的红棕色分散系
D.若 b和 d均能与同一物质反应生成 c,则组成 a的元素一定位于周期表 p区
15.对反应 S(g) T(g)(I为中间产物),相同条件下:①加入催化剂,反应达到平衡所需时间大幅缩短;
②提高反应温度,c 平(S)/c 平(T)增大,c 平(S)/c 平(I)减小。基于以上事实,可能的反应历程示意图为
(—为无催化剂,- - -为有催化剂)
A B C D
16.一种基于氯碱工艺的新型电解池(图 5),可用于湿法冶铁的研究。电解过程中,下列说法不正确的是
图 5
A - -.阳极反应:2Cl -2e =Cl2↑
B -.阴极区溶液中 OH 浓度逐渐升高
C.理论上每消耗 1 mol Fe2O3,阳极室溶液减少 213 g
D.理论上每消耗 1 mol Fe2O3,阴极室物质最多增加 138 g
化学试卷 A 第 4 页 (共 8 页)
二、非选择题:本题共 4小题,共 56分。
17.(14分)含硫物质种类繁多,在一定条件下可相互转化。
(1) 实验室中,浓硫酸与铜丝反应,所产生的尾气可用 (填化学式)溶液吸收。
(2) 工业上,烟气中的 SO 可在通空气条件下用石灰石的浆液吸收,生成石膏。该过程中, (填
元素符号)被氧化。
(3) 工业锅炉需定期除水垢,其中的硫酸钙用纯碱溶液处理时,发生反应:
CaSO4(s)+CO32-(aq) CaCO3(s)+SO42-(aq) (I)
兴趣小组在实验室探究 Na2CO3溶液的浓度对反应(I)的反应速率的影响。
①用 Na2CO3固体配制溶液,以滴定法测定其浓度。
i.该过程中用到的仪器有 。
A B C D
ii.滴定数据及处理:Na2CO3溶液 V0 mL,消耗 c1 mol·L-1盐酸 V1 mL(滴定终点时,CO32-转化为HCO3-),
则 c(Na2CO3) = mol·L-1。
②实验探究:取①中的 Na2CO3溶液,按下表配制总体积相同的系列溶液,分别加入 m1 g硫酸钙固体,
反应 t1 min后,过滤,取 V0 mL滤液,用 c1 mol·L-1盐酸参照①进行滴定。记录的部分数据如下表(忽
略 CO32-水解的影响)。
序号 V(Na2CO3)/mL V(H2O)/mL V(滤液)/mL V 消耗(盐酸)/mL
a 100.0 0 V0 2V1/5
b 80.0 x V0 3V1/10
则 x = ,测得的平均反应速率之比 va : vb = 。
(4) 兴趣小组继续探究反应(I)平衡的建立,进行实验。
①初步实验 将 1.00 g硫酸钙(M =136 g·mol-1)加入到 100.0 mL 0.100 mol·L-1Na2CO3溶液中,在 25℃
和搅拌条件下,利用 pH计测得体系的 pH随时间 t的变化曲线如图 6。
②分析讨论 甲同学根据 t2 min后 pH不改变,认为反应(I)已达到平衡;
乙同学认为证据不足,并提出如下假设:
假设 1 硫酸钙固体已完全消耗;
假设 2 硫酸钙固体有剩余,但被碳酸钙沉淀包裹。
图 6
③验证假设乙同学设计如下方案,进行实验。
步骤 现象
i.将①实验中的反应混合物进行固液分离 /
ii.取少量分离出的沉淀置于试管中,滴加 ,沉淀完全溶解
iii.继续向 ii的试管中滴加 无白色沉淀生成
④实验小结 假设 1成立,假设 2不成立。①实验中反应(I)平衡未建立。
⑤优化方案、建立平衡 写出优化的实验方案,并给出反应(I)平衡已建立的判断依据:
。
化学试卷 A 第 5 页 (共 8 页)
18.(14分)镓(Ga)在半导体、记忆合金等高精尖材料领域有重要应用。一种从电解铝的副产品炭渣(含
C、Na、Al、F和少量的 Ga、Fe、K、Ca等元素)中提取镓及循环利用铝的工艺如下。
工艺中,LAEM是一种新型阴离子交换膜,允许带负电荷的配离子从高浓度区扩散至低浓度区。
用 LAEM提取金属离子Mn+的原理如图 7。已知:
①pKa(HF) = 3.2。
②Na [AlF ](冰晶石)的 Ksp为 4.0×10-10。
③浸取液中,Ga(Ⅲ)和 Fe(Ⅲ)以[MClm](m-3)-(m = 0~4)微粒形式存在,
Fe2+ - -最多可与 2个 Cl 配位,其他金属离子与 Cl 的配位可忽略。 图 7
(1) “电解”中,反应的化学方程式为 。
(2) “浸取”中,由 Ga3+ -形成[GaCl4] 的离子方程式为 。
(3) “还原”的目的:避免 元素以 (填化学式)微粒的形式通过 LAEM,从而有利于
Ga的分离。
(4) “LAEM -提取”中,原料液的 Cl 浓度越 ,越有利于 Ga的提取;研究表明,原料液酸度过高,
会降低 Ga 的提取率。因此,在不提高原料液酸度的前提下,可向 I室中加入 (填化学
式),以进一步提高 Ga的提取率。
(5) “调 pH”中,pH -至少应大于 ,使溶液中 c(F )>c(HF),有利于[AlF6]3-配离子及 Na [AlF ]晶体
的生成。若“结晶”后溶液中 c(Na+) = 0.10 mol·L-1 ,则[AlF6]3-的浓度为 mol·L-1。
(6) 一种含 Ga、Ni、Co元素的记忆合金的晶体结构可描述为 Ga与 Ni交替填充在 Co构成的立方体体心,
形成如图 8 所示的结构单元。该合金的晶胞中,粒子个数最简比 Co : Ga : Ni = ,其立方
晶胞的体积为 nm3。
图 8
化学试卷 A 第 6 页 (共 8 页)
19.(14分)酸在多种反应中具有广泛应用,其性能通常与酸的强度密切相关。
(1) 酸催化下NaNO2与NH4Cl混合溶液的反应(反应a),可用于石油开采中油路解堵。
①基态N原子价层电子的轨道表示式为: 。
- +
②反应a:NO2 (aq)+NH4 (aq)=N2(g)+2H2O(l)
已知:
则反应a的ΔH = 。 图 9
③某小组研究了3种酸对反应a的催化作用。在相同条件下,向反应体系中滴加等物质的量的少量酸,
测得体系的温度T随时间t的变化如图9。据图可知,在该过程中, 。
A.催化剂酸性增强,可增大反应焓变
B.催化剂酸性增强,有利于提高反应速率
C.催化剂分子中含H越多,越有利于加速反应
D.反应速率并不始终随着反应物浓度下降而减小
(2) 在非水溶剂中,将CO2转化为化合物ii(一种重要的电子化学品)的催化机理示意图如图10,其中的
催化剂有 和 。
图10 图11
(3) 在非水溶剂中研究弱酸的电离平衡具有重要科学价值。一定温度下,某研究组通过分光光度法测定
了两种一元弱酸HX(X为A或B)在某非水溶剂中的Ka。
a.选择合适的指示剂HIn,Ka(HIn) = 3.6×10-20;其钾盐为KIn。
b - -.向KIn溶液中加入HX,发生反应:In +HX X +HIn。KIn起始的物质的量为n0(KIn),加入
HX的物质的量为n(HX),平衡时,测得c平(In )/c平(HIn)随n(HX)/n0(KIn)的变化曲线如图11。
已知:该溶剂本身不电离,钾盐在该溶剂中完全电离。
①计算Ka(HA)。(写出计算过程,结果保留两位有效数字)
②在该溶剂中,Ka(HB) Ka(HA);Ka(HB) Ka(HIn)。(填“>”“<”或“=”)
化学试卷 A 第 7 页 (共 8 页)
20.(14分)将3D打印制备的固载铜离子陶瓷催化材料,用于化学催化和生物催化一体化技术,以实现化合
物Ⅲ的绿色合成,示意图如下(反应条件略)。
(1) 化合物Ⅰ的分子式为 ,名称为 。
(2) 化合物Ⅱ中含氧官能团的名称是 。化合物Ⅱ的某同分异构体含有苯环,在核磁共
振氢谱图上只有4组峰,且能够发生银镜反应,其结构简式为 。
(3) 关于上述示意图中的相关物质及转化,下列说法正确的有 。
A.由化合物Ⅰ到Ⅱ的转化中,有π键的断裂与形成
B.由葡萄糖到葡萄糖酸内酯的转化中,葡萄糖被还原
C.葡萄糖易溶于水,是因为其分子中有多个羟基,,能与水分子形成氢键
D.由化合物Ⅱ到Ⅲ的转化中,存在C、O原子杂化方式的改变,有手性碳原子形成
(4) 对化合物Ⅲ,分析预测其可能的化学性质,完成下表。
序号 反应试剂、条件 反应形成的新结构 反应类型
①
② 取代反应
(5) 在一定条件下,以原子利用率100%的反应制备HOCH(CH3)2。该反应中,
①若反应物之一为非极性分子,则另一反应物为 (写结构简式)。
②若反应物之一为V形结构分子,则另一反应物为 (写结构简式)。
(6) 以2-溴丙烷为唯一有机原料,合成CH3COOCH(CH3)2。基于你设计的合成路线,回答下列问题:
①最后一步反应的化学方程式为 (注明反应条件)。
②第一步反应的化学方程式为 (写一个即可,注明反应条件)。
化学试卷 A 第 8 页 (共 8 页)
2024年广东省普通高中学业水平选择性考试
化学参考答案
一、选择题:本题共 16小题,共 44分。第 1~10小题,每小题 2分;第 11~16小题,每小题 4分。在每
小题给出的四个选项中,只有一项是符合题目要求的。
题号 1 2 3 4 5 6 7 8
选项 C C C B D C D A
题号 9 10 11 12 13 14 15 16
选项 C A B D B B A C
二、非选择题:本题共 4小题,共 56分。
17.(14分)
(1)NaOH;
(2)S;
3 BD 1 1( )① ; ; ② 20.0;6 : 5;
0
(4)③ 足量稀盐酸;有气泡生成;少量BaCl2溶液;
④ 将2.36g(或大于此量的)硫酸钙加入到100 mL 0.1 mol·L-1 Na2CO3溶液中,在25℃和搅拌条件下,
利用pH计测量混合液的pH,待混合液pH不变时,加入Na2SO4固体,pH增大,说明反应(Ⅰ)平
衡已建立。
18.(14分)
(1)2Al2O3 4Al+3O2↑(1分);
(2)Ga3++4Cl-=[GaCl -4] ;
(3)Fe; [FeCl ]-4 ;
(4)高;NaCl;
(5)3.2;4.0×10-7;
(6)2 : 1 : 1;8a3。
化学试卷 A 参考答案 第 1 页 (共 2 页)
19.(14分)
(1)① ; ② ΔH1+ΔH4-ΔH2-ΔH3; ③ BD;
(2)AcOH;KI;
(3)① 解:由图11知当n(HX)/n0(KIn) = 1时,c平(In )/c平(HIn) = 3;设n0(KIn) = n0,则有
In- + HX X- + HIn
起始量(mol) n0 n0 0 0
变化量(mol) x x x x
平衡量(mol) n0-x n0-x x x
即 c平(In )/c平(HIn) =
0
= 3 x =
0 n -x = 3 解得 04 0 4
(A )· (HIn) (A )· (HIn) 0 · 0 1
可得 K = = = 4 4 =
(HA)· (In ) (HA)· (In ) 3 0 · 3 0 94 4
(A )· (HIn) (HA)
又 K = =
a = a(HA)
(HA)· (In ) a(HIn) 3.6×10 20
解得 Ka(HA) = 4.0×10-21
② >;>。
20.(14分)
(1)C8H8;苯乙烯
(2)酮羰基; ;
(3)ACD;
(4)① H2,催化剂,加热; 加成反应(或 还原反应);
② 浓HBr,加热; —Br;(或 CH3COOH,浓硫酸,加热; ;)
(5)① ; ② ;
(6) ;
。
化学试卷 A 参考答案 第 2 页 (共 2 页)
同课章节目录
