河南省许昌市2023-2024学年高一下学期期末考试化学试题(无答案)
文档属性
| 名称 | 河南省许昌市2023-2024学年高一下学期期末考试化学试题(无答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1017.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-05 10:06:57 | ||
图片预览

文档简介
许昌市2023-2024学年高一下学期期末考试
化学
(考试时间75分钟,全卷满分100分)
说明:①请把答案书写在答题卡上,直接写在本试卷上无效。
②可能用到的相对原子质量:H:1 C:12 N:14 O:16 S:32 Cu:64
第Ⅰ卷 (选择题,共42分)
一、选择题:本题包括14个小题,每小题3分,共42分。每小题只有一个选项符合题意。
1.科技进步和人们的日常生活都离不开化学。下列说法错误的是
A.“珠海一号”运载火箭中用到的碳化硅属于新型无机非金属材料
B.苯甲酸钠常用作食品防腐剂是因为其具有酸性
C.磁悬浮列车中使用的聚氯乙烯塑料可由氯乙烯通过加聚反应制得
D.红酒中常添加适量二氧化硫可以起到杀菌、防氧化的作用
2.下列化学用语书写正确的是
A.硫离子( S )的结构示意图, B.氮气的电子式:
C.乙烷的结构式:CH CH D.丙烷分子的空间填充模型:
3.下列各组物质中,互为同分异构体的是
A. 和 B.乙烷和丙烷
C.2-甲基丁烷和正戊烷 D.碳纳米管和石墨烯
4.下列关于有机物的说法中,正确的一组是
①糖类、蛋白质、油脂是人体所需的基本营养物质,都是天然有机高分子
②石油的分馏、裂化和煤的干馏都是化学变化
③正丁烷的熔、沸点高于异丁烷的熔、沸点
④绿色化学的核心思想是“先污染后治理”
⑤向鸡蛋清溶液中滴入浓硝酸并加热,溶液呈黄色
A.①③ B.①⑤ C.②④ D.③⑤
5.设NA 为阿伏加德罗常数的值。下列说法正确的是
A.17g羟基中含有的电子数为9NA
B.7.8g苯分子中含有碳碳双键的数目为0.3NA
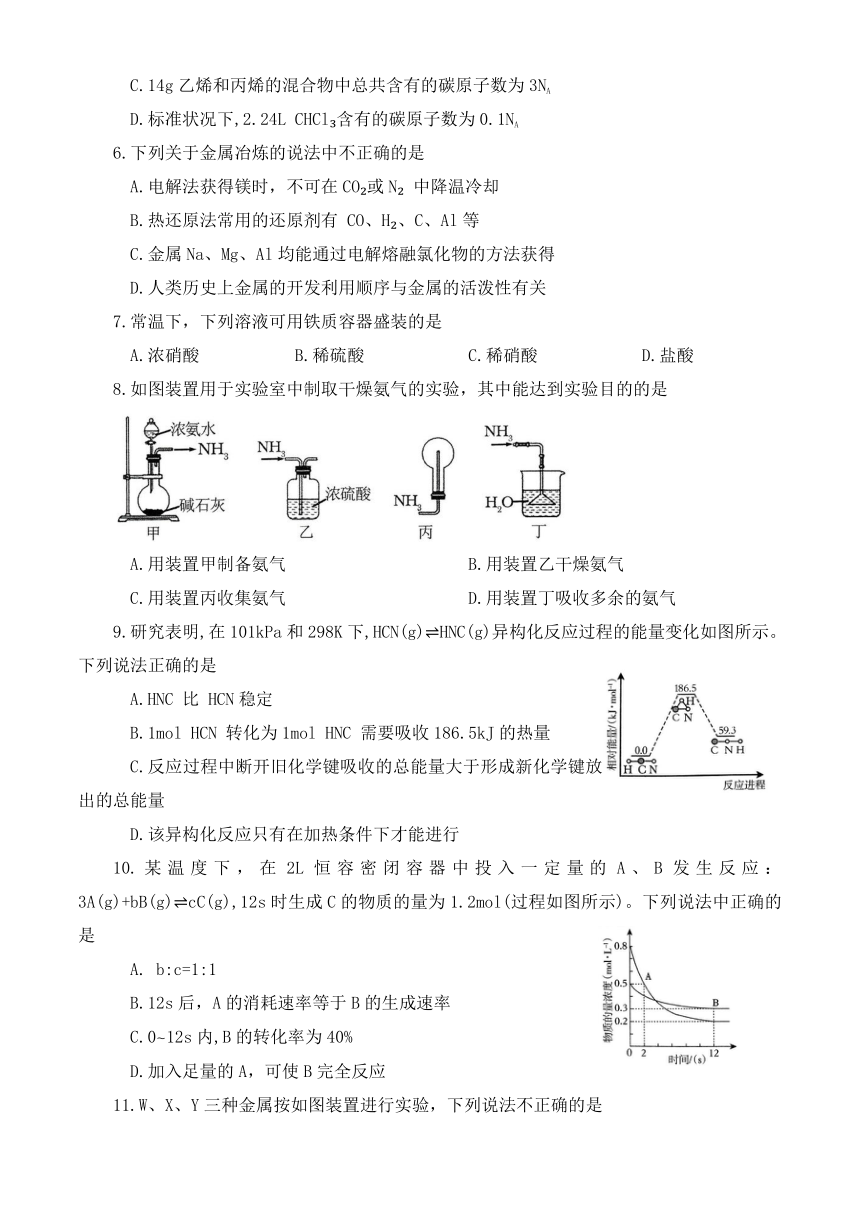
C.14g乙烯和丙烯的混合物中总共含有的碳原子数为3NA
D.标准状况下,2.24L CHCl 含有的碳原子数为0.1NA
6.下列关于金属冶炼的说法中不正确的是
A.电解法获得镁时,不可在CO 或N 中降温冷却
B.热还原法常用的还原剂有 CO、H 、C、Al等
C.金属Na、Mg、Al均能通过电解熔融氯化物的方法获得
D.人类历史上金属的开发利用顺序与金属的活泼性有关
7.常温下,下列溶液可用铁质容器盛装的是
A.浓硝酸 B.稀硫酸 C.稀硝酸 D.盐酸
8.如图装置用于实验室中制取干燥氨气的实验,其中能达到实验目的的是
A.用装置甲制备氨气 B.用装置乙干燥氨气
C.用装置丙收集氨气 D.用装置丁吸收多余的氨气
9.研究表明,在101kPa和298K下,HCN(g) HNC(g)异构化反应过程的能量变化如图所示。下列说法正确的是
A.HNC 比 HCN稳定
B.1mol HCN 转化为1mol HNC 需要吸收186.5kJ的热量
C.反应过程中断开旧化学键吸收的总能量大于形成新化学键放出的总能量
D.该异构化反应只有在加热条件下才能进行
10.某温度下,在2L恒容密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g) cC(g),12s时生成C的物质的量为1.2mol(过程如图所示)。下列说法中正确的是
A. b:c=1:1
B.12s后,A的消耗速率等于B的生成速率
C.0~12s内,B的转化率为40%
D.加入足量的A,可使B完全反应
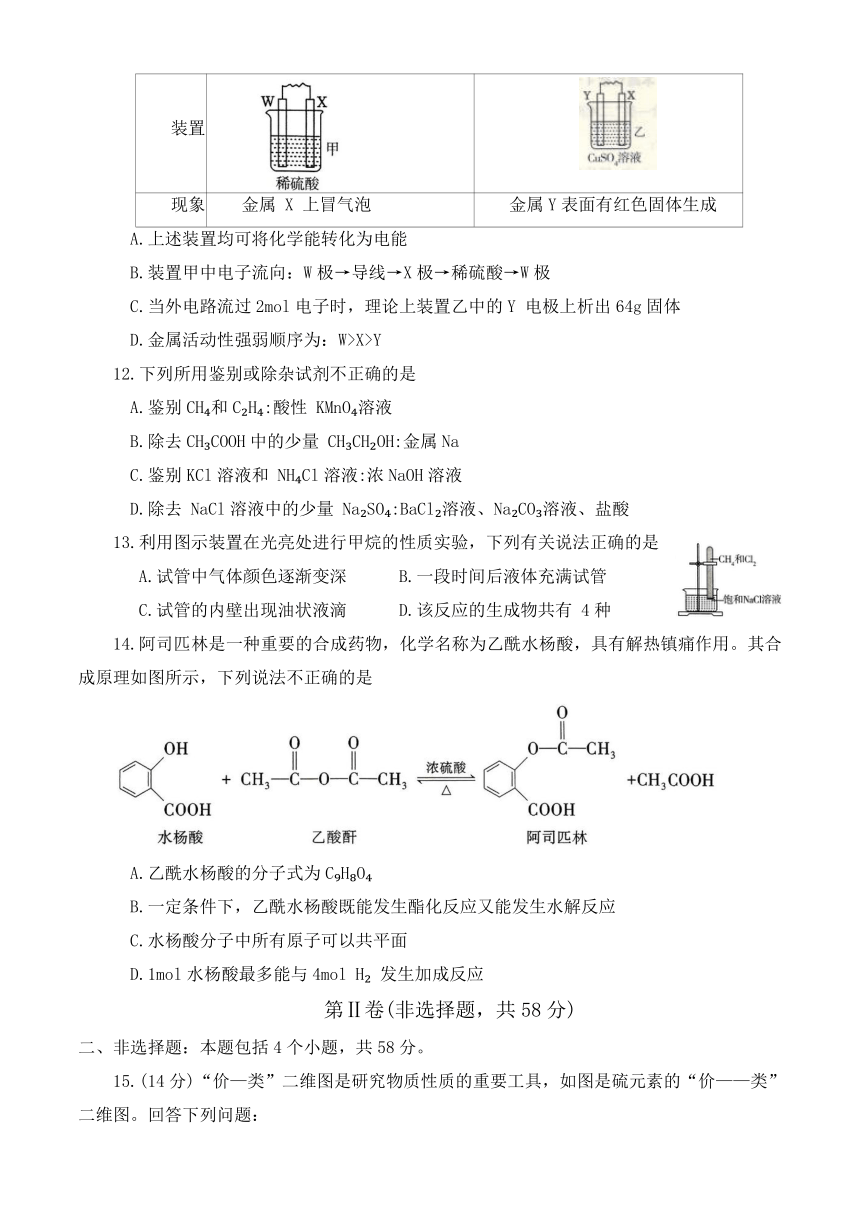
11.W、X、Y三种金属按如图装置进行实验,下列说法不正确的是
装置
现象 金属 X 上冒气泡 金属Y表面有红色固体生成
A.上述装置均可将化学能转化为电能
B.装置甲中电子流向:W极→导线→X极→稀硫酸→W极
C.当外电路流过2mol电子时,理论上装置乙中的Y 电极上析出64g固体
D.金属活动性强弱顺序为:W>X>Y
12.下列所用鉴别或除杂试剂不正确的是
A.鉴别CH 和C H :酸性 KMnO 溶液
B.除去CH COOH中的少量 CH CH OH:金属Na
C.鉴别KCl溶液和 NH Cl溶液:浓NaOH溶液
D.除去 NaCl溶液中的少量 Na SO :BaCl 溶液、Na CO 溶液、盐酸
13.利用图示装置在光亮处进行甲烷的性质实验,下列有关说法正确的是
A.试管中气体颜色逐渐变深 B.一段时间后液体充满试管
C.试管的内壁出现油状液滴 D.该反应的生成物共有 4种
14.阿司匹林是一种重要的合成药物,化学名称为乙酰水杨酸,具有解热镇痛作用。其合成原理如图所示,下列说法不正确的是
A.乙酰水杨酸的分子式为C H O
B.一定条件下,乙酰水杨酸既能发生酯化反应又能发生水解反应
C.水杨酸分子中所有原子可以共平面
D.1mol水杨酸最多能与4mol H 发生加成反应
第Ⅱ卷(非选择题,共58分)
二、非选择题:本题包括4个小题,共58分。
15.(14分)“价—类”二维图是研究物质性质的重要工具,如图是硫元素的“价——类”二维图。回答下列问题:
(1)反应a+c→b中,氧化产物与还原产物的物质的量之比为 ;附着在试管壁上的物质b可以采用物理方法除去,该方法中常用到的试剂为 (填试剂名称)。
(2)可用铜与f的浓溶液反应制备c,反应的化学方程式为 ,该反应表明f的浓溶液具有 (填序号)。
①酸性 ②吸水性 ③脱水性 ④强氧化性
(3)将足量c通入到酸性KMnO 溶液中,可观察到 ,发生反应的离子方程式为 。
(4)工业上产生的大量c排放到大气中会引起酸雨,实验室常用 溶液吸收多余的c。
16.(15分)Ⅰ.传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高,DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量气压、浓度、pH、温度等而在化学实验研究中应用越来越广泛深入。将打磨后的镁条放入锥形瓶中,再将注射器中某浓度的盐酸压入锥形瓶中如图1,通过数字传感器测定实验中密闭容器(气密性良好)内压强与时间的关系如图2所示。
(1)镁条与稀盐酸反应为 (填“吸热”或“放热”)反应,图2中a、b、c、d四个点中,产生氢气最快的为 点。
Ⅱ.向恒温恒容的密闭容器中,加入足量的碳和一定量NO,发生反应:( ,数字传感器测得浓度随时间变化如表:
反应时间/s 0 80 90 100 110
CO 浓度/(mol·L ) 0.00 0.30 0.36 0.39 0.39
(2)下列措施能加快反应速率的是 。
A.及时分离出氮气 B.升高反应体系温度
C.使用高效催化剂 D.在体系中通入氦气
(3)0~90s用NO来表示反应的平均速率为 。
(4)下列能说明反应达到平衡状态的是 。
B.容器内压强不再改变
C.容器内气体的平均相对分子质量不再改变 D.N 的体积分数不再改变
(5)已知合成氨反应中,随温度升高氨的产率会下降。在实际生产中,选定的温度为 ~500℃,为避免产率太低反应的温度不宜过高;但温度也不宜过低,原因是 。除传统方法外,近几年科学家在研究利用原电池原理进行常温常压下合成氨。一种通过原电池进行合成氨的装置如图,在该装置中,电极a为 极(填“正”或“负”),该电极的电极反应式为 ;当外电路流过1mol电子时,理论上消耗H 的体积为 L(标准状况下)。
17.(16分)(一)乙酸乙酯是应用最广的脂肪酸酯之一,是极好的工业溶剂,广泛应用于油墨、人造革生产中。为了提高乙酸乙酯产率,某小组同学对课本装置进行了改进。有关有机物的沸点及实验装置图如下,请回答下列问题:
试剂 浓硫酸(98%) 乙醇 乙酸 乙酸乙酯
沸点/℃ 338.0 78.5 118 77.1
(1)仪器A的名称是 ,仪器B球形干燥管的作用除了冷凝外,还可以 。
(2)若用同位素 O标记乙醇中的氧原子,则 与乙酸生成乙酸乙酯的化学方程式为 。
(3)装置C 中盛放试剂为 ,其作用为 (填字母代号)。
a.吸收挥发出的硫酸,加快反应速率 b.反应乙酸
c.降低乙酸乙酯的溶解度,有利于分层析出 d.吸收部分乙醇
(二)有机物Ⅰ(乙酸环己酯)是一种香料,用于配制苹果、香蕉、醋栗和树莓等果香型香精,下面是利用两种石油化工产品制备Ⅰ的一种合成路线:
(4)A的结构简式为 ,D中官能团的名称为 。
(5)反应①~⑥中,属于加成反应的有 (填序号)。
(6)反应②的化学方程式为 。
(7)X是A的同系物,其相对分子质量比A大42,其中含3个—CH 的X结构简式为 。
18.(13分)海洋是巨大的资源宝库,孕育着丰富的矿产。海水资源的综合利用对人类的生产生活有重要意义。回答下列问题:
Ⅰ.从海带中提取碘的工艺流程如图所示:
(1)灼烧干海带需在仪器 (填“蒸发皿”“坩埚”或“烧杯”)内进行。
(2)用蒸馏水浸取海带灰时,为提高浸取率,可采用的方法有 (写出两种)。
(3)将溶液中的Ⅰ 氧化成 ,最佳选用试剂为 (填标号)。
A.稀硝酸 B.酸性 C.浓硫酸 D.稀硫酸、
(4)欲证明水溶液中含有 ,实验方法为 。
Ⅱ.空气吹出法是目前“海水提溴”的主要方法之一,其主要工艺流程如图所示:
(5)步骤②说明溴单质具有 性,步骤③④的目的是 。
(6)步骤③的还原剂若为 溶液,则其离子方程式为 。
化学
(考试时间75分钟,全卷满分100分)
说明:①请把答案书写在答题卡上,直接写在本试卷上无效。
②可能用到的相对原子质量:H:1 C:12 N:14 O:16 S:32 Cu:64
第Ⅰ卷 (选择题,共42分)
一、选择题:本题包括14个小题,每小题3分,共42分。每小题只有一个选项符合题意。
1.科技进步和人们的日常生活都离不开化学。下列说法错误的是
A.“珠海一号”运载火箭中用到的碳化硅属于新型无机非金属材料
B.苯甲酸钠常用作食品防腐剂是因为其具有酸性
C.磁悬浮列车中使用的聚氯乙烯塑料可由氯乙烯通过加聚反应制得
D.红酒中常添加适量二氧化硫可以起到杀菌、防氧化的作用
2.下列化学用语书写正确的是
A.硫离子( S )的结构示意图, B.氮气的电子式:
C.乙烷的结构式:CH CH D.丙烷分子的空间填充模型:
3.下列各组物质中,互为同分异构体的是
A. 和 B.乙烷和丙烷
C.2-甲基丁烷和正戊烷 D.碳纳米管和石墨烯
4.下列关于有机物的说法中,正确的一组是
①糖类、蛋白质、油脂是人体所需的基本营养物质,都是天然有机高分子
②石油的分馏、裂化和煤的干馏都是化学变化
③正丁烷的熔、沸点高于异丁烷的熔、沸点
④绿色化学的核心思想是“先污染后治理”
⑤向鸡蛋清溶液中滴入浓硝酸并加热,溶液呈黄色
A.①③ B.①⑤ C.②④ D.③⑤
5.设NA 为阿伏加德罗常数的值。下列说法正确的是
A.17g羟基中含有的电子数为9NA
B.7.8g苯分子中含有碳碳双键的数目为0.3NA
C.14g乙烯和丙烯的混合物中总共含有的碳原子数为3NA
D.标准状况下,2.24L CHCl 含有的碳原子数为0.1NA
6.下列关于金属冶炼的说法中不正确的是
A.电解法获得镁时,不可在CO 或N 中降温冷却
B.热还原法常用的还原剂有 CO、H 、C、Al等
C.金属Na、Mg、Al均能通过电解熔融氯化物的方法获得
D.人类历史上金属的开发利用顺序与金属的活泼性有关
7.常温下,下列溶液可用铁质容器盛装的是
A.浓硝酸 B.稀硫酸 C.稀硝酸 D.盐酸
8.如图装置用于实验室中制取干燥氨气的实验,其中能达到实验目的的是
A.用装置甲制备氨气 B.用装置乙干燥氨气
C.用装置丙收集氨气 D.用装置丁吸收多余的氨气
9.研究表明,在101kPa和298K下,HCN(g) HNC(g)异构化反应过程的能量变化如图所示。下列说法正确的是
A.HNC 比 HCN稳定
B.1mol HCN 转化为1mol HNC 需要吸收186.5kJ的热量
C.反应过程中断开旧化学键吸收的总能量大于形成新化学键放出的总能量
D.该异构化反应只有在加热条件下才能进行
10.某温度下,在2L恒容密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g) cC(g),12s时生成C的物质的量为1.2mol(过程如图所示)。下列说法中正确的是
A. b:c=1:1
B.12s后,A的消耗速率等于B的生成速率
C.0~12s内,B的转化率为40%
D.加入足量的A,可使B完全反应
11.W、X、Y三种金属按如图装置进行实验,下列说法不正确的是
装置
现象 金属 X 上冒气泡 金属Y表面有红色固体生成
A.上述装置均可将化学能转化为电能
B.装置甲中电子流向:W极→导线→X极→稀硫酸→W极
C.当外电路流过2mol电子时,理论上装置乙中的Y 电极上析出64g固体
D.金属活动性强弱顺序为:W>X>Y
12.下列所用鉴别或除杂试剂不正确的是
A.鉴别CH 和C H :酸性 KMnO 溶液
B.除去CH COOH中的少量 CH CH OH:金属Na
C.鉴别KCl溶液和 NH Cl溶液:浓NaOH溶液
D.除去 NaCl溶液中的少量 Na SO :BaCl 溶液、Na CO 溶液、盐酸
13.利用图示装置在光亮处进行甲烷的性质实验,下列有关说法正确的是
A.试管中气体颜色逐渐变深 B.一段时间后液体充满试管
C.试管的内壁出现油状液滴 D.该反应的生成物共有 4种
14.阿司匹林是一种重要的合成药物,化学名称为乙酰水杨酸,具有解热镇痛作用。其合成原理如图所示,下列说法不正确的是
A.乙酰水杨酸的分子式为C H O
B.一定条件下,乙酰水杨酸既能发生酯化反应又能发生水解反应
C.水杨酸分子中所有原子可以共平面
D.1mol水杨酸最多能与4mol H 发生加成反应
第Ⅱ卷(非选择题,共58分)
二、非选择题:本题包括4个小题,共58分。
15.(14分)“价—类”二维图是研究物质性质的重要工具,如图是硫元素的“价——类”二维图。回答下列问题:
(1)反应a+c→b中,氧化产物与还原产物的物质的量之比为 ;附着在试管壁上的物质b可以采用物理方法除去,该方法中常用到的试剂为 (填试剂名称)。
(2)可用铜与f的浓溶液反应制备c,反应的化学方程式为 ,该反应表明f的浓溶液具有 (填序号)。
①酸性 ②吸水性 ③脱水性 ④强氧化性
(3)将足量c通入到酸性KMnO 溶液中,可观察到 ,发生反应的离子方程式为 。
(4)工业上产生的大量c排放到大气中会引起酸雨,实验室常用 溶液吸收多余的c。
16.(15分)Ⅰ.传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高,DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量气压、浓度、pH、温度等而在化学实验研究中应用越来越广泛深入。将打磨后的镁条放入锥形瓶中,再将注射器中某浓度的盐酸压入锥形瓶中如图1,通过数字传感器测定实验中密闭容器(气密性良好)内压强与时间的关系如图2所示。
(1)镁条与稀盐酸反应为 (填“吸热”或“放热”)反应,图2中a、b、c、d四个点中,产生氢气最快的为 点。
Ⅱ.向恒温恒容的密闭容器中,加入足量的碳和一定量NO,发生反应:( ,数字传感器测得浓度随时间变化如表:
反应时间/s 0 80 90 100 110
CO 浓度/(mol·L ) 0.00 0.30 0.36 0.39 0.39
(2)下列措施能加快反应速率的是 。
A.及时分离出氮气 B.升高反应体系温度
C.使用高效催化剂 D.在体系中通入氦气
(3)0~90s用NO来表示反应的平均速率为 。
(4)下列能说明反应达到平衡状态的是 。
B.容器内压强不再改变
C.容器内气体的平均相对分子质量不再改变 D.N 的体积分数不再改变
(5)已知合成氨反应中,随温度升高氨的产率会下降。在实际生产中,选定的温度为 ~500℃,为避免产率太低反应的温度不宜过高;但温度也不宜过低,原因是 。除传统方法外,近几年科学家在研究利用原电池原理进行常温常压下合成氨。一种通过原电池进行合成氨的装置如图,在该装置中,电极a为 极(填“正”或“负”),该电极的电极反应式为 ;当外电路流过1mol电子时,理论上消耗H 的体积为 L(标准状况下)。
17.(16分)(一)乙酸乙酯是应用最广的脂肪酸酯之一,是极好的工业溶剂,广泛应用于油墨、人造革生产中。为了提高乙酸乙酯产率,某小组同学对课本装置进行了改进。有关有机物的沸点及实验装置图如下,请回答下列问题:
试剂 浓硫酸(98%) 乙醇 乙酸 乙酸乙酯
沸点/℃ 338.0 78.5 118 77.1
(1)仪器A的名称是 ,仪器B球形干燥管的作用除了冷凝外,还可以 。
(2)若用同位素 O标记乙醇中的氧原子,则 与乙酸生成乙酸乙酯的化学方程式为 。
(3)装置C 中盛放试剂为 ,其作用为 (填字母代号)。
a.吸收挥发出的硫酸,加快反应速率 b.反应乙酸
c.降低乙酸乙酯的溶解度,有利于分层析出 d.吸收部分乙醇
(二)有机物Ⅰ(乙酸环己酯)是一种香料,用于配制苹果、香蕉、醋栗和树莓等果香型香精,下面是利用两种石油化工产品制备Ⅰ的一种合成路线:
(4)A的结构简式为 ,D中官能团的名称为 。
(5)反应①~⑥中,属于加成反应的有 (填序号)。
(6)反应②的化学方程式为 。
(7)X是A的同系物,其相对分子质量比A大42,其中含3个—CH 的X结构简式为 。
18.(13分)海洋是巨大的资源宝库,孕育着丰富的矿产。海水资源的综合利用对人类的生产生活有重要意义。回答下列问题:
Ⅰ.从海带中提取碘的工艺流程如图所示:
(1)灼烧干海带需在仪器 (填“蒸发皿”“坩埚”或“烧杯”)内进行。
(2)用蒸馏水浸取海带灰时,为提高浸取率,可采用的方法有 (写出两种)。
(3)将溶液中的Ⅰ 氧化成 ,最佳选用试剂为 (填标号)。
A.稀硝酸 B.酸性 C.浓硫酸 D.稀硫酸、
(4)欲证明水溶液中含有 ,实验方法为 。
Ⅱ.空气吹出法是目前“海水提溴”的主要方法之一,其主要工艺流程如图所示:
(5)步骤②说明溴单质具有 性,步骤③④的目的是 。
(6)步骤③的还原剂若为 溶液,则其离子方程式为 。
同课章节目录
