化学人教版(2019)必修第一册1.2.1电解质的电离(共41张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.2.1电解质的电离(共41张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 184.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-05 18:46:03 | ||
图片预览









文档简介
(共41张PPT)
第二节 离子反应
课时1 电解质的电离
人教版2019必修第一册
第一章 物质及其变化
素养目标
宏观辨识与微观探析:
从宏观上进一步对物质进行分类,理解电解质的分类标准;从微观上了解电解质的电离,体系导电的原因;从微观出发,对酸碱盐进行更加本质的定义。
证据推理与模型认知:
建立电解质电离的基本模型,通过该模型从电离的角度出发,对物质进行标准的分类,为后续的化学知识的学习奠定坚实基础。
科学探究与创新意识:
通过实验探究,对物质导电的原因进行分析,总结电解质的电离规律,体会实验探究在化学研究过程中的重要意义。
教学目标
本节重点
电解质及电离的概念、电离方程式的书写。
本节难点
电解质概念的理解及判断、实验方案的设计。
通过合作探究对溶液导电性的分析,知道电解质、非电解质的概念,认识常见的电解质,能从微观的角度(电离)认识酸、碱和盐,并能用电离方程式表示酸、碱、盐的电离过程。
新课导入
你知道吗?
为什么不能用湿手去接触电源开关、插座或其他电气设备?
人皮肤中汗液有盐分(主要成分是NaCl)
汗液(NaCl溶液)能导电?
电解质和非电解质
壹
电解质的电离
贰
电离方程式的书写
叁
知识导航
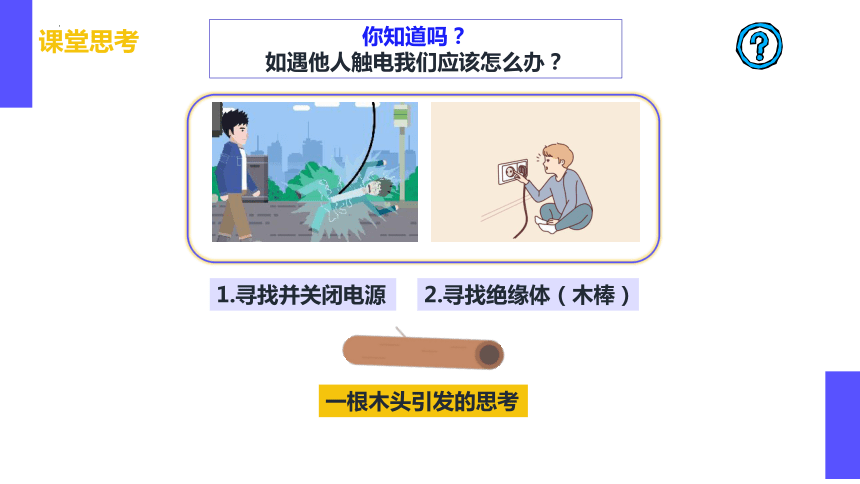
课堂思考
你知道吗?
如遇他人触电我们应该怎么办?
1.寻找并关闭电源
2.寻找绝缘体(木棒)
一根木头引发的思考
01
电解质和非电解质
课堂探究
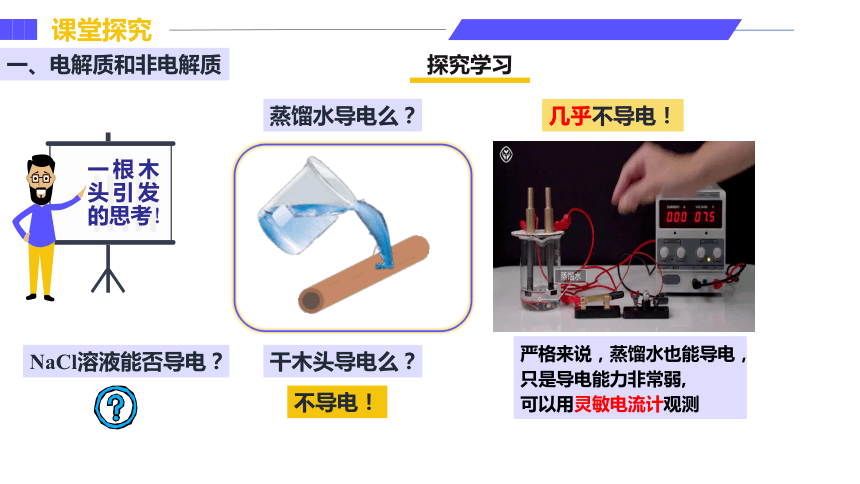
一、电解质和非电解质
探究学习
一根木头引发的思考!
几乎不导电!
干木头导电么?
蒸馏水导电么?
不导电!
严格来说,蒸馏水也能导电,
只是导电能力非常弱,
可以用灵敏电流计观测
NaCl溶液能否导电?
课堂探究
一、电解质和非电解质
探究学习
NaCl溶液能否导电?
任务1:设计实验探究NaCl溶液能否导电
实验现象:
灯泡发光
实验结论:
NaCl溶液能导电
请你猜想!
NaCl溶液能导电的原因?
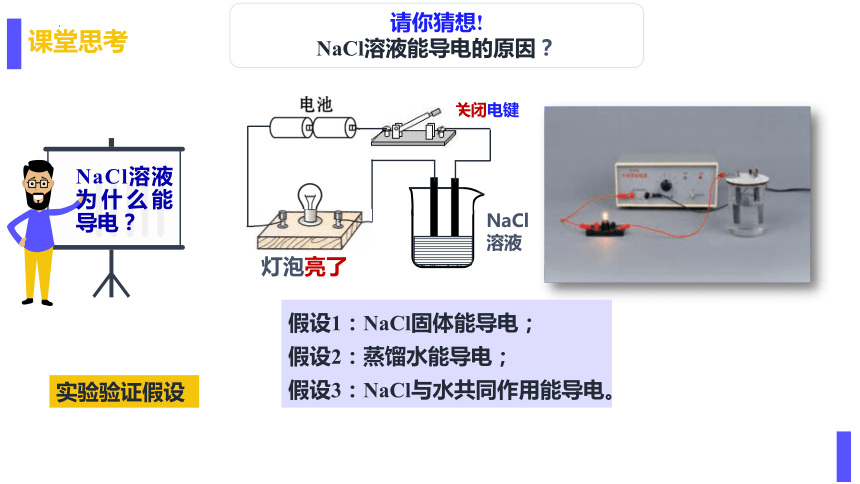
课堂思考
NaCl溶液为什么能导电?
假设1:NaCl固体能导电;
假设2:蒸馏水能导电;
假设3:NaCl与水共同作用能导电。
灯泡亮了
关闭电键
NaCl溶液
实验验证假设
课堂探究
一、电解质和非电解质
探究学习
NaCl溶液为什么能导电?
任务2:实验探究NaCl溶液能导电的原因
课堂探究
一、电解质和非电解质
探究学习
任务2:探究NaCl溶液能导电的原因
NaCl溶液为什么能导电?
实验结果:
干燥的氯化钠固体,KNO3固体和蒸馏水均不导电,而氯化钠溶液和KNO3溶液却能够导电。
NaCl固体,KNO3固溶于水导电,其他条件下是否可以导电?
课堂探究
一、电解质和非电解质
熔融状态NaCl能否导电?
任务3:探究熔融状态下NaCl的导电性
探究学习
实验现象:
灯泡发光
实验结论:
熔融NaCl能导电
课堂探究
一、电解质和非电解质
熔融状态硝酸钾能否导电?
任务3:探究熔融状态下硝酸钾的导电性
探究学习
实验现象:
灯泡发光
实验结论:
熔融硝酸钾导电
课堂思考
请你思考!
下列物质哪些能导电,在什么条件下可以导电?
盐酸溶液、Cu、熔融NaOH、MgCl2、NaOH固体、H2SO4 、Fe2(SO4)3、KNO3、硫酸钡、蔗糖、酒精。
能导电
盐酸溶液、Cu、熔融NaOH
一定条件(溶于水或熔融状态)才能导电
MgCl2、NaOH固体、H2SO4 、Fe2(SO4)3、KNO3、硫酸钡
蔗糖、酒精
一定条件(溶于水或熔融状态)也不能导电
物质的导电性
课堂探究
一、电解质和非电解质
1.在水溶液或熔融状态下,能导电的化合物称之为电解质
2.在水溶液和熔融状态下,不能导电的化合物称之为非电解质
酸:H2SO4、HCl
碱:NaOH、Ca(OH)2
盐:NaCl、KNO3
……
活泼金属氧化物等
H2O
大部分有机物:蔗糖、酒精
非金属氧化物(CO2、SO2等)、NH3等
CO2、SO2、SO3、NH3溶于水可以导电,为什么不是电解质?
它们的水溶液虽然可以导电,但导电的原因实际上是它们和水反应后的物质引起的
H2CO3、H2SO3、H2SO4、NH3 H2O这些酸、碱才是电解质!
课堂探究
一、电解质和非电解质
3.物质分类的另一种方式:
物质
纯净物
混合物
单质
化合物
酸
碱
盐
氧化物
溶液
胶体
浊液
物质
纯净物
混合物
单质
化合物
溶液
胶体
浊液
电解质
非电解质
?
既不是电解质,
也不是非电解质。
按物质的导电性分类
一、电解质和非电解质
课堂探究
4.电解质和非电解质的判断方法
判断物质是否属于电解质:
一看:是不是化合物;
二看:是不是导电;(熔融或水溶液中)
三看:是不是自身电离。
(1)电解质和非电解质都是化合物,单质和混合物既不是电解质,也不是非电解质;
(2)电解质在“水溶液”里或“熔融状态”下能导电,二者具备其一即可;
(3)非电解质在“水溶液”里和“熔融状态”下不能导电,二者需同时满足。
典例精讲
【例1】思考与交流,回答下列问题
(1)金属Cu、稀盐酸都能导电,请问金属Cu、稀盐酸属于电解质吗?
(2)判断盐酸、硫酸、稀硝酸、烧碱溶液是否为电解质或非电解质?
(3)CO2、NH3的水溶液能导电,那么CO2、NH3属于电解质吗?
(4)“一个物质如果不是电解质,就是非电解质”这种说法是否正确?
都不属于,因为金属Cu是单质,稀盐酸是混合物,两者都不是化合物。
盐酸、稀硝酸、烧碱溶液为混合物,既不是电解质,也不是非电解质;硫酸为电解质。
都不属于,因为电解质必须是自身能电离成自由移动离子的化合物。
错误,如单质和混合物既不是电解质也不是非电解质。
一、电解质和非电解质
课堂探究
5.电解质和非电解质的易错提醒
注意!
电解质一定可以导电吗?
电解质与导电性之间没有必然关系:
(1)电解质不一定都能导电:如NaCl固体、HCl气体;
(2)能导电的物质不一定是电解质:如石墨、金属单质、溶液。
电解质与溶解性是否有关?
电解质与溶解性无关
(3)AgCl、BaSO4等难溶盐在水中的溶解度极小,不能导电,但这些物质在熔融状态下能导电,在水中溶解的部分也能完全电离,故属于电解质。
随堂演练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)CO2、NH3溶于水能导电,所以CO2、 NH3是电解质。( )
(2)盐酸能导电,所以盐酸是电解质。 ( )
(3)氯化钠溶液能导电,所以氯化钠溶液是电解质。 ( )
(4)Fe、Cu能够导电,说明它们都是解质。( )
(5)液态氯化氢不导电,但HCl是电解质。( )
(6)氯化钠固体不能导电,所以氯化钠不是电解质。( )
(7)硫黄(S)不能导电,所以硫黄是非电解质。 ( )
(8)CaCO3投入水中几乎不能导电,所以CaCO3是非电解质。 ( )
(9)蔗糖溶液不导电,所以蔗糖溶液是非电解质。( )
×
×
×
×
√
×
×
×
×
课堂思考
请你思考!
为什么NaCl、KNO3等电解质,在干燥时不导电,而溶于水或熔化后却能导电?
02
电解质的电离
二、电解质的电离
课堂探究
探究学习
任务4:NaCl固体不导电的原因探究
NaCl固体为什么不导电?
无自由移动离子
NaCl、KNO3固体不导电
资料:①电流是由带电粒子定向移动形成的。
②影响导电能力的最主要因素为自由移动离子的浓度大小。
课堂探究
二、电解质的电离
NaCl溶液为什么能导电?
探究学习
任务5:微观辨析NaCl溶液导电的原因
电解质导电的原因:产生了可以自由移动的离子
课堂探究
探究学习
二、电解质的电离
插入电极时,带正电荷的Na+向电源负极移动,带负电荷的Cl-向电源正极移动,氯化钠溶液导电。
课堂探究
二、电解质的电离
熔融NaCl为什么能导电?
电解质导电的原因:产生了可以自由移动的离子
任务6:微观辨析熔融NaCl能导电的原因
探究学习
课堂探究
二、电解质的电离
注意
新概念
探究学习
1.电解质溶于水或受热熔化时,形成自由移动的离子的过程叫做电离。
【结论】因此,NaCl固体溶于水或熔融状态能导电的原因是因为在水溶液或熔融状态下均能产生了自由移动的钠离子和氯离子。
课堂探究
二、电解质的电离
为什么蔗糖溶液不导电?
蔗糖分子溶于水时,不能电离
任务7:微观辨析蔗糖溶液、酒精不导电的原因
探究学习
课堂探究
二、电解质的电离
注意
新概念
探究学习
2.理解电解质电离的注意事项
电离的条件是什么?
电离需不需要通电?
电离的结果是什么?
水溶液或熔融状态
电离不需要通电
产生能自由移动的离子
典例精讲
【例 2】判断下列物质在相应条件下能否电离,并说明理由。
①液态HCl:_______,________________________________________________。
②熔融的NaCl:_____,_______________________________。
③熔融的单质铁________,____________。
④固体KOH:________,______________________________。
不能
HCl是酸,液态时不电离,只在水溶液中电离
能
能电离出Na+和Cl-
不能
Fe是单质
不能
电解质在固态时不电离
课堂思考
请你思考!
电解质的电离如何表示?
电解质的电离可以用电离方程式表示(为简便起见,一般仍用离子符号表示水合离子)
如:NaCl = Na+ + Cl-
03
电离方程式的书写
课堂探究
三、电离方程式的书写
注意
新概念
探究学习
1.电离方程式是用化学式和离子符号表示电解质电离过程的式子.
如:NaCl = Na+ + Cl-
化学式
等号
离子符号(代表水合离子)
注意二守恒
质量守恒
电离前后原子或离子个数相等
电荷守恒
右边阴、阳离子所带电荷总数相等
典例精讲
三、电离方程式的书写
注意
练习
HCl、H2SO4、HNO3
【例 3】:写出下列物质的电离方程式
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3-
2.从电离的角度认识酸:电离时生成的阳离子全部是 H+ 的化合物。
思考与讨论
(1)请写出NaOH、Ca(OH)2、Ba(OH)2的电离方程式。
(2)请结合以上电离方程式,并参考酸的本质,尝试从电离的角度概括出碱的本质。
课本P17
课堂探究
三、电离方程式的书写
注意
练习
3.从电离的角度认识碱:电离时生成的阴离子全部是 OH- 的化合物。
NaOH = Na+ + OH -
Ba(OH)2= Ba2+ + 2OH -
Ca(OH)2= Ca2+ + 2OH -
4.从电离的角度认识碱盐:电离时能生成金属阳离子(或NH4+)和酸根离子的化合物
KCl = K+ + Cl-
Na2CO3 = 2Na+ + CO32-
CuSO4 = Cu2+ + SO4 2-
典例精讲
【例4】已知,水溶液中,强酸的酸式根能完全解离,而弱酸的酸式根不能完全解离。书写以下物质的电离方程式。
NaHCO3 NaHSO4
NaHSO4 = Na+ +H+ + SO42-
NaHCO3 = Na+ +HCO3-
思考:NaHSO4溶于水时能电离出H+,NaHSO4属于酸吗?
不是。电离时生成的阳离子不全部是氢离子(H+)、还有Na+。
课堂小结
化合物
非电解质
电解质
水溶液里或熔融状态下能导电
电解质导电原因
电解质种类
电解质电离方程式书写
从电离的角度认识酸碱盐
多数有机物、
非金属氧化物(CO2、SO2等)、
NH3等
随堂演练
2.下列说法中不正确的是( )
①将硫酸钡放入水中不能导电,硫酸钡是非电解质;
②氨溶于水得到氨水溶液能导电,氨水是电解质;
③固态氯化氢不导电,液态氯化氢可以导电;
④硫酸氢钠电离出的阳离子有H+,硫酸氢钠是酸;
⑤电解质放在水中一定能导电,非电解质放在水中一定不导电。
A.仅①④ B.仅①④⑤
C.仅②③ D.①②③④⑤
D
随堂演练
3.以下10种为中学化学常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4
⑥酒精 ⑦BaSO4 ⑧Cu(OH)2 ⑨Fe(OH)3 ⑩NH3·H2O
(1) 属于电解质的是______________________。
(2) 属于非电解质的是 ______________________。
(3) 属于酸的是______________________。
(4) 属于碱的是______________________。
(5) 属于盐的是______________________。
②③⑤⑦⑧⑨⑩
④⑥
⑤
⑧⑨⑩
②③⑦
随堂演练
4.下列电离方程式正确的是( )
A.NaOH 电离方程式:NaOH=Na++H++O2-
B.硫酸铝的电离方程式:Al2(SO4)3=Al23++(SO4)32-
C.NaCl 的电离方程式:NaCl = Na++Cl-
D.硫酸电离方程式:H2SO4=2H++SO42-
D
第二节 离子反应
课时1 电解质的电离
人教版2019必修第一册
第一章 物质及其变化
素养目标
宏观辨识与微观探析:
从宏观上进一步对物质进行分类,理解电解质的分类标准;从微观上了解电解质的电离,体系导电的原因;从微观出发,对酸碱盐进行更加本质的定义。
证据推理与模型认知:
建立电解质电离的基本模型,通过该模型从电离的角度出发,对物质进行标准的分类,为后续的化学知识的学习奠定坚实基础。
科学探究与创新意识:
通过实验探究,对物质导电的原因进行分析,总结电解质的电离规律,体会实验探究在化学研究过程中的重要意义。
教学目标
本节重点
电解质及电离的概念、电离方程式的书写。
本节难点
电解质概念的理解及判断、实验方案的设计。
通过合作探究对溶液导电性的分析,知道电解质、非电解质的概念,认识常见的电解质,能从微观的角度(电离)认识酸、碱和盐,并能用电离方程式表示酸、碱、盐的电离过程。
新课导入
你知道吗?
为什么不能用湿手去接触电源开关、插座或其他电气设备?
人皮肤中汗液有盐分(主要成分是NaCl)
汗液(NaCl溶液)能导电?
电解质和非电解质
壹
电解质的电离
贰
电离方程式的书写
叁
知识导航
课堂思考
你知道吗?
如遇他人触电我们应该怎么办?
1.寻找并关闭电源
2.寻找绝缘体(木棒)
一根木头引发的思考
01
电解质和非电解质
课堂探究
一、电解质和非电解质
探究学习
一根木头引发的思考!
几乎不导电!
干木头导电么?
蒸馏水导电么?
不导电!
严格来说,蒸馏水也能导电,
只是导电能力非常弱,
可以用灵敏电流计观测
NaCl溶液能否导电?
课堂探究
一、电解质和非电解质
探究学习
NaCl溶液能否导电?
任务1:设计实验探究NaCl溶液能否导电
实验现象:
灯泡发光
实验结论:
NaCl溶液能导电
请你猜想!
NaCl溶液能导电的原因?
课堂思考
NaCl溶液为什么能导电?
假设1:NaCl固体能导电;
假设2:蒸馏水能导电;
假设3:NaCl与水共同作用能导电。
灯泡亮了
关闭电键
NaCl溶液
实验验证假设
课堂探究
一、电解质和非电解质
探究学习
NaCl溶液为什么能导电?
任务2:实验探究NaCl溶液能导电的原因
课堂探究
一、电解质和非电解质
探究学习
任务2:探究NaCl溶液能导电的原因
NaCl溶液为什么能导电?
实验结果:
干燥的氯化钠固体,KNO3固体和蒸馏水均不导电,而氯化钠溶液和KNO3溶液却能够导电。
NaCl固体,KNO3固溶于水导电,其他条件下是否可以导电?
课堂探究
一、电解质和非电解质
熔融状态NaCl能否导电?
任务3:探究熔融状态下NaCl的导电性
探究学习
实验现象:
灯泡发光
实验结论:
熔融NaCl能导电
课堂探究
一、电解质和非电解质
熔融状态硝酸钾能否导电?
任务3:探究熔融状态下硝酸钾的导电性
探究学习
实验现象:
灯泡发光
实验结论:
熔融硝酸钾导电
课堂思考
请你思考!
下列物质哪些能导电,在什么条件下可以导电?
盐酸溶液、Cu、熔融NaOH、MgCl2、NaOH固体、H2SO4 、Fe2(SO4)3、KNO3、硫酸钡、蔗糖、酒精。
能导电
盐酸溶液、Cu、熔融NaOH
一定条件(溶于水或熔融状态)才能导电
MgCl2、NaOH固体、H2SO4 、Fe2(SO4)3、KNO3、硫酸钡
蔗糖、酒精
一定条件(溶于水或熔融状态)也不能导电
物质的导电性
课堂探究
一、电解质和非电解质
1.在水溶液或熔融状态下,能导电的化合物称之为电解质
2.在水溶液和熔融状态下,不能导电的化合物称之为非电解质
酸:H2SO4、HCl
碱:NaOH、Ca(OH)2
盐:NaCl、KNO3
……
活泼金属氧化物等
H2O
大部分有机物:蔗糖、酒精
非金属氧化物(CO2、SO2等)、NH3等
CO2、SO2、SO3、NH3溶于水可以导电,为什么不是电解质?
它们的水溶液虽然可以导电,但导电的原因实际上是它们和水反应后的物质引起的
H2CO3、H2SO3、H2SO4、NH3 H2O这些酸、碱才是电解质!
课堂探究
一、电解质和非电解质
3.物质分类的另一种方式:
物质
纯净物
混合物
单质
化合物
酸
碱
盐
氧化物
溶液
胶体
浊液
物质
纯净物
混合物
单质
化合物
溶液
胶体
浊液
电解质
非电解质
?
既不是电解质,
也不是非电解质。
按物质的导电性分类
一、电解质和非电解质
课堂探究
4.电解质和非电解质的判断方法
判断物质是否属于电解质:
一看:是不是化合物;
二看:是不是导电;(熔融或水溶液中)
三看:是不是自身电离。
(1)电解质和非电解质都是化合物,单质和混合物既不是电解质,也不是非电解质;
(2)电解质在“水溶液”里或“熔融状态”下能导电,二者具备其一即可;
(3)非电解质在“水溶液”里和“熔融状态”下不能导电,二者需同时满足。
典例精讲
【例1】思考与交流,回答下列问题
(1)金属Cu、稀盐酸都能导电,请问金属Cu、稀盐酸属于电解质吗?
(2)判断盐酸、硫酸、稀硝酸、烧碱溶液是否为电解质或非电解质?
(3)CO2、NH3的水溶液能导电,那么CO2、NH3属于电解质吗?
(4)“一个物质如果不是电解质,就是非电解质”这种说法是否正确?
都不属于,因为金属Cu是单质,稀盐酸是混合物,两者都不是化合物。
盐酸、稀硝酸、烧碱溶液为混合物,既不是电解质,也不是非电解质;硫酸为电解质。
都不属于,因为电解质必须是自身能电离成自由移动离子的化合物。
错误,如单质和混合物既不是电解质也不是非电解质。
一、电解质和非电解质
课堂探究
5.电解质和非电解质的易错提醒
注意!
电解质一定可以导电吗?
电解质与导电性之间没有必然关系:
(1)电解质不一定都能导电:如NaCl固体、HCl气体;
(2)能导电的物质不一定是电解质:如石墨、金属单质、溶液。
电解质与溶解性是否有关?
电解质与溶解性无关
(3)AgCl、BaSO4等难溶盐在水中的溶解度极小,不能导电,但这些物质在熔融状态下能导电,在水中溶解的部分也能完全电离,故属于电解质。
随堂演练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)CO2、NH3溶于水能导电,所以CO2、 NH3是电解质。( )
(2)盐酸能导电,所以盐酸是电解质。 ( )
(3)氯化钠溶液能导电,所以氯化钠溶液是电解质。 ( )
(4)Fe、Cu能够导电,说明它们都是解质。( )
(5)液态氯化氢不导电,但HCl是电解质。( )
(6)氯化钠固体不能导电,所以氯化钠不是电解质。( )
(7)硫黄(S)不能导电,所以硫黄是非电解质。 ( )
(8)CaCO3投入水中几乎不能导电,所以CaCO3是非电解质。 ( )
(9)蔗糖溶液不导电,所以蔗糖溶液是非电解质。( )
×
×
×
×
√
×
×
×
×
课堂思考
请你思考!
为什么NaCl、KNO3等电解质,在干燥时不导电,而溶于水或熔化后却能导电?
02
电解质的电离
二、电解质的电离
课堂探究
探究学习
任务4:NaCl固体不导电的原因探究
NaCl固体为什么不导电?
无自由移动离子
NaCl、KNO3固体不导电
资料:①电流是由带电粒子定向移动形成的。
②影响导电能力的最主要因素为自由移动离子的浓度大小。
课堂探究
二、电解质的电离
NaCl溶液为什么能导电?
探究学习
任务5:微观辨析NaCl溶液导电的原因
电解质导电的原因:产生了可以自由移动的离子
课堂探究
探究学习
二、电解质的电离
插入电极时,带正电荷的Na+向电源负极移动,带负电荷的Cl-向电源正极移动,氯化钠溶液导电。
课堂探究
二、电解质的电离
熔融NaCl为什么能导电?
电解质导电的原因:产生了可以自由移动的离子
任务6:微观辨析熔融NaCl能导电的原因
探究学习
课堂探究
二、电解质的电离
注意
新概念
探究学习
1.电解质溶于水或受热熔化时,形成自由移动的离子的过程叫做电离。
【结论】因此,NaCl固体溶于水或熔融状态能导电的原因是因为在水溶液或熔融状态下均能产生了自由移动的钠离子和氯离子。
课堂探究
二、电解质的电离
为什么蔗糖溶液不导电?
蔗糖分子溶于水时,不能电离
任务7:微观辨析蔗糖溶液、酒精不导电的原因
探究学习
课堂探究
二、电解质的电离
注意
新概念
探究学习
2.理解电解质电离的注意事项
电离的条件是什么?
电离需不需要通电?
电离的结果是什么?
水溶液或熔融状态
电离不需要通电
产生能自由移动的离子
典例精讲
【例 2】判断下列物质在相应条件下能否电离,并说明理由。
①液态HCl:_______,________________________________________________。
②熔融的NaCl:_____,_______________________________。
③熔融的单质铁________,____________。
④固体KOH:________,______________________________。
不能
HCl是酸,液态时不电离,只在水溶液中电离
能
能电离出Na+和Cl-
不能
Fe是单质
不能
电解质在固态时不电离
课堂思考
请你思考!
电解质的电离如何表示?
电解质的电离可以用电离方程式表示(为简便起见,一般仍用离子符号表示水合离子)
如:NaCl = Na+ + Cl-
03
电离方程式的书写
课堂探究
三、电离方程式的书写
注意
新概念
探究学习
1.电离方程式是用化学式和离子符号表示电解质电离过程的式子.
如:NaCl = Na+ + Cl-
化学式
等号
离子符号(代表水合离子)
注意二守恒
质量守恒
电离前后原子或离子个数相等
电荷守恒
右边阴、阳离子所带电荷总数相等
典例精讲
三、电离方程式的书写
注意
练习
HCl、H2SO4、HNO3
【例 3】:写出下列物质的电离方程式
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3-
2.从电离的角度认识酸:电离时生成的阳离子全部是 H+ 的化合物。
思考与讨论
(1)请写出NaOH、Ca(OH)2、Ba(OH)2的电离方程式。
(2)请结合以上电离方程式,并参考酸的本质,尝试从电离的角度概括出碱的本质。
课本P17
课堂探究
三、电离方程式的书写
注意
练习
3.从电离的角度认识碱:电离时生成的阴离子全部是 OH- 的化合物。
NaOH = Na+ + OH -
Ba(OH)2= Ba2+ + 2OH -
Ca(OH)2= Ca2+ + 2OH -
4.从电离的角度认识碱盐:电离时能生成金属阳离子(或NH4+)和酸根离子的化合物
KCl = K+ + Cl-
Na2CO3 = 2Na+ + CO32-
CuSO4 = Cu2+ + SO4 2-
典例精讲
【例4】已知,水溶液中,强酸的酸式根能完全解离,而弱酸的酸式根不能完全解离。书写以下物质的电离方程式。
NaHCO3 NaHSO4
NaHSO4 = Na+ +H+ + SO42-
NaHCO3 = Na+ +HCO3-
思考:NaHSO4溶于水时能电离出H+,NaHSO4属于酸吗?
不是。电离时生成的阳离子不全部是氢离子(H+)、还有Na+。
课堂小结
化合物
非电解质
电解质
水溶液里或熔融状态下能导电
电解质导电原因
电解质种类
电解质电离方程式书写
从电离的角度认识酸碱盐
多数有机物、
非金属氧化物(CO2、SO2等)、
NH3等
随堂演练
2.下列说法中不正确的是( )
①将硫酸钡放入水中不能导电,硫酸钡是非电解质;
②氨溶于水得到氨水溶液能导电,氨水是电解质;
③固态氯化氢不导电,液态氯化氢可以导电;
④硫酸氢钠电离出的阳离子有H+,硫酸氢钠是酸;
⑤电解质放在水中一定能导电,非电解质放在水中一定不导电。
A.仅①④ B.仅①④⑤
C.仅②③ D.①②③④⑤
D
随堂演练
3.以下10种为中学化学常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4
⑥酒精 ⑦BaSO4 ⑧Cu(OH)2 ⑨Fe(OH)3 ⑩NH3·H2O
(1) 属于电解质的是______________________。
(2) 属于非电解质的是 ______________________。
(3) 属于酸的是______________________。
(4) 属于碱的是______________________。
(5) 属于盐的是______________________。
②③⑤⑦⑧⑨⑩
④⑥
⑤
⑧⑨⑩
②③⑦
随堂演练
4.下列电离方程式正确的是( )
A.NaOH 电离方程式:NaOH=Na++H++O2-
B.硫酸铝的电离方程式:Al2(SO4)3=Al23++(SO4)32-
C.NaCl 的电离方程式:NaCl = Na++Cl-
D.硫酸电离方程式:H2SO4=2H++SO42-
D
