福建省宁德市2023-2024学年高一下学期期末质量检测化学试题(无答案)
文档属性
| 名称 | 福建省宁德市2023-2024学年高一下学期期末质量检测化学试题(无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 514.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-05 18:53:24 | ||
图片预览


文档简介
宁德市2023-2024学年高一下学期期末质量检测
化学试题
(考试时间:75分钟 试卷总分:100分)
注意:
1.本学科试卷分试题卷和答题卡两部分。试题卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)(共6页14题),全部答案必须按要求填在答题卡的相应答题栏内,否则不能得分。
2.相对原子质量:H1 N14 O16 Na23 S32 Fe56 I127
第Ⅰ卷 选择题(共40分)
本题包括10小题,每小题4分,共40分。每小题只有一个选项符合题意。
1.化学与生产、生活、科技密切相关。下列说法不正确的是
A.曾侯乙青铜编钟主要由合金材料制成
B.石油的分馏、煤的液化均属于物理变化
C.“福建舰”航母使用的航空煤油和柴油的主要成分都是烃
D.华为4nm芯片即将上市,高纯硅是生产芯片的原料之一
2.下列说法正确的是
A.CH4的空间结构为平面正方形
B.Cl-的结构示意图:
C.三氯甲烷的球棍模型:
D.HCl的形成过程:
3.设NA为阿伏加德罗常数的值。硫代硫酸钠(Na2S2O3)在酸性环境中易发生歧化反应:Na2S2O3+H2SO4=SO2↑+S↓+Na2SO4+H2O。下列说法正确的是
A.32gS8分子中含有的质子数为2NA
B.常温下,2gH218O中所含中子数为NA
C.0.1mol/LNa2SO4溶液中,Na+的数目为0.2NA
D.2molSO2和1molO2在密闭容器中充分反应,生成SO3的分子数为2NA
4.化学物质与生命过程密切相关。下列说法不正确的是
A.果糖、蔗糖、麦芽糖都属于低聚糖
B.用灼烧的方法可以区分蚕丝和棉花
C.油脂不仅可食用,还可用于生产肥皂和油漆
D.淀粉、纤维素水解的最终产物均为葡萄糖
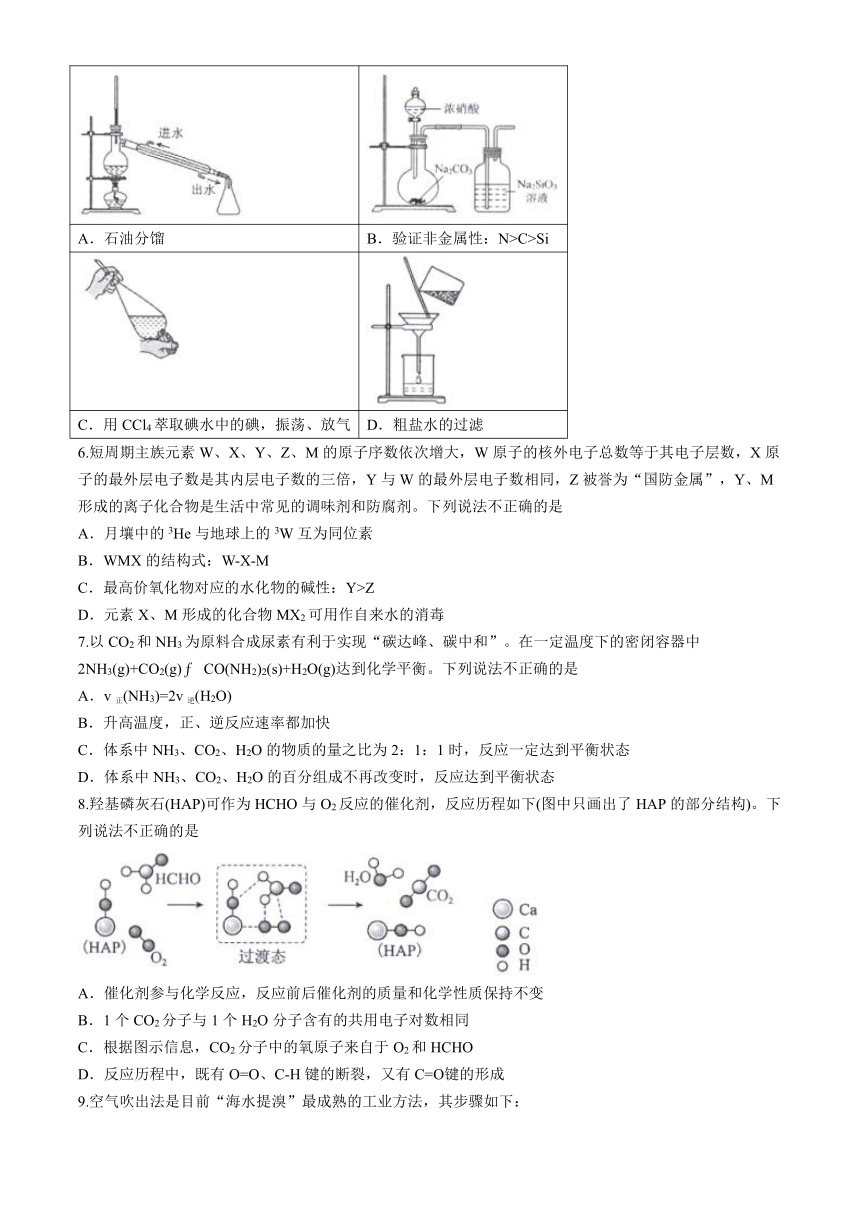
5.下列实验装置(部分夹持仪器未画出)能达到实验目的的是
A.石油分馏 B.验证非金属性:N>C>Si
C.用CCl4萃取碘水中的碘,振荡、放气 D.粗盐水的过滤
6.短周期主族元素W、X、Y、Z、M的原子序数依次增大,W原子的核外电子总数等于其电子层数,X原子的最外层电子数是其内层电子数的三倍,Y与W的最外层电子数相同,Z被誉为“国防金属”,Y、M形成的离子化合物是生活中常见的调味剂和防腐剂。下列说法不正确的是
A.月壤中的3He与地球上的3W互为同位素
B.WMX的结构式:W-X-M
C.最高价氧化物对应的水化物的碱性:Y>Z
D.元素X、M形成的化合物MX2可用作自来水的消毒
7.以CO2和NH3为原料合成尿素有利于实现“碳达峰、碳中和”。在一定温度下的密闭容器中2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)达到化学平衡。下列说法不正确的是
A.v正(NH3)=2v逆(H2O)
B.升高温度,正、逆反应速率都加快
C.体系中NH3、CO2、H2O的物质的量之比为2:1:1时,反应一定达到平衡状态
D.体系中NH3、CO2、H2O的百分组成不再改变时,反应达到平衡状态
8.羟基磷灰石(HAP)可作为HCHO与O2反应的催化剂,反应历程如下(图中只画出了HAP的部分结构)。下列说法不正确的是
A.催化剂参与化学反应,反应前后催化剂的质量和化学性质保持不变
B.1个CO2分子与1个H2O分子含有的共用电子对数相同
C.根据图示信息,CO2分子中的氧原子来自于O2和HCHO
D.反应历程中,既有O=O、C-H键的断裂,又有C=О键的形成
9.空气吹出法是目前“海水提溴”最成熟的工业方法,其步骤如下:
下列说法不正确的是
A.在海水提溴的过程中,步骤③、④的主要目的是实现溴的“富集”
B.根据上述流程可判断氧化性强弱顺序:Cl2>Br2>SO2
C.步骤②中用空气和水蒸气吹出Br2,利用了溴的挥发性
D.步骤③中用SO2水溶液吸收Br2的原理:Br2+SO2+2H2O=2H+++2HBr
10.某兴趣小组拟测定+3=Cl-+3+3H+的反应速率,用10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液进行实验,所得实验数据如图所示。下列说法不正确的是
A.增大KClO3溶液的浓度可以加快反应速率
B.0~4min反应速率v(Cl-)=0.0025mol/(L·min)
C.0~12min反应速率加快的原因可能是反应放热,温度升高,反应速率加快
D.由图中曲线可以预测后期的反应速率仍持续增大,但增大的幅度变小
第Ⅱ卷 非选择题(共60分)
本题包括4大题,共60分
11.(16分)
随着原子序数的递增,9种短周期元素原子半径的相对大小、最高正价或最低负价的递变关系如下图所示。回答下列问题:
(1)e在元素周期表中的位置是____,d、g、h三种元素对应的简单离子半径由大到小的顺序为_________(填离子符号)。
(2)f的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物反应的离子方程式为____________。
(3)d、f所形成的化合物f2d2中的化学键类型有________。
(4)己知h2i2分子中的各原子均满足最外层8电子稳定结构,h2i2电子式为________;下列叙述中不能说明非金属性i强于h的是____(填标号)。
①比较两种单质的熔点高低
②比较两种单质与H化合的难易程度
③比较两种简单气态氢化物的稳定性
④比较两种氧化物对应的水化物的酸性强弱
(5)已知a、b组成的化合物ba4常用作燃料电池的燃料气。该电池的构造示意图如图。
①M处通入的是________(填化学式)。
②该电池正极的电极反应式是____________。
12.(16分)
A~D是常见的有机物,H(乙酸苯甲酯)常用于配制香皂、日用化妆品的香精。A是石油裂解气的主要成分,其产量可用以衡量一个国家的石油化工发展水平,相关物质间的转化关系如下图。
回答下列问题:
(1)A的名称为_________;A在一定条件下可以聚合生成一种高分子化合物,该高分子化合物的结构简式为________。
(2)D中含有的官能团名称为________;E一F的反应类型为_______。
(3)B→C的化学方程式为_______________。
(4)实验室用如图所示装置制备H(乙酸苯甲酯)。
①D和G生成H的化学方程式为______________。
②饱和Na2CO3溶液的作用是溶解挥发出来的苯甲醇和_______、________。
(5)下列有关说法不正确的是___(填标号)。
①石油裂解气中除含有A外,还含有丙烯(CH2=CHCH3),两者互为同系物
②有机物A能使酸性高锰酸钾溶液褪色
③有机物B能用作提取溴水中Br2的萃取剂
④有机物D与甲酸甲酯(HCOOCH3)互为同分异构体
13.(14分)
硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要的铁盐,用铁矿石(主要成分为Fe2O3,还含有少量的FeO、Al2O3、SiO2、有机杂质)制备硫酸铁铵的流程如下。
回答下列问题:
(1)灼烧的主要目的是_______。
(2)为了提高“酸浸”反应速率,可采取的措施有________(写出1点即可)。
(3)设计实验验证“酸浸”后的浸出液中含有Fe2+_________(写出必要的试剂、操作过程及实验现象)。
(4)滤渣X的主要成分的用途有________(写出1种即可)。
(5)浸出液中加入H2O2溶液发生反应的离子方程式为_______________。
(6)“操作I”包括_______、过滤、洗涤、干燥。
(7)采用热重分析法测定硫酸铁铵晶体样品中所含结晶水数目,将样品加热到260℃时,失掉3个结晶水,失重11.18%。硫酸铁铵晶体的化学式为____(x值取整数)。
14.(14分)
2024年4月25日,搭载神舟十八号载人飞船的长征二号F运载火箭发射成功,该火箭用N2O4和偏二甲肼[(CH3)2NNH2]作推进剂。氯胺(NH2Cl)是制备偏二甲肼的原料之一,可由NaClO溶液和氨水反应制得。
Ⅰ.次氯酸钠的制备
按如图所示装置进行实验(夹持装置省略):
(1)按气流从左至右,导管口连接顺序为(填小写字母):f→_____,_____→_____,_____→_____。
(2)装置D中发生反应的离子方程式为____________。
(3)装置B的作用是__________。
Ⅱ.氯胺的制备
在三颈烧瓶中加入375mL浓度为2mol/L氨水,搅拌冷却至5℃以下,再加入500mL浓度为0.5mol/LNaClO溶液,反应生成氯胺(NH2Cl)和NaOH。制备装置如图(夹持装置省略):
(4)仪器E的名称是________。
(5)制取氯胺的化学方程式为_______________。
Ⅲ.氯胺的浓度测定
(6)实验后,量取20.00mLG中的溶液,加入过量KI溶液(反应原理:NH2Cl+3I-+2H2O=NH3·H2O+OH-+Cl-+,=I2+I-),充分反应后,再加入0.2000mol/LNa2S2O3溶液(反应原理:I2+2=2I-+),消耗Na2S2O3溶液20.00mL。则该溶液中氯胺的物质的量浓度为_________。
Ⅳ.推进剂的燃烧
(7)火箭发射过程中发生:(CH3)2NNH2+2N2O4=2CO2↑+3N2↑+4H2O(偏二甲肼中C、N元素的化合价相同)。下列有关叙述正确的是______(填标号)。
①(CH3)2NNH2仅作还原剂
②常温下密闭容器中存在:N2O4(g)(无色)2NO2(g)(红色),温度升高时混合物颜色加深
③(CH3)2NNH2中只含有极性共价键
④1mol液态(CH3)2NNH2燃烧,理论上可以放出2550kJ的热量;当有4mol电子转移时,理论上可以放出1275kJ的热量
化学试题
(考试时间:75分钟 试卷总分:100分)
注意:
1.本学科试卷分试题卷和答题卡两部分。试题卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)(共6页14题),全部答案必须按要求填在答题卡的相应答题栏内,否则不能得分。
2.相对原子质量:H1 N14 O16 Na23 S32 Fe56 I127
第Ⅰ卷 选择题(共40分)
本题包括10小题,每小题4分,共40分。每小题只有一个选项符合题意。
1.化学与生产、生活、科技密切相关。下列说法不正确的是
A.曾侯乙青铜编钟主要由合金材料制成
B.石油的分馏、煤的液化均属于物理变化
C.“福建舰”航母使用的航空煤油和柴油的主要成分都是烃
D.华为4nm芯片即将上市,高纯硅是生产芯片的原料之一
2.下列说法正确的是
A.CH4的空间结构为平面正方形
B.Cl-的结构示意图:
C.三氯甲烷的球棍模型:
D.HCl的形成过程:
3.设NA为阿伏加德罗常数的值。硫代硫酸钠(Na2S2O3)在酸性环境中易发生歧化反应:Na2S2O3+H2SO4=SO2↑+S↓+Na2SO4+H2O。下列说法正确的是
A.32gS8分子中含有的质子数为2NA
B.常温下,2gH218O中所含中子数为NA
C.0.1mol/LNa2SO4溶液中,Na+的数目为0.2NA
D.2molSO2和1molO2在密闭容器中充分反应,生成SO3的分子数为2NA
4.化学物质与生命过程密切相关。下列说法不正确的是
A.果糖、蔗糖、麦芽糖都属于低聚糖
B.用灼烧的方法可以区分蚕丝和棉花
C.油脂不仅可食用,还可用于生产肥皂和油漆
D.淀粉、纤维素水解的最终产物均为葡萄糖
5.下列实验装置(部分夹持仪器未画出)能达到实验目的的是
A.石油分馏 B.验证非金属性:N>C>Si
C.用CCl4萃取碘水中的碘,振荡、放气 D.粗盐水的过滤
6.短周期主族元素W、X、Y、Z、M的原子序数依次增大,W原子的核外电子总数等于其电子层数,X原子的最外层电子数是其内层电子数的三倍,Y与W的最外层电子数相同,Z被誉为“国防金属”,Y、M形成的离子化合物是生活中常见的调味剂和防腐剂。下列说法不正确的是
A.月壤中的3He与地球上的3W互为同位素
B.WMX的结构式:W-X-M
C.最高价氧化物对应的水化物的碱性:Y>Z
D.元素X、M形成的化合物MX2可用作自来水的消毒
7.以CO2和NH3为原料合成尿素有利于实现“碳达峰、碳中和”。在一定温度下的密闭容器中2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)达到化学平衡。下列说法不正确的是
A.v正(NH3)=2v逆(H2O)
B.升高温度,正、逆反应速率都加快
C.体系中NH3、CO2、H2O的物质的量之比为2:1:1时,反应一定达到平衡状态
D.体系中NH3、CO2、H2O的百分组成不再改变时,反应达到平衡状态
8.羟基磷灰石(HAP)可作为HCHO与O2反应的催化剂,反应历程如下(图中只画出了HAP的部分结构)。下列说法不正确的是
A.催化剂参与化学反应,反应前后催化剂的质量和化学性质保持不变
B.1个CO2分子与1个H2O分子含有的共用电子对数相同
C.根据图示信息,CO2分子中的氧原子来自于O2和HCHO
D.反应历程中,既有O=O、C-H键的断裂,又有C=О键的形成
9.空气吹出法是目前“海水提溴”最成熟的工业方法,其步骤如下:
下列说法不正确的是
A.在海水提溴的过程中,步骤③、④的主要目的是实现溴的“富集”
B.根据上述流程可判断氧化性强弱顺序:Cl2>Br2>SO2
C.步骤②中用空气和水蒸气吹出Br2,利用了溴的挥发性
D.步骤③中用SO2水溶液吸收Br2的原理:Br2+SO2+2H2O=2H+++2HBr
10.某兴趣小组拟测定+3=Cl-+3+3H+的反应速率,用10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液进行实验,所得实验数据如图所示。下列说法不正确的是
A.增大KClO3溶液的浓度可以加快反应速率
B.0~4min反应速率v(Cl-)=0.0025mol/(L·min)
C.0~12min反应速率加快的原因可能是反应放热,温度升高,反应速率加快
D.由图中曲线可以预测后期的反应速率仍持续增大,但增大的幅度变小
第Ⅱ卷 非选择题(共60分)
本题包括4大题,共60分
11.(16分)
随着原子序数的递增,9种短周期元素原子半径的相对大小、最高正价或最低负价的递变关系如下图所示。回答下列问题:
(1)e在元素周期表中的位置是____,d、g、h三种元素对应的简单离子半径由大到小的顺序为_________(填离子符号)。
(2)f的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物反应的离子方程式为____________。
(3)d、f所形成的化合物f2d2中的化学键类型有________。
(4)己知h2i2分子中的各原子均满足最外层8电子稳定结构,h2i2电子式为________;下列叙述中不能说明非金属性i强于h的是____(填标号)。
①比较两种单质的熔点高低
②比较两种单质与H化合的难易程度
③比较两种简单气态氢化物的稳定性
④比较两种氧化物对应的水化物的酸性强弱
(5)已知a、b组成的化合物ba4常用作燃料电池的燃料气。该电池的构造示意图如图。
①M处通入的是________(填化学式)。
②该电池正极的电极反应式是____________。
12.(16分)
A~D是常见的有机物,H(乙酸苯甲酯)常用于配制香皂、日用化妆品的香精。A是石油裂解气的主要成分,其产量可用以衡量一个国家的石油化工发展水平,相关物质间的转化关系如下图。
回答下列问题:
(1)A的名称为_________;A在一定条件下可以聚合生成一种高分子化合物,该高分子化合物的结构简式为________。
(2)D中含有的官能团名称为________;E一F的反应类型为_______。
(3)B→C的化学方程式为_______________。
(4)实验室用如图所示装置制备H(乙酸苯甲酯)。
①D和G生成H的化学方程式为______________。
②饱和Na2CO3溶液的作用是溶解挥发出来的苯甲醇和_______、________。
(5)下列有关说法不正确的是___(填标号)。
①石油裂解气中除含有A外,还含有丙烯(CH2=CHCH3),两者互为同系物
②有机物A能使酸性高锰酸钾溶液褪色
③有机物B能用作提取溴水中Br2的萃取剂
④有机物D与甲酸甲酯(HCOOCH3)互为同分异构体
13.(14分)
硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要的铁盐,用铁矿石(主要成分为Fe2O3,还含有少量的FeO、Al2O3、SiO2、有机杂质)制备硫酸铁铵的流程如下。
回答下列问题:
(1)灼烧的主要目的是_______。
(2)为了提高“酸浸”反应速率,可采取的措施有________(写出1点即可)。
(3)设计实验验证“酸浸”后的浸出液中含有Fe2+_________(写出必要的试剂、操作过程及实验现象)。
(4)滤渣X的主要成分的用途有________(写出1种即可)。
(5)浸出液中加入H2O2溶液发生反应的离子方程式为_______________。
(6)“操作I”包括_______、过滤、洗涤、干燥。
(7)采用热重分析法测定硫酸铁铵晶体样品中所含结晶水数目,将样品加热到260℃时,失掉3个结晶水,失重11.18%。硫酸铁铵晶体的化学式为____(x值取整数)。
14.(14分)
2024年4月25日,搭载神舟十八号载人飞船的长征二号F运载火箭发射成功,该火箭用N2O4和偏二甲肼[(CH3)2NNH2]作推进剂。氯胺(NH2Cl)是制备偏二甲肼的原料之一,可由NaClO溶液和氨水反应制得。
Ⅰ.次氯酸钠的制备
按如图所示装置进行实验(夹持装置省略):
(1)按气流从左至右,导管口连接顺序为(填小写字母):f→_____,_____→_____,_____→_____。
(2)装置D中发生反应的离子方程式为____________。
(3)装置B的作用是__________。
Ⅱ.氯胺的制备
在三颈烧瓶中加入375mL浓度为2mol/L氨水,搅拌冷却至5℃以下,再加入500mL浓度为0.5mol/LNaClO溶液,反应生成氯胺(NH2Cl)和NaOH。制备装置如图(夹持装置省略):
(4)仪器E的名称是________。
(5)制取氯胺的化学方程式为_______________。
Ⅲ.氯胺的浓度测定
(6)实验后,量取20.00mLG中的溶液,加入过量KI溶液(反应原理:NH2Cl+3I-+2H2O=NH3·H2O+OH-+Cl-+,=I2+I-),充分反应后,再加入0.2000mol/LNa2S2O3溶液(反应原理:I2+2=2I-+),消耗Na2S2O3溶液20.00mL。则该溶液中氯胺的物质的量浓度为_________。
Ⅳ.推进剂的燃烧
(7)火箭发射过程中发生:(CH3)2NNH2+2N2O4=2CO2↑+3N2↑+4H2O(偏二甲肼中C、N元素的化合价相同)。下列有关叙述正确的是______(填标号)。
①(CH3)2NNH2仅作还原剂
②常温下密闭容器中存在:N2O4(g)(无色)2NO2(g)(红色),温度升高时混合物颜色加深
③(CH3)2NNH2中只含有极性共价键
④1mol液态(CH3)2NNH2燃烧,理论上可以放出2550kJ的热量;当有4mol电子转移时,理论上可以放出1275kJ的热量
同课章节目录
