福建省厦门市2023-2024学年高一下学期期末质量检测化学试题(含答案)
文档属性
| 名称 | 福建省厦门市2023-2024学年高一下学期期末质量检测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 702.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-05 21:08:58 | ||
图片预览

文档简介
厦门市2023-2024学年第二学期高一期末质量检测
化学试题
说明:1.本试卷共6页。总分100分。考试时间75分钟。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在试卷上无效。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Fe-56 Zn-65
一、选择题:本题共10小题,每小题4分,共40分。每小题只有一个选项符合题目要求。
1.科学家首次合成奇数环碳,其结构如图所示。下列关于说法正确的是( )
A.属于环烃 B.与石墨互为同素异形体
C.与互为同位素 D.所有原子均满足8电子稳定结构
2.乙醇在人体内的代谢过程:乙醇乙醛乙酸二氧化碳+水。下列说法错误的是( )
A.乙醇的填充模型: B.乙酸的结构式:
C.二氧化碳的电子式: D.乙醛的结构简式:
《本草纲目》记载:“蚕蛹味咸辛、性平、无毒,人食可强身健身,入药可医多病”。亚麻酸乙酯可从蚕蛹油中提取,具有调节血脂的功效,其结构如图所示。回答3~4题。
3.下列说法错误的是( )
A.亚麻酸乙酯属于油脂 B.可用灼烧法鉴别蚕丝和棉花
C.蚕丝的主要成分为蛋白质 D.桑叶中的纤维素可水解为单糖
4.下列关于亚麻酸乙酯的说法错误的是( )
A.含有2种官能团 B.所有碳原子可共平面
C.与乙酸乙酯互为同系物 D.可使酸性高锰酸钾溶液褪色
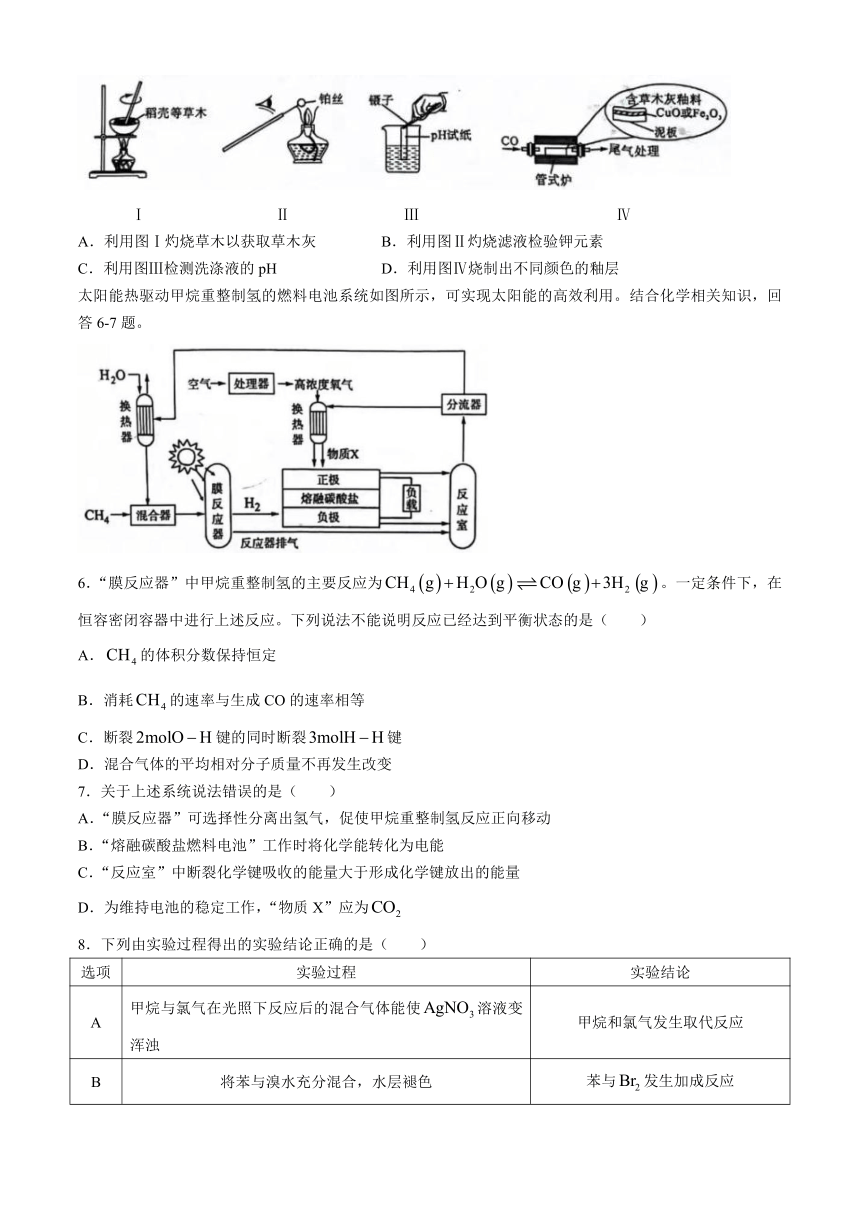
5.草木灰釉是陶器烧制过程中发现的最原始的釉,制备流程为“采集草木→烧灰→洗涤→配釉→烧釉”。实验模拟草木灰釉制备过程,下列实验或操作能达到实验目的的是
Ⅰ Ⅱ Ⅲ Ⅳ
A.利用图Ⅰ灼烧草木以获取草木灰 B.利用图Ⅱ灼烧滤液检验钾元素
C.利用图Ⅲ检测洗涤液的pH D.利用图Ⅳ烧制出不同颜色的釉层
太阳能热驱动甲烷重整制氢的燃料电池系统如图所示,可实现太阳能的高效利用。结合化学相关知识,回答6-7题。
6.“膜反应器”中甲烷重整制氢的主要反应为。一定条件下,在恒容密闭容器中进行上述反应。下列说法不能说明反应已经达到平衡状态的是( )
A.的体积分数保持恒定
B.消耗的速率与生成CO的速率相等
C.断裂键的同时断裂键
D.混合气体的平均相对分子质量不再发生改变
7.关于上述系统说法错误的是( )
A.“膜反应器”可选择性分离出氢气,促使甲烷重整制氢反应正向移动
B.“熔融碳酸盐燃料电池”工作时将化学能转化为电能
C.“反应室”中断裂化学键吸收的能量大于形成化学键放出的能量
D.为维持电池的稳定工作,“物质X”应为
8.下列由实验过程得出的实验结论正确的是( )
选项 实验过程 实验结论
A 甲烷与氯气在光照下反应后的混合气体能使溶液变浑浊 甲烷和氯气发生取代反应
B 将苯与溴水充分混合,水层褪色 苯与发生加成反应
C 向浓盐酸中滴加溶液,将产生的气体直接通入溶液中,生成白色胶状沉淀 酸性:
D 向鸡蛋清溶液中加入醋酸铅溶液,溶液凝固且加水后无法溶解 醋酸铅能使蛋白质变性
9.锌-溴可充电电池装置如图所示。下列说法错误的是( )
A.放电时,电子从电极经导线流向电极
B.b电极上发生的电极反应为
C.放电时,每消耗锌,理论上转移电子
D.b电极上的活性炭层可吸附,提高电池的循环寿命
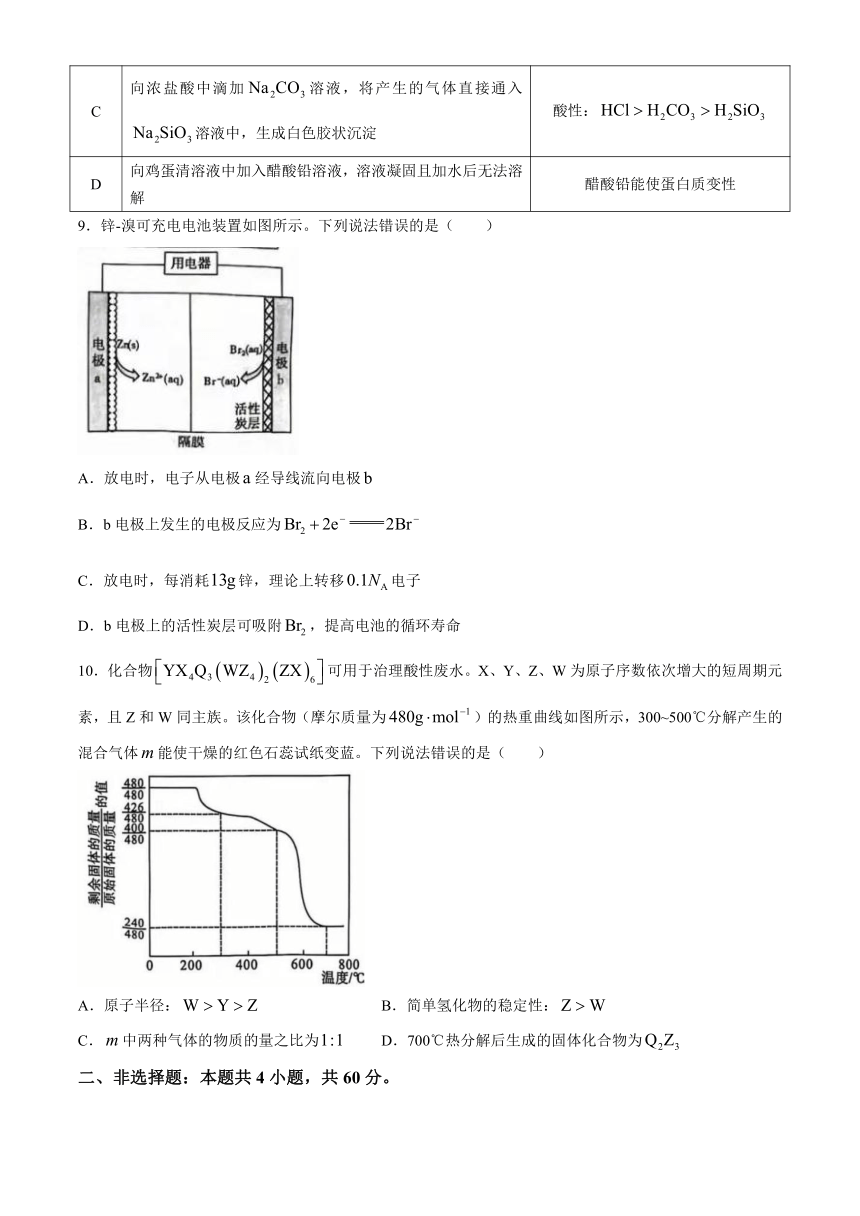
10.化合物可用于治理酸性废水。X、Y、Z、W为原子序数依次增大的短周期元素,且Z和W同主族。该化合物(摩尔质量为)的热重曲线如图所示,300~500℃分解产生的混合气体能使干燥的红色石蕊试纸变蓝。下列说法错误的是( )
A.原子半径: B.简单氢化物的稳定性:
C.中两种气体的物质的量之比为 D.700℃热分解后生成的固体化合物为
二、非选择题:本题共4小题,共60分。
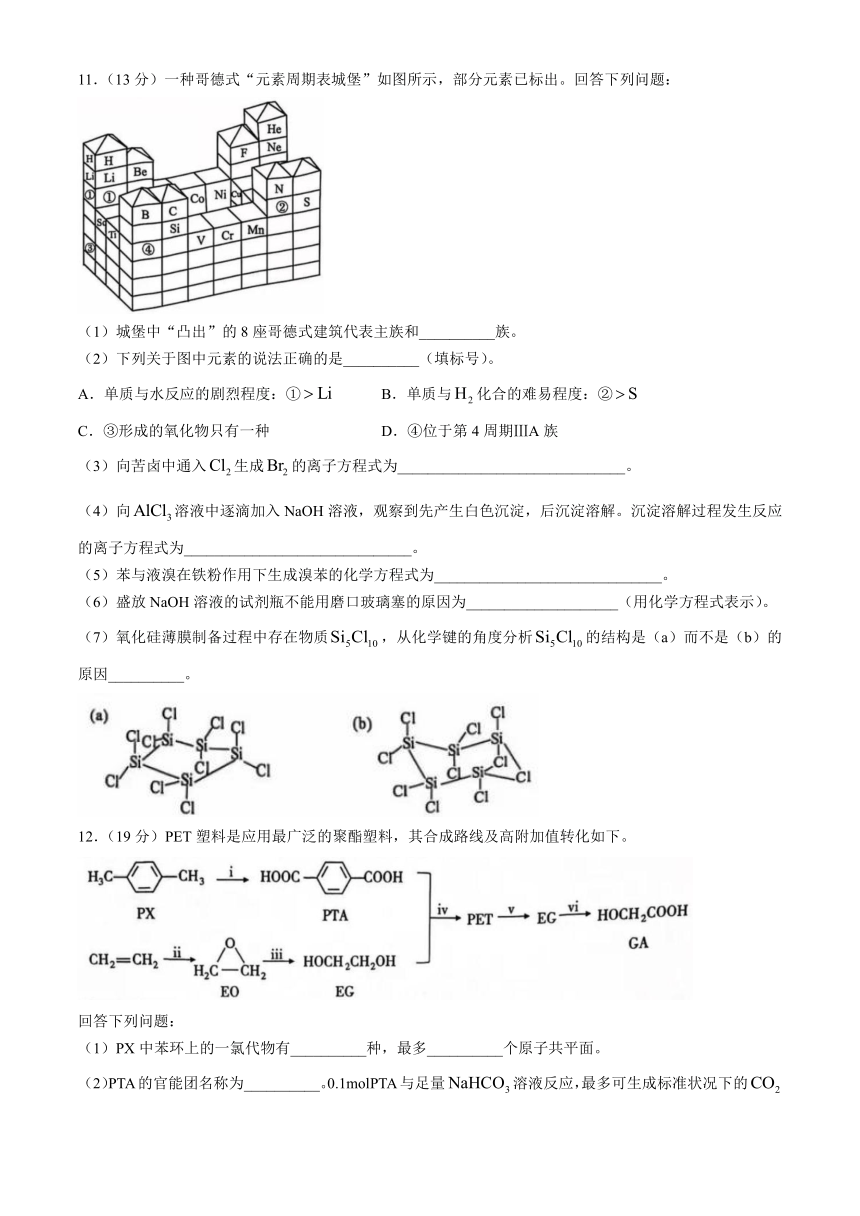
11.(13分)一种哥德式“元素周期表城堡”如图所示,部分元素已标出。回答下列问题:
(1)城堡中“凸出”的8座哥德式建筑代表主族和__________族。
(2)下列关于图中元素的说法正确的是__________(填标号)。
A.单质与水反应的剧烈程度:① B.单质与化合的难易程度:②
C.③形成的氧化物只有一种 D.④位于第4周期ⅢA族
(3)向苦卤中通入生成的离子方程式为______________________________。
(4)向溶液中逐滴加入NaOH溶液,观察到先产生白色沉淀,后沉淀溶解。沉淀溶解过程发生反应的离子方程式为______________________________。
(5)苯与液溴在铁粉作用下生成溴苯的化学方程式为______________________________。
(6)盛放NaOH溶液的试剂瓶不能用磨口玻璃塞的原因为____________________(用化学方程式表示)。
(7)氧化硅薄膜制备过程中存在物质,从化学键的角度分析的结构是(a)而不是(b)的原因__________。
12.(19分)PET塑料是应用最广泛的聚酯塑料,其合成路线及高附加值转化如下。
回答下列问题:
(1)PX中苯环上的一氯代物有__________种,最多__________个原子共平面。
(2)PTA的官能团名称为__________。0.1molPTA与足量溶液反应,最多可生成标准状况下的体积为__________L。
(3)可用溴水除去EO中混有的,生成二溴乙烷的化学方程式为____________________,反应类型为__________。
(4)将反应ⅳ补充完整:
__________
(5)下列说法正确的是__________(填标号)。
A.PX和互为同分异构体 B.1molEG与足量钠反应最多产生
C.PET为天然有机高分子材料 D.将PET水解可实现资源的循环利用
(6)反应ⅱ中的能量变化如图所示。
①图中的反应__________(填“吸收”或“放出”)能量为__________。
②向2L密闭容器中通入和,时测得含量为1.4mol,则内__________。
(7)利用如图所示装置实现反应ⅵ并产生电能。
①正极的电极反应式为______________________________。
②的移动方向为__________(填“”或“”)。
13.(15分)实验室利用草酸自催化制备草酸二丁酯,实验原理及实验过程如下。
实验原理:
实验过程:
回答下列问题:
(1)取用草酸(约为)和正丁醇(约为)的过程中,不需要用的仪器为__________(填名称)。
(2)步骤Ⅰ中沸石也可用碎瓷片替代,其作用为____________________。
(3)步骤Ⅱ中反应温度应控制在115 125℃,理由是______________________________。
(4)步骤Ⅳ反应结束的标志为__________,饱和溶液__________替换为NaOH溶液(填“能”或“不能”)。
(5)已知:正丁醇微溶于水。步骤Ⅴ是为了除去__________杂质。
(6)步骤Ⅵ获取上层液体的过程:打开分液漏斗瓶塞或__________(填实验操作),旋转玻璃旋塞缓缓放出下层液体;从__________口得到上层液体(填“上”或“下”)。
(7)若酯化过程使用浓硫酸作催化剂,分析其优缺点______________________________。
(8)最终获得草酸二丁酯3.03g,计算实验产率__________。
14.(13分)从锌浸渣(含、、、等)中回收锗()的工业流程如下。
已知:Ge(Ⅳ)的存在形式如图所示。
回答下列问题:
(1)“溶浸”过程中被还原的离子方程式为______________________________。
(2)“溶浸”过程中,Ge浸出率与体系温度的关系如图所示。温度高于100℃时,浸出率基本保持不变的原因是______________________________。
(3)“沉淀”后所得的滤液中主要阳离子有__________。
(4)“酸浸”过程发生反应的离子方程式为______________________________。
(5)“萃取Ge”和“反萃取”过程中,有机酸萃取剂HR发生反应:
。
①结合平衡移动原理,解释“反萃取”中NaOH的作用____________________。
②“反萃取”后有机层经“试剂m”处理后循环使用。试剂m可能为__________(填标号)。
A. B.氨水 C.双氧水 D.
③常用分配系数表示萃取达到平衡时溶质X在两溶剂中的浓度之比,萃取率表示有机相中溶质X的物质的量与初始总物质的量之比。
即分配系数、萃取率。
“萃取Ge”过程中,“一次性萃取”与“三级萃取”的实验过程如图所示。
“一次性萃取”的Ge萃取率为__________,“三级萃取”的总Ge萃取率为__________。由此得到结论,多级萃取的效果优于一次性萃取。
厦门市2023~2024学年第二学期高一期末质量检测
化学参考答案及评分标准
说明:化学方程式或离子方程式中,化学式写错的不给分;化学式对而未配平或重要条件错误扣1分,气体或沉淀符号未标扣1分,以上扣分不累计。
一、选择题(每题4分,共40分)
题号 1 2 3 4 5 6 7 8 9 10
答案 B D A C D B C D C C
二、填空题(本题包括4小题,共60分)
11.(13分)
(1)0(1分)
(2)AD(2分)
(3)(2分)
(4)(2分)
(5)(2分)
(6)(2分)
(7)Cl原子最外层有7个电子,若按图b形成2个键,将不满足8电子稳定结构(2分)
12.(19分)
(1)1(1分) 14(1分)
(2)羧基(1分) 4.48(2分)
(3)(2分) 加成反应(1分)
(4)(2分)
(5)AD(2分)
(6)①放出(1分) (1分)
②0.03(2分)
(7)(2分) (1分)
13.(15分)
(1)容量瓶(1分)
(2)防暴沸(1分)
(3)温度过低,反应速率过慢;温度过高,副反应增多(2分)
(4)不再产生气泡或测得溶液约为7(2分) 不能(1分)
(5)(可多写)(1分)
(6)瓶塞处的凹槽与瓶口处的小孔对准(2分) 上(1分)
(7)优点:浓硫酸具有吸水性,有利于酯化反应正向移动;
缺点:浓硫酸具有脱水性,易使有机物炭化,影响产品纯度(2分)
(8)30%(2分)
14.(13分)
(1)(2分)
(2)温度升高,反应速率加快;温度越高,溶解度减少,反应速率减慢;二者作用几乎抵消(2分)
(3)、、(2分)
(4)(2分)
写出得1分
(5)①与结合生成,降低,萃取平衡逆向移动,实现反萃取(2分)
②A(1分)
③81.8%(1分) 93.6%(1分)
化学试题
说明:1.本试卷共6页。总分100分。考试时间75分钟。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在试卷上无效。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Fe-56 Zn-65
一、选择题:本题共10小题,每小题4分,共40分。每小题只有一个选项符合题目要求。
1.科学家首次合成奇数环碳,其结构如图所示。下列关于说法正确的是( )
A.属于环烃 B.与石墨互为同素异形体
C.与互为同位素 D.所有原子均满足8电子稳定结构
2.乙醇在人体内的代谢过程:乙醇乙醛乙酸二氧化碳+水。下列说法错误的是( )
A.乙醇的填充模型: B.乙酸的结构式:
C.二氧化碳的电子式: D.乙醛的结构简式:
《本草纲目》记载:“蚕蛹味咸辛、性平、无毒,人食可强身健身,入药可医多病”。亚麻酸乙酯可从蚕蛹油中提取,具有调节血脂的功效,其结构如图所示。回答3~4题。
3.下列说法错误的是( )
A.亚麻酸乙酯属于油脂 B.可用灼烧法鉴别蚕丝和棉花
C.蚕丝的主要成分为蛋白质 D.桑叶中的纤维素可水解为单糖
4.下列关于亚麻酸乙酯的说法错误的是( )
A.含有2种官能团 B.所有碳原子可共平面
C.与乙酸乙酯互为同系物 D.可使酸性高锰酸钾溶液褪色
5.草木灰釉是陶器烧制过程中发现的最原始的釉,制备流程为“采集草木→烧灰→洗涤→配釉→烧釉”。实验模拟草木灰釉制备过程,下列实验或操作能达到实验目的的是
Ⅰ Ⅱ Ⅲ Ⅳ
A.利用图Ⅰ灼烧草木以获取草木灰 B.利用图Ⅱ灼烧滤液检验钾元素
C.利用图Ⅲ检测洗涤液的pH D.利用图Ⅳ烧制出不同颜色的釉层
太阳能热驱动甲烷重整制氢的燃料电池系统如图所示,可实现太阳能的高效利用。结合化学相关知识,回答6-7题。
6.“膜反应器”中甲烷重整制氢的主要反应为。一定条件下,在恒容密闭容器中进行上述反应。下列说法不能说明反应已经达到平衡状态的是( )
A.的体积分数保持恒定
B.消耗的速率与生成CO的速率相等
C.断裂键的同时断裂键
D.混合气体的平均相对分子质量不再发生改变
7.关于上述系统说法错误的是( )
A.“膜反应器”可选择性分离出氢气,促使甲烷重整制氢反应正向移动
B.“熔融碳酸盐燃料电池”工作时将化学能转化为电能
C.“反应室”中断裂化学键吸收的能量大于形成化学键放出的能量
D.为维持电池的稳定工作,“物质X”应为
8.下列由实验过程得出的实验结论正确的是( )
选项 实验过程 实验结论
A 甲烷与氯气在光照下反应后的混合气体能使溶液变浑浊 甲烷和氯气发生取代反应
B 将苯与溴水充分混合,水层褪色 苯与发生加成反应
C 向浓盐酸中滴加溶液,将产生的气体直接通入溶液中,生成白色胶状沉淀 酸性:
D 向鸡蛋清溶液中加入醋酸铅溶液,溶液凝固且加水后无法溶解 醋酸铅能使蛋白质变性
9.锌-溴可充电电池装置如图所示。下列说法错误的是( )
A.放电时,电子从电极经导线流向电极
B.b电极上发生的电极反应为
C.放电时,每消耗锌,理论上转移电子
D.b电极上的活性炭层可吸附,提高电池的循环寿命
10.化合物可用于治理酸性废水。X、Y、Z、W为原子序数依次增大的短周期元素,且Z和W同主族。该化合物(摩尔质量为)的热重曲线如图所示,300~500℃分解产生的混合气体能使干燥的红色石蕊试纸变蓝。下列说法错误的是( )
A.原子半径: B.简单氢化物的稳定性:
C.中两种气体的物质的量之比为 D.700℃热分解后生成的固体化合物为
二、非选择题:本题共4小题,共60分。
11.(13分)一种哥德式“元素周期表城堡”如图所示,部分元素已标出。回答下列问题:
(1)城堡中“凸出”的8座哥德式建筑代表主族和__________族。
(2)下列关于图中元素的说法正确的是__________(填标号)。
A.单质与水反应的剧烈程度:① B.单质与化合的难易程度:②
C.③形成的氧化物只有一种 D.④位于第4周期ⅢA族
(3)向苦卤中通入生成的离子方程式为______________________________。
(4)向溶液中逐滴加入NaOH溶液,观察到先产生白色沉淀,后沉淀溶解。沉淀溶解过程发生反应的离子方程式为______________________________。
(5)苯与液溴在铁粉作用下生成溴苯的化学方程式为______________________________。
(6)盛放NaOH溶液的试剂瓶不能用磨口玻璃塞的原因为____________________(用化学方程式表示)。
(7)氧化硅薄膜制备过程中存在物质,从化学键的角度分析的结构是(a)而不是(b)的原因__________。
12.(19分)PET塑料是应用最广泛的聚酯塑料,其合成路线及高附加值转化如下。
回答下列问题:
(1)PX中苯环上的一氯代物有__________种,最多__________个原子共平面。
(2)PTA的官能团名称为__________。0.1molPTA与足量溶液反应,最多可生成标准状况下的体积为__________L。
(3)可用溴水除去EO中混有的,生成二溴乙烷的化学方程式为____________________,反应类型为__________。
(4)将反应ⅳ补充完整:
__________
(5)下列说法正确的是__________(填标号)。
A.PX和互为同分异构体 B.1molEG与足量钠反应最多产生
C.PET为天然有机高分子材料 D.将PET水解可实现资源的循环利用
(6)反应ⅱ中的能量变化如图所示。
①图中的反应__________(填“吸收”或“放出”)能量为__________。
②向2L密闭容器中通入和,时测得含量为1.4mol,则内__________。
(7)利用如图所示装置实现反应ⅵ并产生电能。
①正极的电极反应式为______________________________。
②的移动方向为__________(填“”或“”)。
13.(15分)实验室利用草酸自催化制备草酸二丁酯,实验原理及实验过程如下。
实验原理:
实验过程:
回答下列问题:
(1)取用草酸(约为)和正丁醇(约为)的过程中,不需要用的仪器为__________(填名称)。
(2)步骤Ⅰ中沸石也可用碎瓷片替代,其作用为____________________。
(3)步骤Ⅱ中反应温度应控制在115 125℃,理由是______________________________。
(4)步骤Ⅳ反应结束的标志为__________,饱和溶液__________替换为NaOH溶液(填“能”或“不能”)。
(5)已知:正丁醇微溶于水。步骤Ⅴ是为了除去__________杂质。
(6)步骤Ⅵ获取上层液体的过程:打开分液漏斗瓶塞或__________(填实验操作),旋转玻璃旋塞缓缓放出下层液体;从__________口得到上层液体(填“上”或“下”)。
(7)若酯化过程使用浓硫酸作催化剂,分析其优缺点______________________________。
(8)最终获得草酸二丁酯3.03g,计算实验产率__________。
14.(13分)从锌浸渣(含、、、等)中回收锗()的工业流程如下。
已知:Ge(Ⅳ)的存在形式如图所示。
回答下列问题:
(1)“溶浸”过程中被还原的离子方程式为______________________________。
(2)“溶浸”过程中,Ge浸出率与体系温度的关系如图所示。温度高于100℃时,浸出率基本保持不变的原因是______________________________。
(3)“沉淀”后所得的滤液中主要阳离子有__________。
(4)“酸浸”过程发生反应的离子方程式为______________________________。
(5)“萃取Ge”和“反萃取”过程中,有机酸萃取剂HR发生反应:
。
①结合平衡移动原理,解释“反萃取”中NaOH的作用____________________。
②“反萃取”后有机层经“试剂m”处理后循环使用。试剂m可能为__________(填标号)。
A. B.氨水 C.双氧水 D.
③常用分配系数表示萃取达到平衡时溶质X在两溶剂中的浓度之比,萃取率表示有机相中溶质X的物质的量与初始总物质的量之比。
即分配系数、萃取率。
“萃取Ge”过程中,“一次性萃取”与“三级萃取”的实验过程如图所示。
“一次性萃取”的Ge萃取率为__________,“三级萃取”的总Ge萃取率为__________。由此得到结论,多级萃取的效果优于一次性萃取。
厦门市2023~2024学年第二学期高一期末质量检测
化学参考答案及评分标准
说明:化学方程式或离子方程式中,化学式写错的不给分;化学式对而未配平或重要条件错误扣1分,气体或沉淀符号未标扣1分,以上扣分不累计。
一、选择题(每题4分,共40分)
题号 1 2 3 4 5 6 7 8 9 10
答案 B D A C D B C D C C
二、填空题(本题包括4小题,共60分)
11.(13分)
(1)0(1分)
(2)AD(2分)
(3)(2分)
(4)(2分)
(5)(2分)
(6)(2分)
(7)Cl原子最外层有7个电子,若按图b形成2个键,将不满足8电子稳定结构(2分)
12.(19分)
(1)1(1分) 14(1分)
(2)羧基(1分) 4.48(2分)
(3)(2分) 加成反应(1分)
(4)(2分)
(5)AD(2分)
(6)①放出(1分) (1分)
②0.03(2分)
(7)(2分) (1分)
13.(15分)
(1)容量瓶(1分)
(2)防暴沸(1分)
(3)温度过低,反应速率过慢;温度过高,副反应增多(2分)
(4)不再产生气泡或测得溶液约为7(2分) 不能(1分)
(5)(可多写)(1分)
(6)瓶塞处的凹槽与瓶口处的小孔对准(2分) 上(1分)
(7)优点:浓硫酸具有吸水性,有利于酯化反应正向移动;
缺点:浓硫酸具有脱水性,易使有机物炭化,影响产品纯度(2分)
(8)30%(2分)
14.(13分)
(1)(2分)
(2)温度升高,反应速率加快;温度越高,溶解度减少,反应速率减慢;二者作用几乎抵消(2分)
(3)、、(2分)
(4)(2分)
写出得1分
(5)①与结合生成,降低,萃取平衡逆向移动,实现反萃取(2分)
②A(1分)
③81.8%(1分) 93.6%(1分)
同课章节目录
