湖北省部分省级示范高中2023-2024学年高一下学期期末测试化学试题(含答案)
文档属性
| 名称 | 湖北省部分省级示范高中2023-2024学年高一下学期期末测试化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 628.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-06 00:00:00 | ||
图片预览


文档简介
湖北省部分省级示范高中2023-2024学年高一下学期期末测试
化学试卷
考试时间:2024年7月1日
试卷满分:100分
★祝考试顺利★
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。写在试卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内。写在试卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试卷和答题卡一并上交。
可能用到的相对原子质量:H1 C12 O16
一、选择题(本题共15小题,每小题3分,共45分。每小题给出的四个选项中,只有一项符合题目要求。)
1.我国嫦娥六号已完成月背月壤采样,这将是人类获得的第一份月球背面月壤样品。下列有关说法正确的是( )
A.月壤中含有的3He与地球上的4He互为同素异形体
B.返回器外壁的高温结构陶瓷属于新型无机非金属材料
C.使用的太阳能电池和锂离子电池均是将化学能转化为电能的装置
D.动态展示的国旗由玄武岩纤维织成,该材料是一种新型高性能合成纤维。
2.课本习题也是重要的学习资源,下列说法正确的是( )
A.CaCO3可做抗酸药,一般要嚼碎后吞服
B.铁强化酱油可加乙二胺四乙酸铁钠作为增味剂
C.汽车尾气中含有CO、NO等多种污染物,其中NO来源于汽油的燃烧
D.日常生活中,铁制品表面刷油漆,向门窗合页注油均与化学反应速率有关
3.下列有关化学用语表示正确的是( )
A.羟基的电子式:
B.乙醇的结构式:
C.丙烷分子的空间填充模型
D.乙烯的结构简式CH2CH2
4.下列实验方法正确的是( )
A.除去乙醇中的水:加足量生石灰,过滤
B.鉴别乙醇、乙酸和乙酸乙酯:用NaOH溶液
C.鉴别苯和四氯化碳:分别加入溴水,静置、观察
D.除去乙烷中少量的乙烯:将混合气体通入KMnO4(H+)溶液中,洗气
5.设NA表示阿伏加德罗常数,下列说法正确的是( )
A.0.5mol的辛烷中含有的共价键数目为13NA
B.室温下的乙烯、丙烯、丁烯混合气体共14g,其原子总数为3NA
C.1molCH4与1molCl2在光照条件下充分反应,得到CH3Cl的分子数为NA
D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA
6.某化学兴趣小组为探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号 电极材料 电解质溶液 电流表指针偏转方向
① Mg、Al 稀盐酸 偏向Al
② Mg、Al NaOH溶液 偏向Mg
下列说法不正确的是( )
A.实验①中负极反应为:Mg-2e-=Mg2+
B.实验②中负极反应为:Al-3e-=Al3+
C.实验①中将Mg换成Fe,电流表指针偏向Fe
D.原电池中相对活泼的金属可能作正极
7.下列反应中前者属于取代反应,后者属于加成反应的是( )
A.在苯中滴入溴水,溴水褪色;乙烯使溴水褪色
B.乙醇在Cu作用下与O2的反应;乙烯使酸性高锰酸钾溶液褪色
C.乙烷在光照下与氯气的反应;由乙烯制乙醇
D.乙烯使溴的四氯化碳溶液褪色;苯与氢气在一定条件下反应生成环己烷
8.从海带中提取碘的过程如下图:
下列说法正确的是( )
A.步骤①需要的实验仪器是蒸发皿、酒精灯
B.步骤③的操作名称是冷却结晶
C.步骤④在含I-的溶液中加入稀硫酸和双氧水后,碘元素发生氧化反应
D.步骤⑤的操作为萃取分液,还可以用无水乙醇代替CCl4以节约成本
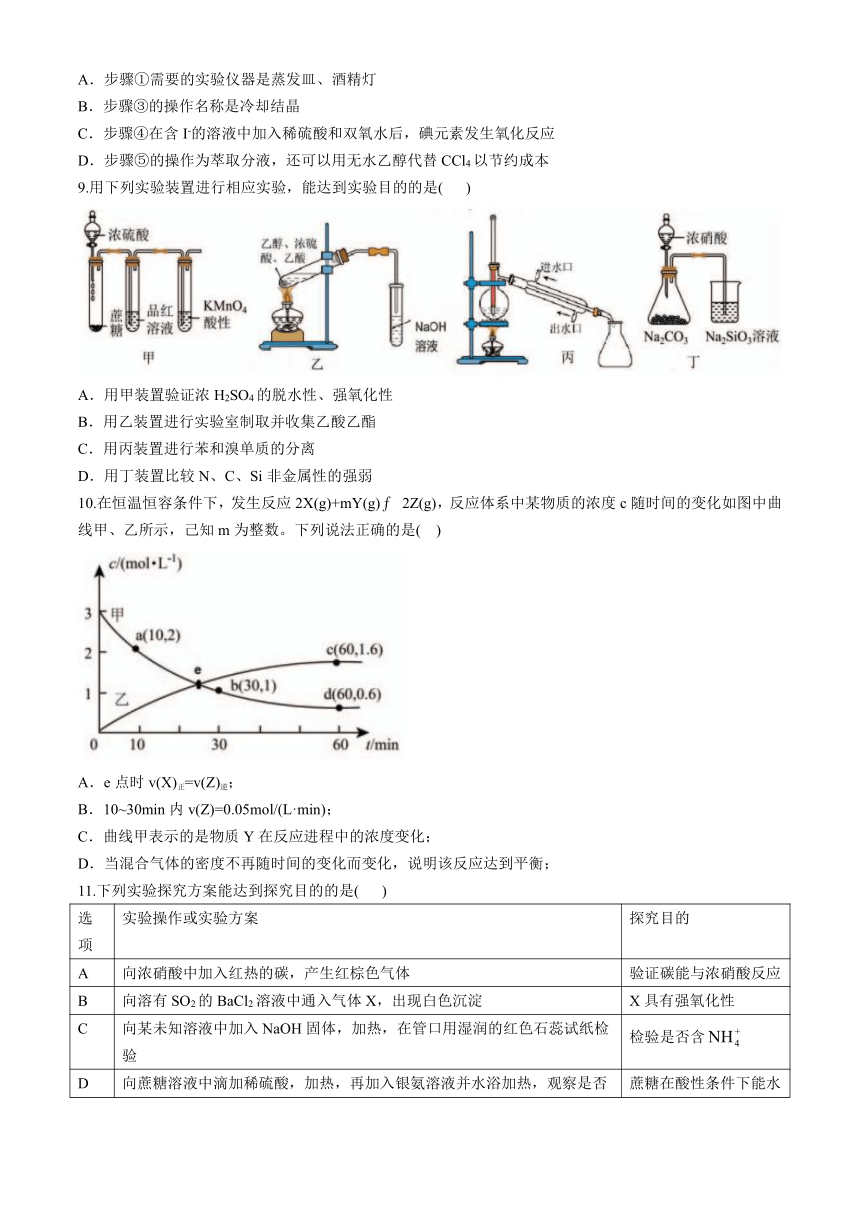
9.用下列实验装置进行相应实验,能达到实验目的的是( )
A.用甲装置验证浓H2SO4的脱水性、强氧化性
B.用乙装置进行实验室制取并收集乙酸乙酯
C.用丙装置进行苯和溴单质的分离
D.用丁装置比较N、C、Si非金属性的强弱
10.在恒温恒容条件下,发生反应2X(g)+mY(g)2Z(g),反应体系中某物质的浓度c随时间的变化如图中曲线甲、乙所示,己知m为整数。下列说法正确的是( )
A.e点时v(X)正=v(Z)逆;
B.10~30min内v(Z)=0.05mol/(L·min);
C.曲线甲表示的是物质Y在反应进程中的浓度变化;
D.当混合气体的密度不再随时间的变化而变化,说明该反应达到平衡;
11.下列实验探究方案能达到探究目的的是( )
选项 实验操作或实验方案 探究目的
A 向浓硝酸中加入红热的碳,产生红棕色气体 验证碳能与浓硝酸反应
B 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 X具有强氧化性
C 向某未知溶液中加入NaOH固体,加热,在管口用湿润的红色石蕊试纸检验 检验是否含
D 向蔗糖溶液中滴加稀硫酸,加热,再加入银氨溶液并水浴加热,观察是否出现银镜 蔗糖在酸性条件下能水解
12.对羟甲基肉桂酸(结构简式如下图)是一种重要的有机合成原料,下列说法不正确的是( )
A.该有机物使酸性KMnO4溶液褪色,证明其含有碳碳双键
B.该有机物可以发生取代反应、加成反应、氧化反应、加聚反应
C.该有机物含有三种官能团,能分别与乙醇、乙酸反应,且反应类型相同
D.1mol该物质可以和1molNaOH反应,也可以与1molNaHCO3反应产生1molCO2
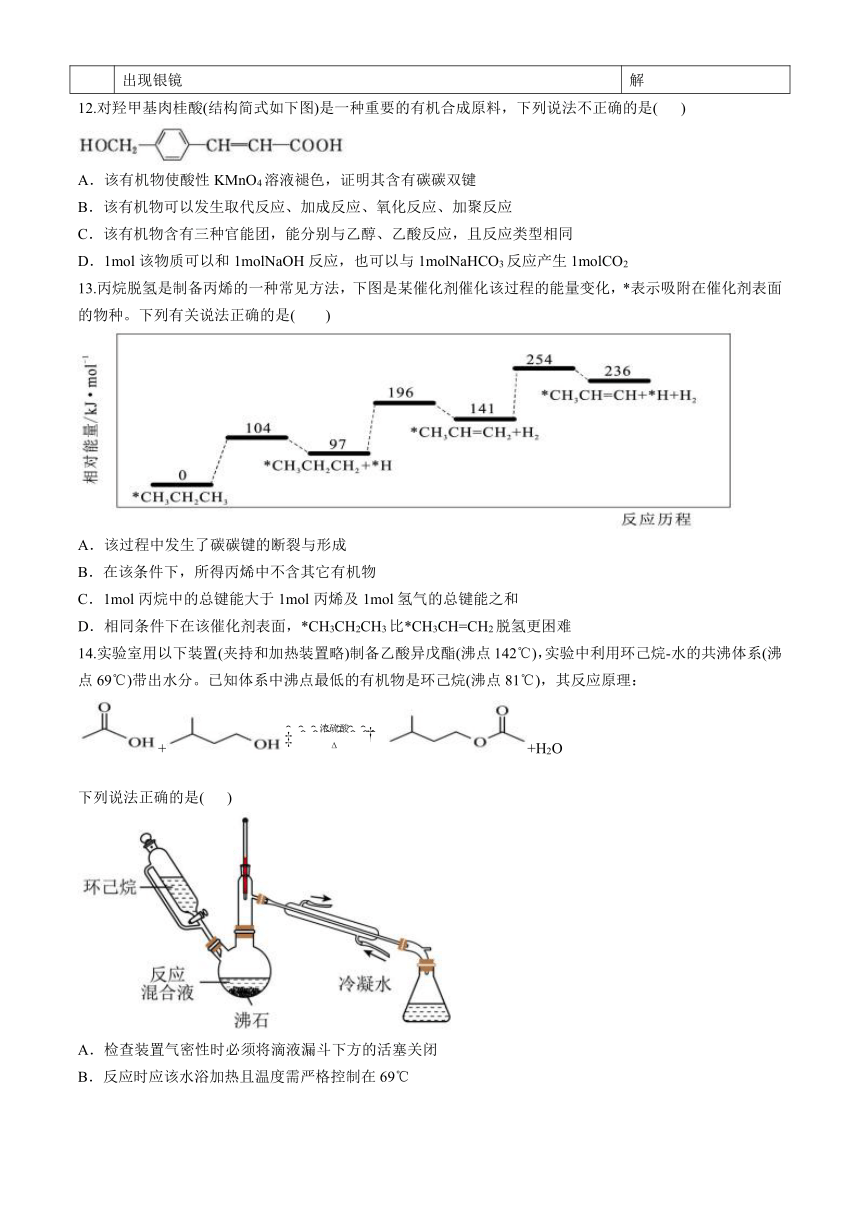
13.丙烷脱氢是制备丙烯的一种常见方法,下图是某催化剂催化该过程的能量变化,*表示吸附在催化剂表面的物种。下列有关说法正确的是( )
A.该过程中发生了碳碳键的断裂与形成
B.在该条件下,所得丙烯中不含其它有机物
C.1mol丙烷中的总键能大于1mol丙烯及1mol氢气的总键能之和
D.相同条件下在该催化剂表面,*CH3CH2CH3比*CH3CH=CH2脱氢更困难
14.实验室用以下装置(夹持和加热装置略)制备乙酸异戊酯(沸点142℃),实验中利用环己烷-水的共沸体系(沸点69℃)带出水分。已知体系中沸点最低的有机物是环己烷(沸点81℃),其反应原理:++H2O
下列说法正确的是( )
A.检查装置气密性时必须将滴液漏斗下方的活塞关闭
B.反应时应该水浴加热且温度需严格控制在69℃
C.可用NaHSO4固体代替浓硫酸进行实验
D.实验结束后应该先停止通冷凝水后停止加热
15.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
A.Y可以是葡萄糖
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
D.1molCuSO4在1100℃所得混合气体X中O2的体积分数可能为50%
二、非选择题(本题共4小题,共55分)
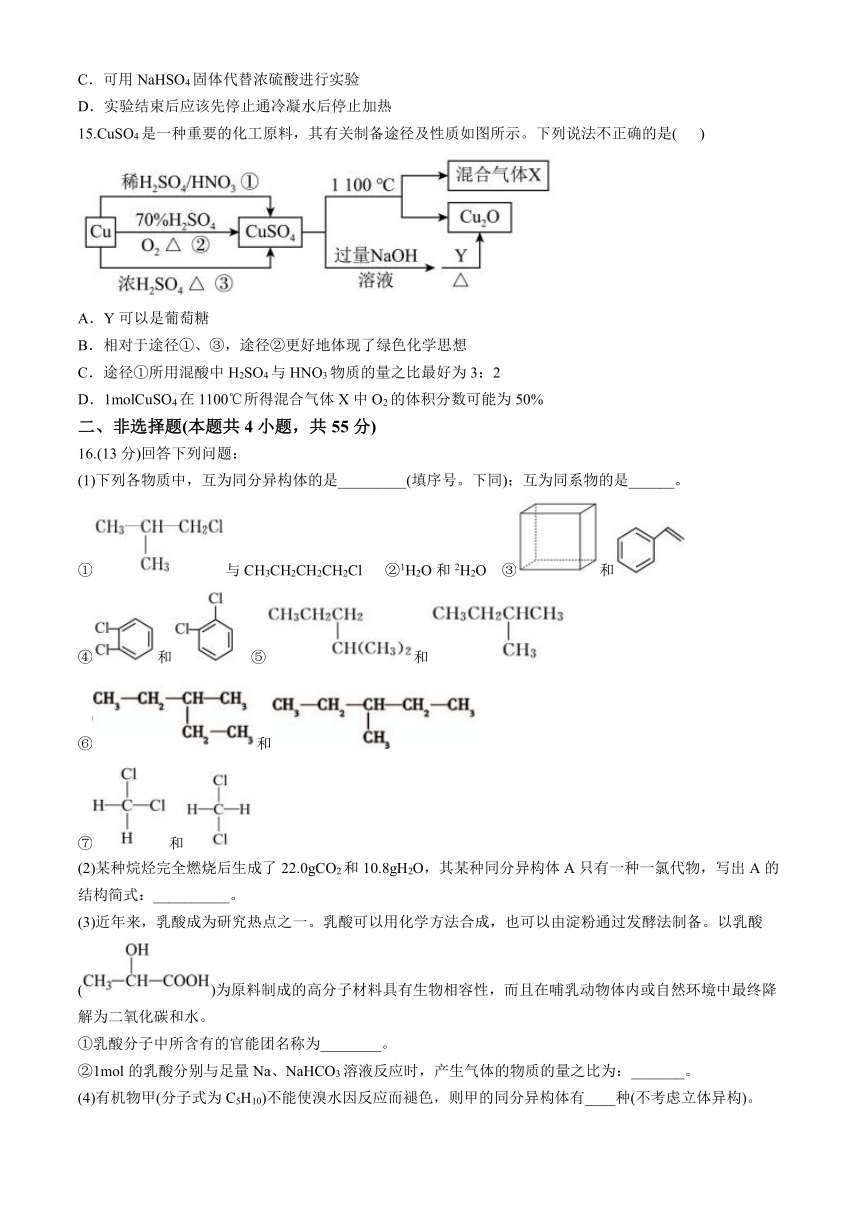
16.(13分)回答下列问题:
(1)下列各物质中,互为同分异构体的是_________(填序号。下同);互为同系物的是______。
①与CH3CH2CH2CH2Cl ②1H2O和2H2O ③和
④和 ⑤和
⑥和
⑦和
(2)某种烷烃完全燃烧后生成了22.0gCO2和10.8gH2O,其某种同分异构体A只有一种一氯代物,写出A的结构简式:__________。
(3)近年来,乳酸成为研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过发酵法制备。以乳酸()为原料制成的高分子材料具有生物相容性,而且在哺乳动物体内或自然环境中最终降解为二氧化碳和水。
①乳酸分子中所含有的官能团名称为________。
②1mol的乳酸分别与足量Na、NaHCO3溶液反应时,产生气体的物质的量之比为:_______。
(4)有机物甲(分子式为C5H10)不能使溴水因反应而褪色,则甲的同分异构体有____种(不考虑立体异构)。
(5)已知Diels—Alder反应,也称双烯合成如图所示:
则+_____________。
17.(12分)减少氮的氧化物在大气中的排放是环境保护的重要内容。合理应用和处理氮及其化合物,在生产生活中有重要意义。
I.雾霾严重影响人们生活,雾霾的形成与汽车排放的NOx等有毒气体有关。
(1)通过活性炭对汽车尾气进行处理,相关原理为C(s)+2NO(g)N2(g)+CO2(g)。下列情况能说明该反应达到平衡状态的是_______。
A.2v正(NO)=v逆(CO2)
B.混合气体中N2的体积分数保持不变
C.单位时间内断裂1个N≡N同时生成1个C=O
D.恒温、恒压条件下,混合气体的平均摩尔质量保持不变
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图1所示,若催化剂表面参与反应的NO和NO2物质的量之比为1:1,则总反应的化学方程式为________________。
(3)在催化转化器中,汽车尾气中CO和NO可发生反应。2CO(g)+2NO(g)2CO2(g)+N2(g),在容积为5L的密闭容器中进行该反应,起始时充入4molCO、2molNO,反应在不同条件下进行,反应体系总压强随时间变化如图2所示。
①实验b从开始至平衡时的反应速率v(CO)=__________;
②实验a、b、c中,达平衡时平均反应速率由大到小的顺序是:_________(用a、b、c表示)。
Ⅱ.(4)潜艇中使用的液氨-液氧燃料电池工作原理如图所示:
①电极b名称是________(填“正极”或“负极”)。
②电解质溶液中OH-离子向________移动(填“电极a”或“电极b”)。
③电极a的电极反应式为_________________。
18.(16分)
I.苯甲酸乙酯可用作食用香精。实验室用苯甲酸(,熔点122.1℃)与乙醇制备苯甲酸乙酯装置如图所示(部分装置已省略)。
步骤如下:
步骤①:在烧瓶中加入苯甲酸12.2g、乙醇60.0mL、浓硫酸5.0mL、适量环己烷。按如图所示安装好装置,加热烧瓶,控制一定温度加热回流2h。
步骤②:将烧瓶中的反应液倒入盛有100.0mL水的烧杯中,加入Na2CO3至溶液呈中性,分离出有机相。
步骤③:在水相中加入乙醚,振荡静置分离,将两次的有机相合并,并洗涤,再加到蒸馏装置中,加入沸石与无水硫酸镁,加热蒸馏制得产品6.0mL。
部分物质的性质如下表所示:
物质名称 苯甲酸 乙醇 环己烷 苯甲酸乙酯
相对分子质量 122 46 84 150
密度/g·cm-3 1.2659 0.7893 0.7318 1.0500
沸点/℃ 249.2 78.3 80.8 212.61
已知:乙醚易溶于醇、醚、酯、石油醚等有机溶剂,几乎不溶于水。
回答下列问题:
(1)仪器A的名称为_________。
(2)下列仪器中,分离有机相和洗涤有机相时均需要使用的是________(填名称)。
(3)写出制备苯甲酸乙酯反应的化学方程式:________。
(4)装置图中分水器的“分水”原理是冷凝液在分水器中分层,上层有机层从支管处流回烧底,下层水层从分水器下口放出,反应结束的标志是________________。
(5)步骤③中加入乙醚的作用是_________。
(6)该实验中苯甲酸的产率为_________。
Ⅱ.海洋是一个巨大的化学资源宝库,下面是海水资源综合利用的部分流程图,请回答下列问题:
(7)反应④由无水MgCl2制取金属镁的常用工业方法是___________(用化学方程式表示)。
(8)步骤⑤已经获得Br2,步骤⑥又将Br2还原为Br-,其目的是_____________。写出步骤⑥反应的离子方程式____________。
19.(14分)利用淀粉和石油化工产品烃C可制备环酯化合物F,其合成路线如下:
查阅资料获得信息:
①烃C在标准状况下密度为1.25g/L
②
回答下列问题:
(1)下列关于淀粉的说法正确的是_______(填字母,下同)。
a.淀粉与油脂均属于天然高分子 b.淀粉与纤维素互为同分异构体
c.淀粉、蛋白质、水等都属于营养物质 d.可用碘水检验淀粉是否水解完全
(2)CH2=CHCH3也是一种常见的石油化工产品,其分子中最多有______个原子共面。
(3)由C生成D的化学方程式为_____________。
(4)写出有机物A的结构简式_________,下列不能与有机物A反应的是________。
a.酸性KMnO溶液 b.NaOH溶液
c.银氨溶液 d.新制Cu(OH)2悬浊液
(5)F分子结构中含有八元环,写出F的结构简式:_________。生成F的反应类型为_________。
(6)以烃C为原料,合成乙酸乙酯的路线如下,请填写空格中有机物的结构简式________。
烃C______________________乙酸乙酯
湖北省部分省级示范高中2023-2024学年高一下学期期末测试
化学答案
1~5:BABCB 6~10:CCAC 11~15:CACCD
16.(13分)
(1)①③(2分);⑤(1分)
(2) (2分)
(3)羟基、羧基(2分),1:1(2分);
(4)5(2分)﹔
(5) (2分)
17.(12分)
(1)BD(2分)
(2)NO+NO2+2NH3N2+3H2O(2分,不写催化剂扣1分)
(3)0.005mol/(L·min)(2分);a>c>b(2分)
(4)正极(1分);电极a(1分);2NH3-6e-+6OH-=N2↑+6H2O(2分,不打“↑”扣1分)
18.(16分)
(1)球形冷凝管(1分)
(2)分液漏斗(1分)
(3) +CH3CH2OH+H2O(2分,不写条件扣一分)
(4)分水器中水层液面不再升高(其他合理答案也给分)(2分)
(5)萃取水相中残留的有机产品,提高产率(2分)
(6)42.0%(2分,写“42%”不给分)
(7)MgCl2(熔融)Mg+Cl2↑(2分)
(8)浓缩、提纯溴元素(或富集溴元素)(2分)
Br2+SO2+2H2O=4H+++2Br-(2分)
19.(14分)
(1)cd(2分)
(2)7(2分)
(3)CH2=CH2+Br2→CH2Br-CH2Br(2分)
(4)CH2OH(CHOH)4CHO(1分);b(2分)
(5) (2分);取代反应(酯化反应)(1分)
(6)CH3CH2OH(1分);CH3COOH(1分)
化学试卷
考试时间:2024年7月1日
试卷满分:100分
★祝考试顺利★
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。写在试卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内。写在试卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试卷和答题卡一并上交。
可能用到的相对原子质量:H1 C12 O16
一、选择题(本题共15小题,每小题3分,共45分。每小题给出的四个选项中,只有一项符合题目要求。)
1.我国嫦娥六号已完成月背月壤采样,这将是人类获得的第一份月球背面月壤样品。下列有关说法正确的是( )
A.月壤中含有的3He与地球上的4He互为同素异形体
B.返回器外壁的高温结构陶瓷属于新型无机非金属材料
C.使用的太阳能电池和锂离子电池均是将化学能转化为电能的装置
D.动态展示的国旗由玄武岩纤维织成,该材料是一种新型高性能合成纤维。
2.课本习题也是重要的学习资源,下列说法正确的是( )
A.CaCO3可做抗酸药,一般要嚼碎后吞服
B.铁强化酱油可加乙二胺四乙酸铁钠作为增味剂
C.汽车尾气中含有CO、NO等多种污染物,其中NO来源于汽油的燃烧
D.日常生活中,铁制品表面刷油漆,向门窗合页注油均与化学反应速率有关
3.下列有关化学用语表示正确的是( )
A.羟基的电子式:
B.乙醇的结构式:
C.丙烷分子的空间填充模型
D.乙烯的结构简式CH2CH2
4.下列实验方法正确的是( )
A.除去乙醇中的水:加足量生石灰,过滤
B.鉴别乙醇、乙酸和乙酸乙酯:用NaOH溶液
C.鉴别苯和四氯化碳:分别加入溴水,静置、观察
D.除去乙烷中少量的乙烯:将混合气体通入KMnO4(H+)溶液中,洗气
5.设NA表示阿伏加德罗常数,下列说法正确的是( )
A.0.5mol的辛烷中含有的共价键数目为13NA
B.室温下的乙烯、丙烯、丁烯混合气体共14g,其原子总数为3NA
C.1molCH4与1molCl2在光照条件下充分反应,得到CH3Cl的分子数为NA
D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA
6.某化学兴趣小组为探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号 电极材料 电解质溶液 电流表指针偏转方向
① Mg、Al 稀盐酸 偏向Al
② Mg、Al NaOH溶液 偏向Mg
下列说法不正确的是( )
A.实验①中负极反应为:Mg-2e-=Mg2+
B.实验②中负极反应为:Al-3e-=Al3+
C.实验①中将Mg换成Fe,电流表指针偏向Fe
D.原电池中相对活泼的金属可能作正极
7.下列反应中前者属于取代反应,后者属于加成反应的是( )
A.在苯中滴入溴水,溴水褪色;乙烯使溴水褪色
B.乙醇在Cu作用下与O2的反应;乙烯使酸性高锰酸钾溶液褪色
C.乙烷在光照下与氯气的反应;由乙烯制乙醇
D.乙烯使溴的四氯化碳溶液褪色;苯与氢气在一定条件下反应生成环己烷
8.从海带中提取碘的过程如下图:
下列说法正确的是( )
A.步骤①需要的实验仪器是蒸发皿、酒精灯
B.步骤③的操作名称是冷却结晶
C.步骤④在含I-的溶液中加入稀硫酸和双氧水后,碘元素发生氧化反应
D.步骤⑤的操作为萃取分液,还可以用无水乙醇代替CCl4以节约成本
9.用下列实验装置进行相应实验,能达到实验目的的是( )
A.用甲装置验证浓H2SO4的脱水性、强氧化性
B.用乙装置进行实验室制取并收集乙酸乙酯
C.用丙装置进行苯和溴单质的分离
D.用丁装置比较N、C、Si非金属性的强弱
10.在恒温恒容条件下,发生反应2X(g)+mY(g)2Z(g),反应体系中某物质的浓度c随时间的变化如图中曲线甲、乙所示,己知m为整数。下列说法正确的是( )
A.e点时v(X)正=v(Z)逆;
B.10~30min内v(Z)=0.05mol/(L·min);
C.曲线甲表示的是物质Y在反应进程中的浓度变化;
D.当混合气体的密度不再随时间的变化而变化,说明该反应达到平衡;
11.下列实验探究方案能达到探究目的的是( )
选项 实验操作或实验方案 探究目的
A 向浓硝酸中加入红热的碳,产生红棕色气体 验证碳能与浓硝酸反应
B 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 X具有强氧化性
C 向某未知溶液中加入NaOH固体,加热,在管口用湿润的红色石蕊试纸检验 检验是否含
D 向蔗糖溶液中滴加稀硫酸,加热,再加入银氨溶液并水浴加热,观察是否出现银镜 蔗糖在酸性条件下能水解
12.对羟甲基肉桂酸(结构简式如下图)是一种重要的有机合成原料,下列说法不正确的是( )
A.该有机物使酸性KMnO4溶液褪色,证明其含有碳碳双键
B.该有机物可以发生取代反应、加成反应、氧化反应、加聚反应
C.该有机物含有三种官能团,能分别与乙醇、乙酸反应,且反应类型相同
D.1mol该物质可以和1molNaOH反应,也可以与1molNaHCO3反应产生1molCO2
13.丙烷脱氢是制备丙烯的一种常见方法,下图是某催化剂催化该过程的能量变化,*表示吸附在催化剂表面的物种。下列有关说法正确的是( )
A.该过程中发生了碳碳键的断裂与形成
B.在该条件下,所得丙烯中不含其它有机物
C.1mol丙烷中的总键能大于1mol丙烯及1mol氢气的总键能之和
D.相同条件下在该催化剂表面,*CH3CH2CH3比*CH3CH=CH2脱氢更困难
14.实验室用以下装置(夹持和加热装置略)制备乙酸异戊酯(沸点142℃),实验中利用环己烷-水的共沸体系(沸点69℃)带出水分。已知体系中沸点最低的有机物是环己烷(沸点81℃),其反应原理:++H2O
下列说法正确的是( )
A.检查装置气密性时必须将滴液漏斗下方的活塞关闭
B.反应时应该水浴加热且温度需严格控制在69℃
C.可用NaHSO4固体代替浓硫酸进行实验
D.实验结束后应该先停止通冷凝水后停止加热
15.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
A.Y可以是葡萄糖
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
D.1molCuSO4在1100℃所得混合气体X中O2的体积分数可能为50%
二、非选择题(本题共4小题,共55分)
16.(13分)回答下列问题:
(1)下列各物质中,互为同分异构体的是_________(填序号。下同);互为同系物的是______。
①与CH3CH2CH2CH2Cl ②1H2O和2H2O ③和
④和 ⑤和
⑥和
⑦和
(2)某种烷烃完全燃烧后生成了22.0gCO2和10.8gH2O,其某种同分异构体A只有一种一氯代物,写出A的结构简式:__________。
(3)近年来,乳酸成为研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过发酵法制备。以乳酸()为原料制成的高分子材料具有生物相容性,而且在哺乳动物体内或自然环境中最终降解为二氧化碳和水。
①乳酸分子中所含有的官能团名称为________。
②1mol的乳酸分别与足量Na、NaHCO3溶液反应时,产生气体的物质的量之比为:_______。
(4)有机物甲(分子式为C5H10)不能使溴水因反应而褪色,则甲的同分异构体有____种(不考虑立体异构)。
(5)已知Diels—Alder反应,也称双烯合成如图所示:
则+_____________。
17.(12分)减少氮的氧化物在大气中的排放是环境保护的重要内容。合理应用和处理氮及其化合物,在生产生活中有重要意义。
I.雾霾严重影响人们生活,雾霾的形成与汽车排放的NOx等有毒气体有关。
(1)通过活性炭对汽车尾气进行处理,相关原理为C(s)+2NO(g)N2(g)+CO2(g)。下列情况能说明该反应达到平衡状态的是_______。
A.2v正(NO)=v逆(CO2)
B.混合气体中N2的体积分数保持不变
C.单位时间内断裂1个N≡N同时生成1个C=O
D.恒温、恒压条件下,混合气体的平均摩尔质量保持不变
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图1所示,若催化剂表面参与反应的NO和NO2物质的量之比为1:1,则总反应的化学方程式为________________。
(3)在催化转化器中,汽车尾气中CO和NO可发生反应。2CO(g)+2NO(g)2CO2(g)+N2(g),在容积为5L的密闭容器中进行该反应,起始时充入4molCO、2molNO,反应在不同条件下进行,反应体系总压强随时间变化如图2所示。
①实验b从开始至平衡时的反应速率v(CO)=__________;
②实验a、b、c中,达平衡时平均反应速率由大到小的顺序是:_________(用a、b、c表示)。
Ⅱ.(4)潜艇中使用的液氨-液氧燃料电池工作原理如图所示:
①电极b名称是________(填“正极”或“负极”)。
②电解质溶液中OH-离子向________移动(填“电极a”或“电极b”)。
③电极a的电极反应式为_________________。
18.(16分)
I.苯甲酸乙酯可用作食用香精。实验室用苯甲酸(,熔点122.1℃)与乙醇制备苯甲酸乙酯装置如图所示(部分装置已省略)。
步骤如下:
步骤①:在烧瓶中加入苯甲酸12.2g、乙醇60.0mL、浓硫酸5.0mL、适量环己烷。按如图所示安装好装置,加热烧瓶,控制一定温度加热回流2h。
步骤②:将烧瓶中的反应液倒入盛有100.0mL水的烧杯中,加入Na2CO3至溶液呈中性,分离出有机相。
步骤③:在水相中加入乙醚,振荡静置分离,将两次的有机相合并,并洗涤,再加到蒸馏装置中,加入沸石与无水硫酸镁,加热蒸馏制得产品6.0mL。
部分物质的性质如下表所示:
物质名称 苯甲酸 乙醇 环己烷 苯甲酸乙酯
相对分子质量 122 46 84 150
密度/g·cm-3 1.2659 0.7893 0.7318 1.0500
沸点/℃ 249.2 78.3 80.8 212.61
已知:乙醚易溶于醇、醚、酯、石油醚等有机溶剂,几乎不溶于水。
回答下列问题:
(1)仪器A的名称为_________。
(2)下列仪器中,分离有机相和洗涤有机相时均需要使用的是________(填名称)。
(3)写出制备苯甲酸乙酯反应的化学方程式:________。
(4)装置图中分水器的“分水”原理是冷凝液在分水器中分层,上层有机层从支管处流回烧底,下层水层从分水器下口放出,反应结束的标志是________________。
(5)步骤③中加入乙醚的作用是_________。
(6)该实验中苯甲酸的产率为_________。
Ⅱ.海洋是一个巨大的化学资源宝库,下面是海水资源综合利用的部分流程图,请回答下列问题:
(7)反应④由无水MgCl2制取金属镁的常用工业方法是___________(用化学方程式表示)。
(8)步骤⑤已经获得Br2,步骤⑥又将Br2还原为Br-,其目的是_____________。写出步骤⑥反应的离子方程式____________。
19.(14分)利用淀粉和石油化工产品烃C可制备环酯化合物F,其合成路线如下:
查阅资料获得信息:
①烃C在标准状况下密度为1.25g/L
②
回答下列问题:
(1)下列关于淀粉的说法正确的是_______(填字母,下同)。
a.淀粉与油脂均属于天然高分子 b.淀粉与纤维素互为同分异构体
c.淀粉、蛋白质、水等都属于营养物质 d.可用碘水检验淀粉是否水解完全
(2)CH2=CHCH3也是一种常见的石油化工产品,其分子中最多有______个原子共面。
(3)由C生成D的化学方程式为_____________。
(4)写出有机物A的结构简式_________,下列不能与有机物A反应的是________。
a.酸性KMnO溶液 b.NaOH溶液
c.银氨溶液 d.新制Cu(OH)2悬浊液
(5)F分子结构中含有八元环,写出F的结构简式:_________。生成F的反应类型为_________。
(6)以烃C为原料,合成乙酸乙酯的路线如下,请填写空格中有机物的结构简式________。
烃C______________________乙酸乙酯
湖北省部分省级示范高中2023-2024学年高一下学期期末测试
化学答案
1~5:BABCB 6~10:CCAC 11~15:CACCD
16.(13分)
(1)①③(2分);⑤(1分)
(2) (2分)
(3)羟基、羧基(2分),1:1(2分);
(4)5(2分)﹔
(5) (2分)
17.(12分)
(1)BD(2分)
(2)NO+NO2+2NH3N2+3H2O(2分,不写催化剂扣1分)
(3)0.005mol/(L·min)(2分);a>c>b(2分)
(4)正极(1分);电极a(1分);2NH3-6e-+6OH-=N2↑+6H2O(2分,不打“↑”扣1分)
18.(16分)
(1)球形冷凝管(1分)
(2)分液漏斗(1分)
(3) +CH3CH2OH+H2O(2分,不写条件扣一分)
(4)分水器中水层液面不再升高(其他合理答案也给分)(2分)
(5)萃取水相中残留的有机产品,提高产率(2分)
(6)42.0%(2分,写“42%”不给分)
(7)MgCl2(熔融)Mg+Cl2↑(2分)
(8)浓缩、提纯溴元素(或富集溴元素)(2分)
Br2+SO2+2H2O=4H+++2Br-(2分)
19.(14分)
(1)cd(2分)
(2)7(2分)
(3)CH2=CH2+Br2→CH2Br-CH2Br(2分)
(4)CH2OH(CHOH)4CHO(1分);b(2分)
(5) (2分);取代反应(酯化反应)(1分)
(6)CH3CH2OH(1分);CH3COOH(1分)
同课章节目录
