第1节 第2课时 元素周期表与核素(同步课件)(共23张PPT)-2023-2024学年高一化学同步精品课堂(人教版2019必修第一册)
文档属性
| 名称 | 第1节 第2课时 元素周期表与核素(同步课件)(共23张PPT)-2023-2024学年高一化学同步精品课堂(人教版2019必修第一册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-08 11:08:03 | ||
图片预览



文档简介
(共23张PPT)
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
课时2 元素周期表与核素
壹
贰
元素周期表
核素
知识导航
本节重点
本节难点
课堂导入
自118号元素发现之后,科学界一直在讨论一个问题,元素周期表第七周期已经被填满,是否证明所有化学元素已经被集齐?元素周期表到底有没有尽头?
斯维尔德罗夫市的工程师C·霍斯特,声称自己发现了一个新元素。经测验,其元素质量是氢元素的299倍,即原子量为299,很可能就是尚未出现的119号元素,经证实后,俄罗斯科学家宣布,他们已经找到了打开第八元素周期的钥匙——119号元素。
资 料
探究课堂
【任务】阅读课本P98,了解元素周期表的发展历程
诞生
依据
意义
1869年,俄国化学家____________编制出第一张元素周期表
按相对原子质量由小到大排列,将化学性质相似的元素放在同一纵列
揭示了元素间的内在联系,成为化学发展史上的重要里程碑之一
发展
元素周期表中为未知元素留下的空位先后被填满
现行
编排依据:相对原子质量 → ___________,形成现行的元素周期表
门捷列夫
核电荷数
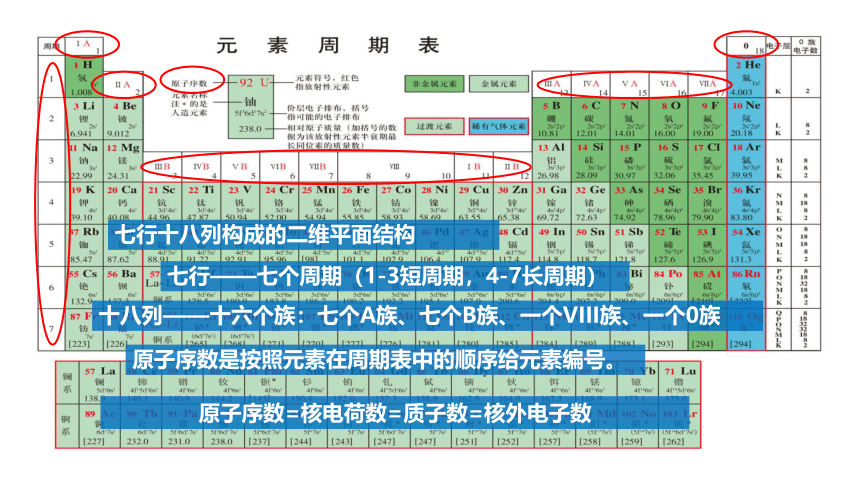
原子序数=核电荷数=质子数=核外电子数
原子序数是按照元素在周期表中的顺序给元素编号。
七行——七个周期(1-3短周期,4-7长周期)
十八列——十六个族:七个A族、七个B族、一个VIII族、一个0族
七行十八列构成的二维平面结构
探究课堂
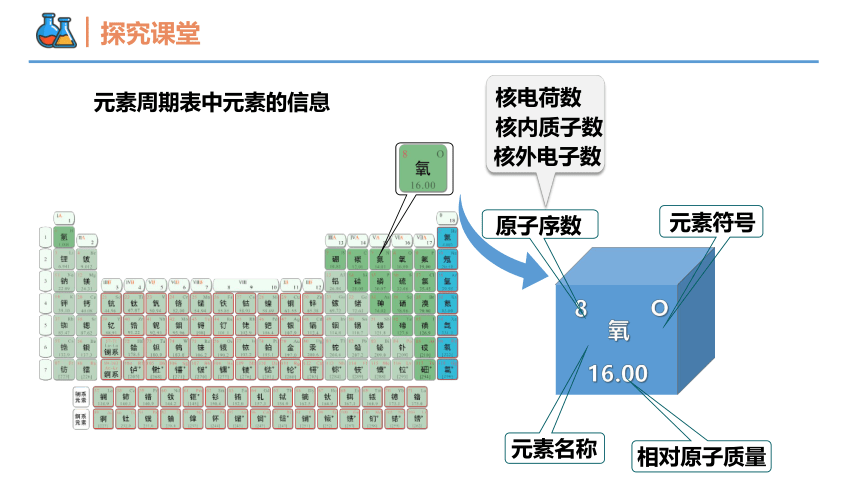
氧
16.00
8
O
元素周期表中元素的信息
原子序数
元素符号
核电荷数
核内质子数
核外电子数
相对原子质量
元素名称
探究课堂
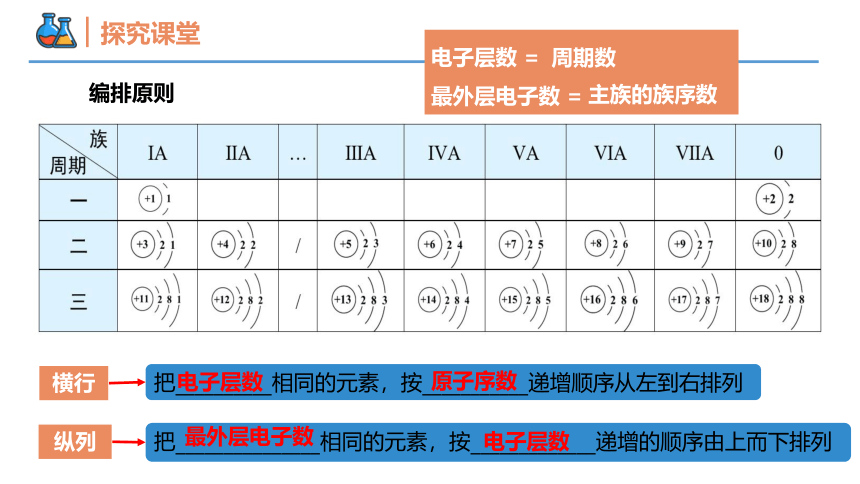
横行
纵列
把__________相同的元素,按___________递增顺序从左到右排列
把_______________相同的元素,按_____________递增的顺序由上而下排列
电子层数
原子序数
最外层电子数
电子层数
编排原则
电子层数 =
最外层电子数 =
主族的族序数
周期数
探究课堂
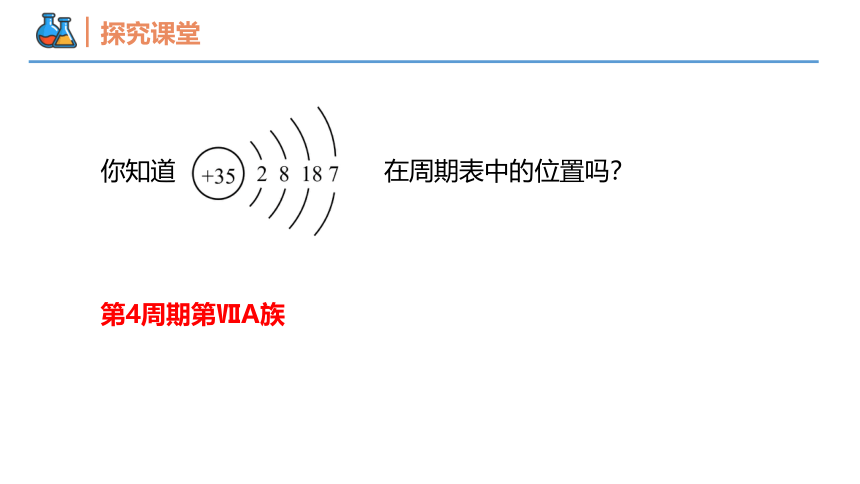
你知道 在周期表中的位置吗?
第4周期第ⅦA族
探究课堂
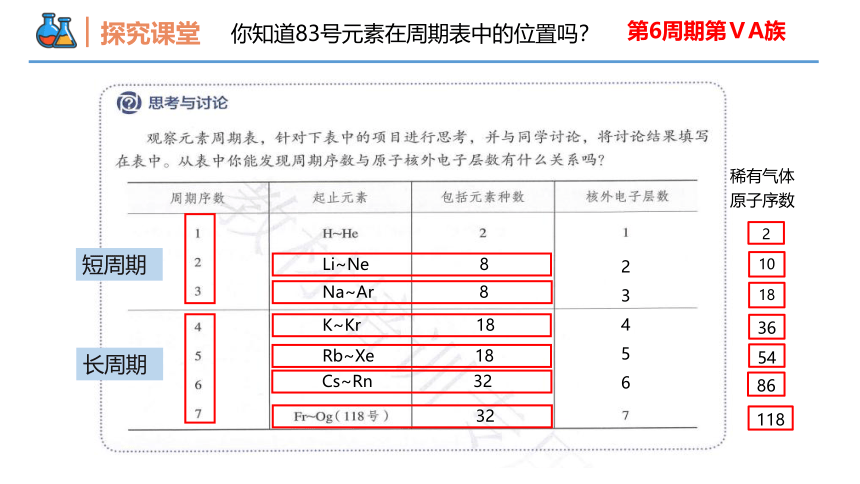
Li~Ne 8
Na~Ar 8
K~Kr 18
Rb~Xe 18
Cs~Rn 32
短周期
长周期
2
3
4
5
6
32
稀有气体
原子序数
2
18
36
54
86
10
118
你知道83号元素在周期表中的位置吗?
第6周期第ⅤA族
探究课堂
【例1】判断正误
(1)一个横行即是一个周期,一个纵列即是一个族( )
(2)每一周期都是碱金属元素开始,稀有气体元素结束( )
(3)同周期中元素电子层数一定相同( )
(4)同族元素的最外层电子数一定等于族序数( )
(5)0族元素的最外层电子数均为8( )
(6)短周期是指一、二、三、四周期( )
(7)元素周期表为元素性质的系统研究提供指导,为新元素的发现提供线索( )
(8)第ⅠA族中元素均为金属元素,又称碱金属元素( )
(9)最外层电子数是2的元素一定为第ⅡA族的元素( )
×
×
×
√
×
×
√
×
×
探究课堂
【例2】假设x是第ⅡB族中某元素的原子序数,那么原子序数为x+1的元素位于( )
A. 第ⅠB族 B. 第ⅢB族
C. 第ⅢA族 D. 第ⅡA族
C
探究课堂
【例3】某同学为1~18号元素设计了一种扇形图(如图),其实就是目前仍在使用的扇形周期表的一部分,下列有关说法不正确的是( )
A. 每个小扇区就是长式周期表的一个族
B. 此扇形周期表中只显示了三个周期
C. 扇形周期表拆下扇子顶螺丝可以转换
为现行的长式周期表
D. 扇形周期表考虑镧系和锕系应有九个周期
D
探究课堂
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N) 1 0 氕(piē)
1 1 氘(dāo)
1 2 氚(chuān)
X
Z
A
在表格中填写三种氢原子的原子符号。
氕、氘、氚的原子结构有何异同?
它们是同一种元素吗?为什么?
H
1
1
H
1
2
H
1
3
或D
或T
探究课堂
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N) 1 0 氕(piē)
1 1 氘(dāo)
1 2 氚(chuān)
X
Z
A
H
1
1
H
1
2
H
1
3
或D
或T
元素是具有相同质子数(核电荷数)的一类原子的总称。
具有一定数目质子和一定数目中子的一种原子叫做核素。
核素
质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(即同一元素的不同核素互称为同位素)
元素
同位素
探究课堂
①“同位”指的是在同期表中的位置相同(核外电子排布一样)
② 化学性质几乎相同,物理性质略有差异
③ 天然存在的同位素,相互间保持一定的比率(丰度),各同位素原子的含量一般不变
元素的相对原子质量是
按照该元素的各种核素所占的一定百分比计算出来的平均值。
同位素的特点
探究课堂
已知17 Cl的相对原子质量是34.969, 17 Cl的相对原子质量是36.966,它们在自然界中的原子百分数分别为75.77%、24.23%。则氯元素的相对原子质量为多少?
35 37
氯元素的相对原子质量=
34.969×0.7577+36.966×0.2423 =35.543
原子的相对原子质量取整数=原子的质量数
元素的相对原子质量和各核素的百分含量有关
探究课堂
能源、农业、医疗、考古等方面都有重要应用。
同位素
PART 1
氧元素
O
16
8
O
17
8
O
18
8
PART 2
碳元素
C
12
6
C
13
6
C
14
6
PART 3
铀元素
U
234
92
U
235
92
U
238
92
例如:
用途:
、用于制造氢弹;
用于制造原子弹、核发电;
考古时利用测定一些文物的年代;
利用放射性同位素释放的射线育种、治疗恶性肿瘤。
探究课堂
O2和O3互为同位素吗?H2O和D2O互为同位素吗?
O2和O3互为同素异形体; H2O和D2O为同种物质。
探究课堂
元素 核素 同位素 同素异形体
本质
范畴
特性
决定因素
举例
质子数相同的一类原子
质子数、中子数都一定的原子
质子数相同、中子数不同的核素
同种元素形成的不同单质
同类原子
原子
原子
单质
只有种类,
没有个数
化学反应中的最小微粒
化学性质几乎相同,物理性质不同
元素相同
性质不同
质子数
质子数、中子数
质子数、中子数
组成元素、结构
H、C、O
三种元素
O2、O3
项目
内容
1H
1
1H
2
1H
3
三种核素
1H
1
1H
2
1H
3
互称同位素
探究课堂
【例4】下列说法错误的是( )
A. 11H、21H、H+和H2是氢元素的四种不同粒子
B. 4020Ca和4220Ca、石墨和金刚石均为同素异形体
C.11H和21H是不同的核素
D. 12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同
B
【例5】回答下列问题:
(1)下列原子:126C、147N、11H、2311Na、21H、4020Ca、4019K、31H、146C中,元素有__________种,核素有___________种,互为同位素的有________________________________________________________。
(2)18O2与16O2,二者的关系是____________________________(填“互为同位素”“互为同素异形体”或“属于同一种物质”)。
探究课堂
6
9
属于同一种物质
课堂小结
谢谢观看
THANKS
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
课时2 元素周期表与核素
壹
贰
元素周期表
核素
知识导航
本节重点
本节难点
课堂导入
自118号元素发现之后,科学界一直在讨论一个问题,元素周期表第七周期已经被填满,是否证明所有化学元素已经被集齐?元素周期表到底有没有尽头?
斯维尔德罗夫市的工程师C·霍斯特,声称自己发现了一个新元素。经测验,其元素质量是氢元素的299倍,即原子量为299,很可能就是尚未出现的119号元素,经证实后,俄罗斯科学家宣布,他们已经找到了打开第八元素周期的钥匙——119号元素。
资 料
探究课堂
【任务】阅读课本P98,了解元素周期表的发展历程
诞生
依据
意义
1869年,俄国化学家____________编制出第一张元素周期表
按相对原子质量由小到大排列,将化学性质相似的元素放在同一纵列
揭示了元素间的内在联系,成为化学发展史上的重要里程碑之一
发展
元素周期表中为未知元素留下的空位先后被填满
现行
编排依据:相对原子质量 → ___________,形成现行的元素周期表
门捷列夫
核电荷数
原子序数=核电荷数=质子数=核外电子数
原子序数是按照元素在周期表中的顺序给元素编号。
七行——七个周期(1-3短周期,4-7长周期)
十八列——十六个族:七个A族、七个B族、一个VIII族、一个0族
七行十八列构成的二维平面结构
探究课堂
氧
16.00
8
O
元素周期表中元素的信息
原子序数
元素符号
核电荷数
核内质子数
核外电子数
相对原子质量
元素名称
探究课堂
横行
纵列
把__________相同的元素,按___________递增顺序从左到右排列
把_______________相同的元素,按_____________递增的顺序由上而下排列
电子层数
原子序数
最外层电子数
电子层数
编排原则
电子层数 =
最外层电子数 =
主族的族序数
周期数
探究课堂
你知道 在周期表中的位置吗?
第4周期第ⅦA族
探究课堂
Li~Ne 8
Na~Ar 8
K~Kr 18
Rb~Xe 18
Cs~Rn 32
短周期
长周期
2
3
4
5
6
32
稀有气体
原子序数
2
18
36
54
86
10
118
你知道83号元素在周期表中的位置吗?
第6周期第ⅤA族
探究课堂
【例1】判断正误
(1)一个横行即是一个周期,一个纵列即是一个族( )
(2)每一周期都是碱金属元素开始,稀有气体元素结束( )
(3)同周期中元素电子层数一定相同( )
(4)同族元素的最外层电子数一定等于族序数( )
(5)0族元素的最外层电子数均为8( )
(6)短周期是指一、二、三、四周期( )
(7)元素周期表为元素性质的系统研究提供指导,为新元素的发现提供线索( )
(8)第ⅠA族中元素均为金属元素,又称碱金属元素( )
(9)最外层电子数是2的元素一定为第ⅡA族的元素( )
×
×
×
√
×
×
√
×
×
探究课堂
【例2】假设x是第ⅡB族中某元素的原子序数,那么原子序数为x+1的元素位于( )
A. 第ⅠB族 B. 第ⅢB族
C. 第ⅢA族 D. 第ⅡA族
C
探究课堂
【例3】某同学为1~18号元素设计了一种扇形图(如图),其实就是目前仍在使用的扇形周期表的一部分,下列有关说法不正确的是( )
A. 每个小扇区就是长式周期表的一个族
B. 此扇形周期表中只显示了三个周期
C. 扇形周期表拆下扇子顶螺丝可以转换
为现行的长式周期表
D. 扇形周期表考虑镧系和锕系应有九个周期
D
探究课堂
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N) 1 0 氕(piē)
1 1 氘(dāo)
1 2 氚(chuān)
X
Z
A
在表格中填写三种氢原子的原子符号。
氕、氘、氚的原子结构有何异同?
它们是同一种元素吗?为什么?
H
1
1
H
1
2
H
1
3
或D
或T
探究课堂
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N) 1 0 氕(piē)
1 1 氘(dāo)
1 2 氚(chuān)
X
Z
A
H
1
1
H
1
2
H
1
3
或D
或T
元素是具有相同质子数(核电荷数)的一类原子的总称。
具有一定数目质子和一定数目中子的一种原子叫做核素。
核素
质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(即同一元素的不同核素互称为同位素)
元素
同位素
探究课堂
①“同位”指的是在同期表中的位置相同(核外电子排布一样)
② 化学性质几乎相同,物理性质略有差异
③ 天然存在的同位素,相互间保持一定的比率(丰度),各同位素原子的含量一般不变
元素的相对原子质量是
按照该元素的各种核素所占的一定百分比计算出来的平均值。
同位素的特点
探究课堂
已知17 Cl的相对原子质量是34.969, 17 Cl的相对原子质量是36.966,它们在自然界中的原子百分数分别为75.77%、24.23%。则氯元素的相对原子质量为多少?
35 37
氯元素的相对原子质量=
34.969×0.7577+36.966×0.2423 =35.543
原子的相对原子质量取整数=原子的质量数
元素的相对原子质量和各核素的百分含量有关
探究课堂
能源、农业、医疗、考古等方面都有重要应用。
同位素
PART 1
氧元素
O
16
8
O
17
8
O
18
8
PART 2
碳元素
C
12
6
C
13
6
C
14
6
PART 3
铀元素
U
234
92
U
235
92
U
238
92
例如:
用途:
、用于制造氢弹;
用于制造原子弹、核发电;
考古时利用测定一些文物的年代;
利用放射性同位素释放的射线育种、治疗恶性肿瘤。
探究课堂
O2和O3互为同位素吗?H2O和D2O互为同位素吗?
O2和O3互为同素异形体; H2O和D2O为同种物质。
探究课堂
元素 核素 同位素 同素异形体
本质
范畴
特性
决定因素
举例
质子数相同的一类原子
质子数、中子数都一定的原子
质子数相同、中子数不同的核素
同种元素形成的不同单质
同类原子
原子
原子
单质
只有种类,
没有个数
化学反应中的最小微粒
化学性质几乎相同,物理性质不同
元素相同
性质不同
质子数
质子数、中子数
质子数、中子数
组成元素、结构
H、C、O
三种元素
O2、O3
项目
内容
1H
1
1H
2
1H
3
三种核素
1H
1
1H
2
1H
3
互称同位素
探究课堂
【例4】下列说法错误的是( )
A. 11H、21H、H+和H2是氢元素的四种不同粒子
B. 4020Ca和4220Ca、石墨和金刚石均为同素异形体
C.11H和21H是不同的核素
D. 12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同
B
【例5】回答下列问题:
(1)下列原子:126C、147N、11H、2311Na、21H、4020Ca、4019K、31H、146C中,元素有__________种,核素有___________种,互为同位素的有________________________________________________________。
(2)18O2与16O2,二者的关系是____________________________(填“互为同位素”“互为同素异形体”或“属于同一种物质”)。
探究课堂
6
9
属于同一种物质
课堂小结
谢谢观看
THANKS
